Akademin för Innovation, Design och Teknik
Vägledning för
medicinteknisk
CE-märkning, och
produktutveckling av
RaceRunner-underkroppsstöd
Examensarbete
Avancerad nivå, 30 hp
Produkt- och processutveckling
Martin Saavalainen
Handledare/uppdragsgivare, företag Psiwisp AB: Pernilla Hanssen Handledare, Mälardalens högskola: Janne Carlsson
Examinator: Sten Grahn Kurskod: PPU502 Datum: 2021-01-14
ABSTRACT
In this project, two problem areas have been explored. The first problem was to investigate how the medical CE marking is executed on a RaceRunner (a product that assist people with different disabilities). This problem also included to investigate how the process of CE marking is affected if an electric motor is applied for the driving of a RaceRunner. The second problem concerned developing an appropriate support device for the user's lower body (for the client´s electric RaceRunner). At present, there is no support for the user´s legs to rest on while driving, which makes driving strenuous during prolonged use.
The medical device CE marking was mostly explored through websites and links by the responsible authority, namely Läkemedelsverket (Swedish). To verify the reliability of
investigated sources, Läkemedelsverket was contacted on two occasions and an interview was conducted with an expert in the field of medical devices. A risk analysis has also been done on the client´s RaceRunners (with and without electric function). The risk analysis was requested by the client, which is the reason why it was carried out.
Concerning the support device, a more traditional product development process supplemented with Design Thinking was used. Practical tests were done with one of the client´s
RaceRunners, with the help of a user, to evaluate the best ergonomic positions to develop concepts around. Ergonomic possibilities for the support device were investigated to capture user-friendliness and safety. Hazardous risks cannot exist for the support device because safe product use is an important factor within the CE marking. A risk analysis was made here as well to evaluate safety and user-friendliness. To adapt concepts from the product development to production, the methodology design for manufacturing and assembly was used. As
ergonomic design choices can affect the manufacturing properties of the developed support device, a quality function deployment (QFD) was made to evaluate the most appropriate prioritization between ergonomic- and manufacturing properties.
The result of the first half of the project was a model. This model describes eight steps that should be done in the medical device CE marking. The model also shows how the process differs if an electric motor is applied for the driving of a RaceRunner. Additionally, the model highlights what is extra important in the implementation of the CE marking. The result is good in that only one difference was discovered between the reviewed electronic sources (secondary data) and what was discussed during the interviews (primary data). The result is slightly worse due to the limited selection for the data collection of primary data. The risk analysis for the client's RaceRunners is also included in the overall result, eight major risks exist that must be addressed by the client.
The result of the product development was a lower body support device that is mounted on the frame near the saddle of the client's electric RaceRunner. The user can fold the support device away and the length can be adjusted for different users. This support device is developed according to where the user's legs would be in a neutral position, which means that almost no flexibility or muscle effort is required to reach the position of the support. In the risk analysis, there were no major risks that had to be addressed. This support device is advantageous in that it will not be an obstacle to the CE marking, in addition, the support does not have a specific user target group (universal). The result is from a manufacturing perspective somewhat worse, due to there are still alternatives to reduce manufacturing costs.
SAMMANFATTNING
I detta projekt har två problemområden studerats. Första problemet handlade om att undersöka hur den medicintekniska CE-märkningen utförs på en RaceRunner, vilket är ett redskap för individer med olika funktionsnedsättningar. För detta problem undersöktes det också hur processen av CE-märkningen påverkas om en eldriven motor tillämpas för körningen av en RaceRunner. Det andra problemet handlade om att utveckla ett lämpligt underkroppsstöd till användaren (för uppdragsgivarens eldrivna RaceRunner). I nuläget finns det inget stöd för användarens ben att vila på under färd, vilket gör den eldrivna körningen ansträngande under längre användning.
Den medicintekniska CE-märkningen undersöktes till stor del genom Läkemedelsverkets (den ansvariga myndigheten för medicintekniska produkter) hemsida och deras utgivna länkar. För att verifiera pålitligheten av undersökta källor kontaktades Läkemedelsverket vid två tillfällen och en expert inom det medicintekniska området intervjuades. En riskanalys utfördes på uppdragsgivarens RaceRunner med och utan eldriven funktion. Riskanalysen efterfrågades av uppdragsgivaren, vilket är anledningen till att den genomfördes.
För produktutvecklingen av underkroppsstödet användes en traditionell
produktutvecklingsprocess som kompletterades med Design Thinking (vilket är en process som är mer inriktad på att fånga upp användarens åsikter och idéer). Praktiska tester gjordes med en av uppdragsgivarens RaceRunners (samt med hjälp av en användare) för att utvärdera de bästa ergonomiska positionerna att utveckla koncept kring. Ergonomiska möjligheter undersöktes i syfte att fånga upp användarvänlighet och säkerhet. Underkroppsstödet får inte medföra stora risker då säker produktanvändning är en viktig faktor inom uppfyllandet av CE-märkningen. En riskanalys gjordes även här för att utvärdera säkerheten. För att anpassa koncepten från produktutvecklingen till produktion användes design för tillverkning och montering. Då ergonomiska designval kan påverka tillverkningsegenskaperna hos underkroppsstödet gjordes en kundcentrerad kvalitetsutveckling (QFD) i syfte att utvärdera den lämpligaste prioriteringen mellan ergonomi och tillverkning.
Resultatet av första projekthalvan blev bland annat en modell. I denna modell beskrivs åtta steg som en tillverkare kan följa vid genomförande av den medicintekniska CE-märkningen.
Modellen visar också hur processen skiljer sig om en eldriven motor tillämpas för RaceRunnerns körning. Dessutom upplyser modellen vad som är extra viktigt vid
genomförandet av CE-märkningen. Resultatet är bra på så vis att endast en skillnad upptäcktes mellan granskade elektroniska källor (sekundärdata) och vad som diskuterades under
intervjuerna (primärdata). Resultatet är något försämrat på grund av det begränsade urvalet för datainsamlingen av primärdata. Riskanalysen för uppdragsgivarens RaceRunners ingår också i det övergripande resultatet, åtta stora risker existerar som måste åtgärdas av uppdragsgivaren. Resultatet från produktutvecklingen blev en anordning som ska sitta vid ramen nära sadeln på uppdragsgivarens eldrivna RaceRunner. Användaren kan fälla fram och bort
underkroppsstödet, samt justera längden. Underkroppsstödet är utvecklad efter vart
användarens ben skulle vara i en neutral position, vilket innebär att nästan ingen flexibilitet eller muskelansträngning krävs för att nå fram till stödet. I riskanalysen fanns inga stora risker som måste åtgärdas. Detta underkroppsstöd är fördelaktig på så vis att den inte kommer bli ett förhinder för CE-märkningen, dessutom har stödet inte en bestämd användarmålgrupp
(universell). Resultatet är från ett tillverkningsperspektiv något försämrat, då det finns fortfarande alternativ att minska tillverkningskostnader.
FÖRORD
Jag vill tacka Janne Carlsson och Pernilla Hanssen som har hjälpt mig igenom hela examensarbetet. Bland annat hade vi Teamsmöten en gång i veckan för att diskutera
arbetsgången. De hjälpte mig också med att framställa en riskanalys som skulle göras i detta projekt. Dessutom var de närvarande under intervjun som gjordes med Mattias Derneborg. Jag vill också tacka Mattias Derneborg som medförde hjälpsam information angående processen av CE-märkning.
INNEHÅLLSFÖRTECKNING
INLEDNING ... 1
1.1.BAKGRUND ... 1
1.2.PROBLEMBESKRIVNING ... 2
1.3.SYFTE OCH AVGRÄNSNINGAR ... 2
1.4.FRÅGESTÄLLNINGAR ... 3
1.5.MÅLBESKRIVNING ... 4
ANSATS OCH METOD ... 5
2.1.PLANERING ... 5
2.2.ÖVERSIKTLIG PROCESSBESKRIVNING ... 6
2.2.1.UNDERSÖKNINGEN OM CE-MÄRKNINGEN ... 6
2.2.2.PRODUKTUTVECKLINGEN AV UNDERKROPPSSTÖDET ... 7 2.3.TILLFÖRLITLIGHETEN AV DATAINSAMLINGEN ... 9 2.4.SÖKMETODER FÖR DATAINSAMLINGEN ... 10 TEORI ... 12 3.1.CE-MÄRKNING ... 12 3.1.1.ALLMÄNT OM CE-MÄRKNING ... 12
3.1.2.VÄGLEDNING FÖR CE-MÄRKNING AV MEDICINTEKNISK PRODUKT KLASS I ... 14
3.1.3.TEKNISKA DOKUMENTATIONEN ... 16
3.1.4.RISKHANTERING ... 17
3.1.5.ALLMÄNT OM HARMONISERADE STANDARDER ... 18
3.1.6.KVALITETSLEDNINGSSYSTEM ... 19
3.1.7.HARMONISERADE STANDARDER EN12182 OCH EN12184 ... 19
3.2.LITTERATURÖVERSIKT FÖR ERGONOMI ... 21
3.3.BESKRIVNING AV OLIKA FUNKTIONSNEDSÄTTNINGAR ... 22
UNDERSÖKNINGEN OM CE-MÄRKNING ... 24
4.1.INTERVJUER ... 24
4.2.JÄMFÖRELSE AV LIKARTADE PRODUKTER SOM FÖLJER ELLER INTE FÖLJER ETT DIREKTIV ... 26
4.3.RISKANALYS PÅ FÖRETAGETS RACERUNNERS ... 27
4.4.STEG 1 OCH 2 I DEN MEDICINTEKNISKA CE-MÄRKNINGEN ANGÅENDE FÖRETAGETS VANLIGA OCH ELDRIVNA RACERUNNER ... 29 PRODUKTUTVECKLING AV UNDERKROPPSSTÖD ... 31 5.1.KRAVSPECIFIKATION ... 31 5.2.TESTNING AV POSITION ... 32 5.3.KONCEPTGENERERING ... 33 5.4.KUNDCENTRERAD KVALITETSUTVECKLING ... 34 5.5.KONCEPTVAL ... 35 5.6.ENKEL PROTOTYP ... 37 5.7.KONCEPTUTVÄRDERING PÅ KOMPONENTNIVÅ ... 39
5.8.FÖRSTA SAMMANSTÄLLNING AV UNDERKROPPSSTÖDET OCH FÖRBÄTTRINGSMÖJLIGHETER ... 45
5.9.INTEGRERING AV DESIGN FÖR TILLVERKNING OCH MONTERING ... 48
5.10.RISKANALYS PÅ UNDERKROPPSSTÖDET ... 55
RESULTAT ... 57
6.1.RESULTERANDE MODELL FRÅN UNDERSÖKNING AV CE-MÄRKNING ... 57
6.2.RESULTATET FRÅN RISKANALYSEN PÅ FÖRETAGETS RACERUNNERS ... 58
6.3.RESULTERANDE LÖSNINGSFÖRSLAG AV UNDERKROPPSSTÖDET ... 59
ANALYS ... 65
7.1.CE-MÄRKNING AV VANLIG OCH ELDRIVEN RACERUNNER ... 65
7.2.ANVÄNDNINGEN AV UNDERKROPPSSTÖDET ... 66
7.3.MÅLUPPFYLLELSE ... 68
SLUTSATSER OCH REKOMMENDATIONER ... 71
REFERENSER ... 73
BILDREFERENSER ... 77
FIGURFÖRTECKNING
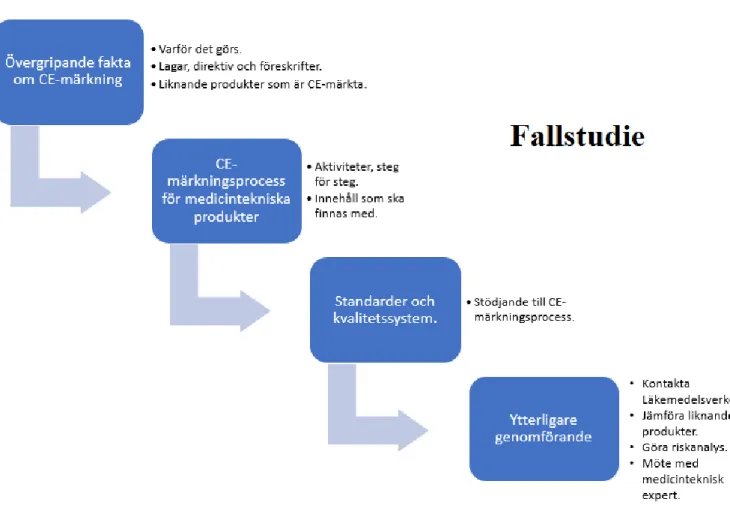
Figur 1: Övergripande process för undersökning av CE-märkning. ... 6
Figur 2: Övergripande process för produktutveckling av underkroppsstöd. ... 7
Figur 3: Bild på DT processen. ... 8
Figur 4: Hur CE-märkningen ser ut på produkter. ... 12
Figur 5: Definitioner om en medicinteknisk produkt. ... 14
Figur 6: Isometrisk vy av företagets RaceRunner utan delar för eldrivna körningen. ... 27
Figur 7: Isometrisk vy av företagets RaceRunner med delar för eldrivna körningen. ... 27
Figur 8: Bild ovanifrån på företagets RaceRunner med delar för eldrivna körningen. ... 27
Figur 9: Risker för olika komponenter som antecknades på en Whiteboardtavla. ... 28
Figur 10: Den definition som angår RaceRunnern (markerat grönt). ... 29
Figur 11: Utvärderade positioner från praktiska tester. ... 32
Figur 12: Valt huvudkoncept (koncept B). ... 36
Figur 13: Prototypframtagning och hur den sattas på RaceRunnern. ... 37
Figur 14: Närbild på hur prototypen fästes. ... 38
Figur 15: Hur prototypen testades. ... 38
Figur 16: Koncept av hur underkroppsstödet kan fästas på eldrivna RaceRunnern. ... 39
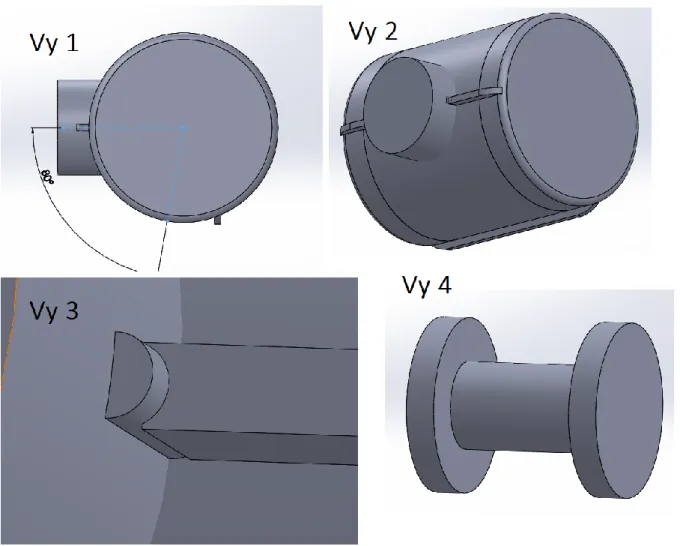
Figur 17: Olika vyer av hur fällbarheten skulle kunna fungera på underkroppsstödet. ... 41
Figur 18: Vart funktionen för att justera längden inspirerades från. ... 42
Figur 19: Funktionen av hur underkroppsstödets längd ska ställas in. ... 42
Figur 20: Olika koncept av fotdelen. ... 43
Figur 21: Första versionen av underkroppsstödet. ... 45
Figur 22: Spärr som togs bort från första versionen av underkroppsstödet. ... 46
Figur 23: Stödhållaren som utvecklades istället för snap-fit funktionen på underkroppsstödet. 46 Figur 24: Motverkan av fullständigt cirkulärt hål. ... 47
Figur 25: Skåra som motverkar att rören roterar. ... 47
Figur 26: Komponenterna som fäster underkroppsstödet på eldrivna RaceRunnern. ... 48
Figur 27: Komponenterna som styr fällbarheten. ... 49
Figur 28: Hur röret svetsas på delen som styr fällbarheten. ... 49
Figur 29: Hur själva huvudet sätts ihop (komponenter för fästning och fällbarhet). ... 50
Figur 30: Hur rotationen förhindras. ... 50
Figur 31: Hur fotdelen sätts ihop med röret. ... 51
Figur 32: Hur ändorna på fotdelen täpps igen. ... 51
Figur 33: Hur längden på röret låses fast. ... 52
Figur 34: Exploderad vy av lösningsförslaget. ... 54
Figur 35: Resulterande modell från undersökningen av CE-märkning. ... 57
Figur 36: Renderad bild på slutgiltigt koncept av underkroppsstöd. ... 60
Figur 37: Olika vyer av slutversionen. ... 61
Figur 38: Renderad bild på slutgiltigt koncept av stödhållare. ... 61
Figur 39: Upp- och nerfällt läge av underkroppsstöd. ... 62
Figur 40: Närbild på när underkroppsstödet är uppfälld. ... 63
Figur 41: Potentiella områden där komponenter kan reduceras. ... 63
Figur 43: Skiss A1. ... 92
Figur 44: Skiss A2. ... 92
Figur 45: Skiss A3. ... 93
Figur 46: Skiss B. ... 93
Figur 47: Skiss C1. ... 94
Figur 48: Skiss C2. ... 94
Figur 50: Existerande produkter av stöd. ... 96
Figur 51: Komponenternas numrering för ritningar. ... 97
Figur 52: Ritning för komponent 1. ... 98
Figur 53: Ritning för komponent 3 (mått går att använda för komponent 2). ... 99
Figur 54: Ritning för komponent 4. ... 100
Figur 55: Ritning för komponent 5 (mått går att använda för komponent 6). ... 101
Figur 56: Ritning för komponent 7. ... 102
Figur 57: Ritning för komponent 8. ... 103
Figur 58: Ritning för komponent 10 (mått går att använda för komponent 9). ... 104
Figur 59: Ritning för komponent 11. ... 105
Figur 60: Ritning för komponent 12. ... 106
Figur 61: Ritning för komponent 13. ... 107
Figur 62: Ritning för komponent 14. ... 108
Figur 63: Ritning för komponent 15. ... 109
Figur 64: Ritning för komponent 16. ... 110
Figur 65: Ritning för komponent 17. ... 111
Figur 66: Programmet Vuforia. ... 112
TABELLFÖRTECKNING
Tabell 1: Sökmetoder för insamling av sekundärdata. ... 11
Tabell 2: Resulterande primärdata/information från intervjuerna (täcker flera sidor). ... 25
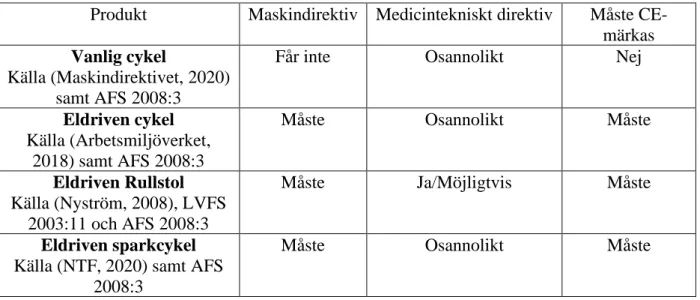
Tabell 3: Likartade produkter till en RaceRunner och hur de relateras till CE-märkning. ... 26
Tabell 4: Visualisering av vanlig och eldriven RaceRunners relation till CE-märkningen. ... 29
Tabell 5: Översiktlighet på regler som angår vanlig och eldriven RaceRunner. ... 30
Tabell 6: Beskrivning av måstekrav. ... 31
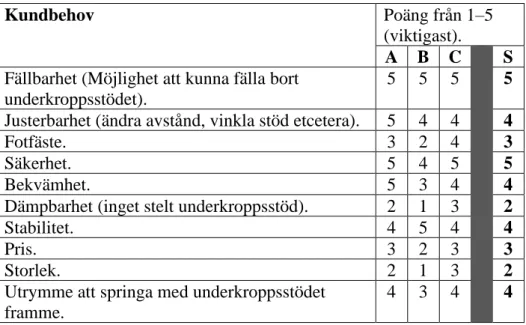
Tabell 7: Viktning av kundbehov. ... 32
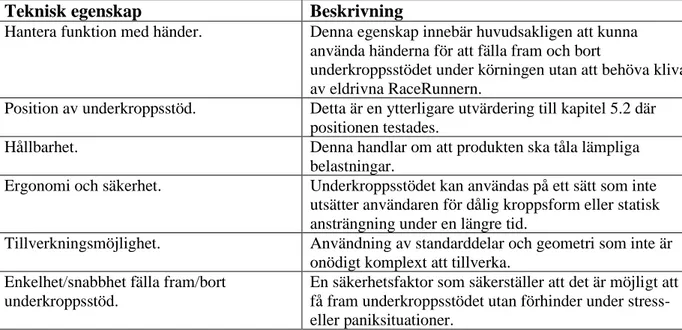
Tabell 8: Beskrivning av de tekniska egenskaperna i QFD:n. ... 34
Tabell 9: Fullständig QFD. ... 35
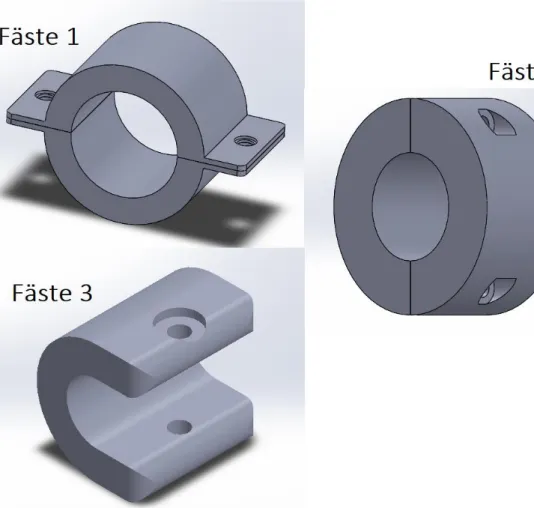
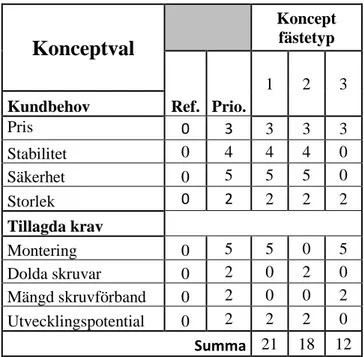
Tabell 10: Val av huvudkoncept. ... 36
Tabell 11: Val av koncept från figur 16. ... 40
Tabell 12: Val av koncept från figur 20. ... 44
Tabell 13: Material och exempel på tillverkningsmetoder. ... 54
Tabell 14: Riskanalys på lösningsförslag av underkroppsstöd (täcker flera sidor). ... 55
Tabell 15: Risker med för högt risktal, riskanalys för RaceRunner. ... 58
Tabell 16: Värden på underkroppsstödet och stödhållarens egenskaper. ... 59
Tabell 17: Hur de tekniska egenskaperna borde prioriteras. ... 64
Tabell 18: Utvärdering av prioritering för underkroppsstödets risker. ... 67
Tabell 19: Gantt schema (del 1 av 2). ... 79
Tabell 20: Gantt schema (del 2 av 2). ... 80
Tabell 21: Riskanalys för uppdragsgivarens vanliga RaceRunner (täcker flera sidor). ... 83
Tabell 22: Riskanalys för uppdragsgivarens eldrivna RaceRunner (täcker flera sidor). ... 88
DEFINITIONER
Tillverkare – Personen som ansvarar över den produkt som vill CE-märkas.
Direktiv – Innehåller krav som har bestämts för en specifik produktgrupp som en tillverkare måste uppfylla för att få sälja sin produkt. Beroende på vad det är för produkttyp avgör vilket typ av direktiv den ska följa då det finns flera olika.
Anmält organ (notified body) – En auktoriserad tredje part som anlitas beroende på
säkerhetsklass av en produkt för att bidra i genomförandet av olika delar i CE-märkningen för ett företag (tillverkaren ansvarar för att anlita en sådan organisation).
Harmoniserade standarder – En standard som uppfyller krav i CE-märkningen helt eller delvis om den appliceras av en tillverkare för sin produkt.
TERMER SOM OFTA ANVÄNDS I RAPPORTEN I majoriteten av sammanhangen syftar dessa begrepp till…
Vanlig RaceRunner – Uppdragsgivarens RaceRunner som inte omfattar nödvändiga delar (komponenter) för att uppfylla en eldriven körning.
Eldriven RaceRunner - Uppdragsgivarens RaceRunner som omfattar nödvändiga delar (komponenter) för att uppfylla en eldriven körning.
Företaget - Uppdragsgivarens företag Psiwisp AB.
Eldriven funktion – Systemet/delarna som behövs för att RaceRunner ska kunna köras med en eldriven motor.
FÖRKORTNINGAR
AFS Arbetsmiljöverkets föreskrifter
AR Augment Reality
CE Conformité Européenne
CP Cerebral Pares
DFA Design For Assembly
DFM Design For Manufacturing
DFMA Design For Manufacturing & Assembly
DT Design Thinking
EES Europeiska Ekonomiska Samarbetsrådet
EU Europeiska unionen
FMEA Failure Mode & Effects Analysis
FMECA Failure Mode, Effects & Criticality Analysis
LVFS Läkemedelsverkets föreskrifter
MDD Medicintekniska direktivet
MS Multipel Skleros
QFD Quality Function Deployment
1 av 72
INLEDNING
1.1. Bakgrund
Att uppfinna nya lösningar som förbättrar vår vardagliga prestanda är en fundamental sak för vår utveckling och överlevnad. För användbara uppfinningar har också regler och lagar utvecklats för att styra upp och kontrollera marknaden (Europaparlamentet och Europeiska Unionens råd, 2008). Produkter måste vara säkra för både oss och miljön. På grund av detta har olika förbund, som exempelvis EU, tagit fram processer som en tillverkare kan följa i syfte att uppfylla kraven från framtagna regler och lagar (europa.eu, 2019). Detta är hjälpsamt på så vis att det skapar vägledning för tillverkaren, som i sin tur förhindrar farliga produkter ifrån att nå marknaden.
En process som är vanligt förekommande för flera olika produkter som måste följa föreskrifter som angår säkerhet, miljö och hälsa är CE-märkning. Detta är en produktmärkning som
används för EU:s inre marknad. CE-märkningen infördes på början av 1990-talet som ett krav för vissa typer av produkter (SIS, 2020). CE står för Conformité Européenne som betyder i överensstämmelse med EG-direktiven.
Om en produkt uppfyller EU:s krav för CE-märkning kan den frisläppas på marknader inom länder som tillhör Europeiska Ekonomiska Samarbetsrådet (EES) (Läkemedelsverket, 2014). För länder utanför EES kan krav från någon annan process än den som används för CE-märkningen behöva följas. Detta är på grund av att dessa länder följer regler och lagar från ett annat förbund än EU. Ett exempel på en annan produktmärkning utanför EU:s
marknadsområde är en så kallad UL-märkningsetikett som behövs för att få exportera varor till USA (Märkas AB, 2019).
Då det kan tyckas vara bra med reglering som förhindrar oss människor ifrån att använda osäkra produkter kan det från en tillverkares perspektiv ibland vara mindre roande. Med bristande kunskaper om dessa regler och lagar från EU, kan en tillverkare påbörja en produktutveckling för att i ett senare skede bli förhindrad av CE-märkningen att sälja sin produkt på marknaden. Det är därför viktigt att börja tidigt med att undersöka om en CE-märkning är ett måste för ens produkt (Europaparlamentet och Europeiska Unionens råd, 2017). Detta är något som också kan vara enklare för större företag som redan arbetar med olika standarder, vilket inte alltid är lika vanligt i mindre eller nya företag. Dessa standarder kan vara för exempelvis kvalitetsledningssystem som många större företag implementerar för sin verksamhet.
Kraven inom en CE-märkning varierar för olika produktgrupper. Några exempel på dessa produktgrupper är maskiner, leksaker, explosiva varor, medicintekniska produkter, elektriska apparater, gasapparater, radioutrustning och tryckbärande anordningar (cemarking, 2020) (SIS, 2020). För exempelvis produkter som klassificeras som en maskin följs ett typ av direktiv, medan exempelvis leksaker följer ett annat typ av direktiv. Det är tillverkaren som ansvarar för att undersöka vilka direktiv ens produkt kan behöva följa för att kunna säljas på marknaden (europa.eu, 2019), vilket kan tyckas vara lite utav ett dilemma eftersom fler än ett direktiv kan gälla för ens produkt. Dock så har många av direktiven samma krav, så det är mera en negativ sak på så vis att man kan behöva anpassa om sig (vilket är tidskrävande) om ett direktiv som måste följas upptäckts i ett senare skede (man behöver alltså inte börja om helt).
2 av 72 Företagsbakgrund
Företaget Psiwisp AB bildades 2015 i syfte att tillverka sina egna RaceRunners (Psiwisp, 2020). En RaceRunner är ett hjälpmedel för individer som har svårt att gå/springa på grund av en funktionsnedsättning. Dock så är företagets RaceRunner inte begränsad till detta utan vilken användare som helst kan egentligen använda denna produkt. Detta är också ett mål inom företaget, att utveckla en RaceRunner som kan attrahera människor med och utan
funktionsnedsättningar. På grund av detta har dem undersökt utvecklingsmöjligheter för deras RaceRunner. I nuläget arbetar företaget med att vidareutveckla sin RaceRunner (göra ett derivat av befintlig produktplattform) så att en eldriven motor för körningen kan tillämpas. Detta kan förhoppningsvis fånga intresset av flera användare samt förbättra användningen. Något som företaget också vill uppnå är att möjliggöra så att deras RaceRunnerns, med och utan eldriven funktion, kan erbjudas som ett hjälpmedel genom olika hjälpmedelscentraler. Detta är i syfte att öppna upp fler möjligheter på marknaden.
1.2. Problembeskrivning
Problembeskrivningen är baserad på uppdragsgivarens utgivna direktiv om detta projekt (bilaga 1) och de konversationer som har hafts med uppdragsgivaren angående problemet.
För att kunna erbjuda en RaceRunner som ett hjälpmedel måste en CE-märkning genom det medicintekniska direktivet genomföras. Hur man genomför en sådan CE-märkning är något företaget inte har tidigare erfarenheter av, därför har de behov av en vägledning genom denna process. Det saknas kunskaper om CE-märkningen är ett måste angående företagets
RaceRunners, det kan till och med vara så att dem inte får CE-märkas. Angående eldrivna funktionen kan det också vara så att ett annat direktiv måste följas, vilket ska också undersökas i detta projekt. Problemet kommer handla om att göra en fallstudie på hur den medicintekniska CE-märkningen uppfylls för en produkt som ska stödja en användares gång och löpning. Med andra ord handlar första projekthalvan om att undersöka alla CE-märkningskrav (speciellt de medicintekniska kraven) som kan gälla för företagets RaceRunners.
Ett ytterligare problem angående företagets eldrivna RaceRunner är att i nuläget finns det inget underkroppsstöd för användarens ben att vila på under körning med den eldrivna motorn. Användaren måste hålla sina ben i luften under körningen vilket blir ansträngande under en längre användning. Detta försämrar användarvänligheten och är mindre säkert, som i sin tur också påverkar CE-märkningen där användarvänlighet och säkerhet är ett betydligt krav.
1.3. Syfte och Avgränsningar
Syftet med detta projekt var att ta fram ett underlag till företaget på hur man genomför den medicintekniska CE-märkningen så att dem kan genomföra detta i framtiden. Syftet var också att förbättra användarvänligheten på företagets eldrivna RaceRunner genom att
produktutveckla ett underkroppsstöd för eldrivna körningen.
Projektet har blivit jämnt tidsuppdelat i två bitar. I första delen av projektet kommer den medicintekniska CE-märkningen undersökas och i andra delen kommer ett underkroppsstöd utvecklas till företagets eldrivna RaceRunner.
Att endast ta fram ett underlag innebär att inga konstruktionsändringar kommer att göras på företagets RaceRunners för att anpassa dem efter kraven av CE-märkningen. Sedan innebär
3 av 72 detta också att kliniska data inte kommer undersökas eller tas fram till produkten. Förklaringar på hur produkten uppfyller de olika kraven som finns inom medicintekniska direktivet kommer inte att göras. Ett undantag, till att inte göra själva genomförandet av CE-märkningen, är riskanalysen då den ansågs av uppdragsgivaren som en nyttig lärdom till detta projekt. Detta projekt utgår från direktiv MDR 2017/745 (nya medicintekniska direktivet) då det äldre direktivet MDD 93/42/EGG slutar att gälla 26 maj 2020. Företaget kommer inte vara färdig med CE-märkningen till detta datum och måste därför anpassa sig till det nya medicintekniska direktivet.
Angående mekanismen för att kunna fälla fram och bort underkroppsstödet eftersträvas endast mekaniska lösningar (inga elektriska) för att motverka för komplexa lösningsförslag och minska kostnader. En annan anledning är också att produktutvecklingen sker under en halva av tidsplanen, därför skulle tidsfaktorn också kunna bli ett problem om lösningsförslaget blir för komplext.
Användningen för detta underkroppsstöd är definierad från uppdragsgivaren som en universell produkt, som då inkluderar äldre personer och individer med olika funktionsnedsättningar. Detta gör att enkelheten av användning och anpassbarhet till användaren blir väsentliga egenskaper som måste finnas hos underkroppsstödet.
För att få en generell bild av hur funktionsnedsättningar kan påverka användningen av en RaceRunner kommer ett fåtal funktionsnedsättningar undersökas, nämligen cerebral pares (CP-skada), Downs syndrom, stroke, multipel skleros (MS) och ryggmärgsbråck. Dessa var förslag från uppdragsgivaren att läsa på om och få en grov överblick. Andra funktionsnedsättningar utöver dessa kommer inte undersökas.
Underkroppsstödet är tänkt att utvecklas till det stadie där en första verklig prototyp kan tas fram. Detta eftersträvas så att eventuella förändringar som krävs inför produktionen kan diskuteras med uppdragsgivaren och möjligtvis åtgärdas i designen av underkroppsstödet.
1.4. Frågeställningar
Angående tillvägagångsättet att undersöka hur en produkt blir CE-märkt är inte beroende av ny forskning. Detta är på grund av att CE-märkningen styrs av EU:s lagar och utgår med andra ord ifrån en specifik källa som är avgörande om en produkt får CE-märkas eller inte, källan är MDR 2017/745 (Europaparlamentet och Europeiska Unionens råd, 2017). Undersökningen om CE-märkningen har där av inte tolkats som ett forskningsproblem. Undersökande fråga 1 och 2 angår detta, dessa frågor hör samman.
Undersökande fråga 1: Hur kan en modell framställas som beskriver väsentliga krav en produkt måste uppfylla för den medicintekniska CE-märkningen, modellen måste också ta hänsyn till att produktens avsikt är att fysiskt stödja en användares gång och löpning? Undersökande fråga 2: När en eldriven motor tillämpas för körningen av en sådan
produkttyp, existerar det några betydliga skillnader i processen av den medicintekniska CE-märkningen som påverkar modellen?
4 av 72 För att tydliggöra, modellen kommer vara baserad på fallstudien som skall genomföras. Det är inte en fysisk modell utan en visualisering av alla viktiga upptäckter i undersökningen om den medicintekniska CE-märkningen.
Angående produktutvecklingen av underkroppsstödet finns ett forskningsområde som kan undersökas för en positiv påverkan i designvalen, nämligen ergonomi. Det finns en relevant sammankoppling mellan ergonomi och CE-märkning. Säkerhet och användarvänlighet är två viktiga faktorer i CE-märkningen, vilket kan uppnås genom ergonomiska principer.
Undersökande fråga 3 angår detta.
Undersökande fråga 3: Hur kan en anordning som ska stödja användarens underkropp vid körning med ett eldrivet fordon/redskap utvecklas så att den uppfyller ergonomiska principer och är säker för användaren?
1.5. Målbeskrivning
Då genomförandet av CE-märkningen är en ganska omfattande process, och det finns flera tillvägagångssätt och val som kan prioriteras, är det värdefullt att undersöka de val som möjligtvis är mest fördelaktiga. Mål 1 framställdes för att fånga upp detta, som är direkt kopplat till undersökande fråga 1 och 2. Ett mål för riskanalysen framställdes också, då den är mycket värdesatt för detta projekt.
Mål 1 för CE-märkningsmodellen: Utvärdera om det finns betydliga avvikelser mellan den primär- och sekundärdata som framställs. Avvikelserna är i form av motsägelser som påverkar validiteten och reliabiliteten av den modell som upptäcks/framställs.
Mål 2 för riskanalysen: Utvärdera riskområdena med ett risktal (felsannolikhet,
allvarlighetsgrad och upptäcksannolikhet) för att avgöra den övergripande säkerheten och användarvänligheten av företagets RaceRunners (med och utan eldriven funktion).
För produktutvecklingen av underkroppsstödet eftersträvas ett realistiskt lösningsförslag som tar hänsyn till tillverkningsparametrar, detta efterfrågades av uppdragsgivaren. Mål 4
framställdes för att arbeta målmedvetet mot ett lösningsförslag som inte har ett onödigt
överflöde av komponenter. Som beskrevs tidigare, är också ergonomi ett tema för detta projekt. Mål 5 framställdes så att lösningsförslaget inte blir ett förhinder i CE-märkningen på grund av säkerhetsskäl. Mål 3 framställdes för att kunna uppnå en prioritering mellan ergonomiska egenskaper och tillverkningsegenskaper. Det finns en sannolikhet att mål 4 och 5 kommer divergera, som innebär att ett av målen möjligtvis inte kan fullständigt uppfyllas på grund av kraven från motsvarande mål.
Mål 3 för tillverkning och ergonomi: Ta fram prioritering mellan tillverkning- och ergonomiska faktorer.
Mål 4 för tillverkning: Reducering av alla onödiga komponenter för valt stödkoncept. Mål 5 för ergonomi: Utvärdera riskområden med ett risktal (felsannolikhet, allvarlighetsgrad och upptäcksannolikhet) för att avgöra den övergripande säkerheten och användarvänlighet hos utvecklat underkroppsstöd.
5 av 72
ANSATS OCH METOD
2.1. Planering
Som en första ansats gjordes en planering av hur projektet borde utföras. Idéer brainstormades med uppdragsgivaren om hur arbetet kan dokumenteras och följa en bra struktur så att projektet inte övergår sin deadline. Som planeringsunderlag gjordes ett Gantt schema och en
planeringsrapport (se bilaga 2 för Gantt schema). Planeringsrapporten var en grov översikt om hur detta projekt borde utspela sig och vad som går att få ut av att göra detta. Gantt schemat strukturerades på så vis att den ska följa sex faser som finns i en mera traditionell
produktutvecklingsprocess. De sex faserna är: fas 0 (planering), fas 1 (konceptutveckling), fas 2 (utveckling på systemnivå), fas 3 (detaljutveckling), fas 4 (testning och vidareutveckling) och fas 5 (produktionsupptakt). Undersökningen om CE-märkningen hamnade inom fas 0 i Gantt schemat då den genomförs förre själva produktutvecklingen.
En ytterligare produktutvecklingsprocess som ska komplettera dessa sex faser är Design Thinking (DT) stegen. Se kapitel 2.2.2 för information om DT. Denna har kompletterat den traditionella produktutvecklingsprocessen på så vis att mer ingående fånga upp användarens åsikter och tänka mera utifrån ett kundcentrerat perspektiv. I kapitel 2.2.2 har DT använts huvudsakligen i fas 1 och 2 av den traditionella produktutvecklingsprocessen (figur 2). I kapitel 2.2.2 går det också att läsa om tre produktutvecklingsmetoder som valdes ut för detta projekt. Två metoder planerar att bli använda för att dokumentera arbetet. Det första sättet är en journal i Word där viktiga händelser som har gjorts under dagarna ska antecknats ner. Det andra sättet är en checklista som ska göras i Excel. I denna checklista finns samma aktiviteter som i Gantt schemat men utöver detta finns stycken som angår; vilka aktiviteter som är slutförda, frågor till handledare, svar från handledare, förslag till varandra och utmaningar med aktiviteterna. Syftet med checklistan är att visualisera vad som är viktigt från journalen. Möten en gång i veckan med handledare och uppdragsgivare planerades in, där en genomgång av checklistan med eventuella svårigheter och förslag ska diskuteras.
6 av 72
Figur 1: Övergripande process för undersökning av CE-märkning.
2.2. Översiktlig processbeskrivning
2.2.1. Undersökningen om CE-märkningenI figur 1 är en översiktlig beskrivning av den arbetsprocess som följdes när undersökningen om CE-märkningen genomfördes. Som beskrevs i kapitel 1 är detta en fallstudie på hur en
medicinteknisk CE-märkning genomförs gällande en produkt som ska stödja en användares gång och löpning.
7 av 72
Figur 2: Övergripande process för produktutveckling av underkroppsstöd.
2.2.2. Produktutvecklingen av underkroppsstödet
I figur 2 är en översiktlig beskrivning av den arbetsprocess som följdes när ett lösningsförslag av underkroppsstödet utvecklades. Produktutvecklingen hann bara med fas 0 till 3 och där av är fas 4 och 5 tom.
Design Thinking
Design Thinking (DT) är en bra produktutvecklingsprocess för att genomföra problemlösning med en kundcentrerad tillvägagång, dessutom att försöka vara realistisk (verklighetskopplande) med de lösningar som framkommer. Detta förhindrar ett alldeles för konceptuellt tänkande (Sándorová, et al., 2019).
Denna process består av fem faser (se figur 3) som är: empati, definiering, idégenerering, prototyp och testning. Empatifasen syftar till att förstå verkliga behov av användaren genom att göra intervjuer och observationer. Nästa fas handlar om att definiera problemet. Detta kan göras genom att sätta upp tydliga frågeställningar runtomkring problemområdet. I
idégenereringsfasen kan flera olika metoder användas men några vanliga tillvägagångssätt är brainstorming, tankekartor och att göra sketcher. Därefter kommer prototypfasen där det valda konceptet tas fram i form av en fysisk modell för att testa huvudfunktionen/funktionerna av idén i verkligheten, vilket är vad som görs i testningsfasen. Dessutom i testningsfasen är tanken också att få feedback från potentiella användare.
DT borde inte endast ses som en process utan också en filosofi eftersom utföraren hela tiden ska tänka på användaren och återkoppla till den som ska använda den potentiella nya
8 av 72 produkten. Där av borde inte denna process tolkas som något som görs steg för steg, utan tillvägagångssättet är iterativt och utnyttjar även holism genom att försöka se problemet från flera olika synvinklar och ett bredare perspektiv. Detta medför också fördelen att processen uppmuntrar till innovation genom ett mer kreativt och kundcentrerat tänkande.
Figur 3: Bild på DT processen.
Produktutvecklingsmetoder
I detta projekt har tre metoder valts ut för olika ändamål, nämligen kundcentrerad
kvalitetsutveckling (QFD), Pughs matris och design för tillverkning och montering (DFMA). QFD-metoden valdes för att kunna skapa prioritering för vilka tekniska egenskaper som är viktigast för stödkoncepten. En teknisk egenskap är en översättning av kundbehoven till en fysisk egenskap som går att tillämpa till konceptet/idén som har tagits fram (Poel, 2007). Denna metod är direkt kopplad med mål 3 för att kunna utvärdera om tillverkning- eller ergonomiska faktorer har störst potential för ett bra lösningsförslag. QFD är ett bra verktyg för att förbättra kvalitet, minska utvecklingstid av ny eller förbättrad produkt och andra före-produktionskostnader, öka en organisations kapacitet och huvudsakligen göra ett
företag/utvecklare mer konkurrenskraftig (Poel, 2007).
Pughs matrisen är vanligt använd för att utvärdera olika alternativ som exempelvis olika produktkoncept. Denna metod är lämplig om det eftersträvas att sålla bort idéer och välja ett alternativ som förhoppningsvis är bättre än de andra alternativen (Decision Making
Confidence, 2019). Detta gör också att valen blir mindre baserat på magkänsla.
DFMA är kopplat med mål 4 där förhoppningen är att få ett mera kritiskt tänkande angående om lösningsförslaget går att ta fram i verkligheten, så att den inte blir alldeles för konceptuell. De viktigaste besluten händer i produktutvecklingsfasen och det är där kostnaden av slutgiltig produkt avgörs (Pișta, et al., 2019). DFMA består egentligen av två olika metoder som är design för tillverkning (DFM) och design för montering (DFA). Metodikerna går hand i hand eftersom designändringar för montering kan påverka tillverkningen positivt eller negativt, där
9 av 72 av borde synergi skapas mellan dessa metoder. Syftet med DFMA är att minska den
övergripande kostnaden med tillverkning och implementeringstiden av ny produkt, dessutom öka kvalitet.
2.3. Tillförlitligheten av datainsamlingen
Denna rapport innehåller både primär- och sekundärdata. För undersökningen om CE-märkning planerades primärdata att bli framställd genom att kontakta Läkemedelsverket, en ostrukturerad intervjuform förberedes att bli använd. Sedan förberedes också en
semistrukturerad intervju med en expert inom det medicintekniska området (frågorna går att hitta i bilaga 3). Båda fallen gav kvalitativa data som går att hitta i kapitel 4.1, här går det också att läsa om genomförandet när intervjuerna utfördes. Syftet med detta är att verifiera hur väl informationen som undersöks fram i de olika delkapitlen av kapitel 3.1 stämmer överens med vad som framgår under intervjuerna. Hela kapitel 3.1 är baserad på sekundärdata, sökmetoden går att läsa om i kapitel 2.4.
Kvalitetssäkringen för undersökandet av CE-märkningen uppfylls till stor del av att MDR 2017/745 är baserad på lagar och regler som har tagits fram av EU (Europaparlamentet och Europeiska Unionens råd, 2017), detta innebär att den större felkällan skulle vara om någon information har missats eller misstolkats. Majoriteten av de andra informationskällorna som har använts (såsom Läkemedelsverket hemsida samt länkar och myndigheter som tar fram
standarder) utgår från MDR 2017/745. Undantaget är informationskällor från
Arbetsmiljöverket som är länkat till ett annat direktiv, men som också utgår från EU:s bestämmelser på liknande vis som det medicintekniska direktivet.
En alternativ datainsamlingsmetod som kunde ha övervägts är en enkät med mera riktade frågor, som hade kunnat skickats ut till anställda på Läkemedelsverket. Detta hade givit kvantitativa data, som kan vara fördelaktigt på så vis att det ger statistik. Exempelvis statistik på vad provgruppen tycker är viktigast i CE-märkningen att fokusera på. Denna
datainsamlingsmetod användes inte då detaljer och djup på datainsamlingen ansågs viktigare att bli prioriterad.
Angående förstudien om ergonomi (för produktutvecklingen av underkroppsstödet) finns också primär- och sekundärdata. Kapitel 3.2 och 3.3 är baserad på sekundärdata. Sedan i kapitel 5.1 har uppdragsgivaren och två användare nyttjats för att samla in primärdata genom att upptäcka kundbehoven och undersöka ergonomiska positioner för underkroppsstödet (med hjälp av användare). Urvalet för primärdata kan dock anses vara något begränsat. Majoriteten användare i dagsläget utnyttjar RaceRunners för RaceRunning (parasport) så användargruppen är något liten, sporten växer fortfarande i intresse (RaceRunning, 2020). Kvalitetssäkringen försökte göras genom att nyttja användare som har bra erfarenheter med en RaceRunner i syfte att få bra förslag till produktutvecklingen av underkroppsstödet men detta gav då istället ett begränsat urval.
Liknande som för undersökningen om CE-märkning hade kvantitativa data kunnat utnyttjas för produktutvecklingen av underkroppsstödet. En enkät hade kunnat skickats ut till flera
slumpmässiga användare för att få statistik som hade kunnat bidragit i beslutsfattandet för produktutvecklingen. Exempelvis vilka egenskaper som bör prioriteras för underkroppsstödet. Samma som beskrevs ovanför användes inte denna metod då detaljer och djup på
datainsamlingen ansågs viktigare. Däremot i detta fall kan det ha varit mer relevant angående vad andra, utöver personer med funktionsnedsättningar, har att säga om produktutvecklingen
10 av 72 av underkroppsstödet (eftersom uppdragsgivaren vill att deras RaceRunners ska klassas som universella produkter). På grund av temat i projektet med medicinteknisk CE-märkning kändes det fortfarande som överarbete att samla in sådan typ av data. Uppdragsgivarens RaceRunners ska i första hand eftersträva medicintekniska egenskaper för att kunna klassas som ett
hjälpmedel, så olika förslag från personer med funktionsnedsättningar ansågs viktigare.
2.4. Sökmetoder för datainsamlingen
I tabell 1 går det att se en sammanställning av sökmetoder som har använts för insamling av sekundärdata om CE-märkning, men också om ergonomi och funktionsnedsättningar som används i det senare skedet i produktutvecklingen av underkroppsstödet. I tabellen beskrivs kategori, sökmotor/databas, sökord och inställningar. Kategori beskriver vad informationen som eftersöks ska handla om. Sökmotor/databas beskriver vart ifrån informationen är tagen. Sökord är enstaka ord, meningar eller kombinationer som användes för att söka fram
informationen. Inställningar angår endast när en akademisk databas har använts och beskriver hur sökningen har avgränsats för att minska träffar av olika vetenskapliga artiklar.
Som går att se i tabellen har Google huvudsakligen använts som vald sökmotor, undantaget är för insamling av information om ergonomi. Specifikt för ergonomi var en eftersträvan att göra en litteraturöversikt för vetenskapliga artiklar från år 2010 och framåt. Syftet var att få fram relevant och pålitlig litteratur som kan stödja produktutvecklingen av underkroppsstödet. Detta gjordes genom att söka fram information med akademiska databasen Scopus istället för
sökmotorn Google.
En tidig upptäckt när CE-märkningen undersöktes var att tillverkaren själv ansvarar för att ta reda på om en CE-märkning behövs, samt genomföra CE-märkningsprocessen om det är ett måste. Med en tillverkare menas produktägaren eller ansvariga över en viss produkt.
Informationen om hur en CE-märkning görs är i sin tur väldigt lätt åtkomligt på internet för vem som helst att läsa på om (alla krav om CE-märkning finns att hitta på nätet). Dessutom angående detta projekt är det mindre relevant vad ny forskning säger om CE-märkning. På så vis uteslöts användningen av akademiska databaser för att hitta information, då informationen mest sannolikt inte kommer vara relevant för problemlösningen av detta projekt.
Angående sökorden och hur repetitivt sökmetoden är, har en högre pålitlighet för kategorierna ergonomi och funktionsnedsättningar i tabellen. Huvudsakligen har all information om
funktionsnedsättningarna tagits ifrån 1177 Vårdguiden. Som nämndes i kapitel 1 är det ett förslag från uppdragsgivaren att få en grov överblick om några vanligt förekommande
funktionsnedsättningar, ingen fördjupning har där av gjorts. För kategorin ergonomi användes en sök-kombination istället (därför ser det lite annorlunda ut i tabell 1). Med hjälp av de angivna inställningarna bör samma vetenskapliga artiklar förekomma varje gång de söks genom Scopus (bra reliabilitet i sökmetoden). För datainsamlingen om CE-märkningen är reliabiliteten i sökmetoden inte lika bra, eftersom inga inställningar för att avgränsa
sökningarna har använts. Dock ska det fortfarande gå att hitta alla elektroniska källor som har använts angående CE-märkningen genom de sökord som finns i tabell 1.
11 av 72
Tabell 1: Sökmetoder för insamling av sekundärdata.
Kategori Sökmotor/
databas
Sökord Inställningar
CE-märkning Google ”Hur görs en CE-märkning” ”CE-märkning” ”CE-marking” ”Teknisk dokumentation” ”Medicinteknisk dokumentation” ”Kvalitetsledningssystem” ”LVFS 2003:11” ”AFS 2008:3” ”MDR 2017/745” ”Medicintekniska direktivet” ”Maskindirektivet” ”Läkemedelsverket” ”Arbetsmiljöverket”
”Läkemedelsverket – vägen till CE-märket” ”Läkemedelsverket – regelverk för medicintekniska produkter” ”Läkemedelsverket – riskklassning” ”Arbetsmiljöverket – CE-märkning” ”Arbetsmiljöverket – maskiner” Inga.
Riskanalys Google ”Mall för riskanalys” ”FMEA”
”FMECA”
”Riskanalys av medicintekniska produkter”
Inga.
Likartade produkter till RaceRunner
Google ”Rullstol CE-märkning” ”Elrullstol CE-märkning” ”Cykel CE-märkning” ”Elcykel CE-märkning” ”Elsparkcykel CE-märkning”
Inga.
Standarder Google ”Harmoniserade standarder” ”CE-märkningsstandarder” ”Svenska institutet för standarder” ”SIS”
Inga.
Ergonomi Scopus (”Ergonomic Design” OR
”Ergonomic Product Development” OR ”Ergonomic Product”) -Öppen tillgänglighet. -Högst citerade artiklar. -Artiklars ålder; 2010 och framåt.
Funktionsnedsättningar Google ”CP-skada” ”Down syndrom” ”Stroke” ”MS” ”Ryggmärgsbråck” Inga.
12 av 72
Figur 4: Hur CE-märkningen ser ut på produkter.
TEORI
3.1. CE-märkning
3.1.1. Allmänt om CE-märkning
För att få sälja en produkt utöver länder i ESS kan det vara nödvändigt med en CE-märkning (europa.eu, 2019). Detta innebär att produkten uppfyller EU:s normer gällande säkerhet, hälsa och miljöskydd. Denna märkning är endast ett krav om produkten omfattas av EU:s
specifikationer som säger att denna märkning är ett måste. Ett exempel på när detta är vanligt är produkter som utnyttjar elektricitet. Produkter som inte instämmer med EU:s specifikationer får inte CE-märkas (Maskindirektivet, 2020). Ett
exempel på detta är vanliga cyklar. En cykel klassificeras inte som en maskin och får där av inte CE-märkas enligt maskindirektivet (Arbetsmiljöverket, 2019). Det behövs inget tillstånd för att få genomföra en CE-märkning (europa.eu, 2019). Figur 4 visar hur CE-märkningen ser ut på produkter.
Lagar och föreskrifter
Det direktiv från EU som gäller för medicintekniska produkter är MDR 2017/745 och 93/42/EGG (MDD) (Läkemedelsverket, 2019). Under 26 maj 2020 kommer 93/42/EGG att sluta gälla. Medicintekniska produkter följer svensk lag (1993:584) och förordning (1993:876) dessa kan också ändras i nära framtid på grund av EU-direktivets kommande ändringar. Enligt denna förordning är det Läkemedelsverket som ansvarar för medicintekniska produkters föreskrifter. Det är också denna myndighet som ska kontaktas angående CE-märkningen av produkter som kan förknippas med medicintekniskt bruk. Myndigheten är rättfärdigad att begära framhandlingar om tillverkarens produkt uppfyller väsentliga regelverk, samt ta åtgärden vid ett fall då produkten inte uppfyller krav. Den föreskrift som utges av
Läkemedelsverket är LVFS 2003:11 men som beskrevs ovanför kan denna också ändras i framtiden då den tillhör det gamla direktivet MDD.
De föreskrifter som används för maskiner är AFS 2008:3 från Arbetsmiljöverket, som är myndigheten ansvarig över produkter av denna typ (Arbetsmiljöverket, 2008). Dessa föreskrifter grundar sig på EU:s maskindirektiv 2006/42/EG (Arbetsmiljöverket, 2019). Exempelvis ingår en eldriven cykel i kategorin för maskiner och har som krav att CE-märkas (Arbetsmiljöverket, 2018). Detta är på grund av att det finns flertal rörliga delar och en elektrisk energikälla så fordonet drivs inte av enbart manuellt arbete från människan.
13 av 72 I maskinföreskrifterna AFS 2008:3 ska dessa punkter uppfyllas för exemplet av en elcykel:
1. ”Elcykeln ska uppfylla de grundläggande hälso- och säkerhetskraven i bilaga 1 i AFS 2008:3. 2. En bruksanvisning översatt till svenska ska medfölja elcykeln.
3. En EG-försäkran ska vara upprättad och medfölja elcykeln.
4. Elcykeln ska vara CE-märkt enligt föreskrifternas bilaga 3 i AFS 2008:3.” (Arbetsmiljöverket,
2008).
Likartad produkt till en RaceRunner samt specialanpassningar
För elrullstolar följs medicintekniska direktivet och dessa har sedan 1998 krävt att produkten CE-märks (Nyström, 2008). Specialanpassningar på en produkt som är CE-märkt genom ett sådant sätt som inte är avsett från tillverkaren innebär att CE-märkningsetiketten måste tas bort och ersättas med en ”specialanpassad produkt” etikett. Se nedanför för vad som tolkas vara en specialanpassad produkt enligt MDR 2017/745.
”Specialanpassad produkt: Produkt som tillverkats efter skriftlig anvisning från en person som genom sina yrkeskvalifikationer är behörig enligt nationell rätt och som på sitt ansvar ger speciella konstruktionsegenskaper åt produkten som är avsedd att användas endast för en viss patient och uteslutande för dennes individuella förhållande och behov.
Massproducerade produkter som behöver anpassas till yrkesmässiga användares krav och produkter som massproduceras industriellt efter skriftlig anvisning från en behörig person ska dock inte anses vara specialanpassade produkter.” (Europaparlamentet och Europeiska Unionens råd, 2017)
Regler för hastigheter av fordon
En eldriven rullstol får som snabbast köra 15 km/h i trafiken (Nyström, 2008) (SVENSK STANDARD SS-EN 12184:2014, 2014). Åker föraren snabbare än gångfart, som är cirka 5 till 6 km/h, gäller samma regler som för en cyklist. Föraren måste då köra på cykelbanan och dessutom vara utrustad med reflexer och belysning. Vid maxhastigheten 15 km/h borde elrullstolen också hinna nödsstanna innan 4,5 meter (SVENSK STANDARD SS-EN
12184:2014, 2014). Från Länsförsäkringsbolagets hemsida sägs det dock att ett elfordon utan trampor som har en maxeffekt på 250 watt eller är självbalanserande, som exempelvis en Segway, kan gå max 20 km/h (Länsförsäkringsbolaget, 2020). Det beskrivs också att elfordon som är avsedda för personer med fysisk funktionsnedsättning inte har någon effektbegränsning men får ändå åka max 20 km/h.
14 av 72 3.1.2. Vägledning för CE-märkning av medicinteknisk produkt Klass I
Steg 1
Det första steget i en medicinteknisk CE-märkning är att avgöra om ens produkt tillhör och borde följa det medicintekniska direktivet (Läkemedelsverket, 2013). Detta görs genom definitionerna (punkterna 1 till 4) som går att se i figur 5.
Figur 5: Definitioner om en medicinteknisk produkt.
Vad som är en medicinteknisk produkt har en mycket bred tolkningsfråga men dessa produkter är avsedda för alla delar inom hälso- och sjukvården (Läkemedelsverket, 2013). Det är
tillverkarens syfte/avsikt eller verkningsmekanismen hos en produkt som avgör om den är medicinteknisk. Konstruktionen eller användaren av produkten påverkar inte om den bör definieras som medicinteknisk.
Steg 2
I andra steget måste produktens säkerhetsklass avgöras. Det finns fyra olika klasser som en medicinteknisk produkt kan omfatta, nämligen klasserna I, IIa, IIb och III (Europaparlamentet och Europeiska Unionens råd, 2017). Det som avgör klassificeringen är framförallt produktens avsedda användning och vilken typ av kontakt den ska ha med användaren (riskpotential) (Läkemedelsverket, 2013). Exempelvis om den ska tillföra strålning till människan är det en högre klassificerad medicinteknisk produkt. Produkter av klass I behöver i allmänhet inte anlita ett anmält organ för att genomföra CE-märkningen (Europaparlamentet och Europeiska
Unionens råd, 2017) (Läkemedelsverket, 2019). Produkter i högre riskklasser (IIa, IIb och III) måste anlita ett anmält organ för att genomföra CE-märkningen i lämpliga delar av processen (Europaparlamentet och Europeiska Unionens råd, 2017). Reglerna för klassificeringen går att hitta i MDR 2017/745 Bilaga 8 sida 140.
15 av 72 Steg 3
Alla medicintekniska produkter måste följa viktiga allmänna krav som har tagits fram av regelverk. Dessa allmänna krav finns att hitta i MDR 2017/745 Bilaga 1 sida 94
(Läkemedelsverket, 2019) (Europaparlamentet och Europeiska Unionens råd, 2017).
Dessa allmänna krav angår bland annat hur en produkt ska hanteras och förpackas, materialval, att tillverkning är säker och följer normer, renhet och hygien, skydd mot strålning, utrustning som använder en energikälla samt information som bör ges ut av tillverkaren
(Läkemedelsverket, 2013).
Definieras produkten som en maskin måste också allmänna krav från Arbetsmiljöverkets föreskrifter (AFS 2008:3) uppfyllas. Undantaget är om harmoniserade standarder som täcker möjliga allmänna krav från AFS 2008:3 har använts, då detta enligt presumtionsprincipen innebär att regelverk har uppfyllts (Läkemedelsverket, 2014).
I detta steg ska också den så kallade tekniska dokumentationen tas fram. Denna ska innehålla allt underlag för bedömning om hur ens produkt uppfyller de krav som behövs för
CE-märkningen (Läkemedelsverket, 2016). En medicinteknisk dokumentation borde generellt innehålla; produktionsdokumentation, tillverkningsunderlag, test- och validerings rapporter, installation- och driftdokumentation, underlag för att uppfylla relevanta medicintekniska krav, användarmanualer för medicinteknisk utrustning (qcg, 2020). Det finns också mer ingående beskrivningar om krav på tekniska dokumentationen i MDR 2017/745 Bilaga 2 sida 108 (Europaparlamentet och Europeiska Unionens råd, 2017).
Steg 4
Efter väsentligt underlag (huvudsakligen den tekniska dokumentationen) har framställts ska en EG-försäkran förföras (Läkemedelsverket, 2013). I denna säkerställer och försäkrar tillverkaren om att ens produkt uppfyller alla tillämpliga krav som finns i MDR 2017/745. Denna försäkran ska innehålla referenser till lagen om medicintekniska produkter samt till MDR 2017/745. Huvudsakligen ska all väsentlig information för att identifiera tillverkaren och produkten, dessutom i fallen harmoniserade standarder har tillämpats, finnas med.
Steg 5
Medicintekniska klass I produkter ska vara försedda med en CE-märkningsetikett
(Läkemedelsverket, 2013). Denna måste vara synlig, lättläst och outplånlig. Detta gäller också för bruksanvisningar och försäljningsförpackningar.
Steg 6
Produkten ska anmälas till Läkemedelsverket om den är en klass I produkt av svensk tillverkare (Läkemedelsverket, 2013). Här ska företagets adress anges samt en beskrivning om produkten. Blankett från Läkemedelsverket med dess anvisningar ska tillämpas. Denna registrering har årliga avgifter.
Steg 7
Tillverkaren är också skyldig att bevaka samt dokumentera olyckor och tillbud som kan uppkomma när produkten har börjat användas av kunder (Läkemedelsverket, 2013). Behörig myndighet ska också underrättas angående de land där olyckan uppstod. Läkemedelsverket måste förmedlas om olyckan skedde i Sverige. Tillverkaren är skyldig att utreda och vidta lämpliga åtgärden för att motverka brister i produkten och skicka en slutrapport till behörig myndighet.
16 av 72 Steg 8
Liknande till steg 7 är också ett system där dokumentering av användarnas erfarenheter av produkten nödvändigt (ett kvalitetsledningssystem). Eftersom ständiga förbättringar gör produkten säkrare (Läkemedelsverket, 2013).
3.1.3. Tekniska dokumentationen
Den tekniska dokumentationen ska mer ingående innehålla detta (Läkemedelsverket, 2013): Beskrivning
Det ska finnas en allmän beskrivning av produkten och avsedd användning. Detta inkluderar planerade varianter av produkten. Detta kan exempelvis vara produktnamn,
modellbeteckningar och storlekar.
Ingående material och komponentförteckning Denna ska innehålla:
• Specifikationer.
• Uppgifter om ingående material. • Komponentritningar.
• Huvudritningar.
• Instruktioner för kvalitetskontroll.
Dokumentation för halvfabrikat och delkonstruktioner Denna ska innehålla:
• Specifikationer.
• Relevanta ritningar och huvudritningar. • Kretsar.
• Relevanta tillverkningsmetoder. • Instruktioner för kvalitetskontroll.
Dokumentation för slutprodukt Denna ska innehålla:
• Specifikationer.
• Relevanta ritningar och huvudritningar. • Kretsar.
• Relevanta tillverkningsmetoder. • Motivering för materialval. • Instruktioner för kvalitetskontroll.
Dokumentation för förpackning och märkning Denna ska innehålla:
• Förpackningsspecifikationer. • Kopior på all märkning. • Eventuella bruksanvisningar.
17 av 72 Konstruktionskontroll
Denna angår konstruktionsberäkningar och prestandatester som behövs för att beskriva
säkerheten av användningen för ens produkt. Detta inkluderar dessutom anslutningar till annan utrustning som behövs för att ens produkt ska fungera. Om underlag existerar som kan stärka att ens produkt har funnits i flera år och att dess konstruktion är säker kan denna information vara tillräcklig för att uppfylla krav.
Riskhantering
Detta angår en riskanalys som måste göras på produkten. Denna ska utvärdera vad det finns för risker vid användning som måste vara förenlig med en hög säkerhet och hälsonivå. Fördelarna av att använda ens produkt ska överglänsa de möjliga faror och osäkerheter som kan finnas. Överensstämmelse med väsentliga allmänna krav och harmoniserade standarder
Harmoniserade standarder som har använts ska dokumenteras. Detta gäller även när vissa delar av en standard har tillämpats. För det fall där en standard bara har använts delvis ska det finnas beskrivningar på lösningar som uppfyller resterande allmänna krav i väsentliga föreskrifter från de olika direktiven. Dessa standarder kan exempelvis, utöver produktrelaterade standarder, vara för märkning och information, elsäkerhet och riskanalysen.
Kliniska data
För detta krav är det möjligt att använda tillgänglig relevant litteratur där ens produkts
prestanda, konstruktionsegenskaper, säkerhet och avsett ändamål beskrivs. Tanken med detta är att bevisa och övertyga att produkten uppfyller säkerhetskrav, angående vad den är tillverkad för att göra/utföra. Det går att använda likartade produkters litteratur för att bevisa en egens produkts pålitlighet. Om ingen litteratur existerar måste egna kliniska data framställas genom klinisk prövning.
Protokoll
Den tekniska dokumentationen måste finnas tillgänglig under minst 5 års tid efter att sista produkten har tillverkats. Detta protokoll är till för att stärka överensstämmelsen med
tillverknings- och testprotokoll för de definierade metoder och specifikationer som har angivits från tillverkaren.
3.1.4. Riskhantering
En viktig del för ökad användarsäkerhet är att på ett systematiskt sätt hitta och hantera möjliga risker vid användning av ens nya medicintekniska produkt (Blomster, et al., 2006). Denna är som mest kraftfull om den görs från ett föreperspektiv. Analysen bör genomföras i en grupp med individer som har olika kompetenser och utbildningsbakgrund. Detta bidrar med att väsentliga aspekter kan enklare komma fram, gruppen får ett bredare perspektiv när de har olika erfarenheter. Till en start borde en förstudie genomföras i form av en grov översikt. Denna förstudie ska undersöka om det är meningsfullt att gå vidare med en riskanalys. Deltagarna ska brainstorma fram olika aspekter inför riskanalysen. Exempelvis vad det finns för faror och om man behöver gå vidare för att utvärdera dessa.
Om det anses vara lämpligt att gå vidare med en riktig analys ska deltagarna bygga vidare på denna förstudie. Riskanalysen ska vara mer detaljerad och följa någon typ av standardmetod. Några exempel på riskanalysmodeller är feleffektanalys och kritisk feleffektanalys (FMEA och FMECA), felträdsanalys (FTA) och händelseträdsanalys (ETA).
18 av 72 Vid en riskanalys ska tre frågor ställas som är: Vad kan hända? Hur stor är sannolikheten att det händer? Om det händer, vilka blir konsekvenserna? (Blomster, et al., 2006).
Några exempel på personer som borde medverka i en riskanalys för medicintekniska produkter är tillverkaren, medicintekniska enheten, användaren och extern konsult/tjänst. En egen policy med en mall för hur en riskanalys ska genomföras bör tas fram.
FMECA mall
Det som ingår i denna mall är aktivitet/riskområde vilket beskriver risker som finns med produkten eller dess komponenter vid användning (Blomster, et al., 2006). Felmöjlighet/fara vilket beskriver vad som kan uppstå när denna risk sker. Feleffekt/konsekvens som angår hur användaren kan skadas eller utsättas mot det sämre. Felorsak som beskriver varför denna risk finns eller uppstår. Dessutom brukar det finnas en numeriskbedömning mellan ett till tio om felsannolikhet, allvarlighetsgrad och upptäcktssannolikhet. Genom att multiplicera dessa med varandra kan ett risktal framställas som beskriver det övergripliga allvaret av de sammanlagda faktorerna. Slutligen brukar denna mall innehålla vad för typ av åtgärd som behövs göras om risktalet är för högt.
3.1.5. Allmänt om harmoniserade standarder
Harmoniserade standarder framställs av organisationer såsom CEN, ETSI, CENELEC, ISO, Socialstyrelsen och Svenska institutet för standarder (SIS).
Standarderna i styckena nedanför kan vara hjälpsamma för att framställa en egen typ av medicinteknisk produkt eller för produkter som räknas som maskiner (som då måste tänka på säkerhet angående bland annat sin eldrivna funktion och rörliga delar).
Standarder för medicintekniska produkter
• SOSFS 2001:12 - Socialstyrelsens föreskrifter och allmänna råd om användning och egentillverkning av medicintekniska produkter i hälso- och sjukvården (Blomster, et al., 2006).
• SOSFS 2011:9 – Socialstyrelsens föreskrifter och allmänna råd om ledningssystem för systematiskt kvalitetsarbete (Socialstyrelsen, 2019).
• ISO 14971 - Tillämpning av riskhantering på medicintekniska produkter (Blomster, et al., 2006).
• ISO 13485 - Kvalitetssystem för medicintekniska produkter (Blomster, et al., 2006). • IEC-60601 - Elektrisk utrustning för medicinskt bruk (Blomster, et al., 2006).
• SS-EN 12182 - Handikapphjälpmedel - Allmänna krav och provningsmetoder (Svenska institutet för standarder, 2020).
• SS-EN 12184 - Eldrivna rullstolar och skotrar samt batteriladdare till dessa - Krav och provningsmetoder (Svenska institutet för standarder, 2020).
19 av 72 Standarder för maskiner
• EN 15194 - Cyklar - Elassisterade cyklar - EPAC (elektriska cyklar) (Svenska institutet för standarder, 2020) (Arbetsmiljöverket, 2018).
• SS-ISO 8715 - Eldrivna vägfordon – Vägegenskaper (Svenska institutet för standarder, 2020).
• ISO 12100:2010 - Maskinsäkerhet - Allmänna konstruktionsprinciper - Riskbedömning och riskreducering (Svenska institutet för standarder, 2020).
• ISO 13857:2019 - Maskinsäkerhet - Skyddsavstånd för att hindra att armar och ben når in i riskområden (Svenska institutet för standarder, 2020).
• SIS-ISO/TR 22100-3:2016 - Maskinsäkerhet - Förhållande till ISO 12100 - Del 3: Implementering av ergonomiska principer i säkerhetsstandarder (Svenska institutet för standarder, 2020).
3.1.6. Kvalitetsledningssystem
ISO 9001 är en standard som används av många företag för att kvalitetssäkra
(KvalitetsGruppen, 2020). Detta verktyg hjälper med att bedriva ett effektivt och strukturerat kvalitetsarbete. Ett kvalitetsledningssystem används för att upprätta riktlinjer för sitt
kvalitetsarbete. Detta är så att företaget, oavsett litet eller stort, kan arbeta aktivt med ständiga förbättringar och säkra kvaliteten på sina varor och tjänster.
Då ISO 9001 är en mer generell standard för kvalitetsledningssystem för stora och små företag finns det också mer ingående standarder som är baserad på ISO 9001 för specifika branscher. Som exempel finns Socialstyrelsens SOSFS 2011:9 föreskrifter om ledningssystem för systematiskt kvalitetsarbete angående företag med produkter inom bland annat hälso- och sjukvården (Socialstyrelsen, 2019). ISO 13485 är också ett annat exempel på detta.
3.1.7. Harmoniserade standarder EN 12182 och EN 12184
Dessa två standarder köptes genom Svenska institutet för standarder.
Inom EN 12182 finns det riskområden som krävs bedömas i en riskanalys för produkter av medicinteknisk typ. Utöver detta finns det andra krav/riktlinjer som kan hjälpa företaget (uppdragsgivaren för detta projekt) med CE-märkningsprocessen, som representeras i detta kapitel. Dessa krav och riktlinjer är utöver det som har blivit nämnt från Läkemedelsverkets föreskrifter. EN 12184 hade också delvis användbar information som har summerats i detta kapitel.
EN 12182
Numreringen hänvisar till vilket stycke i standarden detta har blivit nämnt.
4.1 När andra enheter och apparater används tillsammans med den medicintekniska produkten skall även dessa följa samma allmänna krav (från MDR 2017/745) som finns för helheten av systemet.
4.6 Tillverkaren ska ha angivit max vikt och största möjliga belastning som ens medicintekniska produkt ska tåla.
20 av 72 5.2.1 Material som enkelt kan börja brinna ska undvikas att användas om det är möjligt. Om detta inte går ska det finnas med i den tekniska dokumentationen och instruktioner för produkten, samt vilka material som angår denna risk. Detta är viktigt då det är svårare för
personer med funktionshinder att fly ifrån bränder, rök, elektrostatiska laddningar och liknande. 5.5.1 Om den medicintekniska produkten är tänkt att kunna rengöras ska det finnas
beskrivningar på metoder och lämpliga rengöringsmaterial i den information som ges ut av tillverkaren. Från B.5.5.1 nämns det också att det ska vara enkelt att rengöra produkten och damm, vätskor och/eller förorenade material måste kunna städas bort.
14 En medicinteknisk produkts funktioner som kan fällas samman eller justeras ska vara säker för klämrisk genom användning av exempelvis låsningsmekanismer eller säkerhetsavstånd. Om det inte går att motverka (att en användare kan klämma sig) ska detta medges i information utgivet av tillverkare.
18 Om det inte är ett krav för funktionen ska alla vassa kanter, hörn, ytor och skåror finas ut med antingen avfasning, radie eller släthet. Om inte detta går ska skydd eller annat finnas för att motverka att en användare gör sig illa.
B.23 Användning av spakar (exempelvis handbromsar) ska inte övergå en kraft på 60 N. Användning av fotpedaler ska inte övergå en dragkraft på 60 N eller en tryckkraft på 100 N. EN 12184
8.1.3.1 En elrullstol ska kunna åka på ojämn terräng även om något däck har en högre nivå än de andra.
8.1.4.1 En elrullstol får inte gå över 125% av sin topphastighet horisontellt när den åker ner för en backe.
9.2 Om det är tänkt att elrullstolen ska ha delar som kan plockas isär ska delar som väger mer än 10 kilogram vara försedda med lämpliga hanteringsenheter (exempelvis handtag).
Tillverkaren ska förse användaren med information hur den processen, steg för steg, ska gå till (plocka isär, bära och plocka ihop).
9.3 Alla däck ska ha samma typ av ventilanslutning. Det ska stå skrivet på däcket/hjulet maximalt lufttryck i kPa, bar eller PSI.
12.7 Elrullstolar som används utomhus ska ha lysen och kan behöva följa nationella krav för lysen och reflexer. Från C.1 nämns det också att dessa ska sitta säkert på icke rörliga delar. Från C.2 nämns det att elrullstolar som går snabbare än 8 km/h ska det finnas åtminstone en, men inte fler än två framlyktor, som följer samma krav som för cyklar i trafiken. Dessa ska kunna justeras. Från C.3 nämns det att två sidoreflektorer ska finnas för varsin sida av
elrullstolen. Från C.4 nämns det att två baklyktor ska finnas. Från C.5 beskrivs det att två bakre reflektorer ska finnas, dessa ska inte vara triangulära.