Examensarbete Malmö Universitet
15 hp Hälsa och Samhälle
Biomedicinska analytikerprogrammet 205 06 Malmö Mars 2018
VALIDERING AV VARICELLA
ZOSTER VIRUS OCH HERPES
SIMPLEX VIRUS
FRÅN MANUELL TILL AUTOMATISERAD
KOMMERSIELL ANALYS
1
VALIDERING AV VARICELLA
ZOSTER VIRUS OCH HERPES
SIMPLEX VIRUS
FRÅN MANUELL TILL AUTOMATISERAD
KOMMERSIELL ANALYS
AMINA BAJRIC
Bajric A. Validering av varicella zoster virus och herpes simplex virus – från manuell till automatiserad kommersiell analys. Examensarbete i biomedicinsk
laboratorievetenskap, 15 högskolepoäng. Malmö Universitet: Fakulteten för
Hälsa och Samhälle, institutionen för Biomedicinsk laboratorievetenskap, 2018. Syftet med denna valideringsstudie var att värdera lämpligheten att överföra den manuella analysen av aktuell infektion av Varicella Zoster Virus (aVZV IgM) och Herpes Simplex Virus (aHSV IgM) med SIEMENS Enzygnost® till en av de automatiserade analysinstrumenten EUROIMMUN Analyzer I (ELISA) eller DiaSorin LIAISON® XL. Arbetet utfördes på Klinisk Mikrobiologi i Lund. Konsekutiva serumprover för VZV IgM (n=108) och för HSV IgM (n=116) från det vardagliga flödet analyserades, tillsammans med 10 PCR- eller
serokonversion-konfirmerade positiva serumprover av primär infektion VZV och HSV samt 10 positiva för reaktiverad infektion av VZV och HSV. Utöver det användes 10 serumprover konfirmerade positiva för Cytomegalovirus (CMV) respektive 10 för Epstein-Barr Virus (EBV) för att testa korsreaktionen metoderna emellan. Resultatet från VZV-valideringen i Analyzer I samt LIAISON® XL gav en överensstämmelse på 93% respektive 94% av de konsekutiva proverna, 71% respektive 86% av de primärinfekterade proverna och 75% respektive 58% av de reaktiverade proverna, samt en korsreaktivitet (positiva och gränsvärden) på totalt 33% respektive 20% av proverna. Resultatet från HSV-valideringen i Analyzer I samt LIAISON® XL gav en överensstämmelse på 84% respektive 87% av de konsekutiva proverna, 82% respektive 18% av de primärinfekterade proverna och 40% respektive 10% av de reaktiverade proverna, samt en korsreaktivitet (positiva och gränsvärden) på totalt 67% respektive 47% av proverna. Enligt
rekommendation efter utförandet av denna studie så bör analysen av HSV IgM uteslutas från båda automatiserade metoder medan VZV IgM bör kontrolleras något ytterligare i Analyzer I, med förhoppning om att denna metod kan vara känsligare.
Nyckelord: DiaSorin LIAISON® XL, EUROIMMUN Analyzer I, Herpes
2
VALIDATION OF VARICELLA
ZOSTER VIRUS AND HERPES
SIMPLEX VIRUS
FROM MANUAL TO AUTOMATED
COMMERCIAL ANALYSIS
AMINA BAJRIC
Bajric A. Validation of varicella zoster virus and herpes simplex virus – from manual to automated commercial analysis. Degree project in biomedical
laboratory science, 15 credits. Malmö University: Faculty of Health and Society,
Department of Biomedical science, 2018.
The approach of this validation study was to evaluate the adequacy for
transferring the manual analysis method of ongoing infection of Varicella Zoster Virus (aVZV IgM) and Herpes Simplex Virus (aHSV IgM) with SIEMENS Enzygnost® to one of the automated instruments EUROIMMUN Analyzer I (ELISA) or DiaSorin LIAISON® XL. The study was carried out at Clinical Microbiology in Lund. Consecutive serum samples for VZV IgM (n=108) and HSV IgM (n=116) from the daily local flow of tests were analyzed, along with 10 positive for primary infection of VZV and HSV, confirmed by PCR or
seroconversion, and 10 with reactivated infection of VZV and HSV. Beyond those, 10 serum samples confirmed positive for Cytomegalovirus (CMV) respectively 10 for Epstein-Barr Virus (EBV) to test the cross-reaction between the three methods. The results from the validation of VZV in Analyzer I and LIAISON® XL gave an agreement of 93% and 94% respectively in the consecutive tests, 71% and 86% respectively in the primary infected tests and 75% and 58% respectively in the reactivated tests, and also a cross-reactivity (both positive and in between-values) at a total of 33% respectively 20% of the tests. The results from the validation of HSV in Analyzer I and LIAISON® XL gave an agreement of 84% and 87% respectively in the consecutive tests, 82% and 18% respectively in the primary infected tests and 40% and 10% respectively in the reactivated tests, and also a cross-reactivity (both positive and in between-values) at a total of 67% respectively 47% of the tests. According
recommendations after the performance of this study, the analysis of HSV IgM should be excluded from both of the automated methods while VZV IgM should be controlled further in Analyzer I, with hopes that this new method could be more sensitive.
Key words: DiaSorin LIAISON® XL, EUROIMMUN Analyzer I, Herpes
3
INNEHÅLLSFÖRTECKNING
BAKGRUND ... 4 Grundläggande serologi ... 4 Humana herpesvirus (HHV) ... 4 VZV ... 5 HSV ... 5 SYFTE ... 5MATERIAL OCH METOD ... 6
Material och urval ... 6
Metod ... 6 Enzygnost® ... 6 Analyzer I ... 7 LIAISON® XL ... 7 Resultatsammanställning ... 7 Precision ... 7 Etik ... 7 RESULTAT ... 8 VZV... 8 Korsreaktivitet ... 9 Kvalitetspanel ... 9 HSV ... 10 Korsreaktivitet ... 11 DISKUSSION ... 11 Resultatdiskussion ... 11 Metoddiskussion ... 13 KONKLUSION ... 14 REFERENSER ... 15 BILAGA 1 ... 17 BILAGA 2 ... 22
4
BAKGRUND
I dagsläget på Klinisk Mikrobiologi i Lund används en manuell analys för
påvisning av antikroppar mot bland annat primär, reaktiverad eller utläkt infektion av varicella zoster virus, alltså anti-VZV IgM (aVZV IgM) samt av herpes
simplex virus (aHSV IgM). Den manuella analysen är en indirekt Enzyme Linked Immunosorbent Assay (ELISA) med kittet Enzygnost® Anti-VZV/IgM från SIEMENS Healthcare Diagnostics (Marburg, Tyskland). Denna studie har utvärderat om det är möjligt att överföra den manuella analysen av aVZV IgM och aHSV IgM till någon utav de två automatiserade metoderna med kittet Anti-VZV Glycoprotein ELISA (IgM) i EUROIMMUN Analyzer I (Lübeck, Tyskland) eller med kittet LIAISON® VZV IgM i DiaSorin LIAISON® XL (Saluggia, Italien).
En acceptabel validering bygger på att den nya metoden ska vara lika bra eller bättre än den befintliga metoden, vilket i sig kan ses genom jämförelse av sensitivitet, specificitet och precision. Precisionen ses genom
variationskoefficienten (CV) genom analys av repeterbarhet (intra-CV) och
reproducerbarhet (inter-CV) [1-2]. De automatiserade analysinstrumenten som ska valideras ingår i en flexibel ackreditering utfärdad av SWEDAC, vilket innebär att en medicinskt ansvarig läkare godkänner eller nekar valideringen.
Grundläggande serologi
Benämningen serologi innebär studien av antikroppar som finns i serum, och hur dessa reagerar med diverse antigen [3]. I de flesta fall gäller det specifika
antikroppar riktade mot antigenepitoper tillhörande mikrobiellt betingade infektionssjukdomar. Inom serologiska studier är ELISA en användbar påvisningsmetod som kan ge information om patientens historik med tidigare genomläkt infektion eller immunisering mot mikroben men samtidigt även en pågående primär eller reaktiverad infektion, beroende på vilken isotop av antikroppen som undersöks [4].
Det finns stora möjligheter för antikroppar avseende inbindning, vare sig det är en mikrobs antigen eller en makromolekyl. Igenkänning av antigen sker genom deras så kallade epitoper. En antikropp binder till flertalet epitoper, och affiniteten för alla bindningar som sker är starkare än affiniteten som finns mellan endast en antikropp och en epitop. Denna samlade styrka kallas för aviditet. Det är av stor betydelse att inte förbise affiniteten av det specifika antigenet till antikroppen, då det kan ske en korsreaktion vid serologisk analys. Det innebär att diverse
antikroppar kan binda till liknande epitoper, och en osäker reaktion sker [3].
Humana herpesvirus (HHV)
HHV är en grupp av virus med dubbelsträngat DNA (dsDNA) under familjen humana Herpesviridae och släktet Herpesvirales. Herpesviridae delas in i tre undergrupper: α-, β- och γ-herpesvirus. I den förstnämnda ingår bland annat HSV-1, HSV-2 och VZV, i den andra humant Cytomegalovirus (CMV) och i den sistnämnda Epstein Barr-virus EBV [5]. Medlemmar av HHV har alla samma strukturupplägg, med en glykoproteinomsluten kapsid, där glykoproteinerna spelar roll vid bland annat celladhesion och skydd från immunförsvaret [4, 6]. Genprodukterna och proteinsekvenserna som utgör virusets funktion är också lika, trots skillnaden i storlek och komplexitet i genomet. Dessa står för det initiala
5
inträdet i värdcellen, DNA-syntes och slutligen utsläpp av viremin och därefter spridningen till omkringliggande celler [2, 7]. Många gener i VZV, HSV-1 och HSV-2 är snarlika, och kan därmed utgöra en svårighet vid analys och därmed leda till falskt positiva resultat på grund av korsreaktion [6].
VZV
VZV, som orsakar det som vardagligt kallas vattkoppor, smittas luftburet. De karaktäristiska utslag, vesiklar med omkringliggande rodnad, som ses vid
vattkoppor infinner sig inte förrän 11-13 dagar efter exponering. Detta blåssekret kan användas vid PCR-analys. Vid genomgången utläkt infektion vistas viruset i latent läge i den spinala ganglien och kan vid reaktivering spridas genom
nervsystemet och orsaka så kallat herpes zoster, eller bältros, och kan vid
allvarliga fall leda till ansiktsförlamning (facialis pares). Den största tendensen för allvarliga konsekvenser ses hos primärt infekterade vuxna och äldre, samt hos immunsupprimerade individer [4, 8].
VZV IgM, den primära infektionens immunglobuliner, ses inte i serum förrän ungefär 2-5 dagar efter det initiala utslaget. IgM stegras då tillsammans med IgG, varpå den högsta titern ses efter 2-3 veckor. Efter denna stegring ses en hastigt sjunkande titer för IgM, medan halten IgG, som talar för en genomgången
infektion eller i vissa fall immunisering, sjunker mycket långsammare. En riktlinje är att IgM är detekterbart i maximalt ett år, medan IgG kan detekteras i åratal [9].
HSV
Det finns två typer av HSV, HSV-1 och HSV-2, vars karaktärer är snarlika. Bådadera infekterar mukösa epitelceller med dsDNA som sedan replikeras, varpå virusen orsakar symtom med blåsor och dröjer därefter latent i neuroner. En olikhet är bland annat att HSV-1 oftast förknippas med utslag ovanför midjan, medan HSV-2 oftast ger utslag under midjan. Infektion av HSV möjliggörs genom brister i hudbarriären genom direktkontakt och vätska från en smittad person, som vid sexuell kontakt. Symtomatisk infektion skapar vätskefyllda vesiklar vid den initiala infektionsplatsen, medan infektionen samtidigt kan vara asymtomatisk [4].
Titern av IgM vid en HSV-infektion ökar inte förrän ungefär 10 dagar efter
akutfasen med symtomuppvisande, samtidigt som IgM kan påvisas vid latens utan klinisk signifikans [10]. Serologiska tester, så som ELISA, är bra för kontroll av primär HSV-infektion, men något sämre för en reaktiverad infektion då titern av IgM endast ökar med liten marginal eller inte ökar alls [4].
SYFTE
Syftet med denna studie var att utvärdera om den manuella metoden för analys av aVZV IgM och aHSV IgM med Enzygnost® kan överföras till någon av de automatiserade kommersiella metoderna med Analyzer I eller LIAISON® XL.
6
MATERIAL OCH METOD
För projektet användes LIAISON® XL och Analyzer I för analys av alla prover. Utöver det användes Enzygnost® för jämförelse av korsreaktion metoderna emellan.
Material och urval
Serum- och plasmaprover som användes i studien beställdes från biobanken i Lund eller var lokala prover som förvarats i frys eller kyl på klinisk Mikrobiologi i Lund. 108 konsekutiva prover för VZV IgM och 116 för HSV IgM analyserades. Prover som beställdes var bekräftat IgM-positiva av VZV, HSV, CMV och EBV, antingen genom bekräftad positiv PCR-analys av bland annat blåssekret och cerebrospinalvätska, eller genom serokonversion samt korrekt serologisk bild med logisk anamnes. För CMV gällde även att IgG-aviditeten var låg. Proven som beställdes var följande: 10 prover som påvisat primär infektion av VZV IgM, 10 prover som påvisat reaktiverad infektion av VZV IgM, 10 prover som påvisat primär infektion av HSV IgM, 10 prover som påvisat reaktiverad infektion av HSV IgM, 10 prover som påvisat primär infektion av CMV IgM och 10 prover som påvisat primär infektion av EBV IgM. Utöver detta användes 15 externa kvalitetskontroller av VZV IgM (3 positiva och 12 negativa), samt en kommersiell positiv kontroll (ett positivt patientprov eller en positiv driftkontrollspool) för både VZV IgM och HSV IgM som analyserats 10 gånger under samma körning och 10 gånger under olika körningar för att kontrollera inter- och intra-CV.
Metod
I Analyzer I och LIAISON® XL analyserades alla framtagna prover. De prover som kontrollerades för korsreaktivitet analyserades även i Enzygnost® för att jämföra graden av korsreaktivitet mellan den nuvarande metoden och de två automatiserade.
Enzygnost®
Den manuella metoden med Enzygnost® Anti-VZV/IgM är en indirekt ELISA. Brunnarna består av två ihopsatta remsor, där den ena är antigenbelagd med hjälp utav VZV-infekterade humana fibroblaster och den andra med friska cellantigen, alltså som negativ kontroll för varje prov. Till dessa sätts serum- eller plasmaprov dubbelt som spätts (1:20) med medföljande buffert och tillsatts en reumatoid faktor-absorbent (RF-absorbent). RF-absorbenten binder till all IgG i provet för att minska risken för falskt positiva resultat. Om det i provet finns antikroppar specifika för antigenen på plattan kommer dessa binda in till plattan. Utöver proven tillsätts även positiv respektive negativ kitspecifik kontroll, endast spädda med bufferten (1:40). Plattan tvättas efter inkubation för eliminering av obundna antikroppar samt all IgG som bundit till RF-absorbenten. Det enzymaktiva spädda konjugat som därpå tillsätts, binder in till de specifika antikropparna och gör så att substratet, efter att konjugatet tvättats bort och efter inkubation med substratet, ger en blå färg i brunnen. Reaktionen stoppas. Avläsning av plattan utförs i TECAN Sunrise™ med 450 nm. Under 0,15 anges ett negativt resultat, medan ett värde mellan 0,15-0,24 anger ett gränsvärde (svagt positiv aktivitet) och ett värde över 0,24 anger ett positivt resultat.
7 Analyzer I
Serum- och plasmaprover späds med en IgG-bindande och RF-absorberande lösning innehållande antikroppar från get riktade mot humant IgG. 96-hålsplattans brunnar är belagda med framrenade glykoprotein från VZV. De spädda serum- eller plasmaproven, kalibratorer och positiv samt negativ kontroll inkuberas i dessa brunnar vilket möjliggör inbindning av VZV IgM till glykoproteinet. Plattan tvättas för eliminering av obundet material, och som konjugat används sedan peroxidasmärkt anti-IgM riktat mot humant IgM som binder till de inbundna antikropparna. Efter inkubation tvättas konjugatet bort och vid tillägget av ett kromogent substrat fås ett färgomslag, varpå reaktionen stoppas efter inkubation. Plattan avlästes i 450 nm med referensvåglängden 620 nm. Resultaten beräknades som en kvot mellan absorbansvärdet av provet genom absorbansvärdet av
kalibratorn för kittet. Om detta förhållande har värde under 0,8 anges det som negativt. Om värdet är mellan 0,8-1,1 anges det som gränsvärde och är det över 1,1 anges resultat som positivt.
LIAISON® XL
LIAISON® XL använder sig utav avläsningsmetoden chemiluminescent immunoassay (CLIA), eller kemiluminiscens. CLIA detekterar den elektromagnetiska strålningen som avges då elektroner återgår till deras ursprungliga tillstånd efter en kemiskt inducerad excitation [11]. Antigen från VZV beläggs på magnetpartiklarna i ett av reagensen. Spädningsbufferten för spädning av prover och kontroller verkar absorberande, med hjälp av IgG-antikroppar av get mot humant IgG. VZV IgM i proven binder till den fasta fasen under den första inkubationen, varpå obundet material tvättas bort. Efter tvätten reagerar ett konjugat innehållande musantikroppar mot VZV IgM kopplade till ett isoluminolderivat, med de bundna antikropparna, varpå komplexet tvättas
återigen. Slutligen tillsätts reagens som påbörjar kemiluminiscensreaktionen, och ljussignalen mäts med hjälp av en fotomultiplikator. Ljussignalens styrka kommer från mängden bundna antikroppar till isoluminolkonjugatet. Styrkan går under enheten Relative Light Unit (RLU) och översätts sedan till absorbansenheter (AE). Ett resultat under 0,9 anges som negativt, ett resultat mellan 0,9-1,1 anges som gränsvärde och ett resultat över 1,1 anges som positivt.
Resultatsammanställning
Resultat sammanställdes i Microsoft Excel 2016.
Precision
Intra-CV utförs genom analys av ett prov 10 gånger under en analysgång. Därmed sätts antingen provet i replikat eller hälls upp i tio rör varpå maskinen analyserar dessa oavbrutet en gång. Inter-CV utförs genom analys av ett prov en gång om dagen i 10 dagar. CV beräknades enligt följande:
𝐶𝐶𝐶𝐶 =𝑆𝑆𝑆𝑆100%𝑥𝑥̅
Ekvationen innebär att variationskoefficienten (CV) är standardavvikelsen (SD) i procent genom medelvärdet (x̄) [1].
Etik
Proverna som användes i studien är godkända för forskningsenligt bruk genom patientens godkännande vid provtagningstillfället enligt remissen och lyder därmed under Biobankslagen, 2002:297.
8
RESULTAT
Resultaten för VZV och HSV presenteras var för sig nedan. De två
automatiserade metoderna Analyzer I och LIAISON® XL jämförs mot den manuella metoden Enzygnost. Gränsvärdelinjerna i figurerna 1-6 användes för en överblick av överensstämmelsen mellan metoderna ur oberoende
resultatsynpunkt. Alla prover som blev positiva i både Enzygnost® och Analyzer I eller LIAISON® XL hamnar över gränsvärdet i båda metoder, medan de som blev negativa hamnar under. Samtidigt hamnar de prover som inte fick samma resultat i båda analysmetoder i de två övriga rutorna. En tabellsammanställning av resultaten visas i Bilaga 1.
VZV
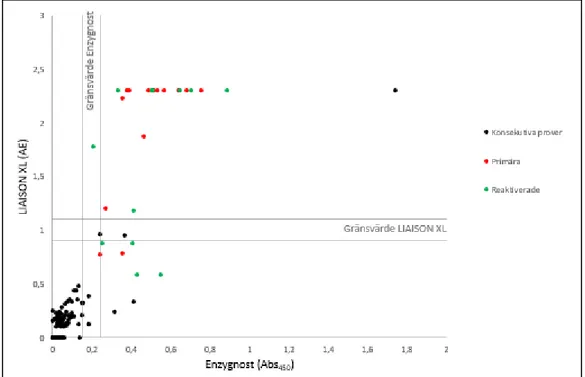
Resultatet från VZV-valideringen i Analyzer I visade en överensstämmelse på 93% av de konsekutiva proverna, 71% av de primärinfekterade proverna och 75% av de reaktiverade proverna (Figur 1).
Figur 1. En sammanställning av resultat från analys av de konsekutiva proverna samt de med primär och reaktiverad infektion av VZV med Analyzer I mot resultatet från Enzygnost®.
I LIAISON® XL fanns en överensstämmelse på 94 % av de konsekutiva proverna, 86% av de primärinfekterade proverna och 58% av de reaktiverade proverna (Figur 2).
9
Figur 2. En sammanställning av resultat från analys av de konsekutiva proverna samt de med primär och reaktiverad infektion av VZV med LIAISON® XL mot resultatet från Enzygnost®. Korsreaktivitet
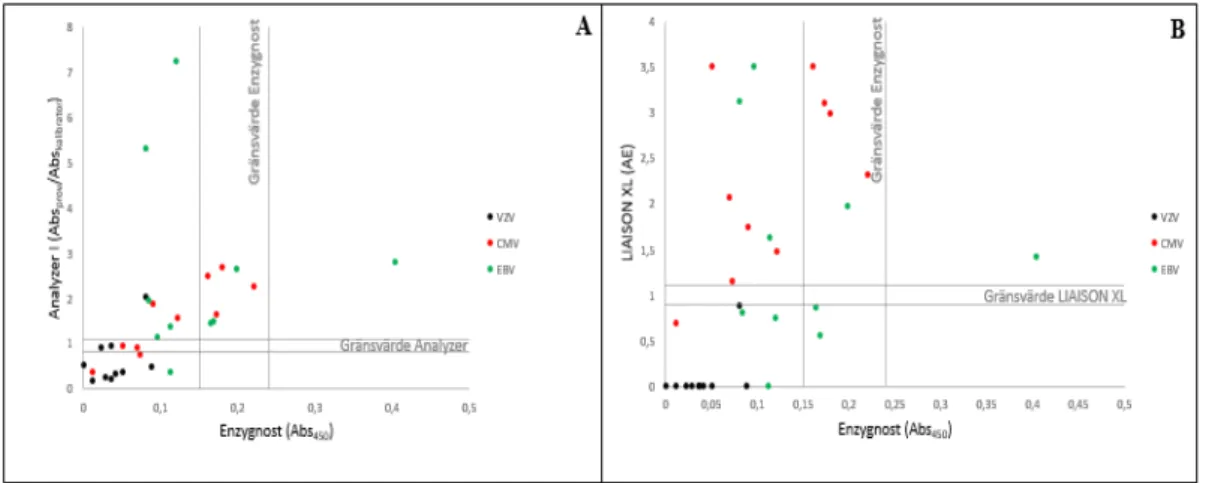
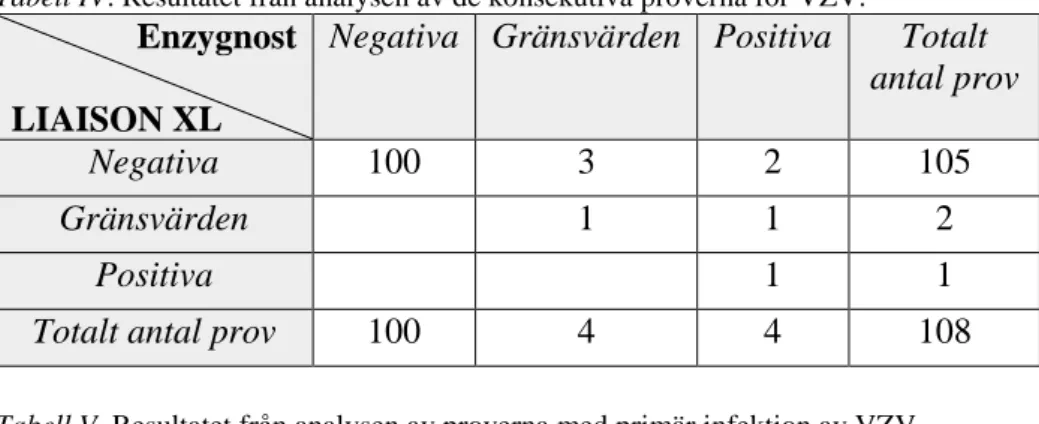
En korsreaktivitet (positiva och gränsvärden) förekom på totalt 33% av proverna i Analyzer I och 20% av proverna i LIAISON® XL (Figur 3).
Figur 3. Resultatet från kontrollen av korsreaktivitet från HSV, CMV och EBV mellan A) Enzygnost® och Analyzer I samt B) mellan Enzygnost® och LIAISON XL.
Resultatet från denna studie visade att intra-CV för Analyzer I blev 6% och inter-CV 8%. För LIAISON® XL blev intra-inter-CV 3% och inter-inter-CV 17%.
Kvalitetspanel
Den internationella kvalitetspanelen från EQUALIS innehöll tre IgM-positiva kontroller och tolv IgM-negativa. I Analyzer I blev de tre positiva kontrollerna positiva och resterande negativa, medan det i LIAISON® XL blev två av de tre positiva, ett gränsvärde på den tredje positiva kontrollen och resterande negativa.
10 HSV
Resultatet från HSV-valideringen i Analyzer I gav en överensstämmelse på 84% av de konsekutiva proverna, 82% av de primärinfekterade proverna och 40% av de reaktiverade proverna (Figur 4).
Figur 4. En sammanställning av resultat från analys av de konsekutiva proverna samt de med primär och reaktiverad infektion av HSV med Analyzer I mot resultatet från Enzygnost®.
I LIAISON® XL förekom en överensstämmelse på 87% av de konsekutiva proverna, 18% av de primärinfekterade proverna och 10% av de reaktiverade proverna (Figur 5).
Figur 5. En sammanställning av resultat från analys av de konsekutiva proverna samt de med primär och reaktiverad infektion av HSV med LIAISON® XL mot resultatet från Enzygnost®.
Resultatet från denna studie visade att intra-CV för Analyzer I blev 8% och inter-CV 13%. För LIAISON® XL blev intra-inter-CV 2% och inter-inter-CV 32%.
11 Korsreaktivitet
En korsreaktivitet (positiva och gränsvärden) visades på totalt 67% av proverna i Analyzer I och 47% av proverna i LIAISON® XL (Figur 6).
Figur 6. Resultatet från kontrollen av korsreaktivitet från VZV, CMV och EBV mellan A) Enzygnost® och Analyzer I samt B) mellan Enzygnost® och LIAISON® XL.
DISKUSSION
Syftet med studien var att överföra den manuella analysen av VZV IgM och HSV IgM med Enzygnost® till en av de automatiserade analyserna i Analyzer I eller LIAISON® XL. De automatiserade metoderna skulle klassas som lika bra eller bättre än den nuvarande manuella. På grund av dålig korrelation mellan resultatet från den manuella och de automatiserade separat, samtidigt som det överlag blev fler falskt positiva och falskt negativa resultat i de automatiserade analyserna, ses den önskade övergången med skepticism.
Resultatdiskussion
Överlag ses en stor skillnad i resultat från de två automatiserade metoderna mot den manuella med Enzygnost®, med låga korrelationer i bådadera (Figur 1-2 och 4-5). De konsekutiva proverna analyserades för en överblick av
överensstämmelsen av kvalitativt resultat metoderna emellan, men somliga manuellt testade negativa prover blev positiva i de automatiserade testerna, vilket leder till en fråga om svikande sensitivitet och specificitet (Figur 1-2 och 4-5). Då ett prov fick negativt resultat i Enzygnost® och positivt resultat i någon av de automatiserade testerna, kontrollerades patientens historik. I fåtal av dessa fall hade VZV påvisats i blåssekret i ett prov taget samma datum eller med någon dags mellanrum. Detta kan optimistiskt innebära att de automatiserade metoderna är känsligare, samtidigt som det kan betyda att det är falska värden på grund av att IgM-titern inte hunnit stiga i serum, då den stiger någon dag efter blåsornas uppkomst. Därmed kan detta resultat inte ses som säkert [9-10].
En svårighet när det kommer till analys av de reaktiverade serum- eller
plasmaproven är att IgM ofta inte ökar vid en reaktiverad infektion, vilket kan bero på att gentranskriptionen för VZV och HSV vid reaktivering är avreglerad jämfört med den reglerade vid primär infektion och avstängda vid latens [4, 12]. Detta kan vara förklaringen till varför så många prover som hade fått positivt resultat eller gränsvärde i Enzygnost® fick negativt resultat i de automatiserade analyserna, vilket möjligen inte ger en grund för en rättvis bedömning. Dessutom
12
är reaktiverade prover svåra att hitta, då det för bedömningen av en reaktiverad VZV- eller HSV-infektion krävs att patienten gått på flera provtagningar för vardera virus för att få en historik över tidslinjen av virusens IgG- och IgM-nivå, eller en korrekt anamnes på remissen med frågeställning om bältros. IgG-nivån är den enda antikroppen som ökar i titer efter reaktivering. Tidigare studier visar att viruspåvisning genom PCR av blåssekret är en känslig metod för en symtomatisk patient i tidigt skede av den reaktiverade infektionen, speciellt med provmaterial från skorpa och vesikelsvabb, samtidigt som det sågs en risk på endast 5-24% för falskt negativt resultat [13]. Även cerebrospinalvätska kan användas för PCR-analys om herpesencefalit misstänks [4].
Ett högst anmärkningsvärt resultat sågs vid analysering av de framtagna
bekräftade positiva proverna. Trots att dessa var konfirmerade med antingen PCR eller serokonversion och eventuellt en korrekt serologisk bild, blev inte vissa av provernas resultat positivt i de automatiserade analyserna. Några av dessa analyserades om i alla tre metoder, för att kontrollera om serumet hade blivit vanskött av upprepad nedfrysning och upptining. Resultatet användes inte i denna rapport då det blev en orättvis behandling av proverna och leder därmed inte till ett representativt urval för en slutsats, som allihopa skulle analyserats om i Enzygnost®, men detta resultat ses ändå med något intresse. De prover som analyserades om för VZV IgM tenderade att öka i absorbansvärde, vilket kan innebära att antikropparna bildat aggregat. Samtidigt tenderade HSV IgM-testet att ge högre absorbansvärde i omanalyseringen, vilket kan innebära att en lägre koncentration av HSV IgM eller en lägre andel aktivt HSV IgM fanns i provet efter frysning och upptining (se Bilaga 2). Om tid hade funnits, hade alla prover analyserats om i den manuella testen för att på så sätt få en bild av om provernas sammanställning av antikroppar förändrats under tiden som de varit frusna eller upptinade, och på sådant sätt ge samma behandling och förhållanden till alla analyser. Tidigare studier har visat att antikroppar är stabila i en temperatur under -70°C, men vid upprepad nedfrysning och upptining minskar
detektionsmöjligheterna av IgG- och IgM-aktivitet [14]. Informationen som fås ur studien är dock vag. Frysningen förstör den hydrofila ytterstrukturen av proteinet och ersätter denna med iskristaller, vilket leder till att proteinet avaktiveras. Vid upptining blottas proteinets hydrofoba inre och denaturerar, samt bildar aggregat till andra protein och därmed förstörs proteinernas funktion [15-16]. Samtidigt finns det inte belägg för detta enligt en senare utförd studie, där
antikroppsnivåerna av IgG för mässling, påssjuka och röda hund inte skiftade i signifikant utsträckning efter upprepad frysning och tining [16]. Att absorbansen för VZV IgM ökade och för HSV IgM minskade kan dock även bero på
produktionsspecifika faktorer, så som vilken sats av reagens som användes vid analysen. Dock är detta inte så troligt med tanke på all tillit producenterna har för att alltid leverera varor med samma funktion och känslighet.
Nästa upptäckt var korsreaktiviteten som ökade i de automatiserade metoderna för HSV-kitten, medan tendensen för korsreaktivitet minskade i de automatiserade metoderna för VZV-kitten (Figur 3 och 6). Största graden av korsreaktion sågs i allmänhet vid analys av CMV- och EBV-positiva prov, vilket ansågs intressant då VZV är närmst besläktat HSV eftersom de båda är α-virus [5]. Studier på
korsreaktioner mellan CMV och EBV mot VZV och HSV har visat att många epitoper på T-celler specifika för HSV-1 och HSV-2 inte finns på VZV, medan de finns i andra α-herpesvirus och EBV. Detta innebär att VZV inte bevisats
13
HSV. Även CMV har bevisats korsreagera med VZV och HSV om än i mer sällsynta fall [17-18]. Trots detta förklaras inte den stora skillnaden mellan korsreaktionerna i Enzygnost® och Analyzer I respektive LIAISON® XL, då det skedde en större grad korsreaktion i de automatiserade metoderna, speciellt vid bruk av HSV IgM-kittet (Figur 6). Totalt sett ses en lägre grad av korsreaktivitet för VZV-kitten i Analyzer I och LIAISON® XL jämfört med Enzygnost®. Resultaten från denna studie visar att inter-CV för både VZV- och HSV-kitten i Analyzer I blev något högre än väntat eller angett (8% respektive 13%), alltså varierar provets resultat mer mellan körningarna än vad producenten hävdar. Producenten för VZV-kittet hävdade att intra-CV är 5,6-7,7% och inter-CV är 7,9-8,5%, och för HSV-kittet att intra-CV är 6,1-10,4% och inter-CV är 8,2-9,1%. Skillnaden i variationskoefficienterna kan dock bero på att serologilaboratoriet på Klinisk Mikrobiologi inte använder sig utav samma sats av reagenskit som
användes då producenten testade detta, men det är en relativt långsökt teori då alla satser borde ge ungefär samma resultat eftersom det används kontroller för att garantera ett säkert resultat. Mest troligt är dock att provet kontaminerats under tiden som det analyserats, då det legat i kylen och öppnats varje dag i tio dagar. Repeterbarheten i de båda kitten är alltså god om kittens metodbeskrivningar används som referens, medan reproducerbarheten är något nedsatt.
Även i LIAISON® XL blev inter-CV i med både VZV- och HSV-kitten högre än väntat eller angett (17% respektive 32%). Producenten hävdade för VZV-kittet att intra-CV är 4,9-10,2% och inter-CV är 8,7-13,0%, och för HSV-kittet att intra-CV är 3,5-14,5% och inter-CV är 6,8-34,3%. Det avsevärt höga värdet för inter-CV för HSV-kittet berodde på att ett värde ena dagen sköt i höjden, medan det resterande 9 dagar inte fluktuerade så mycket. Kontrollen som användes för HSV blev för övrigt positivt varje dag i Analyzer I men endast positivt en dag i
LIAISON® XL, och gränsvärde resterande 9 dagar. Detta är ett udda resultat som möjligtvis hade kunnat förklaras av lågpositiva kitkontroller, vilket dock inte var fallet då de negativa och positiva kontrollerna kontrollerades att de var korrekta varje dag. Återigen är slutsatsen att repeterbarheten i de båda kitten är god, medan reproducerbarheten är något sämre. Det udda beteende som LIAISON® XL visar bekräftas av kvalitetspanelens resultat, där de tre positiva proverna blev positiva i Analyzer I men endast två fick positivt resultat i LIAISON® XL.
Metoddiskussion
Något som framkom senare i arbetet var att producenterna för respektive kit hade inkluderat fler virus i valideringen gällande kontrollen av korsreaktion än de som togs med i denna studie, bland annat parvovirus, ett virus med enkelsträngat DNA, och parasiten Toxoplasma gondii [4]. Detta kan utgöra en framtida studie som kan utföras på Analyzer I för VZV IgM-kittet, då det verkade som att det kittet hade störst chans att godkännas i valideringen. Utöver det bör flera prover analyseras för detta kit, för att få ett mer representabelt värde på valideringen. De VZV positiva proverna togs fram genom en noggrann kontroll av IgM-positivitet i Enzygnost® samt PCR-IgM-positivitet i blåssekret, men möjligheten finns att om det hade utgåtts från prover positiva i LIAISON® XL eller Analyzer I, kunde vissa av dessa visat negativt med testen Enzygnost®. Därför är resultatet något orättvist mot de automatiserade metoderna, samtidigt som det togs i beaktning att dessa metoder möjligen kan vara känsligare än den manuella.
14
En felkälla är det faktum att alla prover inte analyserades om manuellt, vilket är orättvist för de automatiserade metoderna. Detta kunde utförts som försäkring på att sammanställningen i serumet inte hade förändrats efter eventuell upprepad nedfrysning och upptining, då vissa prov var uppemot fem år gamla. En annan frysrelaterad felkälla är det att proverna inte centrifugerades innan analys, för sedimentering av eventuellt störande partiklar som kan fälla ut vid frysning av proverna, så som aggregerade protein eller lipider [15-16]. Å andra sidan blandades proverna innan varje analys, antingen genom vändning av provröret eller genom vortex, för att få bästa möjliga homogenisering av provinnehållet. En kontroll med känd koncentration av antikroppar kunde spätts och en graf kunde ritats med koncentration mot resultat, för att fastställa en detektionsgräns hos metoderna. Även de prover som fått negativt resultat i den manuella metoden men positivt i någon av de automatiserade metoderna, och samtidigt ett positivt PCR-resultat i blåssekret, kunde spädas för en graf av koncentrationen mot resultatet, och därmed bekräftas sant eller falskt positiva.
De konsekutiva proverna för VZV IgM var något komplicerade att ta fram, då många av de flödesprover som kommer in för just denna analys inte
nödvändigtvis inkommer för just frågeställning om infektion av VZV IgM. Kliniker ifrågasätter oftast endast immunitet hos patienten, med kryssar i både IgG och IgM på remissen. Därmed användes 80 konsekutiva prover utan lämplig anamnes, medan det sedan lades till 18 konsekutiva prover med lämplig anamnes och frågeställning. Lämpliga frågeställningar i anamnesen kan vara exempelvis karaktäristiska utslag, facialis pares eller andra symtom för aktuell infektion. Detta kom sedan att tas med i resultatet, trots att dessa tillagda 18 prover klassificerades som selekterade, vilket på ett sätt motverkade syftet. Det ansågs dock inte relevant för resultatet, då de konsekutiva proverna användes för att kontrollera hur mycket de tre metoderna skiljer i resultat på ett och samma prov. De 116 konsekutiva proverna som användes för HSV IgM blev fler än 80
eftersom det först togs fram prover med lämplig anamnes, liknande den för VZV IgM, men sedan kom detta att ändras för att eliminera selektiviteten och alla de 36 prover som kom emellan de 80 framtagna proverna analyserades även de.
KONKLUSION
Slutsatsen med denna studie är att analysen av VZV IgM möjligtvis kommer kunna förflyttas från Enzygnost® till Analyzer I, men inte till LIAISON® XL. För detta krävs dock ytterligare studier. HSV IgM anses inte acceptabel för analys i varken Analyzer I eller LIAISON® XL. Om valideringen av VZV IgM på Analyzer I hade lyckats hade det inneburit ökad patientsäkerhet och snabbare provsvar till kliniker, men det återstår fortfarande att se med ytterligare studier.
15
REFERENSER
1. Nilsson A, Stensiö KE, Lundgren B, (2000). Validering av kemiska
analysmetoder. >https://www.swedac.se< PDF (2018-03-20)
2. Wilson K, (2010) Basic principles. I: Wilson K (Red), Walker J (Reds),
Principles and Techniques of Biochemistry and Molecular Biology.
Cambridge, Cambridge University Press.
3. Abbas AK, Lichtman AH, Pillai S, (2014) Basic Immunology. Philadelphia, Elsevier Saunders.
4. Murray PR, Rosenthal KS, Pfaller MA, (2013) Medical Microbiology. Philadelphia, Elsevier Saunders.
5. Sharma V, Mobeen F, Prakash T, (2016). Comparative Genomics of Herpesviridae Family to Look for Potential Signatures of Human Infecting Strains. International Journal of Genomics, elektroniskt tillgänglig innan publikation.
6. Davison AJ, Bhella D, (2007) Comparative genome and virion structure. I: Arvin A (Red), Campadelli-Fiume G (Red), Mocarski E (Red), Moore PS, Roizman B, Whitley R, Yamanishi K, Human Herpesviruses. Cambridge, Cambridge University Press.
7. Mocarski E, (2007) Comparative analysis of herpesvirus-common
proteins. I: Arvin A (Red), Campadelli-Fiume G (Red), Mocarski E (Red),
Moore PS, Roizman B, Whitley R, Yamanishi K, Human Herpesviruses. Cambridge, Cambridge University Press.
8. Cohen JI, (2013). Herpes Zoster. The New England Journal of Medicine,
369(3), 255-263.
9. Min SW, Kim YS, Nahm FS, Yoo da H, Choi E, Lee PB, Choo H, Park ZY, Yang CS, (2016) The positive duration of varicella zoster
immunoglobulin M antibody test in herpes zoster. Medicine, 95(33), 1-4. 10. Liermann K, Schäfler A, Henke A, Sauerbrei A, (2014) Evaluation of
commercial herpes simplex virus IgG and IgM enzyme immunoassays.
Journal of Virological Methods, vol 199, 29-34.
11. Hofmann A, (2010) Spectroscopic techniques: I Spectrophotometric
techniques. I: Wilson K (Red), Walker J (Red), Principles and Techniques of Biochemistry and Molecular Biology. Cambridge, Cambridge
University Press.
12. Kennedy PG, Rovnak J, Badani H, Cohrs RJ, (2015) A comparison of herpes simplex virus type 1 and varicella-zoster virus latency and reactivation. Journal of General Virology, 96(7), 1581-1602.
13. Mols JF, Ledent E, Heineman TC, (2013) Sampling of herpes zoster skin lesion types and the impact on viral DNA detection. Journal of Virological
Methods, 188(1), 145-147.
14. Petrakis NL, (1985) Biologic banking in cohort studies, with special reference to blood. National Cancer Institute Monographs, vol 67, 193-198.
15. Lee J, Kim SY, Shin S, (2015) Effect of Repeated Freezing and Thawing on Biomarker Stability in Plasma and Serum Samples. Osong Public
Health and Research Perspectives, 6(6), 357-362.
16. Pinsky NA, Huddleston JM, Jacobson RM, Wollan PC, Poland GA, (2003) Effect of Multiple Freeze-Thaw Cycles on Detection of Measles, Mumps, and Rubella Virus Antibodies. Clinical and Diagnostic
16
17. Posavad CM, Wald A, Hosken N, Huang M, Koelle DM, Ashley RL, Corey L, (2003) T Cell Immunity to Herpes Simplex Viruses in Seronegative Subjects: Silent Infection or Acquired Immunity? The
Journal of Immunology, 170(8), 4380-4388.
18. Chiu C, McCausland M, Sidney J, Duh F, Rouphael N, Mehta A, Mulligan M, Carrington M, Wieland A, Sullivan NL, Weinberg A, Levin MJ,
Pulendran B, Peters B, Sette A, Ahmed R, (2014) Broadly Reactive Human CD8 T Cells that Recognize an Epitope Conserved between VZV, HSV and EBV. PLOS Pathogens, 10(3), 1-12.
17
BILAGA 1
En grundligare tabellsammanställning av resultaten från valideringen (Tabell I-XVIII).
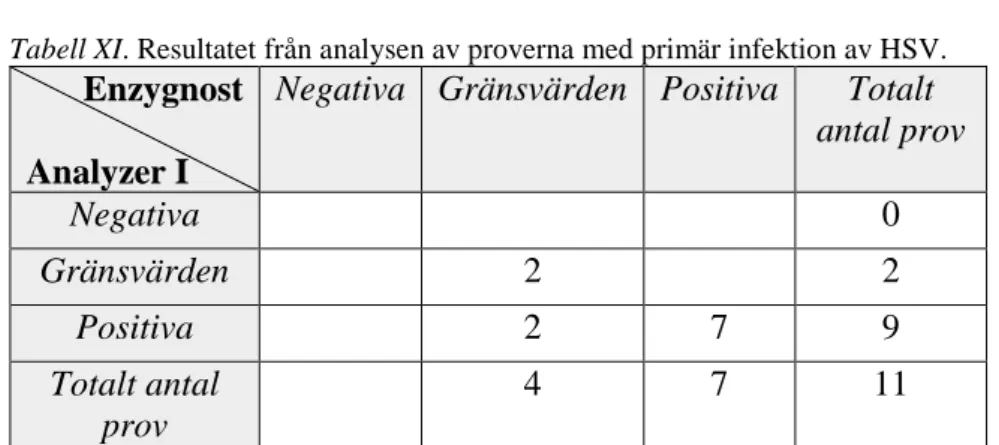
Tabell I. Resultatet från analysen av de konsekutiva proverna för VZV. Enzygnost
Analyzer I
Negativa Gränsvärden Positiva Totalt antal prov Negativa 97 4 1 102 Gränsvärden 0 0 0 0 Positiva 2 1 3 6 Totalt antal prov 99 5 4 108
Tabell II. Resultatet från analysen av proverna med primär infektion av VZV. Enzygnost
Analyzer I
Negativa Gränsvärden Positiva Totalt antal prov Negativa - - 3 3 Gränsvärden - - 1 1 Positiva - - 10 10 Totalt antal prov - - 14 14
Tabell III. Resultatet från analysen av proverna med reaktiverad infektion av VZV. Enzygnost
Analyzer I
Negativa Gränsvärden Positiva Totalt antal prov Negativa 2 2 Gränsvärden 1 1 Positiva 1 8 9 Totalt antal prov 1 11 12
Tabell IV. Resultatet från analysen av de konsekutiva proverna för VZV. Enzygnost
LIAISON XL
Negativa Gränsvärden Positiva Totalt antal prov
Negativa 100 3 2 105
Gränsvärden 1 1 2
Positiva 1 1
Totalt antal prov 100 4 4 108
Tabell V. Resultatet från analysen av proverna med primär infektion av VZV. Enzygnost Negativa Gränsvärden Positiva Totalt
18 LIAISON XL
Negativa 2 2
Gränsvärden
Positiva 12 12
Totalt antal prov 14 14
Tabell VI. Resultatet från analysen av proverna med reaktiverad infektion av VZV. Enzygnost
LIAISON XL
Negativa Gränsvärden Positiva Totalt antal prov
Negativa 4 4
Gränsvärden
Positiva 1 7 8
Totalt antal prov 1 11 12
Tabell VII. Korsreaktiviteten med HSV för Analyzer I och LIAISON XL jämfört med korsreaktiviteten med Enzygnost gällande VZV-kittet.
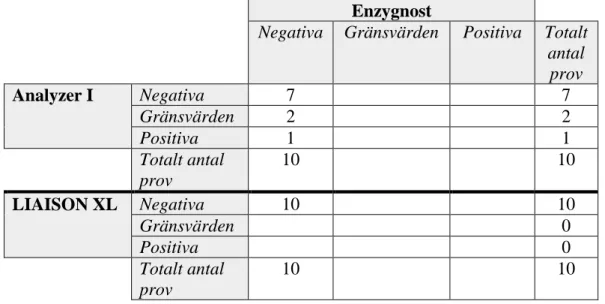
Enzygnost
Negativa Gränsvärden Positiva Totalt antal prov Analyzer I Negativa 7 7 Gränsvärden 1 1 Positiva 1 1 2 Totalt antal prov 9 1 0 10 LIAISON XL Negativa 9 9 Gränsvärden 0 Positiva 1 1 Totalt antal prov 9 1 0 10
Tabell VIII. Korsreaktiviteten med CMV för Analyzer I och LIAISON XL jämfört med korsreaktiviteten med Enzygnost gällande VZV-kittet.
Enzygnost
Negativa Gränsvärden Positiva Totalt antal prov Analyzer I Negativa 7 1 8 Gränsvärden 0 Positiva 1 1 2 Totalt antal prov 7 2 1 10 LIAISON XL Negativa 4 1 5 Gränsvärden 1 1 2 Positiva 2 1 3
19 Totalt antal
prov
7 2 1 10
Tabell IX. Korsreaktiviteten med EBV för Analyzer I och LIAISON XL jämfört med korsreaktiviteten med Enzygnost gällande VZV-kittet.
Enzygnost
Negativa Gränsvärden Positiva Totalt antal prov Analyzer I Negativa 3 3 1 7 Gränsvärden 1 1 2 Positiva 1 1 Totalt antal prov 4 5 1 10 LIAISON XL Negativa 4 5 1 10 Gränsvärden 0 Positiva 0 Totalt antal prov 4 5 1 10
Tabell X. Resultatet från analysen av de konsekutiva proverna för HSV. Enzygnost
Analyzer I
Negativa Gränsvärden Positiva Totalt antal prov Negativa 96 1 1 Gränsvärden 12 12 Positiva 5 2 7 Totalt antal prov 17 1 2 116
Tabell XI. Resultatet från analysen av proverna med primär infektion av HSV. Enzygnost
Analyzer I
Negativa Gränsvärden Positiva Totalt antal prov Negativa 0 Gränsvärden 2 2 Positiva 2 7 9 Totalt antal prov 4 7 11
Tabell XII. Resultatet från analysen av proverna med reaktiverad infektion av HSV. Enzygnost
Analyzer I
Negativa Gränsvärden Positiva Totalt antal prov
Negativa 3 2 5
Gränsvärden 1 1
20 Totalt antal
prov
5 5 10
Tabell XIII. Resultatet från analysen av de konsekutiva proverna för HSV. Enzygnost
LIAISON XL
Negativa Gränsvärden Positiva Totalt antal prov
Negativa 100 1 1 102
Gränsvärden 2 2
Positiva 11 1 12
Totalt antal prov 113 1 2 116
Tabell XIV. Resultatet från analysen av proverna med primär infektion av HSV. Enzygnost
LIAISON XL
Negativa Gränsvärden Positiva Totalt antal prov
Negativa 4 5 9
Gränsvärden
Positiva 2 2
Totalt antal prov 4 7 11
Tabell XV. Resultatet från analysen av proverna med reaktiverad infektion av HSV. Enzygnost
LIAISON XL
Negativa Gränsvärden Positiva Totalt antal prov
Negativa 4 5 9
Gränsvärden 1 1
Positiva 0
Totalt antal prov 5 5 10
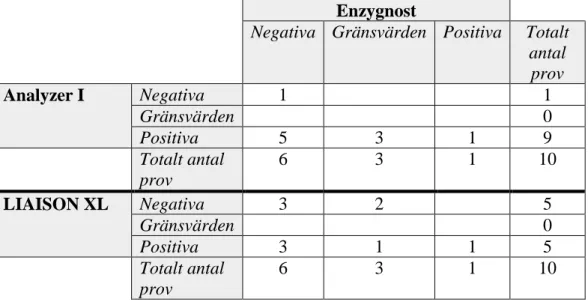
Tabell XVI. Korsreaktiviteten med VZV för Analyzer I och LIAISON XL jämfört med korsreaktiviteten med Enzygnost gällande HSV-kittet.
Enzygnost
Negativa Gränsvärden Positiva Totalt antal prov Analyzer I Negativa 7 7 Gränsvärden 2 2 Positiva 1 1 Totalt antal prov 10 10 LIAISON XL Negativa 10 10 Gränsvärden 0 Positiva 0 Totalt antal prov 10 10
21
Tabell XVII. Korsreaktiviteten med CMV för Analyzer I och LIAISON XL jämfört med korsreaktiviteten med Enzygnost gällande HSV-kittet.
Enzygnost
Negativa Gränsvärden Positiva Totalt antal prov Analyzer I Negativa 2 2 Gränsvärden 2 2 Positiva 2 4 6 Totalt antal prov 6 4 0 10 LIAISON XL Negativa 1 1 Gränsvärden 0 Positiva 5 4 9 Totalt antal prov 6 4 0 10
Tabell XVIII. Korsreaktiviteten med EBV för Analyzer I och LIAISON XL jämfört med korsreaktiviteten med Enzygnost gällande HSV-kittet.
Enzygnost
Negativa Gränsvärden Positiva Totalt antal prov Analyzer I Negativa 1 1 Gränsvärden 0 Positiva 5 3 1 9 Totalt antal prov 6 3 1 10 LIAISON XL Negativa 3 2 5 Gränsvärden 0 Positiva 3 1 1 5 Totalt antal prov 6 3 1 10
22
BILAGA 2
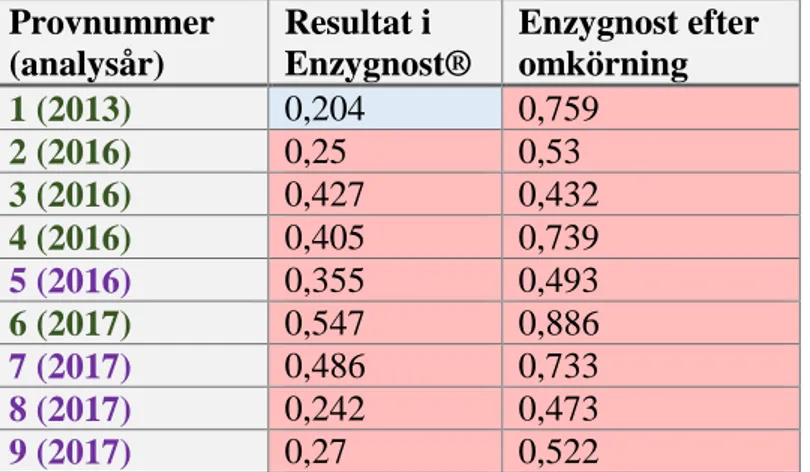
Nedan följer de fåtal prover av primär respektive reaktiverad VZV IgM och HSV IgM som analyserades om manuellt ännu en gång, efter att ha blivit manuellt analyserade mellan åren 2013-2017 (Tabell A och B).
Tabell A. Prov som analyserades för VZV IgM under åren 2013-2017 och analyserades om för denna studie. Rött fält anger positivt resultat, blått anger gränsvärde och vitt negativt. Reaktiverade prover markeras med grön text, primära med lila.
Provnummer (analysår) Resultat i Enzygnost® Enzygnost efter omkörning 1 (2013) 0,204 0,759 2 (2016) 0,25 0,53 3 (2016) 0,427 0,432 4 (2016) 0,405 0,739 5 (2016) 0,355 0,493 6 (2017) 0,547 0,886 7 (2017) 0,486 0,733 8 (2017) 0,242 0,473 9 (2017) 0,27 0,522
Tabell B. Prov som analyserades för HSV IgM under åren 2013-2017 och analyserades om för denna studie. Rött fält anger positivt resultat, blått anger gränsvärde och vitt negativt. Reaktiverade prover markeras med grön text, primära med lila.
Provnummer (analysår) Resultat i Enzygnost® Enzygnost efter omkörning 1 (2013) 0,154 0,086 2 (2013) 0,237 0,159 3 (2014) 0,238 0,21 4 (2014) 0,159 0,141 5 (2014) 0,175 0,195 6 (2014) 0,266 0,222 7 (2014) 0,295 0,277 8 (2014) 0,19 0,152 9 (2015) 0,147 0,115 10 (2015) 0,307 0,188 11 (2015) 0,282 0,141 12 (2015) 0,176 0,239 13 (2015) 0,166 0,163 14 (2016) 0,276 0,106 15 (2016) 0,257 0,242 16 (2017) 0,399 0,277 17 (2017) 0,371 0,198 18 (2017) 0,267 0,232 19 (2017) 0,289 0,149