Hälsa och samhälle
INVENTERING AV
FÖREKOMST AV EN NY
mec
A
VARIANT HOS
CEFOXITIN-RESISTENTA
STAPHYLOCOCCUS AUREUS
KATARINA SUNDIN
HANDLEDARE: ANN CATHRINE PETERSSON
Examensarbete Malmö Högskola Biomedicinsk laboratorievetenskap V Hälsa och Samhälle
Biomedicinska analytikerprogrammet 205 06 Malmö
1
INVENTERING AV
FÖREKOMST AV EN NY
mec
A
VARIANT HOS
CEFOXITIN-RESISTENT
STAPHYLOCOCCUS AUREUS
KATARINA SUNDIN
Sundin, AK. Inventering av förekomst av en ny mecA variant hos cefoxitin-resistent Staphylococcus aureus. Examensarbete i Biomedicinsk
laboratorievetenskap 15 högskolepoäng. Malmö Högskola: Hälsa och Samhälle,
enhet för Biomedicinsk laboratorievetenskap, 2012.
Methicillin-resistenta Staphylococcus aureus (MRSA) har blivit en allt vanligare patogen inom sjukvården och i samhället. MRSA orsakar infektioner som inte kan behandlas med β-laktamantibiotika. För att förhindra spridning genomgår
patienter och sjukvårdspersonal screening-tester. I dessa screening-tester ingår PCR-analys av mecA, nuc och/eller Sa442. MecA är lokaliserad på Staphylococcal Cromosomal Cassette mec (SCCmec) och används som en markör för MRSA medan nuc och Sa442 anger S. aureus. PCR-positiva isolat odlas ut på agarplattor efter anrikning i en selektiv buljong. Kolonier av S. aureus resistensbestäms mot cefoxitin som MRSA är resistent mot. Idag används dock PCR-analys av mecA som en referensmetod för diagnostisering av MRSA. Under det senaste årtiondet har även rapporterats fynd av stammar som enligt resistensmönster är MRSA men som har utfallit negativt för mecA i PCR. Under 2011 rapporterades en ny variant av SCCmec och en ny variant av mecA, mecALGA251. I denna studie har en
realtids-PCR tagits fram för att identifiera den nya varianten, mecALGA251. Denna PCR
användes för att undersöka 43 kliniska isolat, fyra cefoxitin-känsliga S. aureus från rutinen och tre referensstammar. De kliniska isolaten hade samlats in under perioden 2004 – 2011 och hade uppvisat cefoxitin-resistens men gett negativt resultat i mecA-PCR. Totalt 40 av de 43 cefoxitin-resistenta kliniska isolaten visades bära mecALGA251. Resistensbestämningar med diskdiffusion och E-test mot
cefoxitin, oxacillin, cefuroxim och cefotaxim visade att denna typ av MRSA inte kan skiljas från klassisk MRSA. Resultaten visar att cefoxitin-resistenta S. aureus isolat som bär mecALGA251 finns bland skånska patienter. De visar också att det
finns cefoxitin-resistent S. aureus som saknar både klassiska mecA och
mecALGA251. Dessa stammar har inte studerats vidare i denna studie.
Nyckelord: Diskdiffusion, E-test, mecA, mecALGA251, Methicillin-resistant
2
INVENTORY OF EXISTENCE
OF A NEW
mecA
VARIANT IN
CEFOXITIN-RESISTANT
STAPHYLOCOCCU
S AUREUS
KATARINA SUNDIN
Sundin, AK. Inventory of existence of a new mecA variant in cefoxitin-resistant
Staphylococcus aureus. Degree Project in Biomedical science 15 credit points.
Malmö University: Health and Society, Department of Biomedical Laboratory Science, 2012.
Methicillin-resistant Staphylococcus aure s (MRSA) has become a more frequent pathogen within health care facilities and the community. MRSA causes
infections that can’t be treated with β-lactamantibiotics. To prevent the spread of MRSA, patients and medical personnel undergo tests. In the screening-tests PCR-analysis of mecA, nuc and/or Sa442 is included. MecA is located at Staphylococcal Chromosomal Cassette mec (SCCmec) and is a marker for MRSA, whereas nuc and Sa442 state regular S. Aureus infections. PCR-positive isolates are grown on agar plates after enrichment in selective broth. Colonies of S. aureus are tested for cefoxitin susceptibility to which MRSA is resistant. PCR-analysis of
mecA is the reference method that is being used today when MRSA is being
diagnosed. During the last decade cefoxitin-resistant strains that lack mecA in the PCR has been reported. In 2011 a new variant of SCCmec and a new variant of
mecA, mecALGA251 was reported. In this study a new real-time-PCR has been
developed in order to identify mecALGA251. The new PCR protocol was being used
to examine 43 clinical isolates, four cefoxitin-susceptible S. aureus from the routine and three reference strains were examined. The clinical isolates had been collected during the period 2004-2011 and were cefoxitin-resistant but lacked
mecA. In total of 40 of the 43 cefoxitin-resistant was PCR positive for mecALGA251.
Susceptibility testing with disk diffusion and E-test for cefoxitin, oxacillin,
cefuroxime and cefotaxime showed that this type of MRSA can’t be distinguished from regular MRSA. The results showed that cefoxitin-resistant
S. aureus isolates carrying mecALGA251 exist among patients in Skåne County. One
cefoxitin-resistant S. aureus isolate lacked both classic mecA and mecALGA251,
which indicates that other mechanisms may exist, however these results has not been further analysed in this study.
Keywords: Diskdiffusion, E-test, mecA, mecALGA251, Methicillin-resistant
3
FÖRORD
Jag skulle vilja tacka min handledare Ann-Cathrine Petersson samt Maria Liljeheden på klinisk mikrobiologi, Skånes universitetssjukhus (SUS), Lund.
4
INNEHÅLLSFÖRTECKNING
BAKGRUND ... 5
Syfte ... 6
ETISK BEDÖMNING ... 6
MATERIAL OCH METODER ... 6
Bakteriestammar ... 6 Odling ... 7 Resistensbestämning ... 7 PCR ... 7 Statistik ... 8 RESULTAT ... 8 Realtids- PCR ... 8 Resistensbestämning ... 10 DISKUSSION ... 12 Metoddiskussion ... 12 Resultatdiskussion ... 13 SLUTSATS ... 13 REFERENSER ... 14
5
BAKGRUND
Staphylococcus aures är en grampositiv kock som kan påvisas på huden och i
näsan [1]. Bakterien har dock många virulensfaktorer som gör att S. aureus kan bli invasiv. En virulensfaktor som används för verifiering av vissa S. aureus stammar är Panton-Valentineleucocidin (PVL) toxinet [2]. Detta toxin består av två porbildande enheter som lyserar neutrofiler och makrofager. PVL kan därmed orsaka svår nekros av vävnad i bland annat lungorna, vilket kan vara ett
livshotande tillstånd. PVL påvisas med polymerase chain reaction (PCR) [2-3]. En annan virulensfaktor som används för identifiering av S. aureus är ytproteinet protein A [2]. Invasiva S. aureus kan ge svår sepsis med hög mortalitet. Speciellt om sepsisen orsakas av höggradigt resistenta stammar [4].
Methicillin-resistent Staphylococcus aureus (MRSA) har enda sedan dess
upptäckt på 1960-talet varit ett stort problem inom sjukvården, då de orsakar svåra nosokomiala infektioner [5]. Under de senare decennierna har en ökad spridning av MRSA skett i omgivningen [6]. Detta anses bero på att det finns begränsat med yta för patienterna och vårdpersonalen, samtidigt som användningen av
antibiotika har ökat. MRSA är resistenta mot alla β-laktamantibiotika, såsom oxacillin, cefotaxim, cefuroxim och cefoxitin, samt vissa desinfektionsmedel [7]. MRSA är därmed svårbehandlad och förknippat med en hög mortalitet, vilket innebär att screeningen utgör en viktig del i det förebyggande arbetet som görs för att förhindra ytterligare smittspridning [8]. För att påvisa MRSA görs primärt en screening med PCR för mecA samt nuc och/eller Sa442. Både nuc och Sa442 återfinns hos de flesta S. aureus, medan mecA förekommer hos meticillin-resistenta stafylokocker. Parallellt med detta moment görs spa-typning för epidemiologisk typning av S. aureus [9-11]. Spa-typning sker genom
sekvensering av polymorf X-region inom spa-genen som kodar för protein A[12]. Prov som är positiva i PCR odlas ut på blodagar med ampicillindisk och på stafchromagar med cefoxitindisk efter anrikning i selektiv buljong. Blodagar tillåter växt av de flesta bakterier medan stafchromagar är selektiv för S. aureus [9]. I rutinen görs även resistensbestämningar mot cefoxitin och oxacillin för verifiering av MRSA.
MecA är en mobil gen som återfinns inom Staphylococcal Cassette Chromosome mec (SCCmec). SCCmec innehåller olika mobila gener i form av transposoner
[13]. Detta innebär att mecA kan vara integrerad på olika ställen i SCCmec [5]. Förutom mecA består SCCmec även av ccr och blaZ som kodar för enzymer som bryter ner DNA [14] respektive β-laktamantibiotikum [15]. Det finns även mecRI och mecI som reglerar transkriptionen av blaZ samt reglerar uttrycket av mecA [5].
MecA är den viktigaste markören för MRSA, eftersom den kodar för ett unikt
penicillinbindande protein (PBP) olikt de som normalt finns hos S. aureus, (PBP 1-4) [13]. Detta unika protein benämns PBP2a eller PBP2’ och har låg affinitet för β-laktamantibiotika [16]. Detta innebär i sin tur att antibiotikan binder dåligt in till PBP2a och därmed inte kan inhibera syntesen av peptidglykanlagret som bygger upp cellväggen [1].
6
Idag används mecA för diagnostisering av MRSA. Detta kan dock ifrågasättas eftersom det finns stammar som följer resistensmönstret för MRSA men ger ett negativt utslag för mecA i PCR. Orsaken till detta har länge varit oklar. En tänkbar orsak kan vara att stammarna har förlorat SCCmec eller mecA genen. År 2005 rapporterades förlust av mecA hos isolat som frysförvarats vid -80°C [17]. En annan anledning till detta kan ha varit att det förekommer olika varianter av SCCmec. Exempelvis rapporterades nya varianter av SCCmec i asiatiska isolat [15]. Med denna nya kunskap har två andra forskargrupper under 2011 [13,18], genom sekvensering av en ny variant av SCCmec, funnit en muterad mecA hos methicillin-resistenta stammar. Den varianten benämns SCCmec XI och den muterade mecA benämns mecALGA251 [13,18]. Efter denna upptäckt har forskare
utvecklat en multiplex konventionell PCR för att kunna påvisa mecALGA251 [6]. En
mutation inom mecA kan påverka resistensen för oxacillin hos MRSA då dess produkt, PBP2a, kan få förändrad affinitet för oxacillin. Därmed finns det en möjlighet att skilja MRSA med klassisk mecA från mecALGA251 med hjälp av
resistensbestämningar [19].
Sedan mitten av 2000-talet har cefoxitin-resistenta isolat av S. aureus, vilka har utfallit negativt avseende klassisk mecA, spa-typats och sparats vid klinisk mikrobiologi i Lund. Merparten av dessa skånska stammar har uppvisat samma
spa-typer som har rapporterats för stammar med SCCmec XI och mecALGA251
[13,18]. Med den nya informationen om SCCmec XI och mecALGA251, samt ett
validerat och rapporterat protokoll för konventionell PCR [6,13,18], är det möjligt att undersöka om de sparade skånska isolaten bär mecALGA251 genom att jämföra
med referensstammar. Referensstammar som kommer att användas är ATCC 29213,som är methicillin-suspectible Staphylococcus aureus (MSSA). CCUG 35601,som är cefoxitin-resistent och har klassisk mecA (MRSA) samt LGA-Kent, som är cefoxitin-resistent och har den muterade varianten av mecA, mecALGA251.
Syfte
Syftet med denna studie är att utforma ett protokoll för mecALGA251 med
realtids-PCR och att tillämpa detta protokoll på en uppsättning cefoxitin-resistenta mecA-negativa S. aureus insamlade från skånska patienter för att undersöka om
mecALGA251 kan identifieras inom denna grupp av stammar. Detta projekt är en del
av ett utvecklingsarbete inom diagnostik avseende MRSA.
ETISK BEDÖMNING
Endast avidentifierade kliniska isolat studerades.
MATERIAL OCH METODER
Nedan beskrivna material och metoder användes i studien.
Bakteriestammar
Totalt 43 kliniska isolat av S. aureus insamlade från patientprover insända till Klinisk mikrobiologi, Labmedicin Skåne, under perioden 2004-2011,
7
laboratoriet. Isolaten hade sparats då de var cefoxitin-resistenta, men mecA hade inte kunnat påvisas med PCR eller PBP2a med agglutination. Referensstammarna S. aureus ATCC 29213 och S. aureus CCUG 35601, inklusive cefoxitin-känsliga
S. aureus användes som negativa kontroller medan referensstammen LGA-Kent
användes som en positiv kontroll. LGA-Kent erhölls från Dr. Anders Rhod Larsen, Stafylokocklaboratoriet, Statens Seruminstitut (SSI), Köpenhamn, Danmark. Det inkluderas även fyra cefoxitin-känsliga S. aureus stammar från avidentifierade patientprover som negativa kontroller.
Odling
De sparade isolaten, förvarade vid -80°C, tinades och odlades ut på blodagarn (LabM, UK). Referenstammarna och de cefoxitin-känsliga S. aureus stammarna från rutinen isolerades på blodagar. Plattorna inkuberades över natten vid 34-37°C.
Resistensbestämning
Inför resistensbestämningen genom diskdiffusion och bestämning av den minsta koncentration av antibiotika som krävs för att hämma bakterietillväxten (MIC = minimum inhibitory concentration) med epsilometer-tester (E-tester), slammades varje färskisolerad stam i 3 ml 0.9 % (w/v) NaCl till en täthet motsvarande McFarland 0,5. Mueller-Hinton-agar (MH-agar; Oxoid, Basingstoke, UK) inokulerades med täta utstryk med en steril bomullspinne doppad i
bakteriesuspensionen. Efter att plattorna hade torkat applicerades 6 mm
antibiotikadiskar innehållande cefoxitin (10 μg), cefuroxim (30 μg), oxacillin (1 μg) samt cefotaxim (5 μg) (Oxoid). E-tester (bioMeriéux, Frankrike) med cefoxitin, cefuroxim, oxacillin respektive cefotaxim applicerades på separata plattor. Plattorna för E-testerna inokulerades med dubbla utstryk i 90° vinkel. Samtliga plattor inkuberades över natten vid 34-37°C. Zoner och MIC-värden avlästes vid genomfallande ljus. Stammarna resistens eller känslighet för cefoxitin bestämdes med MIC-brytpunkter från NordicAST [20]. För zonbrytpunkter för cefoxitin följdes laboratoriets rutiner för diskar med 10 µg cefoxitin.
PCR
DNA extraherades från varje stam genom att 1-2 kolonier från de uppodlade isolaten, referensstammarna samt cefoxitin-känsliga S. aureus från rutinen, slammades upp i 250 μl 5 mM Tris-buffert. Bakteriesuspensionen inkuberades därefter vid 95°C på ett värmeblock under 15 minuter.
PCR-mixen som användes innehöll primers, Amut-F (5’- CAT CAC CAG GTT CAA CCC A -3’) enligt Garcia-Álvarez et al [13] samt Amut-R (5’- CGC CTT GGC CAT ATC CTG -3’) specifikt designad för denna studie (Eurofins MWG Operon) och inte testad i tidigare studier. Primers slammades upp i UV-strålat ddH2O (Sigma-Aldrisch) till en koncentration på 100 μM (stamlösningen). Till
brukslösningen späddes primers 1:10 till 10μM. I studien provades två primerkoncentrationer, 0,1 och 0,2 µM av Amut-F och Amut-R. PCR-mixen utgjordes även av ljuskänslig 1x SYBR-Green (Brilliant II SYBR®Green Q PCR-mastermix, Agilent Stratagene, USA) samt ddH2O. Mixarna bereddes och
förvarades i bruna sterila eppendorfrör. Den färdiga PCR-mixen blandades med provrörsskak.
I nästa steg pipetterades 20 μl av PCR-mixen i markerade brunnar i en
8
PCR-mixen tillsattes 5 μl DNA-extrakt. Brunnarna i 96-hålsplattan förseglades med plastfilm (Microseal B adheasive seals). Plattan centrifugerades i cirka 6 sekunder vid 10000 G-tal och placerades i instrumentet för realtids-PCR (CFX96 Real-time System, BioRad). Det gjordes en annealinggradient 54°C/62°C, med primerkoncentrationen 0,2 μM av Amut-F och Amut-R och annealingtid 30 sekunder. Reaktionen startades med en denaturering vid 95°Coch aktivering av
taq-polymeras under 5,0 minuter samt extension vid 72°C under 30 sekunder. Totalt 40 cykler utfördes. Ytterligare ett försök gjordes med en annealinggradient av 57°C/62°C med samma primerkoncentration. Försök med
annealingtemperaturen 60°C utfördes med samtliga primerkoncentrationer, 0,1/0,2 μM av Amut-F och Amut-R. Samma tidsintervaller, denaturering- samt
extensiontemperatur som nämns ovan användes i samtliga försök. I alla försöken användes även samma slumpmässigt valda isolat av de kliniska isolaten inklusive referensstammarna S. aureus ATCC 29213, S. aureus CCUG 35601. En negativ kontroll med ddH2O inkluderades för att kontrollera att mastermixen inte var
kontaminerad. Protokollet och primerhalter provades ut och kördes ut på gel och produkten sekvenserades enligt gällande rutiner på laboratoriet. Sekvenseringen utfördes som kontroll på att den önskade produkten (mecALGA251) amplifierades.
Av dessa kliniska isolat skickades fem till Dr. Robert Skov vid
Stafylokocklaboratoriet, Statens Seruminstitut (SSI), Köpenhamn, Danmark, för validering av de egna resultaten. De resterande isolaten inklusive alla
referensstammar och cefoxitin-känsliga S. aureus kördes i realtids-PCR, med primer koncentrationen 0,2 μM av Amut-F och Amut-R och annealingtemperatur 60°C med temperaturer och tidsintervall likvärdiga med ovanstående. Isolat som blev negativa späddes 1:10 och kördes om för att utesluta att det negativa
resultatet berodde på inhibition i PCR-reaktionen.
Statistik
Rådata från resistensbestämningarna utarbetades och sammanställdes i Microsoft Excel 2003 samt 2010i form av tabeller. Layouten bearbetades i Microsoft Power Point 2010. Rådata från realtids-PCR (CFX96 Real-time System, BioRad)
utarbetades av programvaran CFX Manager.
RESULTAT
Nedan beskrivna resultat erhölls från realtids-PCR och resistensbestämningar.
Realtids- PCR
Av de testade primerkoncentrationerna 0,1 samt 0,2 μM gav 0,2 μM skarpare band på gelelektroforesen vilket tyder på mer produkt (figur 1). Primer
koncentration 0,2 μM testades på sex av de 43 nedfrysta kliniska isolaten samt ATCC 29213 och CCUG 35601. Resultaten visar att fyra av de kliniska isolaten uppvisar produkt, medan referensstammarna utföll negativt (figur 1).
Sekvensanalysen från de positiva isolaten visade att produkten utgjordes av
mecALGA251 med 100 % överensstämmelse över 372 bp. Fem av dessa sex kliniska
isolat skickades till SSI, som bekräftade resultaten. Ett av isolaten (nummer 1) rapporterades bära klassisk mecA och klassas härefter som MRSA.
9
Figur 1. Gelelektrofores med primer koncentrationerna 0,1 μM (A1-A9) respektive 0,2 μM
(D1-D9).
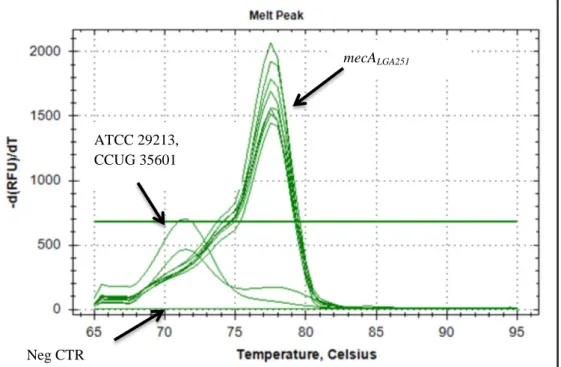
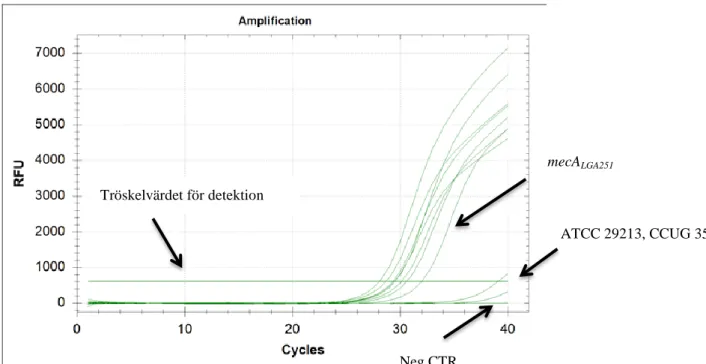
Av de totalt 47 kliniska isolaten, inklusive de fyra cefoxitin-känsliga stammarna från rutinen samt de tre referensstammarna, som analyserades i realtids-PCR gav LGA-Kent ett positivt utfall och visade i smältpunktsanalysen en smältpunkt på ca 77°C liksom de kliniska isolaten som var positiva (figur 2). Vidare visade
resultatet att av de tidigare icke analyserade 43 kliniska isolaten erhölls en amplifierad produkt för 40 stammar. Produkterna från samtliga kliniska isolat uppvisade en smältpunkt identisk med LGA-Kent. De negativa isolaten inklusive referensstammarna gav en svag produkt efter 35 cykler (figur 3) men med en starkt avvikande smältpunkttemperatur (figur 2).
Figur 2. Exempel på smältkurva för stammar medmecALGA251. Referensstammar (MSSA ATCC
29213, MRSA CCUG 35601), samt den negativa kontrollen (Neg CTR)är markerade och visar utseendet på deras smältkurvor.
mecALGA251 Neg CTR ATCC 29213, CCUG 35601 Kliniskt isolat 1 Kliniskt isolat 1
10
Figur 3. Exempel på amplifieringskurva för mecALGA251. I figuren är alla referenstammarna
utmarkerade samt den negativa kontrollen. Resistensbestämning
Vid resistensbestämningarna visade LGA-Kent, CCUG 35601 samt alla
mecALGA251-positiva isolat, förhöjda MIC-värden (tabell 1) och små zondiametrar
(figur 4). Samtliga isolat klassas som resistenta mot cefoxitin enligt gällande tolkningsunderlag [20]. En av stammarna (nummer 1) var även cefoxitin-resistent men bär klassisk mecA (tabell 1), identifierat av SSI. MSSA ATCC 25213, cefoxitin-känsliga S. aureus samt majoriteten av de mecALGA251-negativa isolaten
var cefoxitin-känsliga och hade MIC-värdet 4,0 mg/L (tabell 1). En av de
mecALGA251-negativa stammarna (nummer 12) och en av stammarna från rutinen
var cefoxitin-resistent. Stammen från rutinen (nummer 45) uppvisade MIC-värdet 8,0 mg/L och klassas som cefoxitin-resistent.
Figur 4. Beräknad zondiameter för cefoxitin över samtliga isolat, inklusive referensstammar som
har resistensbestämts genom MIC-bestämning.
Två populationer kunde urskiljas vid resistensbestämning för cefoxitin. De
mecALGA251-positiva stammarna med zondiametrar mellan 6 och 14 mm och de
mecALGA251-negativa stammarna med zondiametrar över 18 mm (figur 4). För de
mecALGA251-positiva stammarna var zondiametern för cefuroxim upptill 12 mm
0 5 10 15 20 25 6 8 10 12 14 16 18 20 22 24 26 28 30 Fre k v en s Zondiameter (mm) FOX-R FOX-S Tröskelvärdet för detektion ATCC 29213, CCUG 35601 Neg CTR mecALGA251
11
(6 – 12 mm), medan zondiametern för cefotaxim visade en stor spridning (6 – 23 mm). Dock kunde det även för cefuroxim och cefotaxim urskiljas två populationer (data visas inte), då den mecALGA251-negativa populationen gav minst 5 mm större
zoner, såsom erhölls vid test med cefoxitin (figur 4). Motsvarande uppdelning i två populationer kunde inte identifieras från MIC-bestämningar, utan en
kontinuerlig skala av MIC-värden uppmättes (tabell 1). En av stammarna
(nummer 1) som bär klassisk mecA uppvisade MIC-värden och zondiametrar som föll inom populationen för de mecALGA251-positiva stammarna (tabell 1).
Resistensbestämning för oxacillin visade MIC-värde och zondiametrar från de
mecALGA251-positiva respektive mecALGA251-negativa stammarna som var
överlappande (tabell 1, figur 5).
Figur 5. Beräknad zondiameter för oxacillin över samtliga isolat, inklusive
referensstammar som har resistensbestämts genom MIC-bestämning enligt gällande tolkningsunderlag från NordicAST [20].
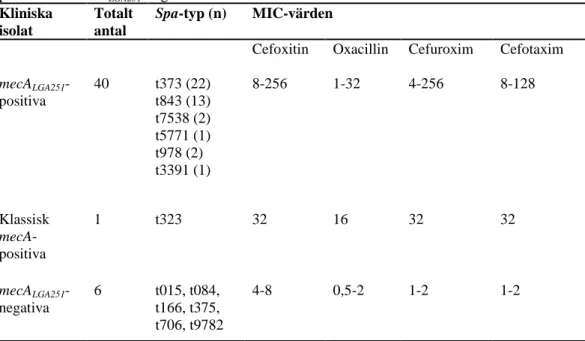
De vanligaste spa-typerna var t373 och 843, som fanns hos samtliga mecALGA251
-positiva stammarna (tabell 1), medan de stammar som var mecALGA251-negativa
hade avvikande spa-typer, varav t9782 inte påträffats tidigare (tabell 1).
Tabell 1. Spa-typer och intervall för uppmätta MIC-värden för klassisk mecA-positiva, mecALGA251
-positiva och mecALGA251-negativa isolat. Referensstammarna är inte inkluderade. Kliniska
isolat
Totalt antal
Spa-typ (n) MIC-värden
Cefoxitin Oxacillin Cefuroxim Cefotaxim
mecALGA251 -positiva 40 t373 (22) t843 (13) t7538 (2) t5771 (1) t978 (2) t3391 (1) 8-256 1-32 4-256 8-128 Klassisk mecA-positiva 1 t323 32 16 32 32 mecALGA251 -negativa 6 t015, t084, t166, t375, t706, t9782 4-8 0,5-2 1-2 1-2 0 5 10 15 20 25 30 35 40 6 8 10 12 14 16 18 20 22 24 26 28 30 Fre k v en s Zondiamter (mm) OX-R OX-S
12
DISKUSSION
Nedan diskuteras val av metod, resultat och felkällor genom att jämföra med föregående rapporter.
Metoddiskussion
Under 2011 presenterades två rapporter som beskriver en ny variant av mecA [13,18]. Den nya varianten, mecALGA251, hade identifierats genom sekvensering av
hela genomet av cefoxitin-resistenta mecA-negativ stammar [13,18] och för att finna andra mecALGA251-positiva stammar presenterades en multiplex
konventionell PCR [6]. I denna studie har sparade cefoxitin-resistenta mecA-negativa isolat från Skåne undersökts med avseende på mecALGA251. Istället för en
multiplex konventionell PCR-analys [6] har en realtids-PCR med
smältpunktanalys utarbetats för denna studie. Vid DNA-preparationen kokades prover, vilket avviker ifrån de tidigare protokollen [6]. Mängden DNA som tillsattes i PCR-mixen var inte kontrollerad. Denna felkälla kan ha varit orsaken till att vissa av stammarna utföll som positiva för mecALGA251 endast efter
omkörningen med spädningen 1:10. I detta projekt användes primers som endast identifierar mecALGA251 medan i rapporten för multiplex konventionell PCR [6]
användes primers som identifierar både mecA och mecALGA251 [6]. Orsaken är att i
denna studie skulle specifikt den nya mutationen identifieras med hjälp av ett nytt protokoll för realtids-PCR.
En av de primer som användes var ny och hade inte testats tidigare, därför utvärderades olika primerkoncentrationer, 0,1 och 0,2 µM, samt
annealingtemperaturer. Vid bedömning av vilken annealingtemperatur som skulle användas togs det hänsyn till om och när den amplifierade produkten erhölls och hur smältkurvorna av PCR-produkten såg ut. Därefter jämfördes de med
referensstammarnas smältkurvor. Referensstammen LGA-Kent var inte tillgänglig när detta examensarbete startades och kunde inte användas som referensstam vid annealinggradienterna. Istället utfördes sekvensering av PCR-produkterna för att fastställa att rätt produkt hade erhållits och protokollet fastställdes utifrån dessa resultat. Därefter analyserades de resterande stammarna i realtids-PCR. I detta protokoll användes 40 cykler för att eventuellt minska antalet falskt negativa resultat (figur 3).
Resistensbestämningar utfördes med E-tester och diskdiffusion mot cefoxitin, oxacillin, cefuroxim och cefotaxim, till skillnad från tidigare studier där de endast utfördes mot cefoxitin och oxacillin. Dessa två antibiotika används normalt i rutinen för att påvisa MRSA [13,18,20]. Orsaken till att även cefuroxim och cefotaxim användes var att se resistensmönstret för andra betalaktamantibiotika. Diskdiffusionstesten utfördes för att undersöka om stammarna med mecALGA251
kan identifieras med denna teknik, medan E-testerna ger MIC-värden som utgör referensvärden. För att E-testerna ska visa korrekta resultat är det viktigt att
materialet ströks tätt på MH-agarn så hela ytan täcktes, att E-testerna inte flyttades efter att de hade applicerats på agarytan och att avläsningen av MIC-värdena skedde enligt anvisningarna [20].
13
Resultatdiskussion
Av de 46 kliniska isolat inklusive de cefoxitin-känsliga stammarna har 40 utfallit som positiva för mecALGA251 med en smältpunkt vid 77°C (figur 1). De
mecALGA251-postiva stammarna var samtliga cefoxitin-resistenta (tabell 1). De
resterande sex isolaten, inklusive de fyra cefoxitin-känsliga stammarna, har
utfallit som negativa för mecALGA251 (tabell 1) med en avvikande smältpunkt (figur
1). En av dessa stammar (nummer 1) bär klassisk mecA, enligt SSI. Av de
resterande sex mecALGA251-negativa stammarna är fyra MSSA (figur 4), vilket
stämmer med teorin eftersom mecA endast har påträffats hos stammar med MRSA [13]. En av de fyra stammarna (nummer 45) från rutinen klassas som cefoxitin-resistens men noterades dock som oren och måste cefoxitin-resistensbestämmas igen för att bekräfta resultatet. Resistensbestämningen med cefuroxim och cefotaxim gav även de en uppdelning i två populationer, mecALGA251-postiva samt mecALGA251
-negativa. Av de fyra MSSA stammarna kom tre från rutinen medan ett utgjordes av ett kliniskt isolat (nummer 6). Detta kan bero på att isolatet under
nedfrysningen har förlorat SCCmec och därmed mecA genen eller endast mecA [17]. Detta kan vara en viktig felkälla när analyser ska göras på nedfrysta isolat. De fanns även två mecALGA251-negativa stammar som var cefoxitin-resistenta
(tabell 1), stammarna nummer 12 och 45. Stam nummer 45, ett färskt kliniskt isolat av S. aureus, noterades som oren, vilket påverkade resistensen. Orsaken till att stam nummer 12 är mecA- och mecALGA251-negativmen ändå cefoxitin-resistent
(tabell 1, figur 4) kan relateras till flera mekanismer som påverkar resistensen förutom mecA hos MRSA. År 2004 rapporterades förekomst av en SCCmec-variant som innehåller andra gener som också kan ge upphov till
antibiotikaresistens [16].
Till skillnad från resistensbestämningen med cefoxitin, cefuroxim och cefotaxim fanns en större spridning av oxacillin-resultaten och med överlappande resultat mellan de mecALGA251-postiva och mecALGA251-negativa stammarna (figur 5). Detta
kan bero på att genen är en transposon som kan förflyttas och integreras på olika ställen inom SCCmec [5]. En annan möjlig orsak kan vara att PBP2a kodat av
mecALGA251, har en annan affinitet för oxacillin än klassisk PBP2a. Homologi
mellan PBP2a- mecALGA251 och PBP2a-mecA är som bäst 63 % [13,18].
SLUTSATS
Resultaten från denna studie visar att mecALGA251 förekommer hos
cefoxitin-resistenta S. aureus i Skåne. Det har endast identifierats cirka 40 isolat sedan 2004, vilket tyder på att dessa typer av MRSA för närvarande är sällsynta. Resultaten från resistensbestämningar med diskdiffusion och E-tester som utfördes i denna studie visar att stammarna med mecALGA251 inte kan skiljas från
stammarna med klassisk mecA. Ett snabbt och enkelt protokoll för att påvisa
mecALGA251 med realtids-PCR har utformats och kan direkt tas i bruk för
diagnostik vad avser mecALGA251. Ytterligare arbete återstår eftersom det
förekommer cefoxitin-resistenta stammar som saknar både klassisk mecA och
mecALGA251. Detta kan bero på att det inte endast är mecA som påverkar
14
REFERENSER
1. Ericsson E & Ericsson T (2009)
Klinisk mikrobiologi: infektioner, immunologi, vårdhygien (4:e upplagan).
Stockholm: Liber
2. Murray PR, Rosenthal KS & Pfaller MA (2009)
Medical microbiology (6nd Edition). Philadelphia: Mosby Elsevier
3. Ek T, Andersson O, KasemoAU, Wede M & Nilsson PA (2007)
PVL-positiva Staphaureus gav nekrotiserande pneumoni. Läkartidningen,
104, 509-513
4. Jackobsson G (2010)
Inför anmälningsplikt för alla Staphylococcus aureus-infektioner!,
Läkartidningen, 107,1128-1129
5. Hiramatsu K (1995)
Review: Molecular Evolution of MRSA. Microbiology Immunology, 39, 531-543
6. Stegger M, Skytte Andersen P, Kearns A, Pichon B, HolmesMA, Edwards G, Laurent F, Teale C, Skov R & Rhod Larsen A (2012)
Rapid detection, differentiation and typing of methicillin-resistant
Staphylococcus aureus harbouring either mecA or the new mecA homologue mecALGA251.Clinical Microbiology and Infection, 18, 395-400
7. Vali L,Davies SE, Lai LLG, Dave J & Amyes SGB (2008)
Frequency of biocide resistance genes, antibiotic resistance and the effect of chlorhexidine exposure on clinical methicillin-resistant Staphylococcus
aureus isolate, Journal of antimicrobial chemotherapy, 61, 524-532
8. Smittskydd Skåne (2008)
Riktlinjer för handläggning av MRSA i vård och omsorg, >www.skane.se/smittskydd< 2011-11-24.
9. Söderquist H & Lagheden C (2011)
MRSA-odling. Labmedicin Skåne: Klinisk mikrobiologi (Metodbeskrivning).
10. Kilic A & Basustaoglu AC (2011)
Double triplex real-time PCR assay for simultaneous detection of
Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus hominis, and Staphylococcus haemolyticus and determination of their
methicillin resistance directly from positive blood culture bottles, Research
in microbiology, 162, 1-7
11. Šeputienê V, Vilkoicaitê A, Armalytê J, Pavilonis A & Sužiedêlienê E (2010) Detection of methicillin-resistant Staphylococcus aureus using double duplex real-time PCR and dye Syto 9, Folia microbiology, 55, 502-507
15
12. Pérez-Vázquez M, Vindel A, Marcos C, Oteo J, Cuevas O, Trincado P, Bautista V, Grundmann H & Campos J (2009)
Spread of invasive Spanish Staphylococcus aureus spa-type t067associated with a high prevalence of the aminoglycoside-modifying enzyme gene
ant(4')-Ia and the efflux pump genes msrA/msrB, Journal of antimicrobial chemotherapy ,63, 21-31
13. Shore AC, Deasy EC, Slickers P, Brennan G, O’Connell B, Monecke S, Ehricht R & Coleman DC (2011)
Detection of staphylococcal cassette chromosome mec type XI carrying highly divergent mecA, mecI, mecRI, blaZ, and ccr genes in human clinical isolates of clonal complex 130 methicillin-resistant Staphylococcus aureus,
Antimicrobial agents and chemotherapy, 55, 3765-3773
14. Jansen WTM, Beitsma MM, Koeman CJ, van Wamel WJB, Verhoef J & Fluit AC (2006)
Novel mobile variants staphylococcal cassette chromosome mec in
Staphylococcus aureus, Antimicrobial agents and chemotherapy, 50,
2072-2078
15. Chongtrakool P, Ito T, Ma XX, Kondo Y, Trakulsomboon S, Tiensasitorn C, Jamklang M, Chavalit T, Song JH & Hiramatsu K (2006)
Staphylococcus cassette chromosome mec (SCCmec) typing of methicillin-resistant Staphylococcus aureus strains isolated in 11 Asian countries: a proposal for a new nomenclature for SCCmec elements, Antimicrobial
agents and chemotherapy, 50, 1001-1012
16. Mongkolrattanothai K, Boyle S, V. Murphy T & S.Daum R (2004) Novel non-mecA-containing staphylococcus chromosomal cassette composite island containing pbq4 and tagF genes in a commensal
staphylococcal species: a possible reservoir for antibiotic resistance island in
Staphylococcus aureus, Antimicrobial agents and chemotherapy, 48,
1823-1835
17. van Griethuysen A, van Loo I, van Belkum A, Vandenbroucke-Grauls C, Wannet W, van Keulen P & Kluytmans J (2005)
Loss of the mecA gene during storage of methicillin-resistant
Staphylococcus aureus strains, Journal of clinical microbiology,43,
1361-1365
18. García-Álvarez L, Holden MTG, Lindsay H, Webb CR, Brown DFJ, Curran MD, Walpole E, Brooks K, Pickard DJ, Teale C, Parkhill J, Bentley SD, Edwards GF, Girvan EK, Kearns AK, Pichon B, Hill RLR, Rhod Larsen A, Skov RL, Peacok SJ, Maskell DJ & Holmes MA (2011)
Meticillin-resistant Staphylococcus aureus with a novel mecA homologue in human and bovine populations in the UK and Denmark: a descriptive study,
16
19. Bressler AM, Williams T, Culler EE, Zhu W, Lonsway D, Patel JB & Nolte FS (2005)
Correlation of penicillin binding protein 2a detection with oxacillin resistance in Staphylococcus aureus and discovery of a novel penicillin binding protein 2a mutation, Journal of clinical microbiology, 43, 4541-4544.
20. Referensgruppen för antibiotikafrågor (RAF) och dess metodgrupp (RAF-M) (2012)