Histopatologiska skillnader
mellan periimplantitlesioner
med olika kliniska utseenden
- En pilotstudie
Sara Arvidsson
Kristin Wennberg
Huvudhandledare: Anna Ljunggren
Handledare: Andreas Stavropoulos
Examensarbete (30 hp)
Malmö universitet
Tandläkarprogrammet
Odontologiska fakulteten
Sammanfattning
Syftet med studien var att undersöka det histopatologiska utseendet hos humana periimplantit-lesioner i relation till lesionens kliniska utseende. Periimplantit-vävnad lokaliserad runt 15 implantat avlägsnades kirurgiskt från 13 individer. De 15 kirurgiskt avlägsnade
vävnadsproverna skiljde sig betydligt i utseende kliniskt och delades in i två grupper beroende på om de var inkapslade och välavgränsade mot omgivande vävnad eller mer diffust
avgränsade. Vävnaderna preparerades histokemiskt (MAYERS HTX) och
immunohistokemiskt (MACH 4 Universal HRP-Polymer Detection System). De celler som undersöktes med immunohistokemiska metoder var T-celler (CD3+), B-celler (CD20+), plasmaceller (CD138+), M1-makrofager (CD68+) och M2-makrofager (CD163+). Förekomsten av neutrofila granulocyter identifierades morfologiskt med rutininfärgning. Därefter scannades och analyserades proverna kvalitativt och kvantitativt. Ingen statistiskt signifikant skillnad kunde påvisas mellan tätheten av infiltrerade lymfocyter (P=0,613) och neutrofila granulocyter (P=0,336) samt arean av inflammationsinfiltratet (P=0,613) mellan de två studerade grupperna. Vidare kunde inget samband observeras mellan den histologiska sammansättningen av de studerade cellerna och det kliniska utseendet vilket dock kan förklaras av otydliga kliniska kriterier. Däremot kan det konstateras att en skillnad föreligger mellan proverna utifrån den histologiska bilden. Däribland varierar antalet plasmaceller avsevärt mellan proverna samt förekomst av fibrös bindvävszon mot benet. Ytterligare studier behövs för att förklara skillnaden i det kliniska och histologiska utseendet.
Histopathological differences
between peri-implantitis
lesions with different clinical
appearance
- A pilot study
S. Arvidsson
K. Wennberg
Main Supervisor: Anna Ljunggren
Supervisor: Andreas Stavropoulos
Master Thesis in Odontology (30 ECTS)
Malmö University
Program in Dentistry
Faculty of Odontology
Abstract
The purpose of this study was to examine the histopathological composition of human peri-implantitis lesions in relation to the clinical appearance of the lesion. Peri-peri-implantitis tissue located around implants was surgically removed from 13 individuals. The surgically removed tissue samples differed significantly in appearance clinically and were divided into two groups, depending on whether they were encapsulated and well-bound to surrounding tissue or more diffusely delimited. The tissues were histochemically prepared (MAYERS HTX) and immunohistochemical (MACH 4 Universal HRP-Polymer Detection System). The cells examined by immunohistochemical methods were T cells (CD3 +), B cells (CD20 +), plasma cells (CD138 +), M1 macrophages (CD68 +) and M2 macrophages (CD163 +). The presence of neutrophilic granulocytes was examined morphologically by routine staining. The samples were then scanned and analyzed qualitatively and quantitatively. No statistically significant difference could be detected between the density of infiltrated lymphocytes (P = 0.613) and neutrophil granulocytes (P = 0.336) and the area of the inflammatory infiltrate (P = 0.613) between the two studied groups. Furthermore, no relationship could be observed between the histological composition of the cells studied and the clinical appearance, which however, can be explained by unclear clinical criteria. The results indicated that there was a difference between the samples based on the histological composition, including the number of plasma cells which varied considerably between the samples and the presence of fibrous connective tissue zone close to the bone. Further studies are required to explain the difference in the clinical and histological appearance.
Innehållsförteckning
Sammanfattning ... 2
Abstract ... 4
Introduktion ... 6
Syfte ... 9
Material och metod ... 10
Etisk prövning ... 10
Insamling av vävnad ... 10
Bakgrund immunohistokemi ... 10
Preparering ... 11
Rutininfärgning HTX och immunohistokemi ... 12
Scanning ... 13 Histologisk analys ... 13 Statistisk analys ... 13 Resultat ... 13 Diskussion ... 15 Konklusion ... 17 Referenser ... 19 Bilaga 1. Informationsblankett ... 22 Bilaga 2. Samtyckesblankett ... 24 Bilaga 3. IHC-protokoll ... 25
Bilaga 4. Kvalitativ analys ... 26
Introduktion
Samlingsnamnet för de inflammatoriska lesionerna som utvecklas i vävnaden runt implantat kallas för periimplantära sjukdomar. Liksom parodontala sjukdomar har
periimplantatsjukdomar två kategorier där mukosit motsvarar gingivit och periimplantit motsvarar parodontit. (1)
Mukosit definieras som en reversibel inflammatorisk reaktion i den kringliggande mjukvävnaden runt implantatet medan periimplantit definieras som en inflammatorisk reaktion kombinerat med irreversibel förlust av ben runt implantatet (1). Prevalensen av periimplantit varierar mycket beroende på studie med ett spann på 1-47%. Orsaken till detta är att sjukdomen definieras och bedöms olika mellan studierna (2). I en svensk studie visade 45% av samtliga undersökta patienter tecken på periimplantit med en blödning vid sondering och benförlust >0,5 mm varav 14,5% diagnostiserades med blödning vid sondering samt benförlust >2 mm (3). Det tycks vara nödvändigt med kompletterande information om sjukdomens utbredning och svårighetsgrad.
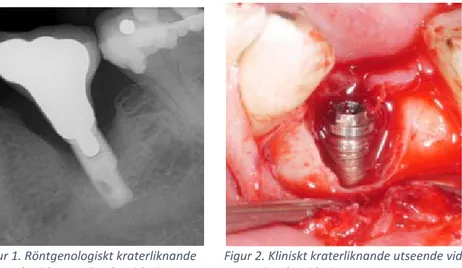
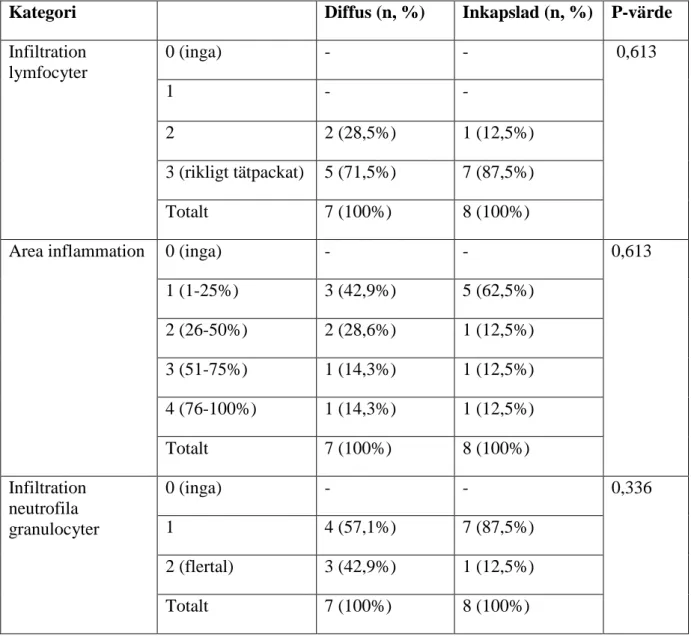
För att upptäcka en närvarande inflammation i mukosan sonderas vävnaden runt implantatet och därigenom kan blödning och/eller pus identifieras. En eventuell marginal benförlust detekteras genom röntgen. Det är viktigt att kunna skilja mellan benremodellering som sker efter installation av implantat och benförlust efter osseointegrering är fullbordad (1). Vid periimplantit kan marginella vävnaden vara svullen och/eller röd men det är inte alltid tydligt kliniskt och en patologisk ficka ska mätas till 5 mm eller mer. Bendefektens utseende är typiskt lik en krater (se figur 1 och 2) och följer runt hela implantatet och är tydligt avgränsad. Mobilitet tar sig inte alltid uttryck då osseointegrationen apikalt kan vara intakt. Mobilitet indikerar fullständigt förlorad osseointegration och är ett tecken på totalt misslyckande (4).
Figur 1. Röntgenologiskt kraterliknande Figur 2. Kliniskt kraterliknande utseende vid utseende vid en periimplantitlesion. en periimplantitlesion.
Det finns olika riskfaktorer för periimplantit och de kategoriseras huvudsakligen som implantat- eller patientrelaterade faktorer som kan vara lokala eller systemiska. Under kategorin implantatrelaterade lokala faktorer faller faktorer som implantatets ytdesign,
position på implantatet och överkonstruktionens design för att upprätthålla en god munhygien. Gällande tidigare historik av parodontit och rökning kategoriseras dessa som patientrelaterade systemiska faktorer och de är undersökta i större utsträckning då de starkt associeras med periimplantit. För att förhindra progression av parodontit och även undvika uppkomsten av periimplantit sätts stödbehandling och regelbundna kontroller in efter implantatinstallationen. (5)
Det finns både kirurgiska och kirurgiska behandlingar vid periimplantit. Den icke-kirurgiska behandlingen innebär munhygieninstruktioner och mekanisk rengöring. Den kirurgiska behandlingen innebär att en lambå fälls upp för att kunna avlägsna bakterier och jämna till implantatytan så att ytråheten minskar. Efter den kirurgiska delen följs
behandlingen upp med plackkontroll (6). Den rekommenderade behandlingen i Sverige av periimplantit är kirurgisk behandling (7).
Till skillnad från en naturlig tand saknar ett implantat parodontalligament. Detta anses
innebära en reducerad mjukvävnadsbarriär mot benet vilket kan medföra att vävnaderna kring implantatet är mer mottagliga för bakteriella infektioner (8). En experimentell studie gjord på hundar har visat att lesionen vid periimplantit, har en sonderbar patologisk ficka
innehållandes en bakteriell biofilm med liknande sammansättning som vid parodontit och själva lesionen består av bindväv som är infiltrerad av inflammationsceller (9). Histologiska studier där humana lesioner av parodontit och periimplantit jämförs har visat att
parodontitlesionen är omgiven av dels ett fickepitel längs sulcus och dels en välavgränsad bindvävszon, som inte är infiltrerad av inflammationsceller, mot benet. Hos
periimplantitvävnad var dock andelen inflammerad bindväv större till ytan och befann sig dessutom närmare fickepitelet samtidigt som den skyddande, icke-inflammerade
bindvävszonen mellan lesionen och benet saknades. Detta innebär att den inflammerade vävnaden befinner sig mycket nära benet och att periimplantitlesionen är betydligt större än lesionen vid parodontit. Den apikala tredjedelen av fickan vid periimplantit saknar dessutom fickepitel, vilket medför att det finns en öppen såryta mellan lesionen och biofilmen i fickan (10).
Mikrofloran vid periimplantit är väldigt lik den vid parodontit, det vill säga en blandad flora. Något som däremot skiljer sig avsevärt är att stafylokocker och enteriska bakterier finns närvarande i hög grad vid periimplantit (11, 12). Vid periimplantit förekommer fler
gramnegativa, rörliga och anareoba arter än vid parodontit (13, 14). Redan 30 minuter efter implantatinstallationen har bakterier koloniserat implantatytan, samma bakteriearter som även återfinns flera månader senare (15). Under de första fyra veckorna hittas liknande arter som även finns vid friska tänder i den subgingivala kolonisationen med skillnaden att
kolonisationen vid implantat initialt sker i en långsammare takt (16).
På samtliga gramnegativa bakteriers cellmembran förekommer lipopolysackarider (LPS) som har proinflammatorisk verkan genom att binda in till Toll-like receptors (TLR) som finns bland annat på keratinocyternas cellmembran. TLR-receptorn är en pattern recognition receptor (PRR) vars uppgift är att identifiera patogena beståndsdelar, patogen-associated molecular patterns (PAMPs), vilka är urskiljbara från kroppsegna molekyler (17, 18). När bakterier dör frigörs stora mängder LPS vilket framkallar en kraftig immunreaktion. Framför allt LPS på Porphyromonas gingivalis har visats föranleda en ökad mängd plasmaceller och högre antikroppsnivåer än vid parodontala sjukdomar. (19)
Både det specifika och det ospecifika immunförsvaret är centrala vid periimplantit och
parodontit. Den inflammerade vävnaden infiltreras av lymfocyter, makrofager och neutrofiler. Studier av histologiska preparat från periimplantitlesioner tyder på att cellsammansättningen i detta inflammatoriska infiltrat skiljer sig från det vid parodontit. Det totala antalet
inflammationsceller är inte bara större, utan den relativa andelen av makrofager och
neutrofiler är även större vid periimplantit än vid parodontit. En större närvaro av neutrofila granulocyter kan vara ett tecken på att inflammationen är utav en mer akut art (10). Vidare har även skillnader i sammansättningen av inflammatoriska mediatorer observerats (20). En
större mängd osteoklaster har även noterats vid periimplantit än vid parodontit och själva progressionen av benresorptionen sker generellt med högre hastighet (9). Det tycks dock fortfarande råda stor osäkerhet kring de cellulära och molekylära mekanismerna för inflammationsreaktionerna vid periimplantit.
Celler från det specifika och ospecifika immunförsvaret kan agera både nedbrytande och skyddande gentemot vävnaden (19). Lymfocyter och plasmaceller utgör de dominerande immunförsvarscellerna vid både periimplantit och parodontit. B-celler ingår i det specifika immunförsvaret och kan aktiveras direkt av ett antigen eller få en förstärkt aktivering via T-celler, som blivit aktiverade av samma antigen, vilket leder till att B-cellen multipliceras och differentierar till antikroppsproducerande plasmaceller. Plasmaceller karaktäriseras av sin stora cytoplasma och kan därför identifieras på rutininfärgning av histologiska preparat. En positiv korrelation mellan antalet B-och-plasmaceller i parodontitlesioner och
allvarlighetsgraden hos tillståndet har observerats. Vilken betydelse antikroppar specifika mot bakterierna i biofilmen har är dock oklart. Antikroppssvaret vid parodontala sjukdomar har inte kunnat påvisas besitta någon hämmande inverkan på sjukdomsprogressionen. B-celler tros även vara involverade i benresorption genom att uttrycka faktorer som RANKL och därigenom främja osteoklastdifferentiering (21).
T-celler spelar en viktig roll i det specifika immunförsvaret och medverkar bland annat i B-cellens antikroppsproduktion och rekrytering av inflammationsceller. T-cellen aktiveras genom igenkänning av ett antigen som presenteras av en antigenpresenterande cell via MHC. Den omogna T-cellen har vid aktivering potential att differentiera till många olika typer av specialiserade T-celler. T-hjälparceller producerar proinflammatoriska cytokiner, däribland RANKL, samt aktiverar dendritiska celler, neutrofila granulocyter och B-celler. Regulatoriska T-celler har däremot antiinflammatoriska egenskaper och skyddar mot vävnadsdestruktion. Vid parodontala sjukdomar har regulatoriska T-celler dock visats vara få till antalet och oförmögna att reducera inflammationsresponsen, vilket kan vara en möjlig förklaring till varför inflammationen blir kronisk. (22)
Makrofager utvecklas från monocyter i blodet som tagit sig ut i vävnaden och differentierats till makrofager. Den slutgiltiga differentieringen och aktiveringen sker genom fenotypisk polarisering beroende på olika stimuli i omgivningen. Makrofager förekommer i två
huvudsakliga aktiverade tillstånd, vilka benämns M1 och M2. De två aktiverade tillstånden är associerade med motsatta funktioner där M1-makrofagen verkar pro-inflammatoriskt och vävnadsnedbrytande medan M2-makrofagen verkar anti-inflammatoriskt och
vävnadsuppbyggande. I frisk vävnad råder det jämnvikt mellan de två tillstånden, men vid inflammation ökar M1/M2-kvoten. LPS från P. gingivalis har speciellt visats främja
aktivering av M1-makrofager och därmed produktion av inflammatoriska cytokiner. Somliga cytokiner som utsöndras vid infektioner med P. gingivalis har dock även visats främja aktiveringen av M2-makrofager vilket bland annat resulterar i ökad deposition av kollagen och induktion av fibros i de gingivala vävnaderna, vilket oftast syns vid kronisk
inflammation. (23)
Neutrofila granulocyter utgör tillsammans med makrofager kroppens första försvarslinje vid infektioner och inflammationer. Histologiskt känns neutrofila granulocyter igen på
rutininfärgningen genom sin typiska polymorfa cellkärna. Vid parodontala sjukdomar infiltrerar de fickepitelet och bildar en barriär mot biofilmen i fickan, vilket tros förhindra bakterier att invadera den underliggande vävnaden. Ett ökat antal neutrofila granulocyter har dock visats vara positivt korrelerat med lesionens svårighetsgrad och celltypen har visats
understödja vävnadsnerbrytningsprocessen. (24)
Som beskrivits ovan har det i histologiska studier av humana periimplantit-lesioner
observerats att fickepitelet ofta saknas, den inflammerade bindvävnadsarealen är omfattande och att det saknas en icke-inflammerad bindvävszon som avgränsning mellan lesionen och benet. Dessa observationer skiljer sig från vad som beskrivits om parodontitlesioner; där det finns fickepitel, den inflammerade bindvävnadsarealen är mindre och att det alltid finns en icke-inflammerad bindvävszon mellan lesionen och benet. (9) (10)
I litteraturen beskrivs periimplantitlesioner som avlägsnas vid kirurgisk behandling ofta ha en morfologi som är diffust avgränsad och mer lucker mot angränsande vävnad. Kliniskt har det dock observerats, enligt personlig kommunikation med Andreas Stavropoulos, att de
avlägsnade periimplantitlesionerna ofta upplevs väldefinierade, nästan inkapslade och sammanhållna mot angränsande vävnad, se figur 3. Detta fenomen har inte observerats vid parodontitlesioner.
Figur 3. Kliniskt utseende vid inkapslad periimplantitlesion innan kirurgiskt avlägsnande. Mjukvävnaden är välavgränsad mot omgivande benet och gingivan.
Syfte
Periimplantit har hög prevalens och innebär stora kostnader för samhället samtidigt som det är ett område där det fortfarande råder oklarheter kring mekanismerna av sjukdomens uppkomst och progression. Det är därför av stor vikt att utforska området mer och öka förståelsen för morfologin av vävnaden vid implantat med periimplantit och hur sjukdomsförloppet i förhållande till vävnadsutseendet skiljer sig.
Vävnader som avlägsnas vid kirurgisk behandling av periimplantit kan ha olika utseenden kliniskt. I denna studie kommer den histopatologiska sammansättningen av humana
periimplantitlesioner som avlägsnas under kirurgisk periimplantit-behandling att undersökas i relation till deras kliniska utseende. Mer specifikt analyseras förhållandet mellan
icke-inflammerad bindväv och inflammatoriskt cellinfiltrat samt förekomsten och lokalisationen av immunförsvarsceller i avlägsnad periimplantitvävnad. Två grupper med olika kliniska
utseenden, välavgränsad eller diffust, kommer att jämföras. De celler som undersöks med immunohistokemiska metoder är T-celler (CD3+), B-celler (CD20+), plasmaceller (CD138+), M1-makrofager (CD68+) och M2-makrofager (CD163+). Förekomsten av neutrofila
granulocyter undersöks morfologiskt med rutininfärgning. Dessa celler är, som beskrivits i inledningen, centrala vid inflammatoriska tillstånd. Hypotesen är att de välavgränsade och inkapslade proverna, som har en mer sammanhållen fibrös konsistens, förväntas innehålla
Lesion Ben
mycket kollagenrik bindväv framför allt mot benet medan att de diffust avgränsade proverna förväntas innehålla mycket inflammationsceller och inte lika mycket fibrös bindväv.
Material och metod
Etisk prövning
Projektplanen granskades och godkändes av Odontologiska fakultetens etiska kommitté vid Malmö universitet. Skriftlig information om projektets syfte och genomförande gavs till samtliga patienter innan den kirurgiska behandlingen påbörjades, se bilaga 1. Patienterna godkände även skriftligt sitt deltagande genom en samtyckesblankett, se bilaga 2. Studien innebär inte att någon ytterligare risk för patienten och ej heller några fördelar. Deltagandet påverkar inte den behandling som patienterna får.
Insamling av vävnad
Inflammerad vävnad från 15 implantat avlägsnades kirurgiskt av samma operatör vid avdelningen för parodontologi vid Odontologiska fakulteten, Malmö universitet. Samtliga individer var över 18 år och patienter som skulle behandlas kirurgiskt för periimplantit. 3-4 veckor innan kirurgiska ingreppet hade samtliga patienter erhållit marginalbehandling. Vävnadsproverna förvarades i formalin fram till preparering. Operatören som utförde de kirurgiska ingreppen delade in proverna beroende på deras utseende, som tidigare beskrivits, det vill säga om vävnaden var välavgränsad eller diffust avgränsad mot omgivande vävnad.
Bakgrund immunohistokemi
Histokemiska metoder är ofta kvalitativa och används för att kunna visualisera och särskilja olika vävnadskomponenter genom att utnyttja deras biokemiska egenskaper. Vävnaden görs först synlig genom att tillsätta reagenter som ger färgade produkter och kan därefter studeras i mikroskop. De idag mest använda infärgningsmedlen är hematoxylin och eosin. Hematoxylin är basiskt och positivt laddat och binder därmed till sura och negativt laddade komponenter i vävnaden såsom DNA. Detta medför att särskilt cellkärnor färgas starkt blå/lila av
hematoxylin. Eosin är en sur och negativt laddad molekyl och binder därför framförallt till positivt laddade aminosyror som återfinns i många proteiner. Därför färgas bland annat kollagenrika fibrer i bindväv röda/rosa av eosin (25).
Immunohistokemi (IHC) är en vidareutveckling av histokemi och innebär att antikroppar används för att exempelvis identifiera och lokalisera celler eller proteiner i vävnaden. Metoden går ut på att vävnaden inkuberas med antikroppar mot ett protein/antigen som är specifikt för den cell som ämnas undersökas. Ett sådant protein är ofta lokaliserat i
cellmembranet men kan även finnas i cellens cytoplasma. Därtill används ett detektionssystem för att visualisera var antikroppen bundit in i vävnaden.
Det finns två huvudmetoder av IHC, direkt och indirekt. Vid den direkta metoden används endast en primär antikropp som är märkt med någon typ av detektionssystem. Vid den indirekta metoden används istället en sekundär märkt antikropp som binder till den omärkta primära. Av dessa två metoder är den senare mer mångsidig då en enda märkt antikropp kan användas till flera olika primära antikroppar. De huvudsakliga detektionssystemen som används är fluorescens-märkta eller enzym-märkta antikroppar (26). Ett av de vanligaste enzymerna är horseradish peroxidase (HRP) som oxiderar substratet diaminobenzidine (DAB) vilket resulterar i att ett brunt färgämne fälls ut. Färgen är olöslig och stannar därmed kvar på platsen där antikroppen bundit till målproteinet vilket möjliggör en specifik infärgning av vävnaden (27). Idag används oftast polymer-baserad märkning, vilket innebär att den
sekundära antikroppen märks med en polymerkedja som är konjugerad med flertalet enzymer. Detta medför att signalen amplifieras och sensitiviteten ökar (26).
Ett avgörande steg vid IHC är blockering av bakgrundsbrus i vävnaden innan antikropparna tillsätts. Detta görs genom att förhindra möjligheten för ospecifik inbindning av antikropparna men även genom att inhibera aktiviteten hos endogena peroxidaser. Antikroppar är laddade molekyler som kan binda ospecifikt till molekyler i vävnaden med motsatt laddning som exempelvis kollagen. För att motverka detta inkuberas först vävnaden med serumproteiner som binder till och blockerar de laddade molekylerna. Kvarvarande endogena peroxidaser i vävnaden riskerar också att ge falskt positiv infärgning genom att oxidera substratet som används i detektionssystemet. Därför preinkuberas även vävnaden med väteperoxid som inhiberar dessa enzymer (26).
En förutsättning för att IHC skall fungera är även att antikroppen känner igen målproteinet och därför måste vävnaden först preserveras på ett adekvat sätt så att proteinernas struktur behålls intakta (27). För att provet inte ska förstöras placeras vävnadsprover i formalin inom en timme efter excision. För att få fram en fast matrix som är snittbar genomgår vävnader fixering, dehydrering och slutligen inbäddning i paraffin. Vävnaderna fixeras innan de bäddas in i paraffin för att optimera preservationen, en process som har stor påverkan på morfologin och resultatet av IHC och rutininfärgning med HTX. Proverna bör ej heller torkas ut innan de fixeras för att undvika att morfologin förändras. (26)
Fixeringsmedel delas in i två grupper, koagulanta fixaturer som till exempel etanol och korslänkande fixturer så som formaldehyd. Båda grupperna kan orsaka förändring i proteiners utseende vilket kan dölja epitoper som påverkar bindningen med antikroppen negativt. Etanol har rapporterats ge minst modifikationer. Under preserveringsprocessen kan dock
förändringar ske i proteinerna och därmed även antigenernas struktur vilken därför måste återställas i en process som kallas antigen retrival (AR). Vävnadsproverna dehydreras i en uppvärmningsprocess, HIER. Effekten av AR är mest avgörande under
upphettningsprocessen. Ett optimalt resultat för AR är korrelerat med den matematiska produkten av upphettningstemperaturen multiplicerat med durationen av AR-behandlingen, temperaturen X upphettningstiden (26). Studier har även visat att pH-värdet kan påverka resultatet av AR och bör därför hållas inom 1,0-10,0 för de flesta antigener (28).
IHC är en diagnostisk metod i flera steg som involverar valet av representativ biopsi, fixering, bearbetning och test av vävnaden. Den slutgiltiga tolkningen av resultatet sker av en patolog baserat på närvaron, mönster och intensitet av infärgningen av specifika antikropps-antigen reaktioner i cellerna (26).
Preparering
Proverna i denna studie tilldelades ett provnummer inom intervallen 1-13. Tre prover kom från samma patient och dessa delades in i a-c. Vävnadsproverna avidentifierades och färgades in med blå tusch på motstående sida mot implantatet. Därefter delades vävnaderna med målet att samtliga strukturer representeras. Vävnaderna dehydrerades sedan genom en gradvis ökad etanolkoncentration (70-100%) i Logos Microwave Hydrid Tissue Processor (Milestone, Sorisole, Italien). Därefter bäddades de in med paraffin. Proverna snittades sedan med 3μm snitt i en serie på 9 per prov och placerades på positivt laddade objektglas. Ett snitt per prov användes för HTX-infärgning, fem snitt per prov användes för de fem olika antikropparna. De kvarstående fem snitten per prov sparades som reserv. Vävnaderna torkades i ugn i 60 grader i 40 minuter för att fixera vävnaderna på glaset. Proverna sparades i biobanken (enl.
Socialstyrelsen godkänd nr. 497) på avdelningen för Oral Patologi vid Odontologiska fakulteten, Malmö universitet.
Rutininfärgning HTX och immunohistokemi
En sammanfattning av IHC-protokollet finns i bilaga 3. Proverna värmdes upp i ugn i fem minuter i 60°C och avparaffinerades därefter. Proverna dehydrerades med minskande
etanolkoncentration (100-95%) till destillerat vatten med Tissue-Tek Prisma (Sakura Finetek, USA). Proverna sänktes ned i en tryckkokare Biocare Medical (Concord, CA, USA) med TEG-buffert förutom för antikroppen CD163 där natriumcitratbuffert pH 6,0 användes istället i 95°C i 40 minuter för att slutföra antigen retrieval. Efter avkylning med rinnande kranvatten i tio minuter sänktes proverna ned i destillerat vatten i fem minuter och förvarades sedan i TRIS-buffert (Tr) i minst fem minuter. Glasen torkades försiktigt av runt vävnadsproverna och en ring ritades runt proverna med Liquid Blocker-penna för att vätskorna ej skulle rinna ut över glaset. Infärgning skedde med MACH 4 Universal HRP-Polymer Detection System (Biocare Medical, Pacheco, CA, USA), vilket är en indirekt IHC-metod. Antikropparna med respektive spädningsförhållande som användes till IHC-infärgningen presenteras i tabell 1. Tabell 1. Antikroppar med motsvarande antigen som används för att identifiera respektive celler med IHC. Samtliga antigener är membranbundna. Antikropparna var antingen monoklonala eller polyklonala och hade olika ursprung (mus eller kanin). Spädningen skedde med Dako Antibody Diluent och antikropp:diluent-förhållandet redovisas i tabellen. Celltyp T-cell B-cell M1-makrofag M2-makrofag Plasmacell
Antigen CD3 CD20cy CD68 CD163 CD138 Antikropp Polyclonal Rabbit, A0452, Dako Monoclonal Mouse, M0755, klon L26, Dako Monoclonal Mouse, M0814, klon KP1, Dako Monoclonal Mouse, Abcam, klon OTI2G12, Dako Monoclonal Mouse, M7228, klon MI15, Dako Spädning (med Dako Antibody Diluent) 1:500 1:2000 1:8000 1:1000 1:800
IHC utfördes manuellt av två operatörer som hanterade tre prover per körning vardera. Som positiv och negativ kontroll användes snitt av tonsillvävnad. I följande protokoll tillsattes 100 mikroliter av varje lösning innanför ringen. Samtliga inkubationer skedde vid
rumstemperatur. Mellan varje lösning sköljdes glasen rikligt med TRIS-lösning. Peroxidase-blockering (HPBK) innehållandes väteperoxid tillsattes först och inkuberades i fem minuter. Detta steg syftar till att blockera perioxidas-enzymer i vävnaden. MACH 4 Background Punisher tillsattes sedan i tio minuter för att avlägsna positiva laddningar och alla möjligheter för antikroppar att binda in till vävnaden och genom detta förhindra ospecifik inbindning. Primära antikroppar applicerades och inkuberades i 30 minuter. Till mus-antikropparna (CD20cy, CD138, CD68, CD163) användes därefter en Mouse Probe, för att underlätta inbindningen av polymer till antikropparna, i 15 minuter. Därefter tillsattes
HRP-polymer vilket är en HRP-polymermärkt antikropp konjugerad med enzymet HRP, vilken binder in till de primära antikropparna. Sedan tillsattes DAB som är substrat till HRP och ger en
brunaktig färg där antikroppen och HRP har bundit. HRP bryter ner peroxiden i DAB:en vilket färgar in antikropparna med den bruna färgen. Slutligen används standardinfärgningen MAYERS HTX (Histolab Products AB, Västra Frölunda, Sverige), för att färga in bland annat alla cellkärnor, som sköljdes av med kranvatten efter två minuters inkubering. Sedan
dehydreringsprocessen där glasen först placerades i destillerat vatten i fem minuter. Vidare placerades de i 96% etanol i fyra minuter, sedan i 100% etanol i två minuter och slutligen i isopropanol i två minuter. Pertex (Histolab Products AB, Göteborg, Sverige) applicerades därefter på täckglas som lades över proverna för att skydda vävnaderna. Ett snitt per prov rutininfärgades med hematoxylin-lösning och eosin.
Scanning
Glasen scannades med NanoZoomer SQ C13140-21 (Hamamatsu Photonics K.K., Herrsching am Ammersee, Tyskland) förutom för CD138 som scannades med NanoZoomer S210
(Hamamatsu Photonics K.K., Herrsching am Ammersee, Tyskland). Samtliga scanningar kördes med serversystemet NDP NanoZoomer Digital Pathology (Hamamatsu Server Software) och analyserades därefter med bildvisningsprogrammet NDP.view2 Viewing Software.
Histologisk analys
Kvantitativ analys
Det snitt för varje vävnadsprov som bedömdes ha högst inflammationsgrad på
HTX-infärgningen valdes ut för vidare analys. Analysen av de rutininfärgade preparaten utfördes av två observatörer enligt blindtestmetoden. Bedömning av inflammationen gjordes genom en variant av en tidigare framställd metod (29), där HTX-infärgningen studerades och tre kategorier undersöktes: lymfocyter, neutrofila granulocyter och area av inflammation. Lymfocyterna graderades 0 till 3 där 0 motsvarar enstaka lymfocyter och 3 rikligt tätpackat med lymfocyter. Arean av inflammation bedömdes utifrån den yta som inflammationen utgjorde i förhållande till vävnadsprovets totala yta och graderades på en skala 0-4 där 0 motsvarar ingen inflammation, 1 1-25%, 2 26-50%, 3 51-75% och 4 76-100%. Till den totala provarean exkluderades fickepitelet. I ett fåtal snitt fanns en bit av den orala slemhinnan samt underliggande lamina propria med som en biprodukt av det kirurgiska ingreppet. Dessa delar uteslöts därför även vid bedömningen av den totala arean. Neutrofila granulocyter kunde identifieras och lokaliseras utifrån dess morfologi och graderades 0 (inga) till 2 (flertal). Kvalitativ analys
För den kvalitativa analysen studerades de IHC-infärgade snitten för respektive antikropp. Snitten granskades i bildvisningsprogrammet och T-celler, B-celler, makrofager och plasmaceller identifierades och lokaliserades i vardera motsvarande IHC-infärgning. Då infärgningen för plasmaceller (CD138+) var otillräcklig på några av snitten identifierades dessa även genom sin morfologi på HTX-infärgningen. Neutrofila granulocyter lokaliserades endast genom HTX-infärgningen. Efter analysen avkodades proverna och resultatet jämfördes för de två grupperna med de olika vävnadsutseendena.
Statistisk analys
Mann-Whitneys test användes för att upptäcka om det föreligger någon skillnad i resultatet från den kvantitativa delen av analysen (grad av infiltrerade lymfocyter och neutrofila
granulocyter samt grad av inflammation) mellan de två grupperna med olika vävnadsutseende kliniskt. Analysen utfördes med IBM Statistical Packages of Social Sciences version 25 (SPSS Inc, Chicago, IL, USA). P-värden togs fram med exakt interferens, då stickprovet är litet, och en signifikansnivå på 0,05 användes.
prover var väl sammanhållna medan andra var trasiga och i flera stycken. Histologiskt noterades att förekomsten av ett fickepitel även varierade mellan proverna, där vissa prover helt saknade epitel medan andra hade ett som dock oftast var mycket tunt och sällan intakt. Resultatet av den kvantitativa analysen utifrån HTX-infärgningen redovisas i tabell 2. Den histologiska inflammationsgraden (tätheten av infiltrerade lymfocyter och neutrofila granulocyter samt arean av inflammationsinfiltratet) varierade mycket mellan de 15 olika vävnadsproverna. Ingen statistiskt signifikant skillnad kunde dock påvisas mellan tätheten av infiltrerade lymfocyter (P=0,613) och neutrofila granulocyter (P=0,336) samt arean av inflammationsinfiltratet (P=0,613) i relation till det kliniska utseendet (inkapslad eller diffust avgränsad).
Vid den kvalitativa analysen av vävnadsproverna observerades att inflammationen gick mycket nära benet hos vissa prover utan att det fanns någon icke-inflammerad bindväv som omgav inflammationen medan det på andra prover visades finnas mycket icke-inflammerad kollagenrik bindväv som avgränsade mot benet. Likväl kunde ingen tydlig skillnad påvisas avseende förekomst av icke-inflammerad, avgränsande bindväv mellan de två studerande grupperna. En sammanfattning av den kvalitativa analysen redovisas i bilaga 4.
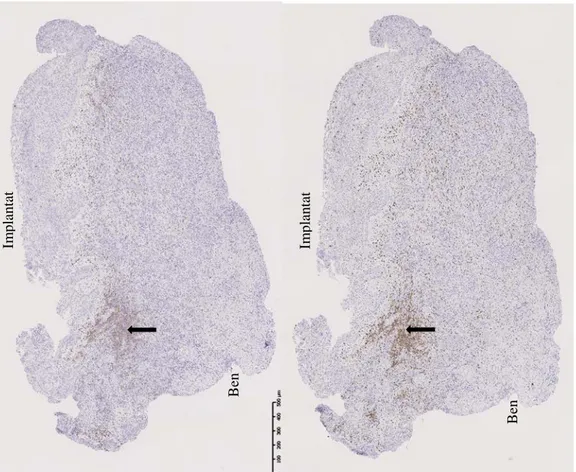
T-celler (CD3+) och B-celler (CD20+) observerades ofta samlade vid ett lokalt
inflammatoriskt infiltrat och tillsammans nära epitelet på samtliga vävnadsprover. T-celler hittades även utspritt ute i vävnaden i större grad än B-celler. Någon skillnad i förekomst eller fördelning av B-och-T-celler kunde dock inte ses i relation till vävnadsprovernas kliniska utseende.
Neutrofila granulocyter kunde observeras i HTX-infärgningarna och fanns ofta i anslutning till eller infiltrerade i hela epitelet, det vill säga nära sårytan. Enstaka kunde även observeras ute i vävnaden. Det fanns ingen tydlig trend mellan förekomst eller lokalisation av neutrofila granulocyter i relation till provernas kliniska utseende, se figur 4, bilaga 5. Det observerades inget samband mellan neutrofilförekomst och andelen kollagen respektive andelen
plasmaceller.
Generellt var M1-makrofager (CD68+) vanligare än M2-makrofager (CD163+) och befann sig oftare strax under epitelet. M2-makrofager observerades i samma område som
M1-makrofager men även utspritt ute i vävnaden. Ingen skillnad observerades mellan de två olika vävnadsutseendena gällande antal av M1- och M2-makrofager eller deras lokalisation. Vad som däremot kunde ses var att M1-makrofager generellt var vanligare än M2-makrofager hos de prover som hade inkapslat utseende kliniskt. På ett av proverna kunde jätteceller av
fusionerade M1-makrofager observeras, se figur 5 bilaga 5.
Det rådde stor skillnad mellan proverna i hur många plasmaceller (CD138+) som fanns i vävnaderna, dock kunde ingen tydlig skillnad ses i relation till det kliniska utseendet. Plasmacellerna befann sig längre från epitelet än övriga undersökta inflammationsceller, se figur 7, bilaga 5.
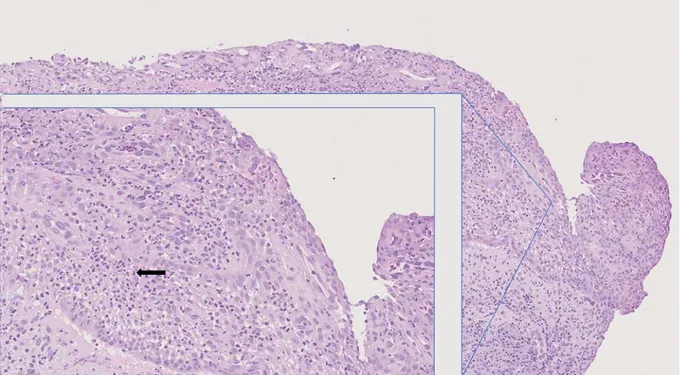
Tabell 2. Grad av infiltrerade lymfocyter och neutrofila granulocyter samt graden av inflammation i vävnadsproverna i relation till deras utseende kliniskt: diffust eller inkapslat. I tabellen anges antalet (n) prover för respektive gradering och hur stor andel (%) denna utgör av det totala antalet prover. För att jämföra resultatet mellan de två grupperna användes Mann-Whitneys test och P-värdet som anges är framtaget med exakt interferens.
Kategori Diffus (n, %) Inkapslad (n, %) P-värde
Infiltration lymfocyter 0 (inga) - - 0,613 1 - - 2 2 (28,5%) 1 (12,5%) 3 (rikligt tätpackat) 5 (71,5%) 7 (87,5%) Totalt 7 (100%) 8 (100%)
Area inflammation 0 (inga) - - 0,613
1 (1-25%) 3 (42,9%) 5 (62,5%) 2 (26-50%) 2 (28,6%) 1 (12,5%) 3 (51-75%) 1 (14,3%) 1 (12,5%) 4 (76-100%) 1 (14,3%) 1 (12,5%) Totalt 7 (100%) 8 (100%) Infiltration neutrofila granulocyter 0 (inga) - - 0,336 1 4 (57,1%) 7 (87,5%) 2 (flertal) 3 (42,9%) 1 (12,5%) Totalt 7 (100%) 8 (100%)
Diskussion
Syftet med studien var att undersöka den histologiska sammansättningen vid periimplantit i relation till det kliniska utseendet, det vill säga om lesionen var välavgränsad och inkapslad eller mer diffust sammanhållen.
Resultatet visar dock att inget samband kunde observeras mellan den histologiska bilden och det kliniska utseendet, vare sig vid den kvalitativa eller kvantitativa analysen. De
välavgränsade och inkapslade proverna hade en mer sammanhållen fibrös konsistens och förväntades därför innehålla mycket kollagenrik bindväv, framför allt mot benet, medan de diffust avgränsade proverna förväntades innehålla mycket inflammationsceller och inte lika mycket fibrös bindväv. Då urvalet var begränsat är det svårt att fastställa några definitiva slutsatser och ett mer omfattande urval samt tydligare kliniska kriterier hade förbättrat studiens kvalitet. Indelningen av grupperna gjordes först efter att proverna lagts i formalin
vilket medförde att deras morfologi var svåridentifierade. Till framtida studier bör indelningen göras direkt efter det kirurgiska avlägsnandet och innan de läggs i formalin. IHC är en diagnostisk metod med många steg och därmed finns det flertalet faktorer som kan påverka resultatet (26). IHC-färgningen vid försöket gav ett sämre resultat för CD138 vilket kan bero på felaktig hantering vid prepareringen eller inkuberingen vid IHC. Plasmaceller har ett karakteristiskt utseende histologiskt och kan därför identifieras vid rutininfärgning med HTX och därmed beslutades det att CD138 ej behövde färgas om. Ett sätt att kontrollera om färgningen har fungerat för CD138 är att studera om epitelcellerna färgats in bra då de även har proteinet på sitt cellmembran (21).
Då indelningen av vävnaderna inte grupperades optimalt kan inga slutsatser dras kring det kliniska utseende i relation till det histologiska utseendet. Däremot kan det konstateras att en skillnad föreligger mellan proverna utifrån den histologiska bilden. Detta har inte diskuterats i litteraturen där periimplantitlesioner ofta jämförs med parodontitlesioner och variationen i utseendet har inte undersökts lika utförligt hos periimplantitlesioner. B- och T-celler
lokaliserades i samtliga vävnader och alltid tillsammans i samma område strax under epitelet, se figur 8 bilaga 5. Detta stämmer väl överens med tidigare studier av periimplantit-biopsier (10). Inget samband kan ses mellan B- och T-lymfocyters förekomst och mängd kollagenrik bindväv. Även de prover som hade mycket bindväv hade alltid ett område av B- och T-celler vid epitelet. Vad som däremot kan observeras bland lymfocyterna är att antalet plasmaceller varierar mycket mellan proverna. Prover där arean med inflammationsinfiltrat upptog en stor andel av hela vävnadsprovet är rikligt infiltrerade av plasmaceller. I dessa fall var
plasmacellerna lokaliserade nära benet utan att det fanns någon icke-inflammerad bindväv mellan inflammation och ben. Detta stämmer väl överens med vad som är beskrivet om plasmacellernas lokalisation vid periimplantit i tidigare studier (10). Däremot visar vårt resultat att plasmaceller inte alltid är den dominerade cellen vid periimplantit-lesioner. Vissa prover saknade helt inslag av plasmaceller och i de fallen fanns det rikligt med
icke-inflammerad kollagenrik bindväv. Som nämnts i inledningen har framför allt LPS från P. gingivalis visats föranleda en ökad mängd plasmaceller (19). Därför kan sammansättningen av bakteriefloran i den patologiska fickan runt implantatet vara en möjlig förklaring till variationen i mängd plasmaceller. I tidigare experimentella studier på djur har det visats att periimplantitinfektionen är periodisk och att episoder med lite inflammation varvas med perioder av mycket inflammation nära benet och snabb progression (8). Detta kan vara en annan möjlig förklaring till den histologiska skillnaden.
Proverna var svåra att jämföra då snittningen är komplicerad att utföra enhetligt och
representativt för att samma komponenter, eventuellt fickepitel och bindvävszon i förhållande till benet, av biopsin fås med. Till framtida studier är det således viktigt att tänka på
orienteringen av vävnaden och hur snittningen ska utföras för att den histologiska bilden ska bli mer jämförbar mellan proverna. Exempelvis snittades prov 3C i transversalled vilket medför att hela fickan mot benet inte inkluderas och provet blir därför ojämförbart med övriga, se figur 6 bilaga 5. En snittning i frontalled eller sagittalled, för att få en representativ bild av hela patologiska fickan, kan vara att föredra.
Det kunde observeras skillnader i neutrofilförekomst mellan proverna. Tidigare studier har visat att det vid periimplantit fanns en relativt hög neutrofilförekomst (10). Det har även observerats att neutrofiler vandrar upp via epitelcellagret och lägger sig på ytan och bildar en barriär mellan placket och epitelet (30). Detta stämmer väl överens med observationen i denna studie och slutsatsen kan därför dras att detta är något som sker inte bara vid parodontit utan även vid periimplantit. En mindre mängd neutrofiler förväntades förekomma i de prover som
hade stor andel plasmaceller respektive stor andel kollagen då dessa är förknippade med kronisk inflammation, i kontrast med neutrofiler som är förknippade med akut inflammation. Det observerades dock inget samband mellan neutrofilförekomst och andelen kollagen respektive andelen plasmaceller. Detta kan möjligen förklaras av att många prover helt saknade epitel samt att epitelets utsträckning skiljde sig åt mellan proverna.
Förhållandet mellan M1- och M2-makrofager studerades eftersom detta troddes kunna förklara närvaron av det kapsel-liknande utseendet. Som tidigare nämnts är M1-makrofager involverade i vävnadsnedbrytande mekanismer medan M2-makrofager är involverade i läkning och verkar främjande vid kollagensyntes. Om det inkapslade kliniska utseendet hos vissa vävnadsprover beror på läkning kan dessa förväntas innehålla fler M2-makrofager än M1-makrofager. Båda typerna av makrofager var väldigt få till antalet i samtliga
vävnadsprover och inget samband mellan kollagenförekomst och makrofager kunde påvisas. Däremot kan den höga andelen kollagenrik bindväv som observerades i vissa av
vävnadsproverna även bero på en låggradig inflammation och behöver inte nödvändigtvis representera läkning. Generellt befann sig M1-makrofagerna i och nära epitelet medan M2-makrofagerna befann sig utspritt i bindväven.
I ett av vävnadsproverna syntes sammansmälta M1-makrofager, så kallade jätteceller (figur 5, bilaga 5). Detta är ett fenomen som ibland observerats vid histologiska studier av
periimplantitlesioner och förekommer i stort sett aldrig hos parodontitlesioner (31). Närvaron av jätteceller har tidigare förklarats som en främmande kroppsreaktion, vilket i detta fall är en inflammatorisk respons mot cement- eller titanpartiklar som tros avges från implantatet till mukosan bland annat genom mekaniskt slitage (31). En del forskare menar att
benresorptionen som syns runt implantat inte uteslutande kan förklaras med bakteriell etiologi utan i många fall induceras av sådana främmande kroppsreaktioner (32). Få studier har dock lyckats påvisa att jätteceller är vanligt förekommande i periimplantitlesioner (33), vilket överensstämmer väl med resultatet i denna studie där jätteceller endast identifierades i ett av proverna. Resultatet tyder däremot på att storleken på det inflammatoriska infiltratet och andelen frisk bindväv skiljde sig signifikant mellan vävnadsproverna, vilket kan indikera olika bakomliggande mekanismer.
Andra faktorer som kan påverka lesionens sammansättning kan vara ytråheten på implantatet. Tidigare studier har visat att detta kan påverka progressionen av periimplantit (33).
Riskfaktorer som påverkar immunförsvaret och läkning såsom rökning, ålder och allmänt hälsotillstånd kan även påverka lesionens sammansättning. Dessa faktorer har diskuterats inför studien men har inte berörts då det inte ryms inom tidsramen för detta arbete. Analys av röntgenbilderna hade kunnat ge ytterligare information såsom progressionshastigheten. Detta kräver dock en ursprungsbild och uppföljningsbilder vilket inte fanns att tillgå för alla
deltagare. Information om plackförekomst och bakteriesammansättning runt implantatet hade även kunnat förtydliga sjukdomsbilden och förklara det histologiska och kliniska utseendet hos lesionen.
Konklusion
Ingen skillnad kunde påvisas i area och täthet av inflammationsinfiltrat mellan de två grupperna. Andelen plasmaceller varierade mellan proverna liksom närvaron av en fibrös bindvävszon mot benet men inget samband med det kliniska utseendet fanns. En förklaring till detta kan vara bristande kliniska kriterier vid uppdelningen i de två grupperna. Däremot kunde en skillnad både kliniskt och histologiskt, framförallt i förekomst av plasmaceller, observeras mellan proverna. Vidare studier behövs för att förklara skillnaden i det kliniska
och histologiska utseendet hos periimplantitlesioner. En möjlig frågeställning är att undersöka sambandet mellan kliniskt utseende av lesionen och progressionshastigheten av periimplantit för att utvärdera om det kliniska utseendet kan användas som en klinisk markör för
Referenser
1. Nicola U. Z, Tord B. Definition and prevalence of peri-implant diseases. J Clin Periodontol. 2008;8:286.
2. Giovanni E. S, Raluca C, Anton S. Prevalence of Periimplant Diseases. Implant Dent. 2019;28(2):100-102.
3. Derks J, Schaller D, Håkansson J, Wennström JL, Tomasi C, Berglundh T. Effectiveness of Implant Therapy Analyzed in a Swedish Population: Prevalence of Peri-implantitis. J Dent Res. 2016;95:43-49.
4. Andrea M, Nada M, Norbert C. The epidemiology of peri-implantitis. Clin Oral Implants Res. 2012;67.
5. Goh MS, Hong EJ, Chang M. Prevalence and risk indicators of peri-implantitis in Korean patients with a history of periodontal disease: a cross-sectional study. J Periodontal Implant Sci. 2017;47:240-250.
6. Esposito M, Grusovin MG, Worthington HV. Interventions for replacing missing teeth: treatment of peri-implantitis. Cochrane Database Syst Rev. 2012;1.
7. Statens beredning för medicinsk och social utvärdering. Behandling av infektioner runt tandimplantat (periimplantit). 2013; 2017.
8. Heitz-Mayfield LJ, Lang NP. Comparative biology of chronic and aggressive periodontitis vs. peri-implantitis. Periodontol 2000. 2010; 53:167-181.
9. Carcuac O, Abrahamsson I, Albouy JP, Linder E, Larsson L, Berglundh T. Experimental periodontitis and peri-implantitis in dogs. Clin Oral Implants Res 2013; 24: 363-371.
10. Carcuac O, Berglundh T. Composition of human peri-implantitis and periodontitis lesions. J Dent Res. 2014;93:1083-1088.
11. Salvi GE, Furst MM, Lang NP, Persson GR. One-year bacterial colonization patterns of Staphylococcus aureus and other bacteria at implants and adjacent teeth. Clin Oral Implants Res. 2008;19:242-248.
12. Charalampakis G, Leonhardt A, Rabe P, Dahlen G. Clinical and microbiological
characteristics of peri-implantitis cases: a retrospective multicentre study. Clin Oral Implants Res. 2012;23:1045-1054.
13. Mombelli A, van Oosten MA, Schurch E, Land NP. The microbiota associated with successful or failing osseointegrated titanium implants. Oral Microbiol Immunol 1987;2:145-151.
14. Mombelli A, Decaillet F. The characteristics of biofilms in peri-implant disease. J Clin Periodontol. 2011;38:203-213.
15. Furst MM, Salvi GE, Lang NP, Persson GR. Bacterial colonization immediately after installation on oral titanium implants. Clin Oral Implants Res. 2007;18:501-508.
16. Quirynen M, Vogels R, Pauwels M, Haffajee AD, Socransky SS, Uzel NG et al. Initial subgingival colonization of 'pristine' pockets. J Dent Res. 2005;84:340-344.
17. Olsen I, Singhrao SK. Importance of heterogeneity in Porhyromonas gingivalis lipopolysaccharide lipid A in tissue specific inflammatory signalling. Journal of Oral Microbiology. 2018;10.
18. Ding P, Darveau RP, Wang C, Jin L. 3LPS-binding protein and its interactions with P. gingivalis LPS modulate pro-inflammatory response and Toll-like receptor signaling in human oral keratinocytes. PLoS ONE. 2017;12:1-13.
19. Lindhe J, Lang NP. Clinical Periodontology and Implant Dentistry. 6th ed. Hoboken: John Wiley & Sons, Incorporated, 2015.
20. Konttinen YT, Lappalainen R, Laine P, Kitti U, Santavirta S, Teronen O.
Immunohistochemical evaluation of inflammatory mediators in failing implants. Int J Periodontics Restorative Dent. 2006; 26:135-141.
21. Zouali M. The emerging roles of B cells as partners and targets in periodontitis. Autoimmunity 2017; 50:61-70.
22. Campbell L, Malcolm J, Culshaw S, Millhouse E. T cells, teeth and tissue destruction – what do T cells do in periodontal disease? Molecular Oral Microbiology 2016;31:445-456. 23. Parisi L, Gini E, Baci D, Tremolati M, Fanuli M, Bassani B. Macrophage Polarization in Chronic Inflammatory Diseases: Killers or Builders? Journal of Immunology Res. 2018. 24. Ricarda Cortés-Vieyra, Rosales C, Eileen Uribe-Querol. Neutrophil Functions in Periodontal Homeostasis. Journal of Immunology Res. 2016.
25. Lyon H. Theory and strategy in histochemistry: a guide to the selection and understanding of techniques. Berlin: Springer-Verlag. 1991.
26. Dabbs D. Diagnostic immunohistochemistry: theranostic and genomic applications. Philadelphia: Elsevier. 2019.
27. Murphy K. Janeway's Immunobiology. New York: Garland Science, Taylor & Francis Group, LLC. 2012.
28. Shi SR, Imam SA, Young L, Cote RJ, Taylor CR. Antigen retrieval
immunohistochemistry under the influence of pH using monoclonal antibodies. J Histochem Cytochem. 1995;43:193-201.
29. Danesh N, Ljunggren AC, Wolf E, Fransson H. Development of criteria for investigation of periapical tissue from root-filled teeth. Acta Odontol Scand. 2019:1-6.
30. Scott DA, Krauss J. Neutrophils in periodontal inflammation. Front Oral Biol. 2012;15:56-83.
31. Wilson TG, Valderrama P, Burbano M, Blansett J, Levine R, Kessler H. Foreign bodies associated with peri-implantitis human biopsies. J Periodontol. 2015;86:9-15.
32. Albrektsson T, Canullo L, Cochran D, De Bruyn H. "Peri-Implantitis": A Complication of a Foreign Body or a Man-Made "Disease". Facts and Fiction. Clin Implant Dent Relat Res. 2016;18:840-849.
33. Are peri-implantitis lesions different from periodontitis lesions? J Clin Periodontol. 2011:188.
Bilaga 1. Informationsblankett
Analys av den borttagna vävnaden vid periimplantit
Du är i gång med en behandling för periimplantit som är en inflammation i mjukvävnaden kring implantat. Som ett led i behandlingen avlägsnas den inflammerade vävnaden. Du tillfrågas härmed om du vill delta i ett forskningsprojekt gällande inflammationsvävnadens sammansättning vid
periimplantit och om du kan tänka dig att låta oss spara det avlägsnade vävnadsprovet för analys.
Studien är ett masterprojekt och kommer att utföras av Kristin Wennberg och Sara Arvidsson som är tandläkarstudenter vid Odontologiska fakulteten, Malmö Högskola.
Bakgrund och syfte
Periimplantit innebär att mjukvävnaden runt tandimplantatet är inflammerad vilket har lett till att benet kring implantatet delvis har förlorats. Periimplatit är en relativt vanlig sjukdom; ca. 25% av alla implantat drabbas av periimplantit. Vid periimplantit ersätts den skadade delen av mjukvävnaden samt det resorberade benet med granulationsvävnad bestående av kärlrik bindväv och immunförsvarsceller. Periimplantit liknar därmed parodontit (tandlossning), dock tycks periimplantit ha ett snabbare sjukdomsförlopp än parodontit. Tidigare undersökningar av granulationsvävnad vid periimplantit tyder på att sammansättningen av immunförsvarsceller skiljer sig från det som ses vid tandlossning. Vid periimplantit är det totala antalet immunförsvarsceller större och utbreder sig över en större yta än vid parodontit. Det råder dock fortfarande stor osäkerhet kring de cellulära och molekylära
mekanismerna vid periimplantit.
Målet med denna studie är att undersöka cellsammansättningen och vävnadens utseende samt faktorer som kan påverka dessa.
Hur går studien till
Den inflammerade vävnaden runt implantatet avlägsnas vid operationstillfället och därmed behövs inga ytterligare ingrepp. Du behöver alltså inte komma på några extra besök eller betala mer om du väljer att delta i studien. Vi tillfrågar dig om ditt godkännande att använda denna vävnad till vår
studie. Detta är vävnad som ändå kommer att avlägsnas som en del i din pågående behandling. Vi ber
dig också om lov att ta kliniska foton under behandlingen av dokumentationsskäl.
Journaluppgifter
Uppgifter om din hälsa och den behandling du tidigare fått på Tandvårdshögskolan i Malmö (undersökningsresultat samt röntgenbilder) kommer att hämtas ur din patientjournal.
Proven sparas i Biobank
De prov som tas i samband med denna studie kommer att lagras i biobanken (enl. Socialstyrelsen godkänd nr. 497) på avdelningen för Oral Patologi vid Odontologiska fakulteten, Malmö Högskola i enlighet med Lagen om biobanker i hälso- och sjukvården (2002:297) som reglerar på vilket sätt prov får sparas och nyttjas och den reglerar även kvaliteten och säkerheten kring biobanker. Proven
kommer att förvaras kodade vilket innebär att proven inte direkt kan härledas till dig som person.
Proven och den tillhörande identifieringslistan (kodnyckel) kommer att förvaras på avdelningen för Oral Patologi vid Odontologiska fakulteten, Malmö Högskola, åtskilda från varandra, och skyddas från åtkomst av obehöriga. Efter studien kommer kodnyckeln att destrueras. Mer info om hantering av datauppgifter kan hämtas av PUL-ansvarig vid Malmö högskola: Tomas Holmström, Malmö
högskola, Gemensam förvaltning, 20506 Malmö, 040-6657733.
Risker och nytta
Frivilligt och om du ändrar dig
Ditt deltagande är frivilligt och du kan välja att avstå utan att förklara varför. Om du väljer att avstå att delta i studien kommer detta inte på något sätt påverka din vård på Tandvårdshögskolan, nu eller i framtiden.
Ansvariga
Ansvariga för studien är tandläkarna Anna Ljunggren och Andreas Stavropoulos.
Kontaktuppgifter Anna Ljunggren Telefon: 040-66 58446 E-post: anna.ljunggren@mah.se Andreas Stavropoulos Telefon: 040-66 58066 E-post: andreas.stavropoulos@mah.se
Bilaga 2. Samtyckesblankett
Informerat samtycke ang. deltagande i studien: Analys av den borttagna vävnaden vid periimplantit
Innan Du signerar läs igenom följande sex punkter
• Jag har tagit del av den skriftliga informationen angående studien.
• Jag ger mitt samtycke till att delta i studien och vet att mitt deltagande är helt frivilligt.
• Jag kommer inte att behöva ha extra besök, ingrepp eller att betala mer om jag deltar i studien.
• Jag är medveten om att jag när som helst och utan förklaring kan dra tillbaka mitt samtycke och avsluta deltagandet.
• Jag tillåter att studieansvarig eller medarbetare får ta del av mina patientjournaluppgifter och foton som är relevanta för den aktuella forskningsstudien.
• Jag ger mitt godkännande till att de prov jag lämnar kommer att sparas i biobank och att proven används för forskning.
Underskrift Namnförtydligande Datum
Bilaga 3. IHC-protokoll
Förbehandling1. Proverna torkas i ugn vid 60° i 40 min. 2. Avparaffinering 43 min totalt.
- Tissue clear - Etanol (100-95%) - dH2O
3. Antigen retrival
- TEG-buffert 95° i 40 min för CD3, CD20, CD68, CD138. Natriumcitratbuffert (10 mmol, pH 6,0) för CD163.
- Kylning i rinnande vatten 10 min.
- 5 min i dH2O och förvaras därefter i TRIS-buffert.
IHC MACH4
1. Glasen torkas på baksidan och täcks med 100 µl av peroxidase blocking (HPBK) och inkuberas vid rumstemperatur i 5 min.
2. Glasen sköljs med TRIS-buffert.
3. Glasen torkas på baksidan och täcks med 100 µl av background punisher och inkuberas vid rumstemperatur i 10 min.
4. Glasen sköljs med TRIS-buffert.
5. Glasen torkas på baksidan och täcks med 100 µl av antikropp (CD3, CD20, CD68, CD138, CD163) och inkuberas vid rumstemperatur i 30 min.
6. Glasen sköljs med TRIS-buffert.
7. Glasen torkas på baksidan och täcks med 100 µl av mouse probe (endast för CD20, CD68, CD138, CD163) och inkuberas vid rumstemperatur i 15 min.
8. Glasen sköljs med TRIS-buffert.
9. Glasen torkas på baksidan och täcks med 100 µl av HRP-polymer och inkuberas vid rumstemperatur i 30 min.
10. Glasen sköljs med TRIS-buffert.
11. Glasen torkas på baksidan och täcks med 100 µl av DAB-lösning och inkuberas vid rumstemperatur i 5 min.
12. Glasen sköljs med TRIS-buffert.
13. Glasen torkas på baksidan och täcks med 100 µl av HTX-lösning och inkuberas vid rumstemperatur i 2 min.
14. Glasen sköljs med rinnande vatten i 2 min.
Dehydrering
1. Proverna sänks ned i dH2O och inkuberas vid rumstemperatur i 5 min. 2. Proverna sänks ned i 96% etanol och inkuberas vid rumstemperatur i 4 min. 3. Proverna sänks ned i 100% etanol och inkuberas vid rumstemperatur i 2 min.
Bilaga 4. Kvalitativ analys
Prov Diffus (D) /inkapslad (K) morfologi CD3+ (T-cell) CD20+ (B-cell) CD68+ (M1-makrofag) CD138+ (Plasma-cell) CD163+ (M2-makrofag) Neutrofiler (HTX) Övrigt 1 D Tät cellansamling strax nedanför epitelet. Generellt relativt mkt i vävn Tät cellansamling i samma område som T-cellerna. Stråk längs med epitelet. Enstaka celler spridda i epitelet och bindväven strax under epitelet. Stor cellansamling syns i HTX:en mot benet. Enstaka celler spridda i bindväven och strax under epitelet. Mindre cellansamlingar framförallt i epitelet och strax under. 2 K Tre cellansamlingar i anslutning till epitelet, lite utspritt i vävn Täta cellansamlingar i samma område som T-cellerna. Enstaka celler spridda i epitelet Väldigt tät cellansamling som täcker hela biopsin och befinner sig även mycket nära benet. Ytterst få celler i bindvävnad. Många celler utspridda i epitelet och strax under. 3a K Tre mindre cellansamlingar i anslutning till epitelet, lite utspritt i vävn Mindre cellansamlingar i samma område som T-cellerna. Enstaka celler spridda i epitelet. Inga plasmaceller kan identifieras vare sig med IHC eller HTX. Ytterst få celler i bindvävnad. Många celler utspridda i epitelet och strax under. 3b K En mindre cellansamling nedanför epitelet. Större cellansamling i samma område som T-cellerna. Enstaka celler under epitelet. Inga plasmaceller kan identifieras vare sig med IHC eller HTX.Enstaka celler i epitelet och strax nedanför. Enstaka celler utspridda i epitelet Mkt kollagen. 3c K En mindre cellansamling strax nedanför epitelet. En mindre cellansamling i samma område som T-cellerna. Generellt relativt många celler utspridda i och under epitelet. Inga plasmaceller kan identifieras vare sig med IHC eller HTX.
Enstaka celler i epitelet och strax nedanför. Enstaka celler utspridda i epitelet Dålig representativ bild av lesionen pga snittning i fel
led. Mycket frisk kollagenrik bindväv. 4 D Två cellansamlingar en bit från epitelet, även generellt mkt i bindvävnaden Två cellansamlingar i samma område som T-cellerna. Generellt relativt många celler utspridda i och under epitelet. Större område med plasmaceller. Dock friskt kollagenrik bindväv mot benet och under epitelet. Relativt många celler i epitelet och i bindvävsskiktet, generellt i vävnaden Enstaka celler utspridda i epitelet Friskt bindvävsskikt mellan epitelet och mot benet. Område med jätteceller identifieras på M1-infärgningen. 5 K En mindre cellansamling strax nedanför epitelet. Tre cellansamlingar längs med epitelet. Generellt relativt många celler utspridda bland plasmacellerna. Ett tätt större område kan identifieras på HTX:en. Enstaka celler i samma område som M1. Fåtal i epitelet. 6 K Två cellansamlingar en bit från epitelet Två cellansamlingar i samma område som T-cellerna. Enstaka celler spridda i epitelet. Få plasmaceller kan identifieras. Frisk kollagenrik bindväv mot benet. Enstaka celler i samma område som M1.
Inga celler kan identifieras. Relativt frisk kollagenrik bindväv. 7 D Två mindre cellansamlingar strax nedanför epitelet. Två större cellansamlingar i samma område som T-cellerna. Enstaka celler spridda i epitelet. En mindre cellansamling i närheten av B- och T-cellerna. Relativt många M2-celler utspridda i vävnaden. Många celler i epitelet. 8 K Två cellsansamlingar strax nedanför epitelet. Två större cellansamlingar i samma område som T-cellerna. Enstaka celler spridda i epitelet. Relativt mkt celler en bit från epitelet. Relativt många M2 bland plasmacellerna.
Inga celler kan identifieras. 9 D Generellt väldigt få utspridda Större cellansamling Generellt utspritt strax Två cellansamlingar Generellt strax under epitelet Många celler utspridda i
celler. som sträcker sig längs med epitelet.
under epitelet. varav ett
befinner sig nära epitelet och det andra en bit ifrån.
och lite utspritt i bindvävnaden. epitelet och strax under. 10 K En mindre cellansamling strax under epitelet. Tät större cellansamling som sträcker sig i samma område som T-cellerna. Generellt utspritt i och strax under epitelet. En tät cellansamling som täcker större delen av biopsin kan identifieras på HTX:en. Enstaka celler i samma område som M1 och utspritt i bindvävnaden. Generellt utspritt i epitelet. 11 D En mindre cellansamling mot förmodat det epitelet.
Tät större cellansamling som sträcker sig i samma område som T-cellerna. Mycket sparsamt med celler. En tät större cellansamling som befinner sig en bit fr epitelet.
Inga celler kan identifieras.
Inga celler kan identifieras, dock saknas epitelet. Epitelet saknas. 12 D En mindre cellansamling mot det förmodade epitelet och strax under.
Tät större cellansamling som sträcker sig i samma område som T-cellerna. Generellt utspritt strax under det förmodade epitelet. En tät större cellansamling som befinner sig en bit fr epitelet.
Enstaka celler i samma område som
plasmaceller.
Inga celler kan identifieras, dock saknas epitelet. Epitelet saknas. 13 D En mindre cellansamling strax under epitelet. Tät större cellansamling som sträcker sig i samma område som T-cellerna. Mycket sparsamt med celler längs med epitelet. Sparsamt med celler kan identifieras. Enstaka celler längs med epitelet.
Fåtal i epitelet. Mkt frisk kollagenrik bindväv mot benet.
Bilaga 5. Histologiska bilder
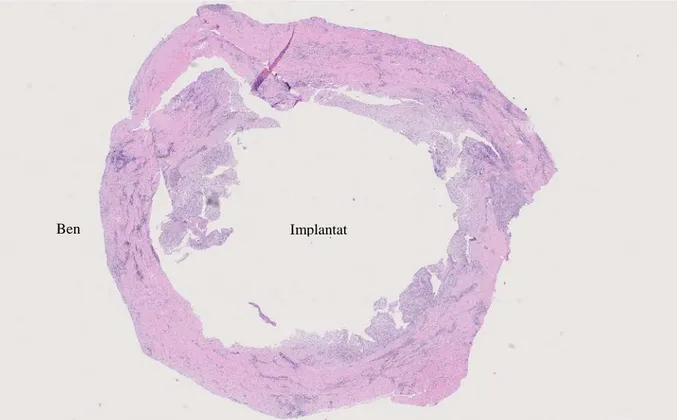
Figur 5. Prov 4. Jätteceller (pil) av M1-makrofager (CD68+). Figur 4. Prov 1. Neutrofiler (pil) som infiltrerat epitelet.
Figur 6. Prov 3c. Snittning i transversalled vilket medför att hela fickan mot implantatet inte inkluderas.
Figur 7. Prov 2. Plasmaceller (CD138+) rikligt infiltrerade i lesionen (pil).
Implantat Ben
Figur 8. Prov 1. Vänster bild: T-celler (CD3+) (se pil). Höger bild: B-celler (CD20+) (se pil). Im p la n ta t B en Im p la n ta t B en