Examensarbete Malmö universitet 15 hp Hälsa och samhälle
INVERKAN AV LEFT
VENTRICULAR ASSIST DEVICE
PÅ HÖGERKAMMARFUNKTION
EFTER
HJÄRTTRANSPLANTATION?
EN EKOKARDIOGRAFISK VÄRDERING AV
HÖGERKAMMARFUNKTION HOS
HJÄRTTRANSPLANTERADE PATIENTER
ARVIN AKBARI
INVERKAN AV LEFT
VENTRICULAR ASSIST DEVICE
PÅ HÖGERKAMMARFUNKTION
EFTER
HJÄRTTRANSPLANTATION?
EN EKOKARDIOGRAFISK VÄRDERING AV
HÖGERKAMMARFUNKTION HOS
HJÄRTTRANSPLANTERADE PATIENTER
Akbari, A. Inverkan av left ventricular assist device på högerkammarfunktion efter hjärttransplantation. En ekokardiografisk värdering av högerkammarfunktion hos hjärttransplanterade patienter. Examensarbete, 15 högskolepoäng. Malmö Universitet: Fakulteten för hälsa och samhälle, institutionen för biomedicinsk laboratorievetenskap, 2018.Då ingen medicinsk behandling längre är tillräcklig anses hjärttransplantation vara det slutliga alternativet för patienter med svår hjärtsvikt (stadie IV). Dock ges endast ett fåtal patienter möjligheten till att få ett nytt hjärta, vilket bland annat beror på organbrist, långa väntetider och annan komorbiditet. Allt fler i denna patientgrupp får stöd av en inopererad hjärtpump; Left Ventricular Assist Device (LVAD) i väntan på transplantation. Syftet med denna studie var att med
transthorakal ekokardiografi undersöka om förbehandling med LVAD kan inverka positivt på högerkammarfunktionen även efter hjärttransplantation och huruvida denna effekt är bestående under längre tid. Totalt 31 patienter (27 män) med medelåldern 53 ± 12 år inkluderades i studien varav 13 stycken förbehandlats med LVAD innan hjärttransplantation. Data samlades in prospektivt. All patientdata är tagen från Lunds universitetssjukhus databaser. I studien undersöktes om
högerkammarfunktionen skiljer sig åt hos hjärttransplanterade vid 1 månad och 12 månader efter transplantation beroende på om de förbehandlats med LVAD eller inte. De konventionella parametrarna för bedömning av högerkammarfunktion som värderades var tricuspid annular plane systolic excursion (TAPSE),
högerkammar systolisk vävnadsdoppler (RVS’), right ventricular fractional area change (RVFAC), samt tvådimensionell högerkammarstrain med hjälp av speckle tracking. Resultatet visade statistiskt signifikanta skillnader för högerkammar- globala longitudinell strain (RVGLS) och högerkammarens fria vägg strain efter 1 månad (RVFS) mellan grupperna (för båda parametrarna p-värde < 0,01). Efter 12 månader uppvisade grupperna ingen signifikant skillnad. För övriga parametrar: TAPSE, RVS’, RVFAC påvisades inga statistisk signifikanta skillnader mellan grupperna efter 1 månad och 12 månader.
Nyckelord: Ekokardiografi, högerkammarfunktion, hjärttransplantation, LVAD,
IMPACT OF LEFT VENTRICULAR
ASSIST DEVICE ON RIGHT
VENTRICULAR FUNCTION
AFTER HEART
TRANSPLANTATION
AN ECHOCARDIOGRAPHIC EVALUATION OF
RIGHT VENTRICULAR FUNCTION IN CARDIAC
TRANSPLANT PATIENTS
Akbari, A. Impact of left ventricular assist device on right ventricular function after heart transplantation. An echocardiographic evaluation of right ventricular function in cardiac transplant patients. Bachelor project in Biomedical Science, 15
Credit. Malmö University: Faculty of health and society, Department of
biomedical science, 2018.
Heart transplantation is considered to be the most appropriate end-stage option in treating patients with severe heart failure. However, lack of organs, long waiting times and other comorbidities reduce the number of patients eligible for this treatment. In order to reduce mortality of this patient group, increasing numbers of patients with severe heart failure receive support from an inoperative cardiac pump (i.e. Left Ventricular Assist Device; LVAD) awaiting transplantation. The purpose of this study was to investigate with transthoracic echocardiography if pretreatment with LVAD may positively affect right ventricular function after cardiac transplantation and whether this effect lasts for a long time. A total of 31 patients were included in this study, where of 13 patients were pretreated with LVAD before cardiac transplantation. The majority of patients were men (n=27) with mean age of 53 ± 12 years. Data has been collected prospectively. All patient data used in this study were taken from Lund University Hospital databases. It was investigated whether right ventricular function differs in cardiac transplanted patients 1 month and 12 months after transplantation based on if patients where pretreated with LVAD and not. The parameters for evaluation of RV function were tricuspid annular plane systolic excursion (TAPSE), right ventricular systolic tissue velocity (RVS'), right ventricular fractional area change (RVFAC) and two-dimensional RV strain with speckle tracking. Results showed statistically
significant differences between the groups 1 months after transplantation for right ventricular global longitudinal strain (RVGLS) and the RV free wall strain
(RVFS), both parameters p-value < 0.01. This difference were not detectable after 12 months. For the parameters TAPSE, RVS ', RVFAC, no statistically significant differences were observed between the groups at either time point.
Keywords: Cardiac transplantation, echocardiography, LVAD, right ventricular
FÖRORD
Jag vill rikta ett stort tack till min handledare Annika Ingvarsson för hennes hjälp med bildinsamlingen och hennes stöd och vägledning genom arbetets gång. Dessutom vill jag tacka enhetschefen på EKO-lab vid Skånes Universitetssjukhus i Lund, Else-Mary Sjöstrand, för möjligheten att utföra examensarbetet i hennes verksamhet.
INNEHÅLLSFÖRTECKNING
BAKGRUND 5
LVAD 5
Transthorakal ekokardiografi 6
Endimensionell ekokardiografi (Motion-mode) 7
Tricuspid Annular Plane Systolic Excursion (TAPSE) 8
Tvådimensionell ekokardiografi (2D, gråskala) 8
Vävnadsdoppler (TDI, Tissue Doppler Imaging) 8
Right Ventricular Systolic excursion velocity (RVS’) 8
Right Ventricular Fractional Area Change (RVFAC) 9
Strain med tvådimensionell speckle tracking 9
Syfte 10
MATERIAL OCH METOD 10
Urval 10 Metod 10 Statistisk analys 14 Etik 14 RESULTAT 14 DISKUSSION 18 Metoddiskussion 19 Resultatdiskussion 20 Begränsning 21 KONKLUSION 21 REFERENSER 22
BAKGRUND
Hjärtsvikt kallas även hjärtinsufficiens. Hjärtats pumpförmåga är nedsatt och kan resultera dels i ett otillräckligt blodflöde ut från hjärtat, ofta benämnt forward
failure (vänstersidigt), samt dels i en ofullständig förmåga att pumpa vidare blodet
som kommer tillbaka till hjärtat, backward failure. Vanligen föreligger båda samtidigt. Dock är hjärtsvikt snarare ett symptom än en sjukdom och beror oftast på en bakomliggande patologi såsom hypertoni, hjärtinfarkt eller klaffel [1]. Hjärtmuskelns kontraktionskraft kan påverkas av hjärtsvikt (systolisk
dysfunktion), vilket medför att den blir reducerad och kammaren inte kan tömma sig normalt [2]. Vid hjärtsvikt kan även nedsatt compliance (töjbarhet) hos kammaren ses (diastolisk hjärtsvikt). Det slutdiastoliska trycket i vänster kammaren stiger och leder indirekt till att trycket i lungkretsloppet ökar med sekundär tryckbelastning av höger kammare [1-2].
Hjärtsvikt kan ur symptomsynpunkt klassificeras enligt en fyrgradig skala där den högsta graden (IV) av hjärtsvikt innebär andfåddhet och trötthet redan i vila [1-3]. För att behandla denna patientgrupp med typ IV hjärtsvikt krävs avancerade behandlingsstrategier. Det är i denna grupp hjärttransplantation och mekanisk cirkulations-stödjande utrustning såsom en inopererad hjärtpump; Left Ventricular Assist Device (LVAD) kan bli aktuella [4].
Hjärttransplantation är det sista alternativet då all annan medicinsk behandling är otillräcklig hos patienter med svår hjärtsvikt (stadie IV). Transplantation leder ofta till att patienten återfår närmast normal funktionell kapacitet samt livskvalitet. Dock ges endast ett fåtal patienter möjligheten att få ett nytt hjärta, vilket beror bland annat på organbrist och långa väntetider. För att minska mortalitet hos denna patientgrupp får allt fler patienter med svår hjärtsvikt stöd av en LVAD i väntan på transplantation [5-7]. Pumpen möjliggör ofta att patienten kan leva ett väsentligen normalt liv i hemmet men kräver regelbundna kontroller och
justeringar av pumphastighet/effekt [8].
LVAD
LVAD är en stödpump för hjärtats vänsterkammare och används vid grav hjärtsvikt. Behandling med pump kan vara ett alternativ i väntan på
transplantation, som en ”bro” till återhämning eller användas som livslång terapi. Systemet parallellkopplas genom ett kirurgiskt ingrepp till patientens befintliga cirkulation [8-10].
Systemet består av en inflödeskanyl som kopplas till vänsterkammarens spets (apex), en utflödeskanyl som leds till aorta ascendens, en pump samt en extern kontrolldosa. Med hjälp av dosan kan pumpens effekt och hastighet ställas in. Systemet fungerar som en avlastning till systemcirkulationen genom att stödja vänsterkammarens systoliska funktion. Pumpen drar in blodet från
vänsterkammaren och återför det till aorta ascendens, detta sker passivt utan att vänsterkammaren behöver kontrahera (Figur 1) [8-10].
Figur 1. HeartMate 3 Left Ventricular Assist System [11].
Patienter som tidigare ansetts inoperabla på grund av t.ex. högt pulmonell vaskulär resistens (PVR) kan efter förbehandling med LVAD bli berättigade till hjärttransplantation med gott posttransplantations-resultat [9]. Ur fysiologiskt synsätt leder en behandling med LVAD till en avlastning av vänster kammares arbete med sänkning av fyllnadstrycket vilket i sin tur leder till minskat tryck i lungkretsloppet (pulmonellt arteriellt tryck; tryck). En minskning av PA-trycket leder följaktligen till att höger kammare får ett lägre motstånd (preload) att arbeta mot [5,8,9,12]. Det är sedan tidigare känt att långvarigt högt tryck i
lungkretsloppet kan medföra strukturella förändringar i lungkärlen
(endotelpåverkan samt hypertrofi av kärlets media-skikt) med ökad resistans som i sin tur ytterligare ger ett ökat motstånd för höger kammares arbete [8,9,12]. Enligt tidigare studier kan förbehandling med LVAD leda till minskat flödesmotstånd i lungkärlen (PVR) hos patienter med svår hjärtsvikt [9,12].
Transthorakal ekokardiografi (TTE)
TTE är en av de vanligaste metoderna vid undersökning av hjärtat med ultraljud. Med hjälp av metoden kan bland annat information om hjärtrummens storlek, kontraktilitet, myokardiets tjocklek, klaffunktion samt centralcirkulationens tryckförhållanden erhållas. Fördelar med denna typ av ekokardiografi är att den inte utgör något obehag för patienten och att det inte råder några direkta
kontraindikationer. Trots användning av metoden i många år har inga
biverkningar iakttagits. Ytterligare fördelar kan vara att undersökningen är relativ enkel, utförs snabbt och ger mycket information om hjärtat. Dock är en stor nackdel med metoden att den är användarberoende; undersökningsresultatens tillförlitlighet är beroende av skicklighet och erfarenhet hos den som utför undersökningen. Ytterligare en nackdel kan vara att det inte alltid är möjligt att utföra en undersökning med optimal bildkvalité, exempelvis kan undersökning av mycket överviktiga personer eller patienter med emfysem ge suboptimal
bildkvalité [2,13-14].
Ekokardiografi är en undersökningsmodalitet med många nya lovande tekniska framsteg. Flera tillämpningar finns tillgängliga och har inom andra grupper av hjärtsjuka visat sig vara värdefulla för att bättre kunna bedöma regional
hjärtfunktion och tidigt upptäcka förändringar i denna. Under senare åren har nyare och betydligt känsligare ultraljudsmetoder såsom speckle tracking, strain och vävnadsdoppler för bedömning av hjärtmekanik utvecklats. Med hjälp av dessa metoder kan vävnadshastigheter, deformation samt aktiv kontraktion mätas och utvärderas så väl globalt som segmentellt [8,13,14,15]. För bestämning av högerkammarfunktion finns det ett flertal olika parametrar. De parametrar som erhålls med speckle tracking verkar lovande. Trots konventionella parametrars (TAPSE, RVFAC, RVS’) goda resultat anses strain vara det mest sensitiva hjälpmedlet vid utvärdering av kontraktilitet [18-20].
Ett antal standardprojektioner används vid 2D-ekokardiografi (TTE). Parasternal (kort och längdaxel), apikal (3-, 4- och 5-kammar) samt subkostal är de vanligaste registreringsställena (”eko-fönster”). Undersökningen utförs bäst med patienten i vänster sidoläge då detta ger bäst resultat vid parasternal och apikal registrering, dock erhålls bäst subkostal registrering med patienten i ryggläge [2,13].
De flesta mätningar som görs för att bedöma kammarfunktion med hjälp av
ultraljud görs från en så kallad fyrkammarprojektion där vänster och höger förmak och kammare ses (Figur 2).
Figur 2. 2D-bild av en fyrkammarprojektion.
Endimensionell ekokardiografi (Motion-mode)
Endimensionella registreringar är de första ultraljudsregistreringar som
utvecklades för undersökning av hjärtat med ultraljud. Vid bestämning av olika hjärtdimensioner används M-mode vilket möjliggör en mätning som är mer exakt än tvådimensionell registrering, vilket beror på den högre upplösningen i bilden [2,13,14]. M-mode fungerar genom att en ultraljudsstråle sänds genom hjärtat och reflektionspunkterna visas längs en tidsaxel. Registrering med M-mode kan utföras genom att i 2D-bilden placera cursorn (ultraljudslinjen) i önskat läge exempelvis vid annulus tricuspidalis för att mäta TAPSE (Tricuspid Annular Plane Systolic Excursion) [2,13,14,18].
Tricuspid Annular Plane Systolic Excursion (TAPSE)
TAPSE är en parameter som kan spegla högerkammares longitudinella funktion (bas-till-apex förkortning) [18,20]. Metoden anger ett mått på annulus
trikuspidalis (högerkammarens fria vägg basalt) longitudinella rörlighet i systole (kontraktionsfas) (Figur 4) [13,18,19]. Normalt är TAPSE ≥ 17 mm [18]. Tekniken är allmänt känd, användbar i klinisk praxis, en möjlig markör för högerkammardysfunktion, men också en viktig prognostisk markör för olika hjärttillstånd, däribland högerkammarsvikt. Dessutom är tekniken den vanligaste för att utvärdera högerkammares systoliska funktion (pumpförmåga) [20].
Metoden är enkel och har lågt beroende av bildkvalitet, kan utföras utan att kräva någon specifik ultraljudsutrustning eller analysprogramvara samt har hög
reproducerbarhet [20]. Metoden är även rekommenderad av de senaste gemensamma amerikanska/europeiska riktlinjerna för ekokardiografisk bestämning av högerkammarfunktionen [18-20]. Metoden har hög specificitet dock låg sensitivitet för att skilja mellan abnorm och normal funktion. Ytterligare en nackdel med metoden kan vara att den är vinkelberoende [18].
Tvådimensionell ekokardiografi
Tekniken fungerar genom att ultraljudsstrålar som skapas med hjälp av en transducer (ultraljudsgivare) sveper fram snabbt i olika riktningar i vävnad och reflekteras sedan tillbaka till transducern. Reflektionsdjupet kan beräknas genom att ultraljudsutrustningen mäter hur länge de utsända ultraljudsvågorna varit ute i kroppen. På detta sätt kan reflektionspunkterna från varje ultraljudsstråle
tillsammans generera en 2D-bild som kan visas på ultraljudsutrustningens skärm [2,13].
Vävnadsdoppler (TDI, Tissue Doppler Imaging)
Tekniken använder sig av ett lågpassfilter som registrerar endast
vävnadsrörelsernas låga frekvenser. Således kan TDI användas för att värdera myokardiets rörelsehastighet (cm/s) [2,13,14,18]. Utslagen i myokardiets
rörelseprofil kan sedan används vid beräkning av den diastoliska funktionen samt fyllnadstrycket i exempelvis vänster kammaren [2,14,21]. Registrering med vävnadsdoppler kan utföras med hjälp av pulsad doppler. Vid registrering med pulsad doppler placeras cursorn längs hjärtväggen och med hjälp av sample volume kan ett specifikt områdes rörlighet granskas. Tekniken används främst vid värdering av AV-planets (atrioventrikulärplanets) rörlighet. Registreringen av rörelsen utförs i regel lateralt och septalt för vänster kammare (i
fyrkammarprojektion), samt i högerkammares laterala vägg för systolisk
värdering av högerkammarfunktion. Slutligen mäts den genomsnittliga rörelsen [2,13,14,18,21]. Tekniken är enkel, reproducerbar och med god urskiljande förmåga att detektera abnorm från normal högerkammarfunktion. All moderna ultraljudsutrustning har pulsad doppler samt kräver inga ytterligare
analysprogramvaror [18].
Right Ventricular Systolic excursion velocity (RVS’)
Annulus trikuspidalis anses vara bland de mest reproducerbara samt mest tillförlitliga regioner för bedömning av högerkammarfunktion. Med hjälp av vävnadsdoppler kan regionens funktion analyseras samt dess longitudinella hastighet (RVS’; max systolisk hastighet) mätas (Figur 6) [13,18]. RVS’ < 9,5 cm/s indikerar systolisk högerkammar-dysfunktion [18].
Right Ventricular Fractional Area Change (RVFAC)
Parametern anger ett kvantitativt mått på högerkammares systoliska funktion. RVFAC uttrycker den procentuella förändringen i högerkammares area mellan end-diastole och end-systole (när kammaren är störst respektive minst) (Figur 5). Parametern anges i procent (%) och kan beräknas enligt formeln nedan
[15,16,18,22].
Parametern anses vara ett surrogatmått till högerkammares ejektions fraktion (RVEF) som inte kan mätas ekokardiografiskt [15-18]. EF är ett mått på den globala systoliska funktionen, det vill säga den mängd av den diastoliska kammarvolymen som pumpas ut under systole. EF anges i procent % [15,18]. Tidigare studier har visat med hjälp av Magnetisk Resonans Imaging (MRI) att det finns en god korrelation mellan RVFAC och RVEF [16-17]. Dessutom visades att parametern ensamt kan vara en markör för olika hjärt-lungtillstånd såsom hjärtsvikt [16,18]. RVFAC < 35 % kan indikera systolisk högerkammar-dysfunktion [15,17,18, 22,29].
Strain med tvådimensionell speckle tracking
Metoden fungerar genom att utrustningen identifierar och följer hur olika speckles (mönster/fingeravtryck) i myokardiet rör sig under hjärtcykeln. Speckels är små oregelbundna strukturer med olika intensitet som ger myokardiets olika delar ett unikt utseende i 2D-bilden (Figur 3). Strain kan mätas med speckle tracking; genom att jämföra speckles förflyttning över tid i två punkter [13,14,18,21].
Figur 3. Förstorade ”speckels” i kammarseptum i en fyrkammarprojektion. Metoden är till skillnad från doppler tämligen vinkeloberoende samt mindre beroende av framerate (antal bilder/sekund) [13,16,23]. Vid speckle tracking ekokardiografi anses en framerate mellan 40-90 frames per second (FPS) vara optimal vid normal hjärtfrekvens [13,24]. Dock kan detta skilja sig mellan olika ultraljudsutrustning [24]. För höga framerates kan leda till minskad optisk
upplösning och skulle därmed sannolikt kunna leda till mätningsvariation, medan
RVFAC
slutdiastolisk area - slutsystolisk area
för låga framerates medför att det blir svårt att följa speckles då de hinner röra sig mellan varje bild [24,25]. Detta är anledningen till varför metoden är mest lämplig för registreringar i systole som inte har lika snabba förändringar som diastole [13].
Strain
För att värdera hur mycket myokardiets olika delar förlängs och förkortas under hjärtcykeln kan strain som fås genom speckle tracking användas som är ett mått på deformation [13,14,21].
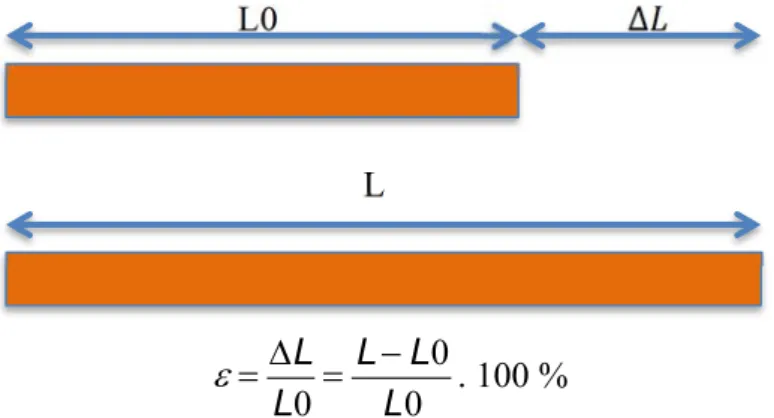
L0 ∆
L
. 100 %
Figur 4. Från den ursprungliga längden (L0) sträcks segmentet ut till längden L.
Strain ( ) är längdskillnad ( ) genom längden från början (L0). Vanligen anges strain i procent (%). Exempelvis en på 25 % erhålls om segmentet sträcks från 1,0 cm till 1,25 cm. Strain kan vara negativ eller positiv. En negativ strain innebär att segmentet förkortas medan en positiv strain innebär att segmentet förlängs. I exemplet ovan mäts endast longitudinell strain [13-14,21,26].
Syfte
Syftet med denna studie var att undersöka med transthorakal ekokardiografi om förbehandling med LVAD kan inverka positivt på högerkammarfunktionen även efter hjärttransplantation och huruvida denna effekt är bestående under längre tid.
MATERIAL OCH METOD
För att erhålla de ekokardiografiska måtten för bedömning av högerkammarfunktion undersöktes patienterna med TTE.
Urval
Sedan 2012 har alla patienter som har hjärttransplanterats i Lunds
universitetssjukhus genomgått en utvidgat ekokardiografisk undersökning vid 5 tillfällen under första året (1 vecka, 1 månad, 3 månader och 1 år). Totalt 31 patienter inkluderades i denna studie varav 13 stycken har förbehandlats med LVAD innan hjärttransplantation. Majoriteten av patienterna var män (n=27) och medelåldern beräknades till 53 ± 12 år. Studiematerialet har insamlats prospektivt och all data som används i denna studie är tagen från Lunds universitetssjukhus databaser.
Metod
All ekokardiografisk undersökning är genomförd på hjärtmottagningen (eko-lab) vid Lunds universitetssjukhus med ett ultraljudssystem (Philips iE33; Philips Healthcare, Eindhoven, NL, USA) utrustat med en 1-5 MHz transducer, S5-1.
L L0 L L0 L0
L
Samtliga undersökningar och mätningar är genomförda enligt de senaste
amerikanska riktlinjerna för ekokardiografi [18] av en legitimerad biomedicinsk analytiker med 10 års erfarenhet inom ekokardiografi.
I denna ekokardiografiska studie undersöktes om högerkammarfunktionen skiljer sig åt hos hjärttransplanterade efter 1 månad och 12 månader beroende på om patienterna förbehandlats med LVAD eller inte. De parametrar för bedömning av högerkammarfunktion som värderats var TAPSE, RVS’, RVFAC (2D)
(konventionella), samt tvådimensionell högerkammarstrain med hjälp av speckle tracking. Tvådimensionell högerkammarstrain omfattar två parametrar: global longitudinell högerkammarstrain samt högerkammarens fria vägg strain.
Ekokardiografisk undersökning utfördes med patienten i vänster sidoläge och bar överkropp med ledning av fyrkammarprojektionen. All data lagrades digitalt samt analyserades off-line i efterhand med olika programvara, Philips IntelliSpace Cardiovascular (konventionella parametrar) samt CMC Q-lab 10.3 (speckle tracking); Philips Healthcare, Eindhoven, NL, USA.
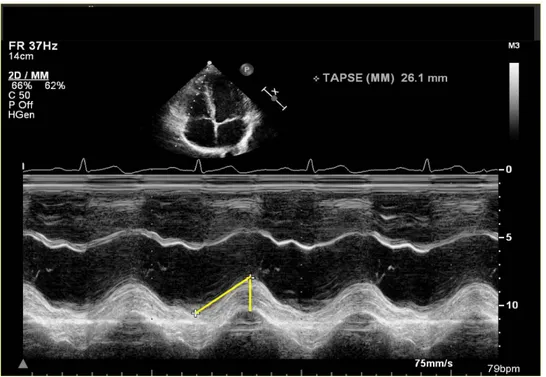
TAPSE erhölls med hjälp av M-mode genom att med ledning av konventionell 2D gråskalebild i apikal fyrkammarprojektionen placera cursorn approximativt i samma riktning (parallell) som högerkammares fria vägg genom laterala annulus trikuspidalis (Figur 5).
Figur 5. TAPSE registrerat med M-mode med ledning av apikal fyrkammarprojektion.
Den streckade linjen (cursorn) i ovansidan bilden visar den ”frysta” ultraljudssignalens riktning i vilken registreringen har utförts. Den resulterande TAPSE-registreringen ses i nedre delen av bilden där den gula linjen visar hur mycket högerkammarens annulus trikuspidalis (lateralt) lyfter sig i systole. Sedan anger utrustningen den erhålla mätvärdet.
RVS’ registrerades genom att med ledning av konventionell gråskale 2D-bild i en fyrkammarprojektion placera cursorn vid apex (approximativt) samt sample volume vid lateralbasala segmenten av annulus trikuspidalis. Vävnadsdoppler färgsektor placerades först så att hela annulus trikuspidalis täcks (Figur 6).
Figur 6. RVS’(Right Ventricular Systolic Excursion Velocity) registrerat med pulsad
vävnadsdoppler med ledning av apikal fyrkammarprojektion. Ovansidan bilden visar vävnadsdoppler-färgsektor över hjärtat, cursorns placering från hjärtats apex till lateralt-basal placering av sample volume vid annulus trikuspidalis. Den nedre illustrationen visar den resulterande S’-registreringen där annulus trikuspidalis i systole rör sig mot sändaren (placerat vid apex) och hastigheterna hamnar ovanför baslinjen (S’). Sedan anger
utrustningen automatiskt ett mått på RVS’.
RVFAC (2D) registrerades genom att med ledning av konventionell gråskale 2D-bild, markera i en stillbild av fyrkammarprojektionen högerkammarens area i end-systole och end-diastole (när kammaren är minst respektive störst); från AV-planet (annulus trikuspidalis) längs hela högerkammares fria vägg till apex och sedan tillbaka till AV-planet längs kammarseptum (Figur 7). Särskilt försiktighet vidtogs vid registreringen; hela högerkammaren inklusive apex och dess laterala vägg visualiseras både i systole och diastole enligt riktlinjer för ekokardiografiska undersökningar [16].
Figur 7. Registrering av RVFAC (Right Ventricular Fractional Area Change) i en stillbild av fyrkammarprojektionen där högerkammarens slutdiastoliska samt slutsystoliska area mäts. Sedan anger utrustningen automatisk ett värde på RVFAC i procent, genom att använda formeln för RVFAC-bestämning.
Högerkammarens globala longitudinella strain med tvådimensionell speckle tracking registrerades med ledning av konventionell gråskale 2D-bild från en fyrkammarprojektion med fokus placerat på högerkammaren (Figur 8).
Figur 8. Bestämning av högerkammarens globala longitudinella strain med 2D-speckle
tracking med ledning av fyrkammarprojektionen. Den övre illustrationen visar
högerkammares olika segment med olika färger. Högerkammares globala longitudinella strain erhålls genom en medelvärdesberäkning av de olika segmentens strain. Den nedre illustrationen visar de erhållna strain-kurvor över ett hjärtslag för de olika
högerkammarsegmenten.
Med ledning av fyrkammarprojektionen spårades endokardiella skiljelinjer manuellt (basalseptal, basallateral och apikal). Sedan analyserade programvaran de markerade områdena och registrerade strain [23,27,28]. Programvarans algoritmer delade automatisk upp högerkammaren i 7 standard-segment (basallateral, midlateral, apikallateral, apikal, apikalseptal, midseptal samt basalseptal) [23]. Efter kontroll av spårningskvalitet samt eventuella manuella justeringar genererade programvaran longitudinella strain kurvor för varje höger- kammarsegment. Slutligen erhölls ett mått på RVGLS genom att programvaran beräknade ett medelvärde på strain av alla högerkammarsegmenten (Figur 8) [27-28]. Strain för högerkammarens fria vägg (RVFS) beräknades manuellt genom en medelvärdesberäkning av strain för de laterala högerkammarsegmenten. Strain mäter procentuell förkortningsgrad vilket innebär att alla värden ska utläsas som negativa då segmentet som analyseras blir kortare i systole [22, 27-28].
Statistisk analys
Kvantitativ data presenterades som medelvärde (M) standardavvikelse (SD). Ett p-värde < 0,05 definierades som statistiskt signifikant (95 % konfidensintervall). För att undersöka om det föreligger en statistik signifikant skillnad i
högerkammarfunktionen mellan grupperna genomfördes ett t-test (oberoende student t-test) för samtliga parametrar. T-test användes även för att detektera eventuella skillnader i invasivt mätt PVR mellan patienter som förbehandlats med LVAD eller inte. Antagandet om varianshomogenitet mellan grupperna för samtliga parametrar testades och uppfylldes via Leven’s F-test (signifikans-värde > 0,05).
Pearsons korrelationsanalys utfördes för att observera eventuellt samband mellan pre-operativt PVR och högerkammar-strain (RVGLS och RVFS), dels för hela materialet men även för de individuella grupperna. Resultatet från
korrelationsanalysen mellan PVR och högerkammarstrain oavsett förbehandling illustrerades i form av spridningsdiagram.
Lunds universitetssjukhus databaser användes för att samla in data för
patienternas PVR-mått (invasiv mått genom kateterisering av högerhjärthalvan) före hjärttransplantation. Samtliga statistiska analyser är utförda med
programvaran (IBM, SPSS Statistics, version 24, Chicago, IL, USA).
Etik
Godkännande av etisk kommitté i Lund föreligger enligt. Dnr 210/114, 210/442, 2011/777. Samtliga patienter är införstådda med och har gett sitt godkännande av användandet av deras patientdata i forskningssyfte. Patienternas personuppgifter och identitet behandlas konfidentiellt och resultatet kommer inte kunna kopplas till någon deltagare i studien då samtliga deltagare har avidentifierats innan materialet analyserades.
RESULTAT
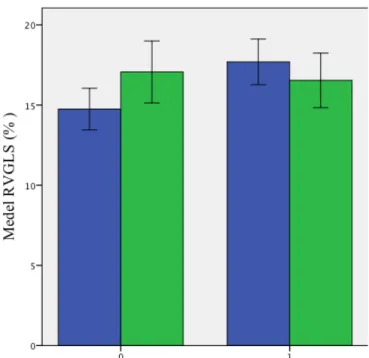
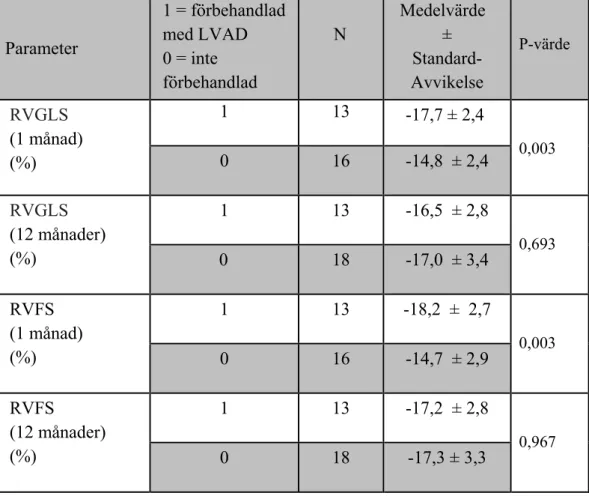
Global longitudinell högerkammarstrain (RVGLS) och högerkammarens fria vägg strain (RVFS) uppvisade statistisk signifikant skillnader mellan grupperna 1 månad efter transplantation (för båda parametrarna p-värde < 0,01). För patienter som hade förbehandlats med LVAD erhölls ett bättre mått på RVGLS (Figur 9), samt för RVFS (Figur 10).
Medel RVGLS (1 månad) för patienter som hade förbehandlats med LVAD var -17,7 ± 2,4 där antal observationer n=13. För den inte förbehandlade gruppen (n=16) var M= -14,8 ± 2,4 (Tabell 1).
Medel RVFS (1 månad) för förbehandlade patienter (n=13) var -18,2 ± 2,7. För inte förbehandlade gruppen (n=16) var M= -14,7 ± 2,9 (Tabell 1).
Figur 9. Medel global longitudinell högerkammarstrain i procent för patienter som inte
hade förbehandlats med LVAD (0) respektive förbehandlade med LVAD (1). Blå staplar visar resultatet efter 1 månad och gröna staplar efter 12 månader. ”Error bars” visar konfidensintervallet (95 %) kring medelvärde. Strainvärden ska utläsas som negativa värden.
Figur 10. Medel högerkammarens fria vägg strain i procent för patienter som inte hade
förbehandlats med LVAD (0) respektive förbehandlade med LVAD (1). Blå staplar visar resultatet efter 1 månad och gröna staplar efter 12 månader. ”Error bars” visar
konfidensintervallet (95 %) kring medelvärdet. Strainvärden ska utläsas som negativa värden.
Tabell 1. Erhållna resultat för strain parametrarna vid bestämning av
högerkammarfunktion där patienter med LVAD-förbehandling visas som 1 och inte förbehandlade patienter som 0 för varje parameter. N representerar antalet patienter för varje grupp. Resultatet presenteras som medelvärde ± standardavvikelse.
För övriga parametrarna TAPSE, RVS’, RVFAC observerades inga statistisk signifikanta skillnader mellan grupperna efter 1 månad och 12 månader (p-värde för samtliga > 0,05) (Tabell 2). Parameter 1 = förbehandlad med LVAD 0 = inte förbehandlad N Medelvärde ± Standard-Avvikelse P-värde RVGLS (1 månad) (%) 1 13 -17,7 ± 2,4 0,003 0 16 -14,8 ± 2,4 RVGLS (12 månader) (%) 1 13 -16,5 ± 2,8 0,693 0 18 -17,0 ± 3,4 RVFS (1 månad) (%) 1 13 -18,2 ± 2,7 0,003 0 16 -14,7 ± 2,9 RVFS (12 månader) (%) 1 13 -17,2 ± 2,8 0,967 0 18 -17,3 ± 3,3
Tabell 2. Erhållna resultat för konventionella parametrarna vid bestämning av
högerkammarfunktion där patienter med LVAD-förbehandling visas som 1 och inte förbehandlade patienter som 0 för varje parameter. N representerar antalet patienter för varje grupp. Resultatet presenteras som medelvärde ± standardavvikelse.
Ingen signifikant skillnad i invasivt mätt PVR mellan patienter som förbehandlats med LVAD (M=2,4 ± 0,9 WU) respektive inte förbehandlad grupp (M= 2,4 ± 1,0 WU) kunde detekteras med oberoende t-test (p = 0,88).
Inget linjärt samband påvisades med hjälp av Pearsons korrelationsanalys mellan preoperativt PVR och högerkammarstrain 1 månad efter transplantation för hela materialet (RVGLS p= 0.40, R2 = 0,034 respektive RVFS p= 0, 21, R2 = 0,074).
Det erhållna resultatet redovisades även i form spridningsdiagram som illustrerar stor spridning av mätvärden i förhållande till regressionslinjen och således inget linjärt samband (Figur 11-12).
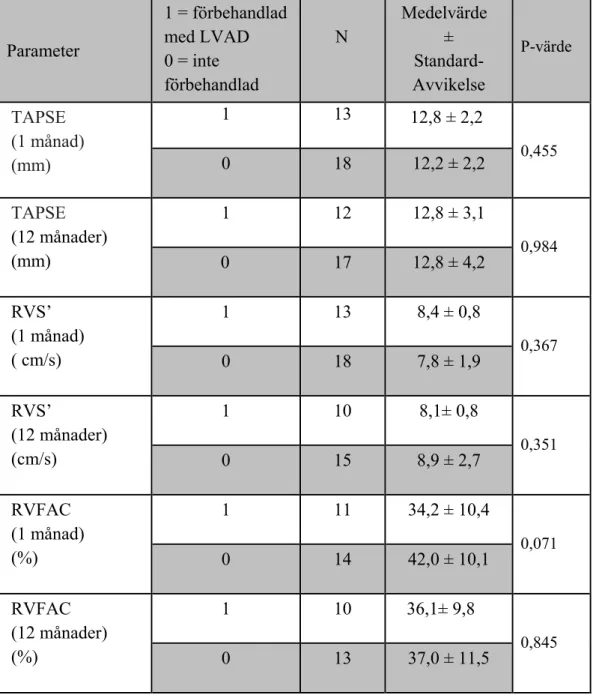
Parameter 1 = förbehandlad med LVAD 0 = inte förbehandlad N Medelvärde ± Standard-Avvikelse P-värde TAPSE (1 månad) (mm) 1 13 12,8 ± 2,2 0,455 0 18 12,2 ± 2,2 TAPSE (12 månader) (mm) 1 12 12,8 ± 3,1 0,984 0 17 12,8 ± 4,2 RVS’ (1 månad) ( cm/s) 1 13 8,4 ± 0,8 0,367 0 18 7,8 ± 1,9 RVS’ (12 månader) (cm/s) 1 10 8,1± 0,8 0,351 0 15 8,9 ± 2,7 RVFAC (1 månad) (%) 1 11 34,2 ± 10,4 0,071 0 14 42,0 ± 10,1 RVFAC (12 månader) (%) 1 10 36,1± 9,8 0,845 0 13 37,0 ± 11,5
Figur 11. Spridningsdiagram för global longitudinell högerkammarstrain (RVGLS) och pulmonell vaskulär resistens (PVR) 1 månad efter transplantation. (Strainvärden ska utläsas som negativa).
Figur 12. Spridningsdiagram för högerkammarens fria vägg strain (RVFS) och pulmonell vaskulär resistens (PVR) 1 månad efter transplantation. (Strainvärden ska utläsas som negativa).
Pearsons korrelationsanalys mellan preoperativt PVR och högerkammarstrain 1 månad efter transplantation baserat på förbehandling påvisade inget linjärt
samband mellan de olika parametrarna. För LVAD-gruppen, RVGLS p= 0,64, R2
= 0,026, och RVFS p= 0,46, R2= 0,063. För inte behandlad grupp RVGLS p=
0,43, R2 = 0,063, och RVFS p= 0,27, R2= 0,122.
DISKUSSION
För att behandla patienter med grav hjärtsvikt krävs avancerade
behandlingsstrategier. I denna patientgrupp kan hjärttransplantation och mekanisk cirkulations-stödjande utrustning såsom LVAD bli aktuell [4]. Enligt tidigare studier leder förbehandling med LVAD till minskat PVR hos patienter med svår
hjärtsvikt [9,12]. Detta gör att patienter som tidigare ansetts inoperabla på grund av högt PVR idag kan transplanteras med gott resultat [12].
Efter transplantation är det viktigt att utvärdera hjärtats funktion. En väl etablerad metod för detta är ekokardiografi. Det är dock sedan tidigare inte väl beskrivet på vilket sätt förbehandling med LVAD påverkar hjärtats högerkammarfunktion efter transplantation. Huvudsyftet med denna studie var att med TTE undersöka om förbehandling med LVAD kan inverka positivt på högerkammarfunktionen efter hjärttransplantation och huruvida denna effekt är bestående under längre tid. Det avsågs även studera eventuella skillnader i PVR vid behandling med LVAD samt hur dessa korrelerade till ekokardiografiska mått på högerkammarfunktion.
Metoddiskussion
Konventionella parametrar såsom TAPSE och RVS’ används rutinmässigt vid bedömning av högerkammares systoliska funktion. Parametrarna mäter
högerkammarens longitudinella sammandragning och anses vara ett surrogatmått för högerkammarens systoliska funktion då denna i normalfallet till stor del består av longitudinell förkortning. Dessutom är parametrarna enkla att erhålla, har hög reproducerbarhet och har visat god korrelation med Cardiac Magnetic Resonance (CMR) [16,18,20]. Antagandet att dessa parametrar kan representera
högerkammarens globala systoliska funktion är inte giltigt vid närvaro av regional högerkammar-dysfunktion eller belastning som kräver kompensatorisk radiell kontraktilitet. Parametrarna kvantifierar endast förflyttning respektive
longitudinell hastigheten av annulus trikuspidalis i förhållande till ultraljudsgivaren och avspeglar således främst basala segmenten av
högerkammarens fria vägg [16,18]. Trots flertal fördelar med metoderna bör dessa parametrar användas i samband med andra parametrar som tar hänsyn till radiell kontraktilitet (ex. RVFAC) och faktisk kontraktilitet (ex. RVstrain) för att erhålla ett mer korrekt mått på högerkammarfunktionen [16].
Hos patienter med svår vänsterkammarsvikt kan även höger kammare vara
påverkad p.g.a. backward failure som tidigare beskrivits. Detta i kombination med eventuell remodullering av hjärtats kammare till följd av hjärtsvikt gör att
parametrar som endast mäter longitudinell funktion troligtvis inte är användbara. I detta arbete har en rad olika parametrar studerats för att utvärdera skillnader mellan grupperna samt värdera vilka parametrar som kan användas för bedömning av högerkammarfunktionen hos denna patientgrupp.
En parameter som studerades för bedömning av högerkammarfunktionen var RVFAC. Parametern anses vara ett surrogat till högerkammares ejektions fraktion (RV EF) som inte kan mätas ekokardiografiskt [15,16-18,]. Tidigare studier med CMR har visat att det finns en god korrelation mellan RVFAC och RVEF [16-17]. Dessutom har det beskrivits att parametern ensamt kan vara en markör för olika hjärt/lungtillstånd såsom hjärtsvikt [16,18]. Anledningen till varför RVFAC användes i detta arbete var bland annat att det är en tvådimensionell metod som är oberoende av vinkel samt att den innefattar både longitudinell och radiell
kontraktilitet av högerkammaren [16]. Metodens främsta begränsning är att den är mycket beroende av bildkvalité, där inkorrekt spårning av högerkammarens area p.g.a. trabekulering (bindvävsbildning) kan medföra under- eller överskattning av högerkammarfunktionen. RVFAC kan således anses vara en bra metod vid undersökning av patienter med misstänkt eller känd sjukdom som involverar
högerkammarens funktion, dock endast vid bildkvalité som tillåter en god utlinjering av myokardiet [16].
Ytterligare en parameter vid bedömning av högerkammarfunktionen i denna studie var högerkammarstrain. Strain har i tidigare studier visat sig vara den mest sensitiva metoden för att erhålla det mest korrekta måttet på aktiv kontraktilitet av höger kammares myokard. Trots många fördelar med metoden finns även ett antal begränsningar. Programvaran som används vid 2D-strain av högerkammaren är i grunden tillverkad för bedömning av vänster kammare men kom senare till användning vid bedömning av högerkammarfunktionen [16]. Dock skiljer
vänsterkammarens geometri från högerkammarens vilket kan påverka algoritmen som ligger till grund för mätmetoden. Vidare är högerkammarens form mer komplex och kräver optimal bildkvalité för att dess funktion ska kunna bedömas med tvådimensionell speckle tracking strain [16-18]. Ytterligare en begränsning med metoden kan vara att bedömning av högerkammarfunktionen med 2D speckle-tracking strain endast erhålls från apikal fyrkammarprojektion, medan bedömning av vänsterkammaren erhålls från tre olika projektioner (2-, 3- och 4-kammar). Vidare ligger den typiska fyrkammarbildens fokus mer åt
vänsterkammaren, och högerkammaren visualiseras då ofta inte helt [16]. Bildinsamlingen av de olika parametrarna till denna studie genomfördes med hjälp av ekokardiografiska undersökningar (TTE). En nackdel med TTE och analys av parametrarna med hjälp av programvaror är att dessa är
användarberoende; undersökningsresultatens tillförlitlighet är beroende av skicklighet och erfarenhet hos den som utför undersökningen och analyserar resultatet [2,13,14,16]. För att erhålla optimala resultat i denna studie har samtliga undersökningar och mätningar genomförts enligt de senaste amerikanska
riktlinjerna för ekokardiografi [18] av en legitimerad biomedicinsk analytiker med 10 års erfarenhet inom ekokardiografi.
Resultatdiskussion
Det främsta resultatet vid undersökning av högerkammarfunktionen för respektive grupp (förbehandlat med LVAD och inte) var att 1 månad efter transplantation observerades statistisk signifikanta skillnader mellan grupperna för global
longitudinell högerkammarstrain samt högerkammarens fria vägg strain (p= 0,003 för båda parametrarna). Patienter som förbehandlats med LVAD uppvisade bättre strain uppmätt med båda metoderna.
Redan efter 1 månad nådde den förbehandlade gruppens fria väggs strainvärden som är jämförbara med tidigare publicerat normalmaterial för stabila
transplanterade patienter [29]. Vid 12 månaders kontroll kunde dessa skillnader mellan grupperna inte längre detekteras. Den grupp som förbehandlats med LVAD hade då bibehållna värden medan den grupp som inte förbehandlats med LVAD initialt hade sämre strain men förbättrade sin högerkammarstrain det första året. Detta tyder på att pre-operativ förbehandling med LVAD har positiva
effekter för den tidiga återhämtningen av högerkammarfunktionen. Fyndet är intressant då högerkammardysfunktion är en av de postoperativa komplikationer som försenar rehabilitering och förlänger intensivvårdstiden på sjukhus efter transplantation.
Anledningen till varför det observerades statistisk signifikanta skillnader mellan grupperna endast vid undersökning av högerkammarfunktionen med strain kan
enligt tidigare studier [23,29] bero på att konventionella parametrarna inte kan skilja på aktiv kontraktion och eventuell sekundär inverkan av vänsterkammarens kontraktion. En annan förklaring kan vara påverkan av hjärtkirurgin. Tidigare studier har visat att öppnande av perikardiet ger negativ inverkan på mätningar av högerkammarens longitudinella funktion utfört med konventionella parametrar [30].
Vid jämförelse av invasivt mätt PVR före transplantation sågs ingen skillnad mellan LVAD och icke LVAD-behandlade patienter. Den skillnad i
högerkammarstrain som detekterades vid 1 månads kontroll kan således inte förklaras av en skillnad i preoperativt PVR. Huruvida den grupp som erhållit LVAD haft ökat PVR innan sin behandling är oklart. Det kan inte heller yttras hur det uppmätta PVR-värdet påverkas av flödesförhållandena som uppstår under LVAD-behandling. Korrelationsanalys mellan högerkammarstrain-parametrar 1 månad efter transplantation och pre-operativt PVR för hela materialet kunde inte påvisa något linjärt samband mellan dessa parametrar. Detta talar för att det finns andra mekanismer involverade i på vilket sätt LVAD påverkar de hemodynamiska förhållandena innan transplantation.
Begränsning
Analysen av högerkammar strain utfördes genom att använda programvara som egentligen har utvecklats för bestämning av vänsterkammar-strain men som har modifierats för att kunna användas vid bestämning av högerkammar-strain. Dessutom utgör även studiens storlek (antal patienter i grupperna) en begränsning. I denna studie inkluderades relativt få patienter vilket medför att resultatet bör tolkas med viss varsamhet. En ytterligare begränsning är att inga uppföljande PVR mätningar utförts i anslutning till datainsamling.
KONKLUSION
Studien har visat att patienter som förbehandlas med LVAD inför transplantation initialt (1 månad efter transplantation) uppvisar bättre högerkammarfunktion mätt med strain. Konventionella parametrar för bedömning av högerkammarfunktion skiljde sig inte åt mellan grupperna vilket kan förklaras av att de påverkats av hjärtoperationen i sig. Detta talar för att strain bör användas som ett komplement för att bedöma högerkammarfunktion hos denna kategori patienter.
Resultaten av denna studie talar för att förbehandling med LVAD bör övervägas för att påskynda återhämtningen av högerkammarfunktion efter transplantation. Mekanismen bakom hur LVAD positivt påverkar denna återhämtning är oklart och behöver studeras ytterligare.
REFERENSER
1. Hedner, Pavo (red.) (2010). Invärtesmedicin. 10. uppl. Lund: Studentlitteratur.
2. Jonson, B & Wollmer, Per (red.) (2011). Klinisk fysiologi: med nuklearmedicin och klinisk neurofysiologi. 3, [rev.] uppl. Stockholm:
Liber.
3. Wallentin, Lars, Lindhal, Bertil (red.) (2010). Akut kranskärlssjukdom. 2, [uppdaterade] uppl. Stockholm: Liber.
4. Gaddam, K K, Yelamanchili, P, Sedghi, Y And Ventura, H O, (2009) Advanced heart failure and management strategies. The Ochsner
journal, 9(4): 227.
5. Matthews J, Lund L H, Aaronson K, (2010) Patient selection for left ventricular assist devices. European journal of Heart Failure, 12(5): 434-443.
6. Russell, S D, Miller, L W And Pagani, F D, (2008) Advanced heart failure: a call to action. Congestive heart failure (Greenwich,
Conn.), 14(6): 316-321.
7. Gustafsson F, Joseph G R, (2017) Left ventricular assist device therapy in
advanced heart failure: patient selection and outcomes. European journal
of Heart Failure, 19(5): 595-602.
8. Longobardo L, Kramer C, Careri S, Zito C, Jain R, Suma V, Thohan V,
Sulemanjee N, Downey F X, Khandheria B K, (2016) Role of
Echocardiography in the Evaluation of Left Ventricular Assist Devices: the Importance of Emerging Technologies. Current Cardiology reports, 18(7):62.
9. Birati Y E, Jessup M, (2015) Left Ventricular Assist Devices in the
Management of Heart Failure. Cardiac Failure Review, 1(1): 25–30. 10. Gaddam, K K, Yelamanchili P, Sedghi Y. And Ventura, H O, (2009)
Advanced heart failure and management strategies. The Ochsner
journal, 9(4): 227-233.
11. HeartMate 3™ Left Ventricular Assist System. St. Jude Medical. Tillgängligt: https://www.sjmglobal.com/patients/heart-failure/our-solutions/left-ventricle-assist-device/heartmate-3 [Jan 31, 2018].
12. Kalogeropoulos A P, Borlaug B A, Gheorghiade M, Butler J, (2013) Left Ventricular Dysfunction with Pulmonary Hypertension. Circulation Heart
failure, 6: 584-593
13. Olsson, Arne (2010). Ekokardiografi. 3.,[omarb. och kompletterade] uppl. Stockholm: Ultraview.
14. Otto, Catherine M. (2009). Textbook of clinical echocardiography. 4. ed. Philadelphia: Saunders/Elsevier
15. Cameli M, Lisi M, Ringhini M F, Focardi M, Lunghetti S, Bernazzli S, Marchetti L, Biagioli B, Galderisi M, Maccherini M, Sani G, Mondillo S, (2013) Speckle tracking echocardiography as a new technique to evaluate right ventricular function in patients with left ventricular assist device therapy. The Journal of Heart and Lung Transplantation, 32(4): 424-430. 16. Longobardo, L, Suma, V, Jain, R, Carerj, S, Zito, C, Zwicke, D L. And
Khandheria, B K, (2017). Role of Two-Dimensional Speckle-Tracking Echocardiography Strain in the Assessment of Right Ventricular Systolic Function and Comparison with Conventional Parameters. Journal of the
American Society of Echocardiography. 30(10): 937-946.
17. Iacoviello M, Citarelli G, Antoncecchi V, Romito, R, Monitillo, F, Leone, M, Puzzovivo, A, Lattarulo, M S, Rizzo C, Caldarola P. And Ciccone, M M, (2016) Right Ventricular Longitudinal Strain Measures Independently Predict Chronic Heart Failure Mortality. Echocardiography, 33(7): 992-1000.
18. Rudski, L G, Lai W W, Afialo J, Hua L, Handschumacher M D, Chandrasekaren K, Solomon S D, Louie E K, Schiller N B, (2010) Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography. Journal
of the American Society of Echocardiography, 23(7): 685-713.
19. Schmid, E, Hilberath, J N, Blumenstock, G, Shekar, P S, Kling, S, Shernan, S K., Rosenberger P, And Nowak-Machen M, (2015) Tricuspid annular plane systolic excursion (TAPSE) predicts poor outcome in patients undergoing acute pulmonary embolectomy. Heart, Lung and
Vessels, 7(2): 151-158.
20. Sun X, Zhang H, Aike B, Yang S, Yang Z, Dong L, Wang F And Wang C (2016) Tricuspid annular plane systolic excursion (TAPSE) can predict the outcome of isolated tricuspid valve surgery in patients with previous cardiac surgery? Journal of Thoracic Disease, 8(3): 369-374.
21. Otto, Catherine M. (red.) (2007). The practice of clinical
echocardiography. 3rd ed. Philadelphia: Elsevier Saunders.
22. Breatnach, C R., Levy, P T, James, A T, Franklin O. And El-Khuffash A, (2016). Novel Echocardiography Methods in the Functional Assessment of the Newborn Heart. Neonatology, 110(4): 248-260.
23. Werther Evaldsson, A, Ingvarsson A, Waktare J, Smith, G J, Thilén U, Stagmo M, Roijer A, Rådegran G, Meurling C, (2017) Right ventricular speckle tracking assessment for differentiation of pressure- versus volume-overloaded right ventricle. Clinical Physiology and Functional
24. Voigt, J, Pedrizzetti G, Lysyansky P, Marwick, T H, Houle H, Baumann, R, Pedri S, Ito Y, Abe Y, Metz S, Song, J H., Hamilton, J, Sengupta, P P, Kolias, T J, D'hooge, J, Aurigemma, G P, Thomas, J D. And Badano, L P, (2015) Definitions for a common standard for 2D speckle tracking
echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. Journal of the American
Society of Echocardiography: Official Publication of the American Society of Echocardiography, 28(2):183-193.
25. Rösner A, Barbosa D, Aarsæther E, Kjønås D, Schirmer H And D'hooge J, (2015) The Influence Of Frame Rate On Two-Dimensional Speckle-Tracking Strain Measurements: A Study On Silico-Simulated Models And Images Recorded In Patients. European Heart Journal - Cardiovascular
Imaging, 16(10): 1137-1147.
26. Dandel M, Hetzer R, (2009) Echocardiographic strain and strain rate imaging -Clinical applications. International Journal of Cardiology, 132:11-24.
27. Focardi, M, Cameli M, Carbone, S F, Massoni A, De Vito R, Lisi M And Mondillo S, (2015) Traditional and innovative echocardiographic
parameters for the analysis of right ventricular performance in comparison with cardiac magnetic resonance. European Heart Journal -
Cardiovascular Imaging, 16(1): 47-52.
28. Herod, J W And Ambardekar, A V, (2014) Right Ventricular Systolic and Diastolic Function as Assessed by Speckle-Tracking Echocardiography Improve With Prolonged Isolated Left Ventricular Assist Device Support. Journal of Cardiac Failure, 20(7): 498-505.
29. Ingvarsson A, Werther Evaldsson A, Waktare J, Nilsson J, Smith, G J, Stagmo M, Roijer A, Rådegran G And Meurling, C J, (2017) Normal Reference Ranges for Transthoracic Echocardiography Following Heart Transplantation. Journal of the American Society of Echocardiography:
Official Publication of the American Society of Echocardiography, pii:
S0894-7317(17)30796-4.
30. Unsworth B, Casula, R P, Kyriacou, A A, Yadav H, Chukwuemeka A, Cherian A, Stanbridge, R D L, Athanasiou T, Mayet J. And Francis, D P, (2010). The Right Ventricular Annular Velocity Reduction Caused By Coronary Artery Bypass Graft Surgery Occurs At The Moment Of Pericardial Incision. American Heart Journal, 159(2): 314-322.
![Figur 1. HeartMate 3 Left Ventricular Assist System [11].](https://thumb-eu.123doks.com/thumbv2/5dokorg/3947882.71459/7.892.204.442.81.395/figur-heartmate-left-ventricular-assist-system.webp)
![Figur 3. Förstorade ”speckels” i kammarseptum i en fyrkammarprojektion. Metoden är till skillnad från doppler tämligen vinkeloberoende samt mindre beroende av framerate (antal bilder/sekund) [13,16,23]](https://thumb-eu.123doks.com/thumbv2/5dokorg/3947882.71459/10.892.149.681.656.1003/förstorade-speckels-kammarseptum-fyrkammarprojektion-metoden-tämligen-vinkeloberoende-framerate.webp)