Bestämning av utfallet av translokationen t(11;18)(q21;q21) hos
patienter med MALT-lymfom genom FISH analys
Sofie Fredriksson
Biomedicinska analytikerprogrammet 180 högskolepoäng Högskolan i Kalmar, Naturvetenskapliga institutionen
Examensarbete i Biomedicinsk laboratorievetenskap 15 högskolepoäng
Handledare
Tomasz Gorecki, Med Dr Avdelningen för Patologi/Cytologi
Länssjukhuset i Kalmar
SE-391 85 KALMAR
Anki Koch-Schmidt, Fil Dr Naturvetenskapliga institutionen
Högskolan i Kalmar
SE-391 82 KALMAR
Examinator
Maria Mattsson, Dr med vet Naturvetenskapliga institutionen
Högskolan i Kalmar
SE-391 82 KALMAR
Sammanfattning
Lymfom är en grupp maligna tumörsjukdomar som utvecklas i det sekundära lymfatiska systemet. Samtliga organ kan drabbas av sjukdomen eftersom lymfocyter finns i hela kroppen. I anslutning till slemhinnorna i kroppen finns mukosa-associerad lymfoid vävnad, MALT, som kan utveckla lymfom spontant, vid kronisk inflammation eller vid autoimmuna sjukdomar. MALT-lymfom utvecklas långsamt. Sjukdomen går idag inte att bota med undantag av en del fall som utlösts av en infektion med Helicobacter pylori. Antibiotikabehandling kan i dessa fall inducera remissioner.
MALT-lymfom har karakteristiska histologiska och molekylära egenskaper. En av dessa egenskaper är reciproka translokationer. Den mest förekommande translokationen vid lymfom är t(11;18)(q21;q21) API2-MALT1 (apoptosis inhibitor 2 – MALT-lymphoma associated translocation 1). Denna innebär att kromosom 11 i API2-genen liksom kromosom 18 i MALT1-genen har brutits av och att kromosomfragmenten bytt plats så att nya fusionsgener bildats. Den fusionsgen, som bildas i kromosom 11, kodar för proteinet API2-MALT1, vilket medför att apoptosen hämmas onormalt mycket samtidigt som nuclear factor (NF)-κB starkt aktiveras. Detta leder till okontrollerad cellproliferation, varigenom tumörceller bildas.
Syftet med föreliggande studie var att studera utfallet av translokationer genom att påvisa MALT1-genen i tumörceller från fall som fått diagnosen MALT-lymfom. Detta utfördes med FISH (fluorescense in situ hybridisation)-teknik. Fluorokrommärkta prober binder då till var sida om brytpunkten på MALT1-genen och resultatet syns som färgade punkter då det studeras i fluorescensmikroskop.
Utfallet av translokationen t(11;18)(q21;q21) blev 22%, vilket stämmer överens med resultat från liknande studier.
Abstract
Lymphoma is a group of malignant tumour diseases developing in the secondary lymphatic system. These diseases can develop in all organs as lymphocytes are
ubiquitously in the body. In connection to mucus membranes we find mucosa-associated lymphoid tissue, MALT, in which lymphoma can spontaneously but slowly develop, mostly at chronic inflammation or at autoimmune diseases. Today these diseases are incureable with the exception of some cases caused by Helicobacter pylori-infection. Antibiotic treatment of these cases can induce remissions.
MALT-lymphomas have characteristic histological and molecular properties. One of these properties is the translocation t(11; 18)(q21; q21) API2-MALT1 (apoptosis inhibitor 2 – MALT-lymphoma associated translocation 1) . This means that the API2 gene in chromosome 11 and the MALT1 gene in chromosome 18 have been broken and the formed chromosome fragments changed places, which results in formation of new fusion genes. The fusion genes API2-MALT1 encodes a protein, which results in
increased inhibition of apoptosis and increased nuclear factor (NF)-κB activation, which results in uncontrolled cell proliferation and tumour cells will be formed.
The aim of this work was to detect and analyse the MALT1-gene in tumour cells from cases with the diagnosis MALT-lymphoma in order to study the outcome of
translocations. This was carried out with FISH (fluorescence in situ hybridization) -technique. Fluorochrome-labelled probes hybridize to each side of the breakpoint of the MALT1-gene and the result is studied in a fluorescence microscope.
The translocation t(11;18)(q21;q21) was found in 22% of the diagnosed MALT-lymphoma patients, which is in accordance to similar studies.
Innehållsförteckning
Introduktion ... 1
Lymfom ... 1
Hodgkins och non-Hodgkins lymfom ... 1
Lymfom i mukosa-associerad lymfoid vävnad ... 1
Histologiska och molekylära egenskaper hos MALT-lymfom ... 2
Translokation t(11;18)(q21;q21) och bildning av API2-MALT1 ... 4
Påvisande av translokationer genom FISH ... 4
Fluorescense ... 5
Fluorescensmikroskop ... 5
LSI MALT1 (18q21) Dual Color Break Apart Rearrangement Probe för att påvisa translokationen t(11;18)(q21;q21) ... 6
Syfte ... 7
Material och metoder ... 7
Framtagning och behandling av patientmaterial ... 7
Förbehandling av snitt ... 7
Beredning och applicering av probemix ... 8
Denaturering och hybridisering ... 8
Stringenstvätt ... 8
Motfärgning av cellkärnorna ... 8
Bedömning av translokation på kromosom 18q21 ... 9
Kontroll ... 9
Etiska aspekter ... 9
Resultat ... 9
Diskussion ... 10
Bedömning av utfallet t(11;18)(q21;q21) ... 10
Klinisk betydelse av translokationen t(11;18)(q21;q21) ... 10
Kontroll och felkällor ... 11
Alternativa metoder ... 11
Slutsats ... 11
Tackord ... 13
Referenser ... 14
Förkortningar
API2 Apoptosis inhibitor 2
BIR Baculovirus inhibitors of apoptosis repeat CD Cluster of differentiation
CISH Chromogenic in situ hybridization (kromogen in situ hybridisering) DLBCL Diffust storcelligt B-cellslymfom
DNA Deoxyribonukleinsyra
FISH Fluorescence in situ hybridisation (fluorescent in situ hybridisering)
ISCN the International System for Human Cytogenetic Nomenclature MALT Mucosa associated lymphoid tissue (mukosa associerad lymfoid
vävnad)
MALT1 Mucosa-associated lymphoid tissue-lymphoma associated translocation 1 NF-κB Nuclear factor-κB
NK-cell Natural Killer cell
PCR Polymerase Chain Reaction Px Provexcision WHO World Health Organization
Introduktion
Lymfom
I Sverige drabbas årligen cirka 2000 människor av lymfom, vilket är beteckningen på en malign tumörsjukdom som utvecklats från lymfocyter, B- eller T-lymfocyter samt Natural Killer (NK)-celler i det sekundära lymfatiska systemet. Sjukdomen orsakas av att den perfekta balansen mellan nybildning av lymfocyter (proliferation) och lymfocyters programmerade celldöd (apoptos) rubbas. Cellerna förändras såväl morfologiskt som molekylärt och tappar förmågan att reglera sin celldelning. De börjar därför dela sig ohämmat samtidigt som deras apoptos vanligen hämmas. Resultatet blir att en tumör bildas.
Lymfkörtlarna är det vanligaste organet där lymfom uppstår, vilket beror på att denna vävnad har flest lymfocyter och att större delen av lymfocyternas proliferation sker här. Men eftersom lymfocyter finns spridda på flera ställen, kan lymfom uppstå även i andra delar av kroppen (1-2).
Hodgkins och non-Hodgkins lymfom
Det finns två huvudgrupper av lymfom, Hodgkins lymfom och non-Hodgkins lymfom. Den förra är ett specifikt lymfom medan den senare innefattar alla övriga lymfom.
Hodgkins lymfom fick sitt namn efter Thomas Hodgkin som var först med att
beskriva sjukdomen. Den är relativt ovanlig hos befolkningen i stort, men är en av de vanligaste tumörsjukdomarna som drabbar personer i 20-30 års åldern. Den drabbar också de som är äldre än 50 år. Man vet idag inte vad som orsakar sjukdomen men ett förändrat svar på en virusinfektion kan troligtvis vara en orsak framförallt hos yngre. De flesta med Hodgkins lymfom kan botas med strålbehandling och cytostatika. Non-Hodgkins lymfom delas in i högmaligna, som är snabbväxande, och lågmaligna som växer långsamt. Dessa delas i sin tur upp i ett tjugotal undergrupper. Lymfom som är högmaligna drabbar oftast yngre och behandlas med cytostatika medan de lågmaligna främst drabbar äldre människor. Det kan ta lång tid innan man får några symtom vid ett lågmalignt lymfom och behandling krävs därför inte den första tiden. Det är när symtomen blir påtagliga som cytostatika sätts in för att hålla tillbaka sjukdomen men behandlingen är inte botande (1-5).
Lymfom i mukosa-associerad lymfoid vävnad
År 1983 beskrevs lymfom i mukosa-associerad lymfoid vävnad, MALT (mucosa associated lymfoid tissue) för första gången av Isaacson och Wright. Idag
klassificeras MALT-lymfom som en subtyp av non-Hodgkins lymfom (6). Enligt World Health Organization (WHO) tillhör MALT-lymfom gruppen lågmalignt extranodalt B-cells lymfom och utgör cirka 8% av alla non-Hodgkinslymfom (7).
Denna typ av lymfom drabbar främst mag-tarmkanalen men kan återfinnas även i andra organ som t.ex. spottkörtlar, sköldkörtel, lungor och bröst.
Sjukdomen kan utvecklas spontant eller förvärvas genom kronisk inflammation och vid autoimmuna sjukdomar (6). En vanlig utlösande faktor är en bakterieinfektion av
Helicobacter pylori. Denna bakterie orsakar kronisk inflammation i magsäckens
(ventrikelns) slemhinna, vilket utan behandling kan leda till MALT-lymfom.
Campylobacter jejuni är en annan bakterie som kan orsaka MALT-lymfom. I detta
fall är det tarmen som blir infekterad men detta är inte lika vanligt som infektion av
H. pylori (8).
Symtomen beror på vilket organ som drabbats men de vanligaste är lokal smärta, feber, trötthet och minskad aptit. Vilken behandling som sätts in beror också på lokaliseringen av lymfomet. Då en bakterieinfektion med H. pylori är orsaken, är behandlingen i första hand antibiotika. Denna behandling kan inducera remission och hålla tillbaka sjukdomsförloppet. I andra fall är sjukdomen obotlig och behandlingen går ut på att lindra symtomen. Femårsöverlevnaden för sjukdomen är cirka 80% (6, 9).
MALT-lymfom kan utvecklas från lågmalignt till att bli högmalignt. Då klassificeras det inte som MALT-lymfom utan övergår till diffust storcelligt B-cellslymfom (DLBCL) (10).
Histologiska och molekylära egenskaper hos MALT-lymfom
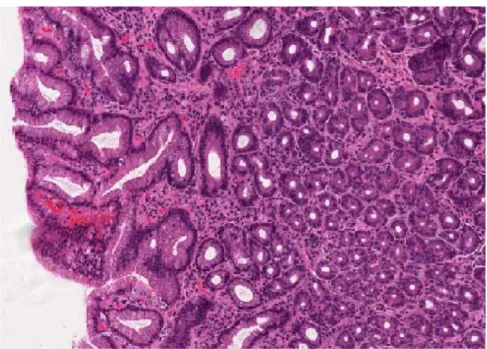
MALT utgör den lymfatiska vävnaden i slemhinnornas mukosa och består av leukocyter i mer eller mindre organiserade strukturer (Figur 1). Den utgör ett
effektivt skydd för kroppen mot virus och mikroorganismer som kan tränga in från de yttre gångarna. Detta sker genom att den lymfatiska vävnaden snabbt aktiveras och eliminera det som är kroppsfrämmande (2).
Trots att MALT-lymfom kan drabba olika organ skiljer de sig inte mycket i histologin. Vid lymfom i denna vävnad ses en infiltration av små till medelstora B-lymfocyter med avvikande form på kärnan och rikligt med cytoplasma. En annan viktig histologisk egenskap är förekomsten av lymfoepiteliala lesioner. De karaktäriseras av att den epiteliala strukturen deformerats på grund av
aggregatinfiltration av lymfocyter. Även enstaka förändrade blaster kan förekomma (Figur 2) (6, 10).
Tumörcellerna har en viss immunofenotyp, vilket innebär att cellerna uttrycker vissa specifika antigen samtidigt som de saknar andra antigen som uttrycks i de friska cellerna. Vid MALT-lymfom saknas bland annat antigen för CD5, CD10 samt CD23. Det finns ingen kombination som är helt unik för denna sjukdom utan
antigenuttrycken kan variera från fall till fall.
MALT-lymfom kan också uppvisa vissa unika kromosomala förändringar. Reciproka translokationer och trisomi är de genetiska förändringar som man idag vet kan
förekomma. En reciprok translokation innebär att två kromosomer bryts av och bildade fragment byter plats med varandra så att nya fusionsgener bildas i respektive
kromosom. De translokationer som kan förekomma vid MALT-lymfom är den mellan kromosom 11 vid band 21 på kromosomens långa arm (q21) och kromosom 18 (q21), dvs. t(11;18)(q21;q21) samt t(1;14)(p22;q32), t(14;18)(q32;q21) och t(3;4)(p14.1;q32) (5-7, 10).
Vid trisomi finns det tre uppsättningar av någon kromosom istället för två som är det normala antalet. Det är trisomi av kromosomerna 3 och 18 som kan förekomma vid MALT-lymfom (7).
Figur 1. Normal ventrikelslemhinna färgad med hematoxylin och eosin.
Bilden är tagen i 200x förstoring.
Figur 2. Ventrikelslemhinna med infiltration av lymfocyter samt en 55,48 µm sto
3
r körtelgång med lymfoepiteliala lesioner. Denna histologiska bild är karakteristisk för MALT-lymfom. Preparatet är färgat med hematoxylin och eosin.
Translokation t(11;18)(q21;q21) och bildning av API2-MALT1
Vid kromosomala translokationer bildas vid fusionsställena nya gener, så kallade fusionsgener, vilka kan koda för onormala proteiner, som gör att tumörceller bildas (6).
Den mest förekommande translokationen vid MALT-lymfom är t(11;18)(q21;q21). De gener som härigenom förändras är genen för apoptosis inhibitor 2 (API2) på kromosom 11q21 och genen för proteinet MALT-lymphoma-associated translocation 1 (MALT1) på kromosom 18q21. Både API2-genen och MALT1-genen har fyra kända brytpunkter var och det finns åtta kända varianter av det bildade
fusionsproteinet API2-MALT1. Samtliga varianter av fusionsgenen ger upphov till ett fusionsprotein. Detta protein har en region med tre domäner ”baculovirus inhibitors of apoptosis repeat” (BIR) från API2:s N-terminal och en region innehållande en caspas-lik domän från MALT1 proteinets C-terminal.
API2 kodar för ett protein som normalt hämmar apoptosen och MALT1 för ett protein
som är delaktigt vid aktivering av nuclear factor (NF)-κB. NF-κB är en transkriptionsfaktor, som kontrollerar många gener som är inblandade i
lymfocyternas tillväxt och överlevnad. Normalt måste MALT1-proteinet bilda ett komplex med ytterligare proteiner för att det ska få någon effekt, vilket
fusionsproteinet API2-MALT1 inte behöver göra. Det bildade fusionsproteinet får också en ökad apoptosinhiberande effekt.
Då resultatet av nämnda translokation blir en fusionsgen som kodar för proteinet API2-MALT1, vilket kraftigt hämmar apoptosen och samtidigt ökar aktiveringen av NF-κB, ökar antalet lymfocyter okontrollerat (7, 10).
Påvisande av translokationer genom FISH
För att påvisa translokationer av gener används ofta fluorescent in situ hybridisering (FISH), som är en molekylärbiologisk teknik som används för att detektera och lokalisera genetiska förändringar i olika vävnadspreparat. Metoden innebär att en specifik DNA-sekvens, så kallad probe, binder till en komplementär sekvens på DNA-molekylerna i cellen. Proben är märkt med en fluorescerande molekyl, så kallad fluorokrom, för att detektionen ska vara möjlig.
FISH kan utföras på ett histologiskt snitt som först måste bli permeabelt för att proberna ska kunna nå DNA:t och därmed binda in situ. Därför förbehandlas preparatet i flera permeabiliseringssteg. Initialt behandlas vävnaden med HCl och natriumthiocyanat (Pretreatment Solution) för att bryta upp protein-DNA-komplex och sedan med proteolytiska enzym (Protease Solution) för att bryta ner proteinerna (11-12). Därefter följer denaturering, som innebär att DNA-molekylerna och
dubbelsträngade prober utsätts för så hög temperatur att vätebindningarna mellan kvävebaserna, vilka håller ihop DNA-strängarna, bryts och strängarna separerar. Temperaturen sänks därefter snabbt så att proberna (i överskott) ska kunna binda till målsekvenserna, så kallad hybridisering. Då proberna hybridiserats till den specifika gensekvensen måste glasen stringenstvättas för att få bort prober som inte bundit
liksom de som bundit ospecifikt. Med stringens menas probens förmåga att binda till DNA. Stringensen är beroende av temperatur, jonkoncentration, pH och även tiden för tvättningen. När resultatet studeras i ett fluorescensmikroskop syns proberna som färgade punkter (13-14).
Fluorescense
Vid FISH används fluorescerande molekyler för att visualisera de hybridiserade proberna. En fluorescerande molekyl är oftast uppbyggd av polyaromatiska kolväten. När energi i form av ljus träffar molekylen absorberas energin och molekylen går från vilofas, S0, till en mer energirik, exciterad fas, S1´. Fluorokromen övergår sedan till en mer stabil fas, S1,efter att ha tappat lite energi i form av konformations-förändringar och samverkan med omgivningens molekyler. Molekylen vill sedan återgå till ursprunglig vilofas igen, vilket den gör genom att avge energi i form av ljus. Detta kallas för emission. Korta våglängder har större energi än långa vågländer, vilket medför att det ljus som emitteras har en längre våglängd än det som exciterar molekylen (Figur 3). Olika fluorescerande molekyler har olika excitations- och emissionsspektra, vilket medför att de har olika färger (15).
S ´ 1 2.
E nergi S1
1. 3.
S0
Figur 3. Fluorescensprocessen illustrerad i ett Jablonski diagram
(energidiagram). En fluorokrom befinner sig i vilofasen S0. 1:
Energi tillförs från en ljuskälla och absorberas av fluoro-kromen som hamnar i den mer energirika fasen S1´. 2: Molekylen tappar lite
energi och hamnar i den stabila fasen S1. 3: Fluorokromen avger
energi för att återgå till vilofasen (15).
Fluorescensmikroskop
För att kunna se fluorescerande molekyler måste man nyttja ett
fluorescens-mikroskop. Detta mikroskop är uppbyggt som ett vanligt ljusmikroskop förutom att ljuset som belyser provet passerar genom två filter. Det första filtret som ljuset passerar innan det når provet släpper endast igenom ljus med våglängder som går att använda för excitation av fluorescens. Det andra filtret blockerar det exciterande ljuset och släpper endast igenom det specifikt emitterade ljuset. Efter det att ljuset passerat det första filtret når det en dikromatisk spegel som reflekterar ljus under en viss våglängd mot provet och som släpper igenom ljus med längre våglängd.
För att en fluorescerande molekyl ska bli synlig i fluorescensmikroskopet måste ett specifikt emissionsfilter för just denna molekyl användas. Då flera fluorokromer ska detekteras i samma prov får man ändra till filter som är specifika för de olika
emitterande våglängderna. Det finns även kombinationsfilter för att kunna detektera fluorokromerna samtidigt men signalerna uppfattas då oftast något svagare och granskningen måste kompletteras med filter för de specifika våglängderna för att bli tillräckligt tillförlitlig (15-16).
LSI MALT1 (18q21) Dual Color Break Apart Rearrangement Probe för att påvisa translokationen t(11;18)(q21;q21)
Det finns flera olika reagenskit för att påvisa translokationen t(11;18)(q21;q21). Ett av dessa är LSI MALT1 (18q21) Dual Color Break Apart Rearrangement Probe (Abbott Molecular Inc, Des Plaines, USA). Denna innehåller en mix av två prober som binder till specifika DNA-sekvenser. Den ena proben har en storlek på 460 kb och emitterar ljus vid 615 nm, vilket ger en orange färg. Denna probe binder till den sekvens av MALT1-genen som ligger närmast centromeren. Den andra proben har en storlek på 660 kb och emitterar grönt ljus vid 520 nm och binder till den sekvens av MALT1-genen som ligger mot telomeren. Detta medför att det blir en region på 65 kb mellan proberna och i denna region finns brytpunkterna i MALT1-genen. I en cell utan translokation av MALT1-genen syns från de båda kromosomerna 18 två gröna signaler som båda sitter tätt intill varsin orange signal (Figur 4). Då en translokation skett syns i kärnan en ensam orange signal i kromosom 18 och en ensam grön signal i kromosom 11 (Figur 5) (17).
Figur 5. En cellkärna där det skett en translokation
av MALT1-genen. Det syns då en grön och en orange signal var för sig. Sekvensen med orange signal är kvar i kromosom 18 medan sekvensen med grön signal har förflyttats till kromosom 11. Translokationen har påvisats med LSI MALT1 (18q21) Dual Color Break Apart Rearrangement Probe med FISH (17).
Figur 4. Cellkärnor med normal uppsättning
av MALT1-genen utan translokation. De båda gröna signalerna i varje kärna sitter intill signalerna med orange färg. Det påvisas med LSI MALT1 (18q21) Dual Color Break Apart Rearrangement Probe med FISH (17).
Syfte
Syftet med föreliggande studie var att studera utfallet av translokationer hos patienter som diagnostiserats för MALT-lymfom genom att påvisa lokalisationen av olika delar av MALT1 genen (18q21) med FISH teknik.
Material och metoder
Framtagning och behandling av patientmaterial
Materialet som användes i föreliggande arbete utgjordes av provexcisioner (px) från mag- och tarmkanalen. Ingreppet utfördes med hjälp av ett instrument, endoskop, som fördes ner genom munnen till magsäcken eller upp genom ändtarmsöppningen beroende på var provet skulle tas. Instrumentet består av en böjlig slang som är cirka 1 cm i diameter och cirka 1 m lång. Längst fram på instrumentet sitter en liten lins med belysning och en kamera så att läkaren kan bedöma var prover ska tas (18-19). Vävnadsbitarna som togs fixerades direkt i 4% buffrad formaldehyd för att förhindra autolysförändringar. På laboratoriet dehydrerades de sedan i maskin över natten. Vid dehydreringen gick proverna från lägre till högre koncentration alkohol för att vattnet i vävnaderna skulle avlägsnas. De placerades därefter i xylen, som är lösligt i både alkohol och paraffin, för att i sista steget kunna använda varm flytande paraffin för impregnering av vävnaden. Efter dehydreringen bäddades således vävnaden in i flytande paraffin för att sedan kunna snittas med mikrotom (20).
Det arkiverade provmaterialet utgjordes av px från 12 olika patientfall vid
Länssjukhuset i Kalmar. Åtta av proven var tagna från slemhinnan i ventrikeln, tre från tjocktarmslemhinnan och 1 fall var taget från tunntarmsslemhinnan. Samtliga fall hade fått diagnosen MALT-lymfom. Materialet snittades med mikrotomen inställd på 4 µm. Snitten placerades på en droppe destillerat H2O på objektglas Superfrost Plus Ultra (Histolab Products AB). Glasen lades sedan på en värmeplatta vid 45ºC för att snitten skulle sträckas. Glasen torkades i värmeskåp vid 60ºC över natten och inkuberades mörkt vid rumstemperatur i minst 24 timmar efter torkningen.
Förbehandling av snitt
Vid förbehandlingen av snitten användes Paraffin Pretreatment Reagens Kit (Abbott Molecular Inc, Des Plaines, USA) som är utformat för att ge optimal permeabilitet för Vysis® LSI® (Locus Specific Identifier) DNA Probes. Snitten avparaffinerades i xylen 2 x 5 minuter och rehydrerades i absolut alkohol (99,9%) 2 x 5 minuter och sattes sedan i värmeskåp vid 60ºC i 5 minuter för att torka. En markering runt snitten gjordes med en tandläkarborr, varefter glasen behandlades i 0,2 M HCL (aq) i 20 minuter. Glasen sköljdes i rinnande destillerat H2O i 3 minuter och i Pretreatment Wash Buffer i 5 minuter innan de behandlades i Pretreatment Solution vid 80ºC i 30
minuter. Därefter sköljdes glasen på samma sätt som tidigare. Inför
enzymbehandlingen togs överflödig vätska bort från glasen genom att glasets ände trycktes mot en pappersservett. De placerades direkt i Protease Solution vid 37ºC i 15 minuter och sköljdes sedan i Pretreatment Wash Buffer i 5 minuter. Snitten
dehydrerades i 2 minuter i vardera 70% alkohol, 95% alkohol och absolut alkohol och fick lufttorka stående mörkt vid rumstemperatur.
Beredning och applicering av probemix
För varje snitt blandades 7 µl LSI/WCP® Hybridization Buffer, 1 µl LSI MALT1 (18q21) Dual Color Break Apart Rearrangement Probe (Abbott Molecular Inc, Des Plaines, USA) samt 2 µl renat H2O (Apotekets). Röret centrifugerades i 1 minut vid 1000 g, vortexades och centrifugerades igen. Tio µl probemix placerades på ett täckglas av storleken 22 x 22 mm. Objektglaset sänktes, med snittytan nedåt, mot täckglaset och droppen spreds över snittet. Glaset förseglades med Fastik
gummiklister.
Denaturering och hybridisering
Vid denaturering och hybridisering användes instrumentet HYBriteTM från Vysis. Den fungerar som en fuktkammare med en platta som ändrar temperatur för optimal denaturering och hybridisering.
Fuktade papper lades på var sida om plattan i instrumentet som sedan värmdes till 37ºC. Glasen placerades på den förvärmda plattan och program 1 startades där denatureringen sker vid 75ºC i 5 minuter och hybridiseringen vid 37ºC i minst 16 timmar.
Stringenstvätt
Gummiförseglingen avlägsnades försiktigt från glasen och glasen ställdes i 2 x saline sodium citrate (SSC) innehållande 0,3% nonyl phenoxylpolyethoxylethanol-40 (NP-40) pH 7,2 (Post Hybridization Wash Buffer) innan de placerades i Post
Hybridization Wash Buffer vid 72ºC i 2 minuter. Glasen sattes sedan i 2 x SSC/0,1% NP-40 pH 7,1 i 1 minut och ställdes mörkt i rumstemperatur för att torka.
Motfärgning av cellkärnorna
För motfärgning av kärnorna användes en blandning av
4´,6-diamidino-2-phenylindole och 1,4-phenylenediamine i fosfat-buffrad saltlösning och glycerol (DAPI I Counterstain, Abbott Molecular Inc, Des Plaines, USA). För varje glas placerades 10 µl DAPI I Counterstain på ett täckglas av storlek 22 x 22 mm och objektglaset sänktes mot täckglaset så att droppen spred sig över snittet. Täckglaset förseglades med nagellack och placerades vid cirka -20ºC.
Bedömning av translokation på kromosom 18q21
Arkiverade glas som tidigare färgats med hematoxylin och eosin studerades för varje fall. Detta gjordes för att kunna göra en bedömning av var i snittet tumörcellerna var lokaliserade. Vid bedömningen av FISH användes fluorescensmikroskopet Axioskop 2 plus från Zeiss. Resultatet studerades vid förstoring 100x efter det att en droppe immersionsolja Immersol 518 F (Zeiss) placerats på glaset. De filter som användes var DAPI, sulforhodamine 101 acid chloride (Texas Red), Fluorescein Isothiocyanate (FITC), kombinationsfilter Texas Red/FITC samt översiktsfilter. Fyrtio tumörceller per fall bedömdes. Enligt the International System for Human Cytogenetic
Nomenclature (ISCN) måste fler än två celler visa samma kromosomala förändring för att få bedömas som positiv för den reciproka translokationen (21).
Kontroll
Ett glas med känd positiv kontroll togs med varje gång analysen utfördes och kontrollerades innan provmaterialet bedömdes.
Etiska aspekter
Materialet som användes i studien består av arkiverade vävnader från patienter. Då proverna togs har samtliga patienter informerats och gett sitt godkännande till att materialet får användas i detta syfte enligt Biobankslagen.
Det är viktigt att tänka på att det är en patient bakom varje prov och att man har tystnadsplikt för att skydda patientens integritet.
Resultat
Gensekvenser i MALT1 påvisades med FISH för att studera utfallet av
translokationen t(11;18)(q21;q21). Resultatet visade förekomst av translokationen i två fall. I det ena fallet var vävnaden tagen från ventrikelslemhinnan och i det andra från tunntarmslemhinnan.
Analysen utfördes på totalt tolv fall men endast i nio fall blev resultaten bedömbara i mikroskop. Några tydliga foton av dessa kunde dock ej erhållas.
Utfallet av translokation t(11;18)(q21;q21) blev således 22%.
Kontrollen utföll positiv samtliga gånger som resultatet av provmaterialet bedömdes.
Diskussion
Bedömning av utfallet t(11;18)(q21;q21)
Flera studier visar att utfallet translokationer av t(11;18)(q21;q21) ligger mellan ca 15-50% och att den förekommer i ventrikeln oftare än i andra organ med MALT-lymfom (6-7, 10, 21-25).
Resultatet i denna studie visade ett utfall av translokationen på 22%. Endast ett av sju fall från ventrikelslemhinnan var positiv, vilket är något mindre än vad som
förväntades. Däremot var fallet från tunntarmslemhinnan positiv. Dessa värden visar att det totala utfallet av translokationen blev som förväntat trots att antalet patientfall var lågt. Det behövs dock fler fall per specifikt organ för att kunna göra en
bedömning om var translokationen är mest förekommande.
Tre fall av samtliga tolv kunde inte bedömas. Den positiva kontrollen utföll positiv men dessa tre fall visade inga tydliga kärngränser samt att signalerna inte syntes tydligt. Eftersom kontrollen blev som förväntat kan det konstateras att det inte är något som gått fel under analysens gång. Den troligaste orsaken till att preparaten inte gick att analysera är att de inte fått någon optimal fixering.
Klinisk betydelse av translokationen t(11;18)(q21;q21)
Studier har visat att i ventrikeln förekommande MALT-lymfom, vilka är positiva för translokationen t(11;18)(q21;q21), inte svarar lika bra på behandling med antibiotika vid infektion av H. pylori. Detta kan förklara varför en infektion av H. pylori inte gått att behandla med antibiotika i ett tidigt stadium utan utvecklats till ett
MALT-lymfom.
Studier har också visat att MALT-lymfom som är positiva för denna translokation inte löper lika stor risk att utvecklas till DLBCL.
MALT-lymfom i tunntarmen kan orsakas av en infektion av C. jejuni. Men i detta fall brukar normalt inte behandling med antibiotika sättas in. Därför har
translokationen t(11;18)(q21;q21) inget behandlande värde i detta fall utan endast för diagnosbekräftelse och prognos för transformationsrisk till DLBCL (6-7, 10).
Patientprovet, som var taget från ventrikeln och var positivt för t(11;18)(q21;q21) visade vid tidigare bedömning samma histologiska bild som vid MALT-lymfom utan tecken på transformation till högmalign bild. Strukturer av H. pylori kunde inte påvisas. Detta innebär att det från början inte varit aktuellt med antibiotikabehandling mot H. pylori och därför har translokationen i detta fall inte någon behandlande betydelse. Det som är intressant är att det inte finns några tecken på transformation till DLBCL och med vetskapen om att translokationen t(11;18)(q21;q21) föreligger är risken liten även i framtiden att det utvecklas till högmalignt lymfom.
I det andra fallet, som var positivt för translokationen, var provmaterialet taget från tunntarmen. Detta innebär att det inte var aktuellt med antibiotikabehandling. Vid tidigare bedömning visade den histologiska bilden inte en klar diagnos för
MALT-lymfom då inga klassiska lymfoepiteliala lesioner kunde påträffas. Den övriga histologiska bilden talade däremot för att det handlar om ett lymfom. Genom analysen med FISH kunde det konstateras att translokationen t(11;18)(q21;q21) förelåg, vilket talar för MALT-lymfom. Detta medför att diagnosen är säkerställd och att risken för eventuell framtida transformation till DLBCL är liten.
Kontroll och felkällor
Det är mycket som kan påverka resultatet vid FISH. Det är därför viktigt att ha med en positiv kontroll för att kontrollera att analysens alla steg har fungerat så att bedömningen av resultatet blir tillförlitligt. I denna studie användes en positiv kontroll som bedömdes innan provmaterialet studerades. Det är också enkelt att se om de normala kärnorna i preparaten har förväntade signaler för att sedan kunna göra en tillförlitlig bedömning av tumörcellerna.
Om vävnadspreparatet inte genomgått optimal fixering och dehydrering kan analysen misslyckas. Det är också viktigt att det inte finns något vatten kvar under snittet då detta kan medföra att snittet lossnar från objektsglaset vid förbehandlingen. Felaktiga temperaturer eller tider kan också ge misslyckat resultat. Det är därför viktigt att kontrollera alla temperaturer innan analysen påbörjas och att man maximalt har fyra objektglas i kyvetterna för att temperaturen inte ska sjunka för mycket.
Temperaturerna får skilja maximalt ± 1ºC för att analysen ska fungera. Stringensen påverkas av jonkoncentration, pH, tid och temperatur. En ökad jonkoncentration och minskad temperatur medför en minskad hybridiseringsstringens och tvärtom.
Alternativa metoder
Det förekommer alternativa metoder för denna analys. De fluorescerande
molekylerna kan ersättas med andra kromogen, så kallad CISH (Chromogenic in situ hybridization), eller med radioaktiva markörer.
En annan detektionsmetod för gener är PCR (Polymerase Chain Reaction). Metoden går ut på att mångfaldiga en specifik DNA-sekvens. Det fungerar genom upprepade cykler av temperaturväxlingar. Specifika DNA-sekvenser (primrar) hybridiseras till de båda ändarna på den sökta sekvensen och med hjälp av specifikt DNA-polymeras och trideoxynukleotider bildas kopior av denna sekvens. För varje cykel fördubblas antalet kopior, och den stora mängden bildade kopior medför att deras sekvenslängd enkelt kan anlyseras och därmed kan ev translokation identifieras (26). Fördelen med in situ hybridisering är att den kan detektera DNA direkt i histologiska preparat, vilket inte är möjligt med PCR. Metodens svaghet är att den inte är lika känslig som PCR.
Slutsats
Syftet med föreliggande studie var att påvisa MALT1-genen (18q21) hos patienter som diagnostiserats för MALT-lymfom för att bestämma utfallet av translokationen t(11;18)(q21;q21). Denna specifika translokation har betydelse för både diagnostisk
verifiering, bedömning av behandlingseffekter samt riskprognos för utveckling till DLBCL. Detta eftersom translokationen endast förekommer vid MALT-lymfom och i de fall den förekommer har antibiotikabehandling inte någon effekt vid H. pylori-infektion samt att risken för transformation till DLBCL är liten.
Utfallet av translokationen t(11;18)(q21;q21) blev 22%, vilket stämmer överens med resultat från liknande studier.
Tackord
Ett stort tack till min handledare Tomasz Gorecki på Klinisk Patologi/Cytologi i Kalmar som har väglett och stöttat mig under mitt examensarbete. Ett tack även till Charlotte Bergström, Gudrun Holmsten samt övrig personal på laboratoriet för Klinisk Patologi/Cytologi i Kalmar som även de på olika sätt hjälpt mig med mitt arbete. Jag vill också tacka Anki Koch-Schmidt på Naturvetenskapliga Institutionen vid Högskolan i Kalmar för hjälpen med den skriftliga delen.
Referenser
1. http://www.internetmedicin.se/dyn_main.asp?page=587, 080501; 17.30. 2. Agger R, Anderssen V, Leslie G, Aasted B. Immunologi. 1:a uppl. Lund:
Studentlitteratur, 2006. .
3. http://ki.se/ki/jsp/polopoly.jsp?d=1761&a=3552&l=sv, 080517; 15.30. 4. http://www.vardguiden.se/templates/Article.aspx?Articleid=3056, 080517;
16.00.
5. Rubin E. Essential Pathology. 3rd edition. Philadelphia: Lippincott Williams & Wilkins, 2001.
6. Cohen SM, Petryk M, Varma M, Kozuch PS, Ames ED, Grossbard ML. Non-Hodgkin´s Lymphoma of Mucusa-Associated Lymfoid Tissue. Oncologist 2006; 11:1100-1117.
7. Inagaki H. Mucosa-associated lymfoid tissue lymphoma: Molecular pathogenesis and clinicopathological significance. Pathology International 2007; 57:474-484. 8. http://www.karolinska.se/templates/Page.aspx?id=37889&epslanguage=SV, 080507; 19.20. 9. http://www.cancerfonden.se/templates/Information___388.aspx?fulltext=1, 080501; 18.15.
10. Bacon CM, Du M-Q, Dogan A. Mucosa-associated lymfoid tissue (MALT) lymphoma: a practical guide for pathologists. Journal of Clinical Pathology 2007; 60:361-372.
11. Certificate of Analysis Paraffin Pretreatment Reagent Kit. Abbott Molecular Inc, Des Plaines, 2006.
12. http://zytovision.com/zytolightmanuals/ZytoLight_Manuals_Swedish/Z-2020-CE-IVD-Swe.pdf, 080425; 10.00.
13. http://sv.wikipedia.org/wiki/Stringens, 080425; 10.30.
14. http://www.ki.se/odont/cariologi_endodonti/Exarb1999/Fadi_Somie.pdf, 080425; 20.15. 15. http://www.iob.uio.no/forskning/celler/teknikk/fluorescens.html 080501; 15.30.
16. Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. Molecular Biology of the Cell. 4th edition. New York: Garland Science, 2002.
17. http://www.abbottmolecular.com/LSIMALT1(18q21)DualColorBreakApartR earrangementProbe_5479.aspx, 080424; 20.45. 18. http://www.sjukvardsradgivningen.se/artikel.asp?CategoryID=28702&PreVie w=, 080422; 16.10. 19. http://www.sjukvardsradgivningen.se/artikel.asp?CategoryID=28534&PreVie w=, 080422; 16.15.
20. Wickman-Bergström C. Histologiska tekniker. Kalmar: Högskolan i Kalmar, 2003.
21. Tibiletti MG, Milani K, Martin V, Zucca E, Motta T, Cortelazzo S. et al. Chromosome instability and translocation t(11;18) in primary gastric marginal zone B-cell lymphoma of MALT-type. Wiley InterScience, Hematological Oncology 2007; 25:184-188.
22. Streubel B, Huber D, Wöhrer S, Chott A, Raderer M. Frequency of Chromosomal Aberrations Involving MALT1 in Mucosa-Associated
Lymphoid Tissue Lymphoma in Patients with Sjögren´s Syndrome. Clinical Cancer research 2004; 10:476-480.
23. João C, Farinha P, da Silva MG, Martins C, Crespo M, Cabeçadas.
Cytogenetic abnormalities in MALT lymphomas and their precursor lesions from different organs. A fluorescence in situ hybridization (FISH) study. Histopathology 2007; 50:217-224.
24. Remstein ED, James CD, Kurtin PJ. Incidence and Subtype Specificity of API2-MALT1 Fusion Translocations in Extranodal, Nodal, and Splenic Marginal Zone Lymphomas. American Journal of Pathology 2000; 156:1183-1187.
25. Zhang W, Garces J, Dong HY. Detection of the t(11;18) API2/MALT1 Translocation Associated With Gastric MALT1 Lymphoma in Routine Formalin-Fixed, Paraffin-Embedded Small Endoscopic Biopsy Specimens by Robust Real-Time RT-PCR. American Journal of Clinical Pathology 2006; 126(6):931-940.
26. http://www.genteknik.nu/index.asp?id=570&typ=print, 080518; 16.30.
I
Bilaga 1
Kemikalier och lösningsberedningar
Kemikalier/Reagens
Kemikalie Kemisk formel Artikelnr. Leverantör
Xylen C6H4(CH3)2
Absolut etanol C2H5OH 95% etanol C2H5OH 70% etanol C2H5OH Saltsyra, koncentrerad HCl
Paraffin Pre-treatment Kit 32-801200 Vysis/Abbott Molecular Inc. Des Plaines, USA 20 x Saline Sodium Citrate,
SSC Na3C6H5O7 32-804850 Vysis/Abbott Molecular Inc. Des Plaines, USA Nonyl
Phenoxylpolyethoxylethanol, NP-40
32-804818 Vysis/Abbott Molecular Inc. Des Plaines, USA LSI® MALT1 Dual Color
Break Apart Probe Kit 32-190055 Vysis/Abbott Molecular Inc. Des Plaines, USA DAPI I Counterstainer 32-804830 Vysis/Abbott Molecular Inc. Des Plaines, USA
Lösningar/Reagensberedning 0,2 M HCl (aq)
Saltsyra, koncentrerad 17 ml
Fyll en 1000 ml mätkolv till minst ¾ med aq. dest. Tillsätt koncentrerad saltsyra under stor försiktighet. Fyll till 1000 ml med aq. dest.
Paraffin Pre-Treatment Kit
Pretreatment Wash Buffer (2 x SSC, pH 7,0) Pre-treatment Solution (NaSCN)
Protease Buffer (NaCl, pH 2,0)
Protease (Pepsin A, 2500-3000 U/mg protease, frystorkad)
Protease förvaras i frys vid cirka -20ºC. Övriga lösningar förvaras i kylskåp vid ca 8ºC.
Beredning av Protease Solution
Ta en flaska Protease Buffer och häll i en 50 ml kyvett och placera i vattenbad för uppvärmning till 37ºC. När lösningen nått 37ºC ± 1ºC tas ett rör med Protease ur frysen. Lös innehållet med den uppvärmda bufferten genom att suga upp buffert med
en pasteurpipett och spruta ner i röret. Sug upp innehållet med pasteurpipetten och blanda ner i kyvetten.
LSI® MALT1 (18q21) Dual Color Break Apart Probe Kit
LSI DNA Probe (Fluorescensmärkta specifika prober med DNA-blockering i TRIS- EDTA buffert)
LSI/WCP® Hybridization Buffer (Dextransulfat, formamid och SSC, pH 7,0)
20 x SSC pH 5,3
SSC 66g Lös saltet med 200 ml aq. dest. Mät pH och justera till 5,3 med koncentrerad saltsyra. Fyll till 250 ml med aq. dest. Lösningen förvaras i rumstemperatur och är hållbar i 6 månader.
2 x SSC/0,3% NP-40 pH 7,0-7,5
20 x SSC pH 5,3 100 ml
NP-40 3 ml
Blanda 20 x SSC och NP-40 i 800 ml aq. dest. Mät pH och justera till pH 7,0-7,5 med NaOH. Fyll till 1000 ml med aq. dest. Lösningen förvaras i rumstemperatur och är hållbar i 6 månader.
2 x SSC/0,1% NP-40 pH 7,0-7,2
20 x SSC pH 5,3 50 ml
NP-40 0,5 ml
Blanda 20 x SSC och NP-40 i 400 ml aq. dest. Mät pH och justera till pH 7,0-7,2 med NaOH. Fyll till 500 ml med aq. dest. Lösningen förvaras i rumstemperatur och är hållbar i 6 månader.
Miljöaspekter
Kemikalierna hanteras med varsamhet. Häll xylen i avsedd vask.
Referenser
Certificate of Analysis Paraffin Pretreatment Reagent Kit, 32-801200. Abbott Molecular Inc. 2006.
Certificate of Analysis Vysis® LSI® DNA Probes, 30-608314. Abbott Molecular Inc. 2007.