Innehållsförteckning
1 Inledning ..… … … 1
1.1 Bakrund ..… … … .. 2
1.1.1 Kolera … … … .. 2
1.1.2 Vibrio Cholerae 01 … … … ... 3
1.1.3 Immunförsvarets respons vid exponering av naturligt förekommande Vibrio Cholerae 01 … … … 4
1.1.4 Kolera toxinet (CT) … … … .. 4
1.1.5 Kolera toxinets induktion till intracellulära signaler … … … 5
1.1.6 Recombinant Kolera Toxin, subenhet B (rCTB) … … … . 7
1.1.7 Vaccinet Dukoral ® … … … . 8 1.2 Syfte… … … ... 8 1.3 Avgränsningar … … … ... 9 2 Metod … … … . 9 2.1 Angreppssätt … … … .. 9 2.1.1 Observationer … … … ... 9 2.1.2 Litteraturstudier … … … 9 2.1.3 Databearbetning … … … ... 10
2.2 Validitet och reliabilitet … … … 10
2.3 Teoretisk referensram för duglighetsanalys/processkapabilitetsstudie … … … . 10
2.3.1 Statistisk processtyrning … … … .. 10
2.3.2 Variation i processer … … … 12
2.3.3 Styrdiagram för väntevärde och spridning … … … ... 13
2.3.3.1 Styrgränser för väntevärdesdiagram … … … 13
2.3.3.2 Styrgränser för spridningsdiagram … … … .. 15
2.3.3.3 Utvärdering av styrdiagram … … … 15
2.3.4 Processkapabilitet / duglighet … … … .. 15
2.3.4.1 Utvärdering av processkapabilitetsindex … … … . 18
3 Tillverknings processen för monovalent bulk rCTB-213 … … … . 18
3.1 Tillverkare … … … . 18
3.2 Tillverkningsmetod … … … ... 19
3.3 Flödes schema över produktionsprocessen av Monovalent bulk, rCTB-213 … … … 20
3.4 Beskrivning av produktionsprocessen … … … .. 21 3.4.1---… … … . 21 3.4.2 Fermentering … … … 21 3.4.2.1 Ympodling … … … ... 22 3.4.2.2 Huvudodling … … … . 22 3.4.3 Skördesteg… … .… … … 22 3.4.4 Reningssteg… … … … .. 23 3.4.5 Reningssteg … … .… … … . 23 3.4.6 Reningssteg … … … .. 23 3.4.7 Reningssteg … … … ... 23 3.4.8 Reningssteg … … … .. 24
3.4.9 Sterilfiltrering och fyllning … … … .. 24
4 In-processkontroller för tillverkningsprocessen av Monovalent bulk, rCTB-213 … … … . 24
4.1 Flödes schema med utsatt in-processkontroller … … … ....… … … 24
5 Kritiska parametrar för tillverkningsprocessen av Monovalent bulk, rCTB-213 … … … . 24 5.1 --- … … … . 24 5.2 Fermentering … … … . 24 5.2.1 Ympodling … … … ... 25 5.2.2 Huvudodling … … … . 25 5.3 Skördesteg… … … .. 25 5.4 Reningssteg … … … ... 25 5.5 Reningssteg … … … ... 25 5.6 Reningssteg… … … … … … ... 25 5.7 Reningssteg … … … 25 5.8 Reningssteg … … … ... 25
5.9 Sterilfiltrering och fyllning … … … ... 25
6 Analys och resultat … … … .. 26
Utvärdering av tillverkningsprocessen för monovalent bulk rCTB-213 under perioden februari 2004 – juni 2005 för tillverkningsbatcherna RC20401-RC20519 6.1 Sammanställning av produktionen … … … 26
6.2 Erhållna mängder rCTB för respektive processteg … … … ... 26
6.3 Skördesteget… … … … .… … … .. 26
6.3.1 Samband vid skördesteget… … … … .… … … 26
6.4 Huvudodlingssteget … … … .. 27
6.4.1 Black-box modellen … … … . 27
6.4.2 Råvaran casaminosyra … … … . 27
6.4.3 Temperatur, pH-värde och andelen löst syre i BR600 under februari 2004-juni 2005… … … ... 28
6.4.3.1 Kontroll av normalfördelning … … … .. 28
6.4.3.2 Skattning av processkapabilitet … … … 29
7 Diskussion … … … . 29
7.1 Studiens resultat … … … 30
8 Slutsatser och rekommendationer … … … .. 30
8.1 Huvudodling och skörd … … … . 30
8.2 Processkapabilitet … … … .. 30
9 Definitioner … … … 30
10 Referensförteckning … ... 32 Bilagor
1 Inledning
Vid Unitech Biopharma, Matfors (Sverige) sker tillverkning av rekombinant Kolera Toxin subenhet B (rCTB-213), vilket är en av de aktiva substanserna i vaccinet Dukoral®.
Unitech Biopharma AB är ett bioteknikföretag fokuserade på legotillverkning av rekombinanta proteiner och tillverkar rCTB för SBL Vaccin AB Solna, (Sverige). Anläggningen där tillverkningen av denna produkt sker har alla nödvändiga tillstånd (Läkemedelsverket, Länsstyrelsen,
Arbetsmiljöverket) och uppfyller gällande cGMP-krav samt är godkänd av läkemedelsmyndigheterna i EU och Kanada, WHO samt i ytterligare ca 35 andra länder.
Dukoral® är ett drickbart vaccin som stimulerar immunförsvaret i tarmen och skapar ett bra skydd mot sjukdomen kolera. Vaccinet ger även skydd mot enterotoxinbildande stammar av Escherichia coli (ETEC) vars värmekänsliga toxin (LT) delvis liknar koleratoxinet både strukturellt, funktionellt och immunologiskt[34]. Vaccinet består förutom rCTB av tre olika stammar inaktiverade Vibrio Cholerae bakterier, vilka produceras vid SBL-vaccin AB, där även slutformulering av vaccinet sker.
Tillverkningsprocessen av Monovalent bulk rCTB-213 sker genom mikrobiell fermentering av en genetiskt modifierad produktionsstam av Vibrio Cholerae, där huvudodlingssteget sker i 500 liters skala där hela tillvekningsprocessen sker under Good Manifacturing Practise (GMP) förhållanden för att garantera en säker, effektiv och kvalitetsmässigt bra produkt.
Målet med detta examensarbete är att upprätta en processbeskrivning för tillverkningsprocessen av Monovalent bulk rCTB-213. Beskrivningen skall baseras på den process som görs idag och innefatta respektive processtegs mål, teori och kritiska parametrar.
Den kunskap som skapas genom att definiera och kartlägga (dvs. dokumentera arbetsflödet) i en process har ett stort värde i sig, den är dessutom en utomordentlig plattform för förbättringsarbete genom att den skapar en gemensam bild av vad som sker i processen i dag.
I detta examensarbete sker även en sammanställning av produktionen av Monovalent bulk rCTB-213 för perioden februari 2004 - juni 2005.
Fakta om hur processen tidigare har betett sig måste användas som bas för förbättringsarbete[1]. För att se om eventuell förekomst av variation för enskilda variabler kan urskiljas, utvärderas processdata för variabler som dokumenterats av företaget för batcher tillverkade under perioden februrari 2004 tom. juni 2005.
Under fermentationssteget regleras parametrarna temperatur, pH och andelen löst syre i
huvudfermentorn för att upprätthålla optimal fysisk miljö för tillväxt och rCTB produktion. För att få en uppfattning om hur dessa parameterar förhållit sig vid odlingar som utförts under perioden februari 2004 – juni 2005 utvärderas dessa variabler via duglighetsanalys/processkapabilitetsstudie (Cpk). I denna studie beräknas de korrigerade duglighetsindexen för de ovan nämda parametrarna, där den naturliga spridningen för processen sätts i förhållande till vilka gränser som är angivna i
registreringsdokument (Process Manifacturing Description) för att få en uppfattning om det som är angivet i registrerings- dokument efterlevs.
1.1 Bakrund
1.1.1 Kolera
Kolera är en livshotande epidemisk sjukdom orsakad främst av bakterien Vibrio Cholerae 01. Kolera förekommer främst i länder som saknar rinnande vatten och sanitär utrustning, men förekommer även då och då i i-länder. Infektionen har funnits som endemi i Indien ända sedan 1500-talet men
invaderade inte andra områden förrän den första pandemin bröt ut år 1817 och spreds därefter successivt till andra delar av världen. Det har totalt varit sju stora pandemier som skördat miljontals med människoliv, där den senaste tog fart i Indonesien 1961 och pågår fortfarande främst i Afrika och
Asien men har även invaderat Europa, Nordamerica och Japan i begränsad omfattning[2]. (Se figur 1)
Figur 1. Utbredning av kolera år 2004-2006[3].
Bakterierna överförs till människa via kontaminerat vatten eller mat och inkubationstiden varierar mellan 6-48 timmar [4]. Bakterierna fäster sig i tunntarmen där de bildar kolonier och avger
enterotoxinet Koleratoxin (CT), som binder till receptorer i tunntarmens epitelceller och orsakar de för sjukdomen karaktäristiskt vattniga diarrérna. Andra symptom som följer med infektionen är
kräkningar, kramper och feber[5]. De stora förlusterna av salter och vätska leder till törst, muskelkramper, svag puls, förlorat turgortryck hos cellerna och insjunkna ögon[4].
1.1.2 Vibrio Cholerae 01
Vibrio Cholerae isolerades första gången i renkultur av Robert Koch 1883, men hade observerats redan 1854 av bla. Pacini.
Bakterierna är gram-negativa med lätt böjd stavform och försedda med en enkel polär flagell, vilket gör dem rörliga. Bakterierna har enkla näringskrav och kan växa till i media innehållande en oorganisk kvävekälla . V. Cholerae växer till snabbt med en generationstid på mindre än 30 minuter i passande media och kan växa anaerobt men uppnår högre celldensiteter vid kraftig syresättning av mediet. Bakterierna är känsliga för låga pH-värden och dör snabbt vid pH<6, men tåliga mot alkaliska miljöer[4].
Bakterierna har en eller flera faktorer som gör att de kan fästa sig i tunntarmens microvilli, som vanligtvis inte innehåller så mycket bakterier pga. de peristaltiska rörelserna och det slem som de är försedda med. Bakteriernas rörelseförmåga i kombination med dess produktion av enzymer som bryter ned slemmet i tunntarmen, samt den mekanism den antar för att fästa sig, som troligtvis utgörs via toxin-corregulated pili med inblandning av flera hemaglutininer gör att de kan etablera sig och bilda kolonier[4].
Figur 2. Elektronmikroskåp fotografi på Vibrio Cholerae som bildat kolonier i epithelcellerna på kanin[4].
Vibrio Cholerae 01, karaktäriseras av att vara agglutinerande i 0 grupp 1-specifikt antiserum riktat mot det dominerande endotoxinet på bakeriernas yta[6]. Vibrio Cholerae 01 delas in i serotyperna Inaba och Ogawa vilka skiljs åt via antikroppstester mot lipopolysackarid kapseln. Gruppen Cholerae har ett gemensamt antigen A och serotyperna skiljs åt via de typspecifika antigenen B för Ogawa (som har metylerad terminal på perosaminet[6]) och C för Inaba (saknar metylering på perosaminets terminal[6]). Ytterligare en serotyp, Hikojima med typspecifikt antigen B och C finns men är inte så vanligt
förekommande[4]. Serotyperna delas in i biotyperna Klassisk och E1 Tor vilka skiljer sig åt i dess förmåga att agglutinera erythrocyter från kyckling, där E1 Tor stammen har förmåga medan den Klassiska biotypen saknar den[6]. Gruppen Vibrio Cholerae har även gemensamma antigen på flagellen, somatiska antigen, yttre membran proteiner och enterotoxinet Kolera Toxin (CT) [4].
1.1.3 Immunförsvarets respons vid exponering av naturligt förekommande Vibrio Cholerae 01
Det ospecifika immunförsvarets respons vid infektion av V. Cholerae involverar tarmrörelse, högre produktion av slem och magsyra samt de akuta tömningarna av tarmen. Eftersom bakterierna är syrakänsliga är kroppens försvarsmekanism att producera magsyra ett relativt effektivt sätt att försöka förhindra att bakterierna bildar kolonier i tunntarmen, och studier tyder på att personer med högre magsyra produktion är mer resistenta mot kolera än personer med mindre produktion av magsyra[4]. Det mest effektiva sättet för kroppen att skydda sig mot bakterie infektioner är via antigen-antikropps reaktioner. I vilken utsträckning denna försvarsmekanism fungerar beror av hur väl kroppens
immunförsvar känner igen de antigen som är kopplat till patogenen den exponeras för.
För att bakterierna ska kunna bilda kolonier måste de först fästa sig vid en yta. Immunoblobulin A (IgA) antikroppar reagerar med antigen hos bakterierna, som då blir täckta av antikroppar och tappar förmågan att fästa sig[2]. Människans resistens mot kolera är relaterad till i vilken utsträckning som lokala IgA antikroppar mot bakterierna och/eller endotoxinet Koleratoxin finns tillgängliga. IgA antikropparna kan neutralisera CT och/eller förhindra att bakterierna eller toxinet fäster sig i
tunntarmen[4]. Även cirkulerande Vibriocidala antikroppar mot flera antigen hos organismerna inkl. CT, somatiska 0 antigen och antigen på flagellen har även detekteratats efter naturliga infektioner, men dessa antikroppars påverkan vad det gäller immunitet mot infektionen är ännu inte fastställd[7]. Av någon oförklarad anledning är personer med blodgrupp 0 mer mottagliga för infektionen än andra [6].
1.1.4 Koleratoxinet (CT)
Vibrio Cholerae producerar i sitt naturliga tillstånd bla. enterotoxinet Koleratoxin, vilket är den virulenta faktorn hos bakterierna och som ger upphov till de för sjukdomen karraktäristiska diarrerna. Kolera toxinet består av en A subenhet med en molekylvikt på 28 kDa, samt fem B subenheter om ca: 11,6 kDa vardera. A subenheten är bunden till B pentameren via icke-kovalenta interaktioner och är troligtvis delvis placerad i B pentamer ringens mitt. Båda dessa subenheter svarar för olika aktiviteter vid inducering av de allvarliga diarrérna.
B subenheten svarar för den bindande aktiviteten och är även den mest immunologiskt aktiva delen av toxinet, medan A subenheten svarar för den enzymatiska aktivitet som gör molekylen toxisk[4].
A enheten består av en aktiv A1 subenhet om 23,5 kDa samt en A2 subenhet om 5,5 kDa. A2 enheten binder B pentameren till A1 enheten genom icke-kovalenta interaktioner medan de båda
beståndsdelarna i A enheten hålls samman via disulfidbindning[4] (se figur 3). Generna som kodar för A subenheten respektive B subenheten ligger på V. Choleraes kromosom, inom samma operon med A cistronen (ctxA) följt av B cistronen (ctxB) och studier tyder på att de klassiska biotyperna har två kopior av ctx. AB medan E1 Tor biotypen endast har en kopia[8]. Vibrio Cholerae avger CT över det yttre plasmamembranet till omgivningen troligtvis via någon form av interaktioner mellan membranet och B subenhetens domäner[8]. Ctx. operonen har två Ribosombindandesites (RBS), en som ligger uppströmms i den A kodande regionen och en som ligger uppströmms i den B kodande regionen. RBS i den B kodande regionen är minst sju gånger starkare än den som ligger i den A kodande regionen vilket gör att V. Cholerae uttrycker toxinet i proportionen 1A:5:B. Transkriptionen av ctx. AB
operonen regleras av flera olika signaler från omgivningen som temperatur, pH, osmolaritet och vissa aminosyror[7].
1.1.5 Koleratoxinets induktion till intracellulära signaler
Kolera toxinet binder specifikt till GM 1 gangliosid receptorerna i tarmarnas epithelceller via B subenheten. A1 enhetens enzymetiska aktivitet inducerar en kaskadreaktion som resulterar i höga koncentrationer av cyklisk adenosin monofosfat (cAMP)[4]. cAMP fungerar som en andra budbärare och har i epithelcellerna till uppgift är att stimulera aktiv transport av Na+ över plasma membranet[10]. Resultatet av de förhöjda koncentrationerna av cAMP blir att joner flödar ut ur cellerna och pga. det osmotiska trycket passerar även vatten ut i tarmarna och orsakar på detta vis de kraftiga diarrérna, som volymmässigt kan bestå av upp till ca: 20 l vätska och elektrolyter per dag[4].
Mekanismen kan beskrivas genom följande händelseförlopp:
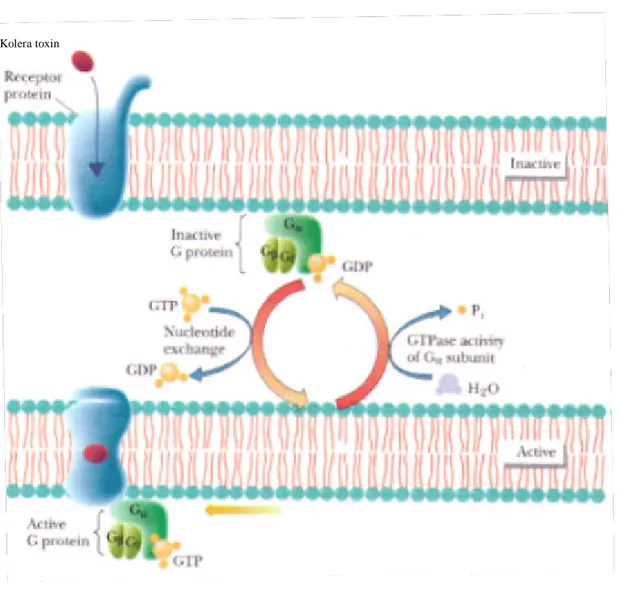
Kolera Toxinet binder till oligosackaridendelen av hos GM 1 gangliosiden på epithecellens yta. Efter bindningen sker en konformationsändring av CT, vilket gör det möjligt för toxinet att överlämna A subenheten till cell ytan. A enheten tränger in i cellens plasmamembran, där disulfidbindningen mellan A1 och A2 enheten reduceras av intracellulära glutathione, vilket gör att dessa två enheter frigörs från varandra. A1 överför enzymatiskt Nikotinamid adenin dinukleotid (NAD+) till produkterna Adenosin monofosfat-ribos (ADP-ribos) och nikotinamid[4] (se figur 4).
Till plasmamembranet är Guanosin nukleotid bindande protein (G protein) och adenylatcyclas bundna. G proteinet består av tre subenheter a, ß och ? (se figur 5). Detta protein kan antingen befinna sig i ett aktivt tillstånd eller i ett inaktivt tillstånd. När proteinet är aktivt är Guanosin trifosfat (GTP) bundet till G proteinets a enhet och komplexet innehar GTPase aktivitet, vilket innebär att GTP kan
hydrolyseras till Guanosine Difosfat (GDP) som är den inaktiva formen av molekylen.
Figur 5. Aktivering av G- protein. Den inaktiva formen av G- proteinet är en trimer som består av en
a, ß och ? subenhet där GDP är bundet till a subenheten. Vid aktivering binder istället GTP till a subenheten som via dess GTPase aktivitet hydrolyserar till GTP till GDP och blir inaktivt [10].
ADP-ribos dvs. en av de produkter som A1 enheten ger upphov till binder till G proteinet a enhet, som då förlorar sin GTPase aktivitet och förblir aktivt.
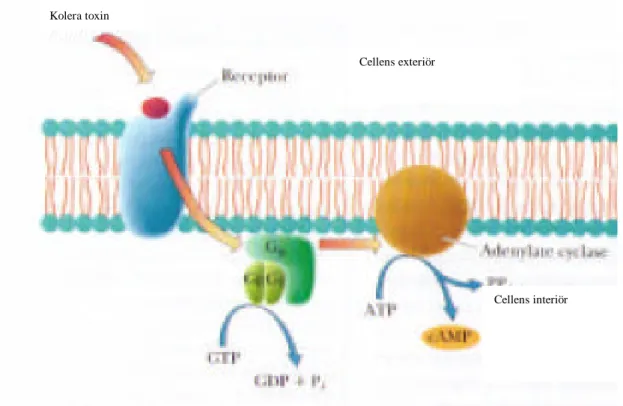
När G proteinet är aktivt medlar den aktivitet till Adenylat cyclas vilket är ett enzym som katalyserar reaktionen (Adenosin trifosfat) ATP till cAMP(se figur 6). Det aktiva G proteinet och de höga koncentrationerna av cAMP resulterar i stimulans av jonpassage och vatten ut från epithelcellernas interiör[10].
Figur 6. Koler toxinet binder till receptor på plasmamembranets yta och medlar aktivitet till Adenylat cyclas via G-proteinet. Adenylat cyclas katalyserar då reaktionen ADP till cAMP.
1.1.6 Recombinant Kolera Toxin, subenhet B (rCTB) (se figur 7) --- Figur 7. CTB pentameren [11]. Kolera toxin Cellens exteriör Cellens interiör
1.1.7 Vaccinet Dukoral ®
Det orala vaccinet Dukoral (ATC-kod J07A E01) [12] är utveckat för aktiv immunisering mot sjukdom orsakad av Vibrio Cholerae serogrupp 01 hos vuxna och barn från 2 år. Vaccinet stimulerar
immunförsvaret i tarmen[12] och framkallar antikroppar mot nedanstående aktiva innehållsämnen[13]. Vaccinsuspensionen innehåller förutom de aktiva substanserna natriumdivätefosfat,
dinatriumvätefosfat, natriumklorid och vatten. Denna suspension blandas i ett glas vatten med ett brusgranulat som består av natriumbikarbonat, citronsyra, natriumkarbonat, sackarinnatrium,
natriumcitrat och hallonarom. Denna lösning intas oralt och förväntas ge skydd mot kolera en vecka efter avslutad grundvaccination[12].
De aktiva innehållsämnena i en dos om 3ml av vaccinet är:
Vibrio Cholerae 01 Inaba klassisk biotyp, värme-inaktiverade ~2,5·109 Vibrios (före inaktivering) Vibrio Cholerae 01 Inaba E1 Tor biotyp, formalin-inaktiverade ~2,5·109 Vibrios (före inaktivering) Vibrio Cholerae 01 Ogawa klassisk biotyp, värme-inaktiverade ~2,5·109 Vibrios (före inaktivering) Vibrio Cholerae 01 Ogawa klassisk biotyp, värmeinaktiverade ~2,5·109 Vibrios (före inaktivering) Recombinant cholerae toxin, subenhet B (rCTB) 1mg
(producerat i Vibrio Cholerae 01 Inaba, klassisk biotyp stam 213)
För vuxna och barn från 6 år är grundvaccinationen 2 doser som tas med 1-6 veckors mellanrum och för att upprätthålla skyddet rekommenderas en boosterdos efter 2 år. Om upp till 2 år har gått sedan den senaste vaccinationen räcker det med en dos. Om mer än 2 år har gått sedan den senaste
vaccinationen, bör grundvaccinationen om 2 doser förnyas[12].
För barn mellan 2-6 år är grundvaccinationen 3 doser som tas med 1-6 veckors mellanrum och för att upprätthålla skyddet rekommenderas en boosterdos efter 6 månader. Om upp till 2 år har gått sedan den senaste vaccinationen räcker det med en dos. Om mer än 2 år har gått sedan den senaste
vaccinationen, bör grundvaccinationen om 3 doser förnyas[12].
1.2 Syfte
Målet med detta examensarbete är att upprätta en processbeskrivning för tillverkningsprocessen av Monovalent bulk rCTB-213. Beskrivningen skall baseras på den process som görs idag och innefatta respektive processtegs mål, teori och kritiska parametrar. Samband mellan processparametrar och processtegets syfte skall utvärderas utifrån processdata för tillvekningsbatcher körda under februari 2004 – juni 2005. Processkapabilitet (Cpk) skall beräknas för processtegen för att få en uppfattning om hur bra tillverkningen gått i förhållande till satta gränser.
1.3 Avgränsningar
Eftersom rCTB formuleras under huvudodlingssteget och eftersom utbytet över detta processteg styr den maximala mängden produkt som går vidare till de följande reningsstegen i processen, beslutades att duglighetsstudien skulle baseras på parametrar som är viktiga under detta processteg.
Duglighetsanalysen avgränsades till att utföras på parametrarna temperatur, pH och andelen löst syre i fermentorn under huvudodling. Dessa parameterar är viktiga för att upprätthålla fysiskt optimal miljö för bakterierna. I duglighetsanalysen skattas dugligheten mot de värden som angivits i
registeringsdokumentet, Process Manifacturing Description för att få en uppfattning om det som registrerats till myndigheten efterlevs. Dessa parametrar loggas och dokumenteras med jämna
tidsintervall under hela processteget för varje tillverkningsbatch, vilket även gör det praktiskt möjligt att utföra studien, då data för de studerade parametrarna finns tillgänglig för hela perioden.
Eftersom förlusterna av produkt varit störst under skördesteget beslutades att teoridelen för detta processtegen skulle erhålla mest fokus.
Eftersom det påvisats en nedgång i utbytet över huvudodlingssteget under den senare delen av perioden som studerats (februari 2004-juni 2005) och eftersom förlusterna av rCTB är störst över skördesteget beslutades att utvärdering av processparameterfilen (insamlad data för olika variabler för respektive processteg för tillverkningsprocessen av monovalent bulk rCTB-213) skulle avgränsas till att fokuseras på dessa processteg, för att undersöka hurvida urskiljbar variation för enskilda variabler föreligger under perioden.
2 Metod
2.1 Angreppssätt
För att få förståelse för tillverkningsprocessen av Monovalent bulk rCTB-213 upprättas en processbeskrivning där varje processteg beskrivs med syfte, utförande samt identifierade kritiska parametrar för respektive processteg.
2.1.1 Observationer
För att lättare kunna koppla den teoretiska studien till hur processen ser ut och fungerar i praktiken observerades operatörernas förfarande under en tillverkningsbatch av Monovalent bulk rCTB-213. För att få så mycket kunskap som möjligt om den undersökta processen ställdes så mycket frågor som möjligt till alla i organisationen.
2.1.2 Litteraturstudier
För att få en teoretisk insikt i processen studerades satsprotokoll, interna rapporter som
valideringsrapporter, rapporter från processutveckling, tekniska rapporter, processparameterfiler (bestående av insamlad data för viktiga parametrar för respektive processteg) och rapporter för kritiska parametrar för tillverkningsprocessen av monovalent bulk rCTB-213.
Efter denna studie skedde en teoretisk fördjupning i de olika processtegen där det mesta fokus riktades mot teori för Tvärflödesfiltrering, där även en två dagars kurs för Milliepore med kursprogram bestående av uppskaling, design och optimering av Tvärflödesfiltreringssystem ingick. Eftersom det i examensarbetet ingick att utvärdera parametrar i processen via
duglighetsanalys har även detta område studerats. Litteratur som använts utöver de ovan nämda interna dokumenten är böcker, rapporter, publikationer på nätet och broschyrer.
2.1.3 Data bearbetning
Det datamaterial som använts i studien har inte samlats in under tiden för examensarbetet, utan är datamaterial som dokumenterats av företaget under perioden februari 2004 till juni 2005.
För att sammanställa och behandla det insamlade datamaterialet har programmen Excel och MINITAB 14 använts.
Konstruktion av processens flödesschema har upprättats i dataprogrammet Visio.
2.2 Validitet och reliabilitet
I denna studie har datamaterial undersökts kvantitativt vilket medför att begreppen validitet och reliabilitet bör beaktas. Eftersom reliabiliteten är ett mått på hur lika resultat ett instrument eller tillvägagångssätt ger, under samma förutsättningar, vid olika tillfällen kommer det att påverka slutsatser om hurvida den studerade parametern påverkar resultatet i studien.
Validiteten är ett mått på mätinstrumentets förmåga att mäta vad det avser att mäta. Om
reliabiliteten är låg blir även validiteten låg. Att validitet och reliabilitet är höga är av största vikt, för det spelar ingen roll om ett mätinstrument ger samma svar varje gång om det inte mäter vad det avser att mäta.
Reliabiliteten och validiteten för det insamlade datamaterialet som behandlats i arbetet har inte kunna påverkats av examensarbetaren, då materialet som utvärderats är värden för olika processparametrar som uppmätts med olika utrustningar, material och människor. Eftersom tillverkningsprocessen sker under Good Manufacturing Practice (GMP)förhållanden har
examensarbetaren förutsatt att den datainsamling som behandlats är av hög validitet och reliabilitet och att de utförda analyserna är säkerställda att mäta samma saker på samma sätt varje gång, samt är lämpade för sitt ändamål, för att i slutänden erhålla hög kvalitet på datasamlingen.
2.3 Teoretisk referensram för duglighetsanalys/processkapabilitetsstudie
2.3.1 Statistisk processtyrning
För produktionsprocesser är det vanligt att många variabler mäts för att värdera de enstaka värdena men denna information utnyttjas sällan för att dra väsentliga slutsatser om produktionsprocessen eller för att värdera och förbättra en produktionsprocess (För definitioner till nedanstående text se avsnitt 9). Insamlade värden ligger ofta outnyttjade i pärmar, eller på senare tid på skiva eller hårddisk. Det
statistiska synsättet innebär att inte bara betrakta varje enskild observation som något unikt utan istället som en del av den information som kan berätta om hur bra processen fungerar och hur den kan
förbättras. De insamlade värdena kan användas i enkla statistiska metoder för bearbetning av data som skulle kunna ge ett underlag för en minskning av produktionens variation och därigenom en förbättrad kvalitet. Statistisk processtyrning är en vital del i det kontinuerliga förbättringsarbetet[1].
Statistiska tekniker kan vara till hjälp genom hela cykeln för en produkt från utveckling till
tillverkning, för att kvantitativt bestämma hur processen varierar, för att analysera processens variation relativt till specifikationer för produkten och för att underlätta utvecklingsarbeten med syfte att
reducera eller eliminera variationer[14].
I alla typer av processer förekommer variation som antigen kan vara av slumpmässig eller urskiljbar karaktär och beroende av olika orsaker. Dessa olika orsakers enskilda bidragande till variationen kan
då vara svåra att identifiera, eftersom den variation som förekommer kan ha sitt ursprung i många olika källor genom hela tillverkningsprocessen.
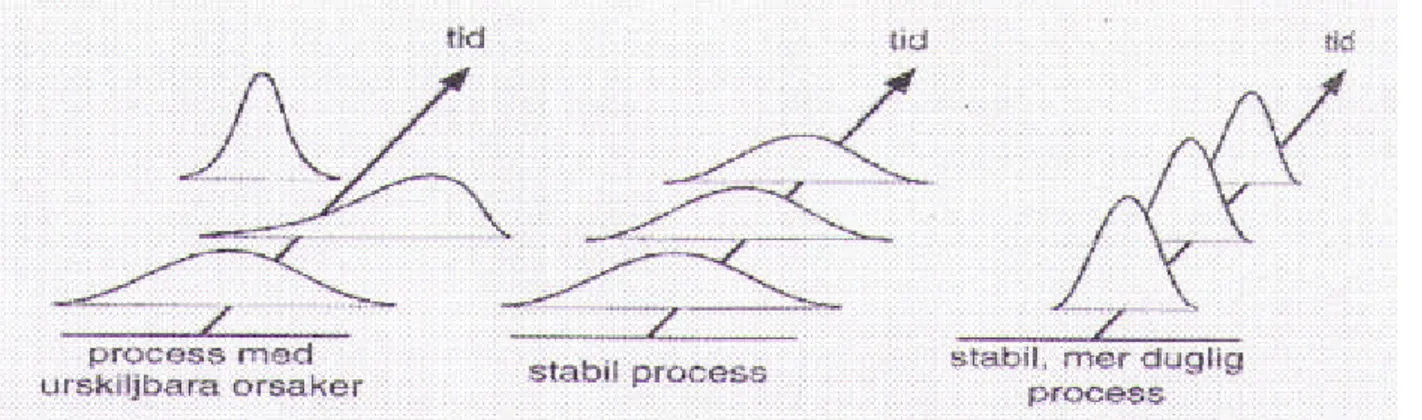
En stabil process innehåller endast slumpmässiga variationer och fortlöper på ett konstant och
förutsägbart vis med varaktiga medelvärden för variablerna och kontrollerad variation (se figur 8). [15]. För att erhålla en stabil process är det viktigt att identifiera och kvantifiera dessa variationskällor så att den urskiljbara variationen kan reduceras och elimineras[1].
Figur 8. Genom att eliminera de urskiljbara orsakerna till variationen får vi en process som är i statisktisk jämvikt. Genom att skaffa ytterligare med kunskap om processen kan fler orsaker till variationen få en process med mindre variation, en process som är dugligare[1].
Många gånger kan kvalitetsproblem hänföras till något av nedanstående orsaker:
- Management. Ger företagsledningen exempelvis tillräckligt med stöd och tillräckligt med medel för kvalitetsaktiviteterna?
- Människan. Har exempelvis operatören tillräcklig utbildning, motivation och erfarenhet? Förstår användaren hur produkten ska användas?
- Metod. Finns ordentliga verktyg och ritningsunderlag? Är processparametrarna väl specificerade och styrbarheten tillräcklig?
- Mätning. Är mätdonen kalibrerade ordentligt? Finns störande miljöfaktorer?
- Maskin. Utförs ett lämpligt förebyggande underhåll? Är maskinen sådan att variationen mellan de tillverkade enheterna är tillräckligt liten?
- Material. Hur är det med kvaliten på det material som används i processen. Är leverantörens kvalitetsaktiviteter tillräckliga?
- Miljö. Påverkar miljön produktutfallet?
För att söka efter orsaker till urskiljbar variation och förbättra processer gäller det att arbeta noggrant och systematiskt och prioritera i rätt ordning. Först bör de problem som är mest lönsamma för besparing angripas, när detta är löst kan övergång till nästa problem ske. Som hjälp för förbättringar kan de sju förbättringsverktygen användas, dessa är:
- Datainsamling - Histogram
- Paretodiagram
- Ishikawadiagram / Fiskbensdiagram - Styrdiagram
- Uppdelning - Sambandsdiagram
- Flödesschema (ingår ibland som ett åttonde verktyg)[1]
2.3.2 Variation i processer
Den variation som kan observeras i en tillverkningsprocess är som ovan nämts en ackumulering av de olika källornas bidragande till variationen, där spridningen av datan för en storhet kan beskrivas med en normalfördelning. Genom att beräkna medelvärde och standardavvikelse erhålls en uppfatting om hur den studerade storheten varierat under den undersökta tidsperioden. Medelvärdet definieras som summan av mätvärdena divierat med antalet mätningar enligt:
n x x x x ? 1? 2 ? .... n Formel 1
Beräkning av standardavvikelse (s) görs för att för att få en uppfattning om hur nära medelvärdet de insamlade mätvärdena befinner sig och beräknas enligt:
?
? ?
?
?
?
n x x x x x x s n 2 2 2 2 1 ? ? ? ? .... ? ? Formel 2Det sanna medelvärdet (µ) och den sanna standardavvikelsen (s ) går inte att mäta eftersom den beskriver det oändliga antalet mätvärden[16].
Statistiken säger att ungefär 60-78% av den studerade storhetens värden för en variabel kommer att ligga inom 1 standardavvikelse från variabelns medelvärde och att ungefär 90-98% av värdena kommer att ligga inom gränserna för 2 standard avvikelser. Mer är 99% (99,7%) av värdena kommer att hamna inom 3 standardavvikelser (3s ) från variabelns medelvärde (se figur 9).
Figur 9. Standard avvikelsens förståelse till spridning av data[15].
2.3.3 Styrdiagram för väntevärde och spridning
För att bestämma om en process är stabil/i statistisk jämvikt eller inte kan flera statistiska metoder användas som baseras på just detta att den studerade variabeln varierar på ett konstant och förutsägbart vis inom gränserna för den ovan nämda spridningen (3s ). Tekniker som kan användas för att utvärdera hurvida statistisk jämvikt råder är exempelvis histogram, normalfördelnings plott eller styrdiagram[14]. Styrdiagram är ett viktigt verktyg vid statistisk processtyrning för att finna urskiljbara orsaker till variation i en process och för att avgöra hurvida processer är stabila eller inte. Vid tillämpning av styrdiagram (väntevärdesdiagram) tas ett antal observationer (en provgrupp) ut från processen och utifrån dessa beräknas någon form av kvalitetsindikator, vilken avsätts i ett diagram. En
kvalitetsindikator kan alltså vara en storhet som är beräknad med utgångspunkt från de erhållna observationerna och kan tex. vara dess arithmetiska medelvärde, deras stickprovsstandardavvikelse eller det totala antalet fel i provgruppen. Som kvalitetsindikator kan man tänka sig varje storhet som på lämpligt sätt indikerar processens utfall och behöver alltså inte baseras på mätningar på själva
produkten. Det är istället en fördel om den baseras på mätningar redan i processen och inte på själva produkten, eftersom framförhållningen då blir större. I styrdiagrammet plottas kvalitetsindikatorns medelvärde med en sk. centrallinje (CL) samt styrgränser, en övre Sö och en undre Su (se figur 10). Så länge kvalitetsindikatorn håller sig inom föreskrivna gränser säger vi att processen är i statistisk jämvikt eller att vi har en stabil process. Genom att upprätta styrdiagram för medelvärde
(väntevärdesdiagram) samt styrdiagram för spridningen kan bedömning ske hurvida statistisk jämvikt råder för den studerade storheten[1].
Figur 10. Principen för styrdiagram[1].
2.3.3.1 Styrgränser för väntevärdesdiagram
Det är viktigt att inte blanda ihop styrgränser och specifikationsgränser, då styrgränserna upprättas utifrån processens naturliga variation (standardavvikelse eller variationsvidd) (Konstanter för konstruktion av styrdiagram se bilaga 1)[14]. Styrgränserna är kopplade till en process, medan toleransgränserna är kopplade till en enskild enhet[1].
Utifrån statistiska grunder är det lämpligt att sätta dessa naturliga variationsgränser/styrgränser till tre gånger standardavvikelsen för medelvärdet.
Specifikationsgränserna bestäms externt av ledningen, tillverknings ingenjörer, kunderna eller produktutvecklarna. När dessa specifikationsgränser sätts är det viktigt att kunskap om processens naturliga variation finns och att man kommer i håg att det inte finns matematiska eller statistiska samband mellan styrgränserna och specifikationsgränserna[14].
Vid upprättande av styrdiagram brukar medelvärden betraktas istället för enskilda observationer för att öka chansen att upptäcka en avvikelse. För att upprätta ett styrdiagram som ska användas till
utvärdering av hurvida processen är stabil eller inte krävs att 20-25 provgrupper tas ut. Dessa provgrupper bör baseras på 4,5 eller 6 mätvärden [1].
Det sanna medelvärdet (µ) och den sanna standardavvikelsen (s ) går inte att mäta eftersom den
beskriver det oändliga antalet mätvärden,därför sker en skattning av medelvärde och standardavvikele utifrån analyser av dokumenterad data[1].
Skattning av µ
Som skattning av µ tas medelvärdet av provgruppsmedelvärdena enligt:
s kan skattas enligt s-metoden vilket sker utifrån provgruppernas standardavvikelse men skattning av s kan även ske utifrån variationsvidden för provgruppen då med R-metoden som sker enligt liknande förfarande med korrelering för antalet mätvärden med en annan konstant. Fördelen med skattningen av s via standardavvikelsen är att den innehåller mer information om s och är därför normalt en bättre skattning[1].
s-metoden för skattning av s
När s skattas med s-metoden beräknas först standardavvikelsen för varje provgrupp och skattningen görs sedan enligt:
s = Standardavvikelse för respektive provgrupp 1, 2 … k k = Antalet provgrupper
= Medelvärdet för respektive provgrupps standardavvikelse
c4 = Konstant som korrelerar för antalet mätvärden i provgruppen och kan beräknas enligt nedanstående formel, men avläses oftast från tabeller (se bilaga 4).
Utifrån denna skattning kan styrgränserna övre styrgräns (Sö) respektive undre styrgräns (Su)sättas
genom att för övre och undre styrgräns addera respektive subtrahera 3 gånger standardavvikelsen för provgruppsmedelvärdena.
Därav ges styrgränserna utifrån formlerna:
= Medelvärdet av provgruppsmedelvärdena.
När individuella observationer plottas kan det vara till hjälp för överskådligheten att plotta specifikationsgränserna, men inte i ett styrdiagram där medelvärden används[14].
Formel 4 Formel 3
Formel 5
2.3.3.2 Styrgränser för spridningsdiagram (S-diagram/R-diagram)
Styrdiagram för spridningen kan antingen upprättas utifrån standardavvikelsen (S-diagram) eller variationsvidden (R-diagram), där fördelen med att avsätta skattningen av standardavvikelsen i diagrammet är att den innehåller mer information om s och är därför normalt en bättre skattning[1].
S-diagram
I ett spridningsdiagram kan variabelns spridning övervakas och användas för utvärdering av om
statistisk jämvikt för den undersökta variabeln. När ett s-diagram upprättas erhålls s via skattning mha. s-metoden, vilket ger nedanstående styrgränser då med avståndet 3- s från centrallinjen(CL):
Om s skattas enligt s-metoden får i styrgränserna[17]: 2 4 1 3 c s Su ? ? ? ? ? Formel 7 ? ? s CL 2 4 1 3 c s Su ? ? ? ? ? Formel 8 2.3.3.3 Utvärdering av styrdiagram
Utifrån styrdiagram kan bedömning ske hurvida processen arbetar vid en konstant nivå eller varierar okontrollerbart. Om nedanstående Western Electric Company Rules uppfylls är processen i statistisk jämvikt/stabil:
- En punkt ligger utanför 3 s gränserna
- Två av tre på varandra följande punkter plottade utanför 2 s gränserna.
- Fyra av fem på varandra följande värden plottas på ett avstånd som är större än 1 s från centrallinjen.
- Åtta mätvärden i följd plottas på samma sida av centrallinjen.
Dessa regler är baserade på sannolikhet och att vi vet att för en normaldistribuering kommer endast 0.3 % av mätvärdena att påträffas utanför gränserna av 3 s [18].
2.3.4 Processkapabilitet / duglighet
Processkapabilitetsstudier är en vital del i förbättringsprogram. En processkapabilitetsstudie utförs främst för att få en uppfattning om hur bra tillverkningen har gått i förhållande till satta tolerans krav, med avseende på den studerade storheten (se figur 11). Andra användningsområden för
processkapabilitetsstudier är att:
- Ge information för produktutvecklare var förbättringsarbete behövs.
- För att fastställa inom vilka intervall som provtagningar för övervakning av en process ska ske. - Specificera krav för hur ny utrustning ska användas.
- Välja mellan olika konkurrenter.
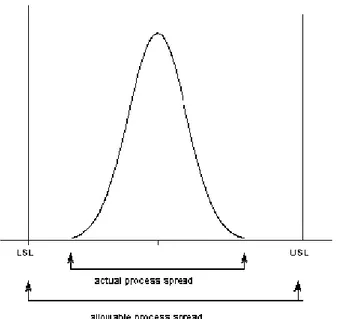
Figur 11. Bilden representerar processkapabilitetsindexets definition dvs. hur den studerade storhetens naturlinga variation i processen varierar i förhållande till satta toleranser/specifikationer
( LSL= Lower Specification Limit och USL=Upper Specification Limit)[19].
Eftersom duglighetsstudien avser att utvärdera processens ”normala” tillstånd skall den göras när processen befinner sig i statistisk jämvikt vilket också är en förutsättning för att duglighetsindexet skall kunna tolkas. Om processen är i statistisk jämvikt/stabil kan fördelningen av den studerade
produktstorheten i många fall med god approximation beskrivas av en normalfördelning
För att avgöra om statistisk jämvikt råder för den studerade storheten kan tex. datamaterialet plottas i en normalfördelningsplott, histogram eller upprätta styrdiagram och utifrån respektive teknik avgöra hurvida stabilitet råder i processen (se punkt 2.4.3.1 och 2.4.3.2).
Det finns flera olika kapabilitetsindex som kan beräknas för att få en uppfattning om hur den studerade storhetens naturliga variation är i förhållande till de satta gränserna, där de vanligaste indexen för processer är duglighetsindexet (Cp) och det korrigerade duglighetsindexet (Cpk) (som även tar hänsyn
till processens centrering dvs. hur processens genomsnittsvärde stämmer med målvärdet). På liknande vis kan duglighetsindex för maskiner beräknas då med beteckningarna Cm respektive Cpm . Samtliga
dessa index förutsätter att datapopulationen som studeras är normalfördelad.
Kapabilitetsindex Cp beräknas enligt formel nedan där Tö och Tu representerar övre respektive undre toleransgränser/specifikationsgränser. Nackdelen med detta index är att det endast tar hänsyn till processens spridning och inte till dess centrering kring målvärdet (se formel 9 samt figur 12). Cp mäter
snarare de möjligheter som processen kan ge om den är rätt centrerad och inte riktigt processens förmåga[1] . Formeln för duglighetsindexet är: ? 6 u ö p T T C ? ? Formel 9
(A) ( B) (C)
Figur 12[11].
(A) En process med stort värde på duglighetsindexet (Cp) kommer att producera enheter inom satta toleransgränser om
processen är väl centrerad.
(B) En process med ett stort värde på duglighetsindexet (Cp) kommer att producera enheter med mått utanför
toleransgränserna om processgenomsnittet alltför långt från toleransområdets mitt.
(C) En process med allt för litet värde på duglighetsindexet (Cp) kommer att producera enheter med mått utanför
toleransområdet även om processen är perfekt centrerad.
Eftersom inte Cp tar hänsyn till processens centrering utan endast till dess spridning är det korrigerade
duglighetsindexet (Cpk) ett bättre mått på processens förmåga, då det visar hur processens
genomsnittsvärde stämmer med målvärdet. Cpk mäter avståndet mellan processens genomsnittsvärde
och närmsta toleransgräns i förhållande till 3s (se formel 10 samt figur 13). Om endast en toleransgräns finns, antingen en övre (Tö) eller en undre (Tu) för den studerade storheten kan det
ensidiga korrigerade duglighetsindexet användas, som då betecknade som (Cpö) för det övre indexet
samt (Cpu) för det undre.
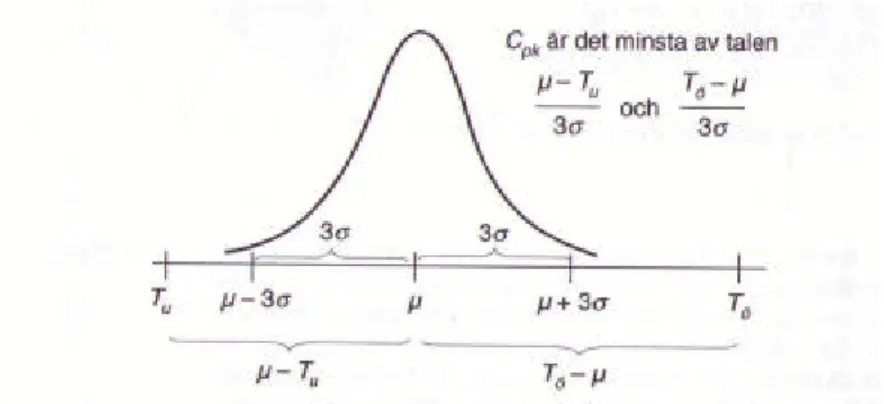
Formeln för det korrigerade duglighetsindexet är (där Cpk definieras som det minsta av talen Cpö och
Cpu): ? ? ? ? ? ? ? ? ? ? ? ? ? 3 , 3 min ö u pk T T C Formel 10
Formlerna för övre respektive undre korrigerade duglighetsindexen är:
? ? 3 ? ? ö pö T C Formel 11 ? ? 3 u pu T C ? ? Formel 12 Tö= Övre toleransgräns Tu= Undre toleransgräns s = spridningen (standardavvikelse) µ = genomsnittsvärde (väntevärde)
Figur 13. Det korrigerade duglighetsindexet (Cpk) är det minsta av Cpö och Cpu, där Cpu är avståndet mellan genomsnitts
nivn µ och undre toleransgräns Tu i förhållande till hälften av processens naturliga spridning, medan Cpö är motsvarande
förhållande mellan Tö- µ och 3s[1].
2.3.4.1 Utvärdering av processkapabilitetsindex
Ett stort värde på duglighetsindexet indikerar att processen är duglig med avseende att producera inom satta toleranser. I allmänhet rekommenderas nedanstående minimivärden för att processen skall anses som duglig med avseende på den variabel som studeras[14].
Process Två sidig specifikation En sidig specifikation
Existerande process 1,33 1,25
Ny process 1,50 1,45
Tabell 1.Rekommenderade minimivärden för processkapabilitets index[14].
3 Tillverknings processen för Monovalent bulk rCTB-213
3.1 Tillverkare
Tillverkning av rCTB sker vid Unitech Biopharma AB, 864 23 Matfors, Sverige. Unitech Biopharma AB är ett bioteknikföretag fokuserade på legotillverkning av rekombinanta proteiner och
kontraktstillverkar rCTB för SBL vaccin Solna, Sverige. Unitech Biopharma hanterar i dag klass I organismer då i den befintliga anläggningen som består av en Fermentations- ocgh Reningsanläggning. För fermentering finns en fermentor med arbetsvolym 500 l samt en ympfermentor på 7 l. För
cellavskijning finns idag centrifuger samt ett filtersystem på 16 m2. Ytterligare ett filtersystem för koncentrering av produkt finns på 10 m2. Fermentationsprocessen styrs via ett Genisis
processtyrsystem. För rening av produkten finns utrustning för fällning, filtrering samt kromatografisk
teknik. Anläggningen har alla nödvändiga tillstånd (Läkemedelsverket, Länsstyrelsen,
Arbetsmiljöverket) och uppfyller gällande cGMP-krav samt är godkänd av läkemedelsmyndigheterna i EU och Kanada, WHO samt i ytterligare ca 35 andra länder.
Unitech Biopharma AB är en del i Unitech Pharma som bildades 2003 av personer med lång erfarenhet från svensk läkemedelsindustri. Unitech Pharma arbetar för närvarande med uppbyggnaden av
fabriken Unitech Pharamceuticals som byggs i anslutning till Unitech Biopharma och förväntas stå klar för kommersiell produktion Q2 2007. Företagets ambition för framtiden är att fungera som en
regelverk (EU/FDA) åt små och medelstora bioteknik- och läkemedelsbolag. Anläggningen kommer i och med den nya utbyggnationen att kunna erbjuda marknaden sluttillverkning av produkter som är godkända för prövning på människa och som kräver aseptisk produktion samt eventuell frystorkning. Dessutom kommer anläggningen att kunna tillverka konventionella injektions-lösningar med
slutautoklavering.
3.2 Tillverkningsmetod
rCTB produceras av en genetiskt modifierad produktionsstam (213) av Vibrio Cholerae klassisk Biotype, Inaba Serotype, där produktionen sker batch-vis.
Tillverkningsprocessen sker under Good Manufacturing Practise (GMP) förhållanden och består av följande steg (för flödesschema se punkt 3.3) :
3.4.1 --- 3.4.2 Fermentering 3.4.2.1 Ympodling 3.4.2.2 Huvudodling 3.4.3 Skördesteg 3.4.4 Reningssteg 3.4.5 Reningssteg 3.4.6 Reningssteg 3.4.7 Reningssteg 3.4.8 Reningssteg
3.3 Flödes schema över produktionsprocessen av Monovalent bulk rCTB-213
---3.4 Beskrivning av produktionsprocessen
För teori för vissa processteg se bilaga 1 och för in-processkontroller och kravgränser för de olika momenten i tillverkningsprocessen se bilaga 2 och bilaga 3.
3.4.1 --- Syfte --- Utförande --- 3.4.2 Fermentering ---
För att ha kontroll över odlingsstegen är fermentorerna (ympfermentor (BR07) och huvudfermentorn (BR600)) kopplade till ett datastyrt kontrollsystem som dokumenterar och reglerar de reglerbara processparametrarna temperatur, pO2, pH, tryck och skumbildning. Temperaturen regleras genom att ympfermentorns mantel hålls tempererad vid optimal temperatur för V.Cholerae.
För att upprätthålla pO2 mäts koncentrationen löst syre i odlings mediet mha. en löst syreelektrod som känner av den relativa förekomsten löst syre (DOT) i mediet. pO2 regleras via konstant lufttillförsel och anpassad omrörning för att tillföra kulturen med tillräcklig mängd syre.
pH mäts mha. en pH-elektrod som känner av vilket pH-värde lösninen antar. pH-värdet regleras via tillförsel av 25 % ammoniak, för att undvika att pH sjunker vid ev. syrabildning. Under odling appliceras ett övertryck i fermentorerna, främst för att undvika kontamination men denna faktor ökar även syrets löslighet i odlingsmediet.
För att undvika skumbildning kontrolleras denna parameter genom att en sensor känner av ev. skumbildning. När skummet nått en viss nivå aktiveras pumpning för tillförsel av skumdämpare.
A) Sterilisering och förberedelser ---
B) Kontaminationskontroll av odlingsmediet
Innan insådd av fermentorerna utförs en kontamineringskontroll av odlingsmedierna genom att börvärden på reglerparametrarna ställs in för att ge optimala tillväxtförhållanden, därefter genomgår odlingsmedierna en stabiliserinsfas om minst fem timmar för ympfermentorn och minst tolv timmar för huvudfermentorn. Efter denna fas kontrolleras medierna visuellt för att se om eventuell grumlighet föreligger, samt att pO2 signalen är och har varit stabiloch att pH ligger och har legat inom angivna gränser.
3.4.2.1 Ympodling
Syfte
Målet med ympodlingssteget är att odla upp V. Cholerae Inaba 213 i det aktuella odlingsmediet så att bakterierna finns i tillräcklig mängd och befinner sig i rätt tillväxtfas för överföring till nästa
processteg, huvudodlingen. Utförande[20]
Efter kontaminationskontrollen av mediet inokuleras BR07 med bakteriesuspensionen.
För att hålla den omgivande miljön optimal för tillväxt av V. Cholerae är de parametrar som styr de fysiska faktorerna för kulturen inställda på nedanstående börvärden:
---
3.4.2.2 Huvudodling
Syfte
Målet med huvudodlingssteget är att odla upp V. Cholerae som uttrycker och utsöndrar rCTB i så stor mängd som möjligt. Att utbytet blir bra i detta processteg är viktigt eftersom den mängd rCTB som erhålls här är den mängd som går vidare till de följande reningsstegen.
Utförande[20]
Efter avslutad ympodling och utförd kontaminationskontroll av mediet inokuleras BR600 genom överföring av innehållet i BR07. Efter cirka 18 timmar, eller tidigare om OD sjunker kraftigt, avbryts odlingen genom att temperaturen i BR600 sänks till 20?C.
För att hålla den omgivande miljön optimal för tillväxt och rCTB-produktion av V. Cholerae, är de parametrar som styr de fysiska faktorerna för kulturen inställda på nedanstående börvärden:
---
3.4.3 Skördesteg
Syfte
Målet med detta steg är att separera rCTB från V. Cholerae och dess fragment, med optimalt utbyte av rCTB. I detta processteg avlägsnas även skumdämparen till stor del.
Utförande
3.4.4 Reningssteg Syfte --- Utförande --- 3.4.5 Reningssteg Syfte --- Utförande --- 3.4.6 Reningssteg Syfte --- Utförande --- 3.4.7 Reningssteg Syfte --- Utförande ---
3.4.8 Reingssteg
Syfte
---
Utförande
---
3.4.9 Sterilfiltrering och fyllning
Utförande
---
4 In-processkontroller för tillverkningsprocessen av Monovalent bulk, rCTB-213
---
4.1 Flödes schema med utsatta in-processkontroller
---
4.2 In-processkontrollernas kravgränser
---
5 Kritiska parametrar för tillverkningsprocessen av Monovalent bulk, rCTB-213.
5.1 ---
Identifierade kritiska parametrar. ---
5.2 Fermentering
5.2.1 YmpodlingIdentifierade kritiska parametrar. ---
5.2.2 Huvudodling
Identifierade kritiska parametrar. ---
5.3 Skördesteget
Identifierade kritiska parametrar.
---
5.4 Reningssteg
Identifierade kritiska parametrar.
5.5 Reningssteg
Identifierade kritiska parametrar.
---
5.6 Reningssteg
Identifierade kritiska parametrar.
---
5.7 Reningssteg
Identifierade kritiska parametrar.
---
5.8 Reningssteg
Identifierade kritiska parametrar.
---
5.9 Sterilfiltrering och fyllning
Identifierade kritiska parametrar.
6 Analys och resultat
Utvärdering av tillverkningsprocessen för monovalent bulk rCTB-213 under perioden februari 2004 – juni 2005 (för tillverkningsbatcherna RC20401-RC20519).
6.1 Sammanställning av produktionen
---
6.2 Erhållna mängder rCTB för respektive processteg
---
Diagram 1. Mängd erhållen rCTB för respektive processteg för tillverkningsbatcherna RC20401-RC20519.
---
Diagram 2. Totalt utbyte över alla processteg för tillverkningsprocessen för monovalent bulk rCTB-213 för tillverkningsbatherna RC20401-RC20519.
6.3 Skördesteget
---
6.3.1 Samband vid skördesteget ---
Diagram 3. Utbytet av rCTB (%) för tillverkningsbatcherna RC20401-RC20519 beroende av mängden tillförd Adekanol (g) till BR600.
---
Diagram 4. Mängden tillförd skumdämpare (g) till BR600 för tillverknings batcherna RC20401-RC20519.
---
Diagram 5. Erhållet flux (l/min) vid skördefiltreringssteget för tillverkningsbatcherna RC20401-RC20519.
---
Diagram 6. OD-värden för tillverkningsbatcher RC20401-RC20519.
---
6.4 Huvudodlingssteget
Eftersom rCTB formuleras under huvudodlingssteget och eftersom utbytet över detta processteg styr den maximala mängden produkt som kan erhållas i denna process, undersöks viktiga parametrar för detta processteg.
6.4.1 Black-box modellen
Black-box modellen illustrerar processteget huvudodling i BR600 (se figur 14).
Den faktor vilket gör det möjligt att erhålla produkt (dvs. Vibrio Cholerae Klassisk Biotype, Inaba Serotype) illustreras som det som tillförs till processteget och de parametrar som är viktiga/styr processteget är illustrerade med den uppåtgående pilen. Efter utförd enhetsoperation har de styrande parametrarna påverkat processteget för att genererara responsen dvs. många organismer som
producerat produkten rCTB 3URFHVVWHJ HW + XYXGRGOLQJ %5 ,1 8 7 9 LNWLJ DSDUDP HWUDU S+ 7 HP SHUDWXU $ QGHOHQO| VWV\ UH 5 nYDURU U&7 % 9 LEULR&KROHUDHL ORJ IDV
Figur 14. Schematisk bild som visar vad som tillförs till processteget huvudodling, samt vilka parametrar som styr enhetsoperationen med avseende på syftet.
6.4.2 Råvaran casaminosyra ---
Diagram 8.. Mängd rCTB (g) för huvudodlingen, för tillverkningsbatcherna RC20401-RC20519, visar även vilken batch casaminosyra som använts under perioden.
---
Diagram 9. Total tid för huvudodlingen för tillverkningsbatcherna RC20401-RC20519.
---
Diagram 10. Medelvärden för erhållen mängd rCTB (g) under huvudodling, där odling skett med olika batcher casaminosyror.
6.4.3 Temperatur, pH-värde och andelen löst syre i BR600 under februari 2004-juni 2005. --- 6.4.3.1 Kontroll av normalfördelning --- a) Temperatur ---
Diagram 11. Normalfördelnings plott för temperaturen i BR600 för mätvärden insamlade under perioden februari 2004-juni 2005.
Diagram 12. Väntevärdesdiagram för temperaturen i BR600 för provgrupperna 1-20.
---
Diagram 13. Styrdiagram för spridningen (standardavvikelse) för temperaturen i BR600 för provgrupperna 1-20.
b) pH
---
Diagram 14. Normalfördelnings plott för pH-värdet i BR600 för mätvärden insamlade under perioden februari 2004-juni 2005.
---
Diagram 15. Väntevärdesdiagram för pH-värdet i BR600 för provgrupperna 1-20.
---
Diagram 16. Styrdiagram för spridningen (standardavvikelse) för pH-värdet i BR600 för provgrupperna 1-20.
c) Andelen löst syre
---
Diagram 17. Normalfördelnings plott för andelen löst syre i BR600 för mätvärden insamlade under perioden februari 2004-juni 2005.
Diagram 18. Väntevärdesdiagram för andelen löst syre i BR600 för provgrupperna 1-20.
---
Diagram 19. Styrdiagram för spridningen (standardavvikelse) för andelen löst syre i BR600 för provgrupperna 1-20.
6.4.3.2 Skattning av processkapabilitet
---
a) Temperatur
---
Diagram 20.. Histogram för temperaturen i BR600 för värden insamlade under perioden februari 2004- juni 2005
b) pH
---
Diagram 21.. Histogram för pH-värdet i BR600 för värden insamlade under perioden februari 2004- juni 2005
c) Andelen löst syre i BR600
---
Diagram 22. Histogram för pO2 i BR600 för värden insamlade under perioden februari 2004- juni 2005
7
Diskussion
7.1 Studiens resultat
Eftersom det under perioden februari 2004 till juni 2005 observerats en nedgång i erhållet utbyte över huvudodlingssteget och eftersom utbytesförlusterna är stora över skördefiltreringssteget i processen analyserades enskilda variabler för olika processparametrar för att se om urskiljbar variation
förekommit i processen. Vid denna analys gjordes iakttagelsen att mängden tillförd skumdämpare till BR600 minskat under den senare delen av perioden då i samband med att utbytet vid huvudodlingen minskat. Dessa utbytesförluster har inte påverkat utbytet totalt över hela tillverkningsprocessen utan mängden rCTB som erhållits på den monovalenta bulken ser dock ut att ha den motsatta trenden. Produkten ser ut att passera skördefiltret lättare under den senare delen av perioden vilket ser ut att påverka skördesteget så att produktförlusten vid huvudodlingen inte slår igenom i samma utsträckning i detta processteg. Om passagen av produkt över membranen går lättare pga. mindre mängd produkt, mindre mängd skumdämpare eller att processvätskan förändrat karraktär av någon annan anledning och på detta vis bidragit till den variation som påvisats kan endast spekuleras i under denna studie. Kanske Vibrio Choleraes påverkan av skumdämparen leder till att bakterierna lyseras i större utsträckning och på detta vis orsakar den ovan nämda observationen?
8 Slutsatser och rekommendationer
8.1 Huvudodling och skörd
---8.2 Processkapabilitet
a) Temperatur --- b) pH-värdet --- c) Andelen löst syre ---9 Definitioner:
ProcessEn uppsättning sammanhängande aktiviteter som upprepas i tiden . Processen transformerar vissa instorheter i form av exempelvis information och material till vissa utstorheter i form av olika typer av varor eller tjänster[1].
Parameter
Konstant storhet i funktion, statistisk fördelning, figur eller uttryck[21].
Storhet
Ett begrepp som används för en egenskap hos ett föremål eller fenomen som går att mäta[22]. Produkt
Alster, avkastning, vara, verk, resultat[21]. Kvalitet
Värde, egenskap, beskaffenhet; i sht god beskaffenhet[21].
Vissa organisationer har skapat egna tolkningar av begreppet kvalitet, som ofta har en klart kundorienterad grundton
Kvalitet är ett begrepp, som skall uppfattas ur betraktarens synpunkt[1]: a) produktbaserat
b) användarbaserat c) produktionsbaserat d) värdebaserat e) transcendent
a) Produktbaserad kvalitet
Detta synsätt definierar kvalitet som något mätbart och precist och bestäms av mått eller egenskaper som produkten har[1].
b) Användarbaserad kvalitet
Detta synsätt definieras som att kvalitet bedöms av kunden[1]. c) Produktionsbaserad kvalitet
Definitionen för detta synsätt är kopplat till uppfyllande av toleranser och krav i produktionen[1]. d) Värdebaserad kvalitet
Kvalitet är enligt detta synsätt definierat i relation till kostnad och pris[1]. e) Transcendenta perspektivet på kvalitet
Förespråkare av detta synsätt definierar kvalitet som något som inte kan preciseras utan först kan identifierats efter att det upplevts[1].
Kritisk
Skarpsynt i fråga om fel och brister, avgörande, farlig, riskabel[21]. Kritiska parameterar
Definieras som ”Parametrar som kan påverka en kritisk kvalitetsegenskap” Vid bedömning av vilka parametrar som är kritiska har hänsyn tagits till produktkvalitet, stegets funktion och utbyte?23?.
10 Referensförteckning
1. Bo Bergman, Bengt Klevsjö Kvalitet från behov till användning 2. Jacquelyn G. Black 5 th edition Microbiology ISBN 0-471-38729-0
3. http://www.sblvaccines.se/uploads/Cholera04-05.jpg Datum:2006-02-03 4. http://gsbs.utmb.edu/microbook/ch024.htm Datum:2005-09-14 5. http://www.cfsan.fda.gov/~mow/cap8.html Datum:2006-01-26 6. http://www.emea.eu.int/humandocs/PDFs/EPAR/dukoral/408903en6.pdf Datum: 2006-02-01 7. http://www.textbookofbacteriology.net/cholera.html Datum 2006-02-01 8. http://www.patentstorm.us/patents/5268276.html Datum:2006-02-01 9. http://www.rctb.net/images/Cholera_holotoxin_cartoon.jpg Datum:2006-02-03
10. Mary K. Campbell Biochemistry Third Edition ISBN 0-03-024426-9 11. http://www.rctb.net/ Datum: 2006-02-03
12. http://www.fass.se/LIF/produktfakta/artikel
produkt.jsp?Np1ID=2004042800156&DocTypeID=7&UseTypeID=2 Datum 2006-01-20
13. http://www.emea.eu.int/humandocs/PDFs/EPAR/dukoral/408903sv1.pdf. Datum: 2006-01-20
14. Montgomery, Douglas C. Introduction to Statistical Quality Control, Fifth Edition ISBN 0-471-661228
15. http://www.itl.nist.gov/div898/handbook/ppc/section1/ppc132.htm Datum: 2006-03-29
16. Daniel C. Harris, Quantitative Chemical Analysis, sixth edition ISBN 0-7167-4464-3
17. http://www.itl.nist.gov/div898/handbook/pmc/section3/pmc321.htm Datum:2006-04-04
18. http://www.itl.nist.gov/div898/handbook/pmc/section3/pmc32.htm Datum: 2006-03-29
19. http://www.itl.nist.gov/div898/handbook/pmc/section1/pmc16.htm Datum: 2006-03-29
20. Internt dokument, Östling Rustan, Satsprotokoll Monovalent bulk, rCTB-213 Unitech Biopharma doc. no.50019/1
21. Prismas främmande ord BOKFÖRLAGET PRISMA STOCKHOLM ISBN: 91-518-2419-1
22. sv.wikipedia.org/wiki/storhet Datum: 2006-01-12
23. Norberg Anna, Critical parameters in bulk manufacturing of rCTB 213 at Matfors, 2001, report 2 doc. no. 2002/1106
![Figur 1. Utbredning av kolera år 2004-2006 [3] .](https://thumb-eu.123doks.com/thumbv2/5dokorg/4752116.126268/4.892.106.822.379.802/figur-utbredning-kolera-år.webp)
![Figur 2. Elektronmikroskåp fotografi på Vibrio Cholerae som bildat kolonier i epithelcellerna på kanin [4]](https://thumb-eu.123doks.com/thumbv2/5dokorg/4752116.126268/5.892.353.558.454.758/figur-elektronmikroskåp-fotografi-vibrio-cholerae-bildat-kolonier-epithelcellerna.webp)
![Figur 4. Kolera toxinets bindningsmekanism och påverkan vid inhibering av GTPase aktiviteten hos G- proteinet [4]](https://thumb-eu.123doks.com/thumbv2/5dokorg/4752116.126268/7.892.231.708.544.1093/kolera-toxinets-bindningsmekanism-påverkan-inhibering-gtpase-aktiviteten-proteinet.webp)
![Figur 9. Standard avvikelsens förståelse till spridning av data [15] .](https://thumb-eu.123doks.com/thumbv2/5dokorg/4752116.126268/14.892.276.616.735.1014/figur-standard-avvikelsens-förståelse-spridning-data.webp)
![Figur 10. Principen för styrdiagram [1] .](https://thumb-eu.123doks.com/thumbv2/5dokorg/4752116.126268/15.892.95.659.561.726/figur-principen-för-styrdiagram.webp)