Examensarbete Malmö universitet
REKONSTRUKTIONENS
PÅVERKAN AV KVANTITATIV
BEDÖMNING VID FET-PET
REKONSTRUKTIONENS
PÅVERKAN AV KVANTITATIV
BEDÖMNING VID FET-PET
HAVA TAIPOVA
Taipova, H. Rekonstruktionens påverkan av kvantitativ bedömning vid FET-PET.
Examensarbete i biomedicinsk laboratorievetenskap, 15 högskolepoäng.
Malmöuniversitet: Fakulteten för hälsa och samhälle, institutionen för Biomedicinsk laboratorievetenskap, 2020.
Flour-etyl-L-tyrosin positronemissionstomografi (FET-PET) undersökning är en undersökningsmetod som har hög sensitivitet och specificitet vid diagnostisering av bland annat tumör och tumörrecidiv. För att bestämma FET-upptaget i tumören kan tumör till bakgrundsförhållande (TBR) beräknas. TBR är förhållandet mellan upptag i tumör och upptaget i grå och vit substans. Syftet med studien var att kartlägga hur olika rekonstruktioner påverkar värdet av TBR vid FET-PET undersökningar genom att studera TBR vid olika tidsintervall och sex olika rekonstruktioner. Vid genomförande av studien inkluderades 15 patienter med FET-upptag som genomgått FET-PET undersökning i Klinisk Neurofysiologi på Skånes Universitetssjukhus (SUS) i Lund. Hela undersökningstiden 30 minuter, sista 20 minuter samt sista 15 minuter testades för att se om dagens
bildtagningsprotokoll går att optimera. Rekonstruktionsmetoderna QClear (QC) och Ordered Subset Expectation Maximization (OSEM) användes i studien. Vid beräkning av TBR-värden användes standardiserade upptagsvärden (SUV). För att beräkna TBR ritades region av intresse (ROI), ROIthreshold samt ROIsfär, över tumörområdet samt i frisk grå och vit substans i den kontralaterala hemisfären, för att bestämma FET-upptaget i förhållande till varandra. TBR beräknades utifrån maximala (SUVmax) och medelvärdet (SUVmedel) i ROI och benämns som TBRmax och TBRmedel. Resultatet av studien visade att ett lägre -värde för QC erhåller högre TBR-värden. TBR-värdena för rekonstruktionsmetoden OSEM låg mellan TBR-värdena för QC-rekonstruktionerna. Medelvärdet av den procentuella skillnaden, av alla patienter, mellan TBR-värden och de olika tiderna, för
respektive rekonstruktionsmetod låg mellan 5-10 %. Detta indikerar att mängden injicerad aktivitet till patienten alternativt undersökningstiden kan minskas. Den maximala procentuella skillnaden av TBRmax och TBRmedel för ROIthreshold
respektive ROIsfär mellan de olika rekonstruktionerna för alla tre tiderna och alla 15 patienterna, låg mellan 25-40 %. Medelvärdet av den procentuella skillnaden av TBRmax och TBRmedel för ROIthreshold respektive ROIsfär mellan de olika
rekonstruktionerna för alla tre tiderna och alla 15 patienterna, låg mellan 15-25 %. Slutsatsen för denna studie är att den kvantitativa bedömningen av TBR-värdet varierar beroende på använd rekonstruktionsmetod.
THE IMPACT OF THE
RECONSTRUCTION OF
QUANTITATIVE ASSESSMENT
ON FET-PET
HAVA TAIPOVA
Taipova, H. The impact of the reconstruction of quantitative assessment on FET-PET. Degree project in Biomedical Laboratory Science, 15 Credits Points. Malmö University: Faculty of Health and Society, Department of Biomedical Laboratory Science, 2020.
Flourethyl-L-tyrosine positron emission tomography (FET-PET) examination is an examination method that has high sensitivity and specificity in diagnosing tumors and tumor recurrence. Tumor-to-background-ratio (TBR) could be
calculated to determine FET-uptake in the tumor. TBR is the ratio between uptake in tumor and uptake in gray and white matter. The purpose of the study was to identify how different reconstructions affect the value of TBR in FET-PET examinations by studying the TBR-value at different time intervals and six different reconstructions algorithms. In the study, 15 patients were included, all with FET-uptake and all had performed a FET-PET examination at the
department of Clinical Neurophysiology at Skåne University Hospital (SUS) in Lund. The entire examination time 30 minutes, the last 20 minutes and the last 15 minutes were tested to evaluate if the imaging protocol used today can be
optimized. The reconstruction methods used in the study were QClear (QC) and Ordered Subset Expectation Maximization (OSEM). Standardized uptake values (SUV) were used during the calculation of TBR-values. To calculate TBR, the region of interest (ROI), ROIthreshold and ROIsphere were drawn. ROIthreshold and ROIsphere were drawn over the tumor area and in grey- and white matter in the contralateral hemisphere, to determine FET-uptake in relation to each other. The TBR-value was calculated based on maximum- (SUVmax) and mean values
(SUVmedel) in ROI and is referred as TBRmax and TBRmean. The results of the study showed that a lower -value for QC obtains higher TBR-values. The TBR-values for the OSEM reconstruction method were between the TBR-values of the QC reconstruction methods. The mean value of the percentage difference, of all patients, between TBR-values and the different times, for each reconstruction method were between 5-10 %. These results indicate that the amount of injected activity to the patient or the examination time can be reduced. The maximum difference in percentage of TBRmax and TBRmean for ROIthreshold respective ROIsphere between the reconstructions for the tree times and all the 15 patients, were between 25-40 %. The mean percentage difference of TBRmax and TBRmean for ROIthreshold respective ROIsphere between the reconstructions for the tree times and all the 15 patients, were between 15-25 %. The conclusion of this study is that the TBR-value will vary with different reconstruction methods.
FÖRORD
Jag vill tacka sektionschefen Douglas Hägerström, mina handledare Pernilla Lindén-Mickelsson och Fanny Mörnsjö-Centofanti på Skånes universitetssjukhus i Klinisk Neurofysiologi i Lund, för kunskapen, möjligheten samt stöden att utföra mitt examensarbete. Jag vill även tacka övrig personal samt nära och kära som tagit sin tid att stödja mig genom studiens gång.
INNEHÅLLSFÖRTÄCKNING
FÖRKORTNINGSLISTA ... 5
BAKGRUND ... 6
Syfte ... 7
MATERIAL OCH METOD ... 8
Urval ... 8
Metod ... 8
Beräkning av TBR ... 9
Beräkning av TBR vid undantagsfall ... 11
Metod vid resultatsammanställning av TBR ... 12
Etik ... 12
RESULTAT ... 12
Resultatredovisning av TBRmax och TBRmedel ... 12
Resultatredovisning av procentuella skillnader ... 14
DISKUSSION ... 16 Metoddiskussion ... 16 Resultatdiskussion ... 16 Begränsningar ... 18 SLUTSATS ... 18 REFERENSER ... 19 BILAGA 1 ... 21 BILAGA 2 ... 25
FÖRKORTNINGSLISTA
FET Flour-etyl-L-tyrosin
M Minuter
OSEM 8it34sub3mm Ordered Subset Expectation Maximization med inställning på 8 iterationer, 34 subsets och 3 millimeter filter
PET Positronemissionstomografi
QC QClear
ROI Region av intresse
SUV Standardiserat upptagsvärde
SUVmax Maximala värdet av standardiserat
upptagsvärde
SUVmedel Medelvärde av standardiserat
upptagsvärde
TBR Tumör till bakgrundsförhållande
TBRmax Maximala värdet av tumör till
bakgrundsförhållande
TBRmedel Medelvärdet av tumör till
BAKGRUND
Vid en positronemissionstomografi (PET) undersökning injiceras patienten med ett s.k. radiofarmaka som fördelar sig i kroppen och sönderfaller. Isotoper som används till PET-undersökningar sönderfaller genom β+-sönderfall. Det innebär att en proton konverteras till en neutron, en positron och en neutrino. När den utsända positronen bromsas upp i materia och träffar en elektron uppstår annihilation. Annihilationsprocessen bildar två motsattriktade fotoner, s.k. annihilationsfotoner, som utsänds med 180° vinkel mellan varandra.
Annihilationsfotonerna har en energi på 511 kiloelektronvolt (keV) vardera som kan detekteras av PET-kameran och ge en avbildning av fördelningen av
radiofarmaka. PET-kameran är uppbyggd av tusentals detektorer som är sammankopplade via en s.k. koincidenskrets som är utvecklad för att registrera annihilationsfotoner. Den tomografiska bilden skapas genom rekonstruktionen. Vid PET-undersökning skapas ett s.k. sinogram när data samlas in. Sinogram används för att rekonstruera den tomografiska bilden [1-3].
Hjärntumörer (gliom) är indelade i tumörgrad I, II, III och IV. Tumörgrad I och II betraktas som lågmalign tumör med utdragen utveckling, tumörgrad III
kännetecknar anaplastiskt gliom och tumörgrad IV karakteriserar glioblastom. Tumörgrad III och IV är högmaligna tumörer och leder till döden inom veckor till månader vid avsaknad av behandling [4]. Vid diagnostisering av hjärntumörer med PET används radiomärkta aminosyror. De radiomärkta aminosyrorna har högt upptag i tumörvävnad men lågt upptag i frisk hjärnvävnad [5]. Flour-etyl-L-tyrosin (FET) kopplad till Flour-18 är ett konstgjort aminosyraspårämne med ett dynamiskt förlopp och är ett av det mest framgångsrika spårämnena vid
avbildning av hjärntumörer med PET [6-8].
FET-PET ger information om tumörupptag och avgränsandet av tumörzoner. Då ett ökat FET-upptag även kan ses vid kärl, kärlskador och metastaser är det
nödvändigt att detta beaktas för att undvika felaktig tolkning vid FET-PET [9-10]. Trots dessa svagheter är FET-PET en undersökning av värde vid val av
behandling, tumörprognos, vägledning inför biopsi och diagnosticering vid återfall av hjärntumörer då FET har hög sensitivitet och specificitet [11-14]. Enligt en studie av Dunet m.fl. [13] och Kunz m.fl. [14] visade undersökningar med FET-PET att 50 % av tumörerna som misstänks för patologigrad II
egentligen hade patologigrad III-IV.
Standardiserat upptagsvärde (SUV) är inom nuklearmedicin en term som representerar mängden upptag av radiofarmaka i ett område. För beräkning av SUV används formeln:
SUV = 𝐶𝑅𝑂𝐼 𝐴 𝑚
(1)
där 𝐶𝑅𝑂𝐼 [kBq/ml] representerar aktivitetskoncentrationen i regionen av intresse (ROI), 𝐴 [kBq] är mängden injicerad aktivitet och m [g] är patientens massa [15]. För att kunna kvantifiera FET-upptaget i tumören används SUV-värdet och utifrån utritad ROI kan det maximala standardiserade upptagsvärdet (SUVmax) och
medelvärdet av det standardiserade upptagsvärdet (SUVmedel) tas fram [15-16]. Tumör till bakgrundförhållande (TBR) är ett sätt att mäta FET-upptag i tumören, i förhållande till upptaget i frisk grå- och vit substans. TBR beräknas genom att
lägga ett ROI över respektive område och kvantifiera upptaget i SUV, i
förhållande till varandra. Erhållna TBR-värden ger möjlighet till differentiering mellan lågmaligna samt högmaligna tumörer genom att erhålla maximala (TBRmax) alternativt medelvärde (TBRmedel) av upptagsmängden i tumören i förhållande till en referensregion [4,13]. För beräkning av TBRmax används formeln:
TBRmax = 𝑆𝑈𝑉𝑚𝑎𝑥 𝑢𝑝𝑝𝑡𝑎𝑔𝑠 𝑅𝑂𝐼 𝑆𝑈𝑉𝑚𝑒𝑑𝑒𝑙 för 𝑅𝑂𝐼𝑟𝑒𝑓𝑒𝑟𝑒𝑛𝑠
(2)
där SUVmax i upptags ROI, representerar maxvärdet inom ROI och SUVmedel för
ROIreferens representerar medelvärdet inom ROI [4]. För beräkning av TBR-medel
används formeln:
TBRmedel =
𝑆𝑈𝑉𝑚𝑒𝑑𝑒𝑙 𝑢𝑝𝑝𝑡𝑎𝑔𝑠 𝑅𝑂𝐼 𝑆𝑈𝑉𝑚𝑒𝑑𝑒𝑙 för 𝑅𝑂𝐼𝑟𝑒𝑓𝑒𝑟𝑒𝑛𝑠
(3)
där SUVmedel i upptags ROI representerar medelvärdet inom ROI och SUVmedel för
ROIreferens representerar medelvärdet inom ROI [4]. I studien av Kinahan m.fl. [17]
varierar SUV-värdena i utsatta ROI med olika rekonstruktionsmetoder. Då TBR-värden beräknas baserat på SUV-TBR-värdena, finns det anledning att anta att även TBR-värdena kommer variera beroende på vilken rekonstruktionsmetod som används. Enligt Dunet m.fl. [4], Pauleit m.fl. [18] och Pöpperl m.fl. [19] anses TBRmax 2,2 och TBRmedel 1,6 vara optimala värden för urskiljning mellan tumörer och icke-tumörer i hjärnan. Högmaligna tumörer resulterar i högre TBRmax och TBRmedel jämfört med lågmaligna tumörer [13].
QClear (QC) och Ordered Subset Expectation Maximization (OSEM) är två olika iterativa rekonstruktionsmetoder. Till skillnad från OSEM har QC en extra term i beräkningen som styr rekonstruktionen mot en mindre brusig bild. Hur mycket inflytande den extra termen får på rekonstruktionen bestäms av -värdet, som operatören ställer in innan påbörjad rekonstruktion [16]. I nuläget är OSEM en typ av iterativ rekonstruktionsmetod som är den mest använda kliniskt.
Rekonstruktionsmetoden brusreducerar genom filterinställningar som operatören ställer in [9,16,20]. Rekonstruerade bildvolymer och dess pixelvärden presenteras i SUV. Då olika företag samt kameraapparater använder olika
rekonstruktionsmetoder, varierar SUV-värdena beroende på vilken undersökningskamera som används. Av denna anledning har
rekonstruktionsmetoden en stor inverkan på TBR-värdena, då de beräknas baserat på SUV-värden i ROI, och det är således av stor betydelse att observera hur TBR-värdena skiljer sig åt mellan de olika rekonstruktionsmetoderna [12-13].
Syfte
Syftet med studien var att kartlägga hur olika rekonstruktioner påverkar värdet av TBR vid FET-PET undersökningar. Detta görs genom att rekonstruera bilder på sex olika sätt och tre tidsintervall för respektive patient och studera hur TBR-värdet varierar mellan de 18 olika bildvolymerna.
MATERIAL OCH METOD
För bestämmande av rekonstruktionens påverkan av kvantitativ bedömning vid FET-PET beräknades TBR på bildvolymer för varje patient. Bildvolymerna rekonstruerades med sex olika metoder vid hela undersökningstiden 30 minuter (30M), sista 20 minuter (20M) och sista 15 minuter (15M).
Urval
Studien är retrospektiv och omfattar 15 patienter som genomgått FET-PET undersökning på Skånes Universitetssjukhus (SUS) i Lund. Patienter efter september 2017 som genomgått en undersökning med FET-upptag på PET-kameran GE Discovery MI (GE Discovery I, Boston, USA) inkluderades. Exklusionskriterier för studien var patienter som inte hade FET-upptag, därför exkluderades patient 5 samt 16. Enkäter, intervjuer och informationsbrev till patienter var inte aktuellt under denna studie. Inklusionskriterier för studien var patienter med FET-upptag på grund av gliom eller metastas. Vid urval av
patienter med FET-PET upptag var kön, ålder samt andra sjukliga tillstånd inte av betydelse då endast tumörer, metastaser och eventuella kärlskador ger ett ökat FET-upptag i hjärnan. Efter remissgranskning av patienternas tumörupptag visade det sig att majoriteten av patienterna hade högmaligna tumörer (Bilaga 2).
Metod
Studien genomfördes på SUS i Lund. Legitimerad sjukhusfysiker rekonstruerade alla bildvolymer på kameran GE Discovery MI. De rekonstruerade bildvolymerna för respektive patient överfördes till programmet HERMES Data Management GOLD LxTM (HERMES MEDICAL SOLUTIONS, HERMES, Stockholm, Sverige). De sex olika rekonstruktionerna som användes i studien var QC med -värde 50, 100, 200, 400 respektive 600 samt OSEM 8it34sub3mm. OSEM
8it34sub3mm står för rekonstruktionsinställning på 8 iterationer, 34 subsets och 3 millimeter filter. Undersökningstiden vid FET-PET är 30 minuter (30M). Statiska 3D-bildvolymer rekonstruerades för hela undersökningstiden, 30 minuter, samt de sista 20 minuterna (20M) och de sista 15 minuterna (15M), enligt tabell 1.
Tabell 1. Tabellen visar de sex olika rekonstruktionerna och dess inställningar för de
statiska bildvolymerna för tidsintervallet 0-30 minuter (30M). Motsvarande inställning utfördes för de sista 20 (20M) respektive sista 15 (15M) minuterna.
Olika
rekonstruktioner vid tidsintervallet 30M
Förklaring av tidsintervall och dess rekonstruktioner
30M QC 50 Statisk bildvolym för hela 30 minuter med -värde 50. 30M QC 100 Statisk bildvolym för hela 30 minuter med -värde 100. 30M QC 200 Statisk bildvolym för hela 30 minuter med -värde 200. 30M QC 400 Statisk bildvolym för hela 30 minuter med -värde 400. 30M QC 600 Statisk bildvolym för hela 30 minuter med -värde 600.
30M OSEM 8it34sub3mm
Statisk bildvolym för hela 30 minuter med angivna inställningar för OSEM.
it=iterationer; M=minuter; mm=millimeter; OSEM=Ordered Subset Expectation Maximization; QC=Qclear; sub=subsets.
Beräkning av TBR
ROI-ritning för beräkning av TBR gjordes i HERMES. Alla rekonstruerade bildvolymer var attenueringskorrigerade. Innan påbörjandet av ROI-ritning på bildvolymer jämfördes patientens computed tomografi (CT), dvs. datortomografi, med 30 minuters (30M) bildtagningstid med QC100 för att visuellt avgöra om PET och CT-bildvolymerna fusionerats korrekt. En felaktig fusionering kan leda till felaktig attenueringskorrektion i den rekonstruerade bildvolymen. Ingen av de inkluderade patienterna i studien hade fusionerats felaktigt. Initialt gjordes ROI-ritningar på bildvolymen med 30 minuters (30M) bildtagningstid rekonstruerad med QC100. Arbetet som utfördes av en biomedicinsk analytikerstudent
granskades kontinuerligt av legitimerad biomedicinsk analytiker och legitimerad sjukhusfysiker.
Vid bestämning av TBR har i tidigare studier olika typer av ROIthreshold använts [12]. I denna studie användes ROIthreshold som utlinjerade pixelvärden inom 90 % av SUVmax. Vid bestämning av TBR-värden studerades bildvolymerna i en gråskala. Gråskalan på bildvolymen ställdes in för att visualisera maximalt pixelvärde mellan 71 transaxiella snitt där pixlar med mörk gråskala
representeradehögre SUV-värden. ROIthreshold ställdes in på 90 % av SUVmax för att programmet automatiskt skulle utlinjera de pixlar som var 90 % av SUVmax.
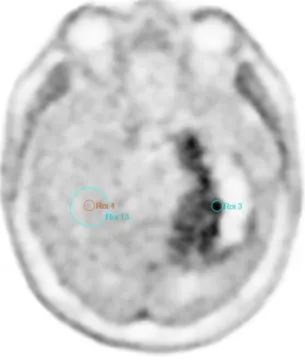
ROI 1 motsvarade ROIthreshold. ROI 1 kopierades för att erhålla spegelvänd referensregion, ROI 2 (ROIref threshold), i den kontralaterala hemisfären (Figur 1). ROI1 och spegelvänd ROI 2 ritades för beräkning av TBR mellan ROI 1 och 2. Motsvarande ROI markerades på snittet under snittet med maxvärdet för ROI 5 respektive ROI 6 samt på snittet över snittet med maxvärdet för ROI 9 och ROI 10 (Tabell 2).
Ett annat sätt att beräkna TBR är användning av ROIsfär, med en bestämd
diameter, som centreras över maxvärdet [18,21]. I denna studie användes ROIsfär enligt Pauleit m.fl. [18] och Floeth m.fl. [21] med en area av 25 mm2. ROI
sfär ställdes in på 0,56 cm diameter vilket representerar en area på 25 mm2. ROI 3 motsvarade en ROIsfär som också kopierades för att erhålla spegelvänd
referensregion, ROI 4 (ROIref sfär), i den kontralaterala hemisfären (Figur 2). ROI 3 och spegelvänd ROI 4 ritades för beräkning av TBR mellan ROI 3 och 4.
Motsvarande ROI markerades på snittet under snittet med maxvärdet, ROI 7 respektive ROI 8 samt på snittet över snittet med maxvärdet, ROI 11 respektive ROI 12 (Tabell 2).
Både ROIthreshold och ROIsfär innehåller få pixlar, därav ritades ytterligare referens-ROI på 2,0 cm diameter (referens-ROIref 2,0cm). ROIref 2,0cm placerades över grå och vit substans samt över ROIref threshold och ROIref sfär för att vara säker på att erhålla ett referens-ROIsom innefattar både grå och vit hjärnsubstans. Samtliga ROIref 2,0cm ritades över ROIref threshold och ROIref sfär i snittet med maxvärdet (ROI 13), snittet under (ROI 14) samt snittet över snittet med maxvärdet (ROI 15).
Figur 1. Bilden visar ett exempel på ritning av ROI 1, ROI 2 och ROI 13 i en av
patienterna.
Figur 2. Bilden visar ett exempel på ritning av ROI 3, ROI 4 och ROI 13 i en av
Tabell 2. Tabellen redovisar namngivning av ROI samt dess placering i förhållande till
snittet med maxvärdet.
ROI Förklaring av ROI ritningar
1 Representerar ROIthreshold inställd på 90 % av SUVmax i snittet med maxvärdet
2 Representerar ROIref threshold vilket är spegelvänd ROI 1, som används som referensregion vid beräkning av TBR mellan ROI 1 och 2 3 Representerar ROIsfär med 0,56 cm diameter som centreras i snittet
som innehåller maxvärdet i hela bildvolymen
4 Representerar ROIref sfär vilket är spegelvänd ROI 3, som används som referensregion vid beräkning av TBR mellan ROI 3 och 4 5 Representerar ROIthreshold inställd på 90 % av SUVmax i snittet under
snittet med maxvärdet
6 Representerar ROIref threshold vilket är spegelvänd ROI 5, som används som referensregion vid beräkning av TBR mellan ROI 5 och 6 7 Representerar ROIsfär med 0,56 cm i diameter som centreras i snittet
som innehåller maxvärdet i hela bildvolymen
8 Representerar ROIsfär vilket är spegelvänd ROI 7, som används som referensregion vid beräkning av TBR mellan ROI 7 och 8
9 Representerar ROIthreshold inställd på 90 % av SUVmax i snittet över snittet med maxvärdet
10 Representerar ROIref threshold vilket är spegelvänd ROI 9, som används som referensregion vid beräkning av TBR mellan ROI 9 och 10 11 Representerar ROIsfär med 0,56 cm i diameter som centreras i snittet
som innehåller maxvärdet i hela bildvolymen
12 Representerar ROIsfär vilket är spegelvänd ROI 11, som används som referensregion vid beräkning av TBR mellan ROI 11 och 12
13
Representerar ROIref 2,0cm och placeras över ROI 2 och 4. ROI 13 används för beräkning av TBR då skillnaden mellan ROI 2 respektive ROI 4 och ROI 13 är 30 %
14
Representerar ROIref 2,0cm och placeras över ROI 6 och 8. ROI 14 används för beräkning av TBR då skillnaden mellan ROI 6 respektive ROI 8 och ROI 14 är 30 %
15
Representerar ROIref 2,0cm och placeras över referens-ROI 10 och 12. ROI 15 används för beräkning av TBR då skillnaden mellan
referens-ROI 10 respektive referens-ROI 12 och ROI 15 är 30 % ROIref 2,0cm=referens-ROI på 2,0 cm diameter; ROI=region av intresse; SUVmax=maximala upptaget av standardiserat upptagsvärde; TBR=tumör till bakgrund förhållande.
Beräkning av TBR vid undantagsfall
Vid analys av TBR kunde vid vissa fall, ROIthreshold inställd på 90 % av SUVmax, utlinjera FET-upptag över kärl, skallben eller utanför hjärnvävnad. I dessa förhållanden flyttades ROIthreshold till FET-upptag som bestod av tumörvävnad.
Metod vid resultatsammanställning av TBR
Efter genomförda ROI ritningar sparades ROI-filen och ROI kopierades till resterande rekonstruerade bildvolymer. Alla datauppgifter exporterades till CSV-filformat och överfördes sedan till Excel-fil. Två olika TBR-värden beräknades, TBRmax beräknades enligt ekvation (2) och TBRmedel beräknades enligt ekvation (3).
För att vara säker på att ROIref threshold respektive ROIref sfär väl representerar bakgrundsupptag i vit- och grå hjärnsubstans, jämfördes ROIref 2,0cm med ROIref sfär respektive ROIref threshold. Skillnaden mellan dem beräknades i procent [%]. Vid skillnad 30 % beräknades TBRmax samt TBRmedel på nytt genom att parametern
SUVmedel för ROIreferens ersattes med SUVmedel för ROIref2,0cm i ekvation (2-3). Under det situationer där ROIref 2,0cm inte kunde placeras i samma snitt som övriga
ROIreferens, gjordes ingen jämförelse mellan referensregionerna.
Medelvärdet av de tre snittens TBRmax respektive TBRmedel, beräknades. Slutligen erhölls fyra medelvärden, d.v.s. medelvärdet för TBRmax ROIthreshold, TBRmax ROIsfär, TBRmedel ROIthreshold och TBRmedel ROIsfär. Den procentuella skillnaden [%], beräknades mellan de olika tiderna för respektive
rekonstruktionsmetod för att bedöma hur TBR varierar med olika
bildtagningstider. Likaså beräknades den procentuella skillnaden [%], mellan de olika rekonstruktionsmetoderna för att bedöma hur mycket TBR-värdet varierar med de olika rekonstruktionsmetoderna.
Etik
Ansökan till etikrådet vid fakulteten Hälsa och samhälle på Malmö Universitet godkändes 2020-01-31 (Ärendenummer: HS2020, löpnummer: 1). Samtliga personuppgifter har behandlats konfidentiellt där pseudonymisering använts. Det finns ingen spårbarhet till patienterna i resultatet.
RESULTAT
Resultaten av rekonstruktionens påverkan vid kvantitativ bedömning av FET-PET presenteras i diagram samt tabeller.
Resultatredovisning av TBRmax och TBRmedel
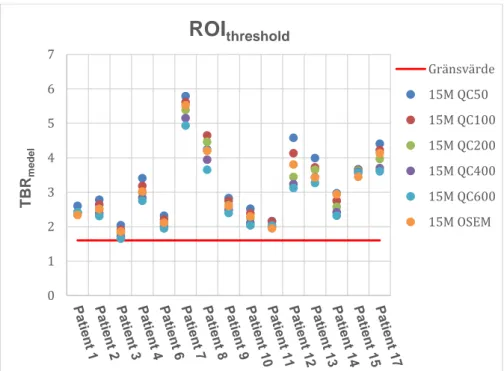
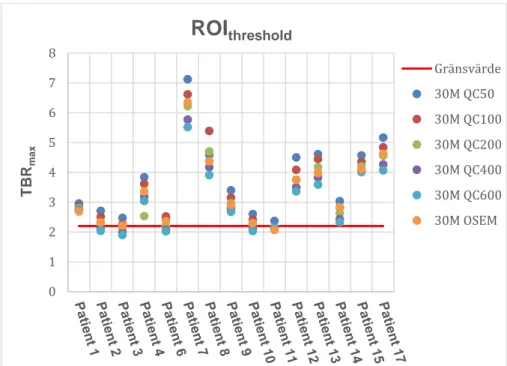
Resultat av studien för medelvärden mellan snittet med maxvärdet, snittet under snittet med maxvärdet och snittet över snittet med maxvärdet, för TBRmax och TBRmedel för ROIthreshold respektive ROIsfär presenteras i figur 3-6. Gränsvärdet sattes ut för visuellt syfte. Resultaten visar att ju lägre -värde för QC, desto högre TBR-värden erhålls. Variation i TBR-värde ses beroende på vilken
Figur 3. Figuren visar TBRmax för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärdet för TBRmax på 2,2. Motsvarande diagram redovisas för sista 20M respektive 15M (Bilaga 1). M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
Figur 4. Figuren visar TBRmax för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärdet för TBRmax på 2,2. Motsvarande diagram redovisas för sista 20M respektive 15M (Bilaga 1). M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
0 1 2 3 4 5 6 7 8 T BR m ax
ROI
threshold Gränsvärde 30M QC50 30M QC100 30M QC200 30M QC400 30M QC600 30M OSEM 0 1 2 3 4 5 6 7 8 T BR m axROI
sfär Gränsvärde 30M QC50 30M QC100 30M QC200 30M QC400 30M QC600 30M OSEMFigur 5. Figuren visar TBRmedel för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärdet för TBRmedel på 1,6. Motsvarande diagram redovisas för sista 20M respektive 15M (Bilaga 1). M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear;
TBR=tumör till bakgrundförhållande.
Figur 6. Figuren visar TBRmedel för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärdet för TBRmedel på 1,6. Motsvarande diagram redovisas för sista 20M respektive 15M (Bilaga 1). M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear;
TBR=tumör till bakgrundförhållande.
Resultatredovisning av procentuella skillnader
Resultaten av den procentuella skillnaden mellan de olika rekonstruktionerna och mellan de olika tiderna presenteras i tabeller. Resultaten visar att medelvärdet av den procentuella skillnaden mellan de tre olika tiderna respektive
rekonstruktionsmetod för de olika -värdena och OSEM ligger mellan 5-10 %
0 1 2 3 4 5 6 7 T BR m ed el
ROI
threshold Gränsvärde 30M QC50 30M QC100 30M QC200 30M QC400 30M QC600 30M OSEM 0 1 2 3 4 5 6 7 T BR m ed elROI
sfär Gränsvärde 30M QC50 30M QC100 30M QC200 30M QC400 30M QC600 30M OSEM(Tabell 3). Resultaten i tabell 4 visar den maximala procentuella skillnaden och medelvärdet av den procentuella skillnaden för TBRmax alternativt TBRmedel mellan de olika rekonstruktionerna, för alla tre tiderna och alla 15 patienter, för ROIthreshold respektive ROIsfär. Den maximala procentuella skillnaden mellan TBRmax alternativt TBRmedel för ROIthreshold respektive ROIsfär ligger mellan 25-40 %. Medelvärdet för den procentuella skillnaden mellan TBRmax alternativt
TBRmedel för ROIthreshold respektive ROIsfär ligger mellan 15-25 % (Tabell 4).
Tabell 3. Tabellen redovisar medelvärdet av den procentuella skillnaden i [%] för TBRmax alternativt TBRmedel för ROIthreshold respektive ROIsfär och alla patienter, mellan tiderna 30M, sista 20M och sista 15M, för respektive rekonstruktionsmetod.
Den procentuella skillnaden mellan tiderna 30M, sista 20M samt sista 15M
-värde 50 100 200 400 600 OSEM Medelvärdet av den procentuella skillnaden, i procent [%], för TBRmax ROIthreshold 9,1 10,5 6,8 6,0 5,2 7,1 Medelvärdet av den procentuella skillnaden, i procent [%], för TBRmax ROIsfär 11,2 7,4 5,7 4,9 4,5 7,8 Medelvärdet av den procentuella skillnaden, i procent [%], för TBRmedel ROIthreshold 7,6 9,2 6,3 5,6 5,4 7,4 Medelvärdet av den procentuella skillnaden, i procent [%], för TBRmedel ROIsfär 7,6 5,8 5,2 4,6 4,3 6,5
Tabell 4. Tabellen redovisar maxvärdet respektive medelvärdet av den procentuella
skillnaden, i [%] för TBRmax alternativt TBRmedel mellan de olika
rekonstruktionsmetoderna, för ROIthreshold respektive ROIsfär, alla tre tiderna och alla patienter.
Den procentuella skillnaden mellan de olika rekonstruktionerna TBRmax ROIthreshold TBRmax ROIsfär TBRmedel ROIthreshold TBRmedel ROIsfär Maxvärdet av den procentuella skillnaden, i procent [%]. 38,4 35,6 31,8 25,0 Medelvärdet av den procentuella skillnaden, i procent [%]. 22,6 21,3 17,2 13,6
DISKUSSION
Metoddiskussion
I denna studie användes ROIthreshold inställning på 90 % av SUVmax, vilket även har använts i studien av Jansen m.fl. [12] för beräkning av TBR-värden. Gränsen 90 % valdes av anledningen att endast inkludera pixlar med tumörupptag. Desto lägre gräns, desto fler pixlar inkluderas och risken för att involvera pixlar som inte är tumörupptag ökar. TBRmedel blir påverkad om bakgrundsupptag inkluderas eftersom pixelvärden medelvärdesberäknas i ROI.
Det uppstod förändringar vid tillämpning av ROIref 2,0cm för patient 3, 7, 9, 10 samt 14 (Bilaga 2). ROIref 2,0cm kunde inte alltid läggas på snittet över ROIref sfär och ROIref threshold då tumörupptag låg i delar av hjärnan med mindre visualiserad andel grå- och vit hjärnsubstans. Jämförelsen mellan ROIref 2,0cm är inte lämpligt när det markeras i ett annat snitt. Jämförelsen mellan ROIref 2,0cm och ROIref threshold samt ROIref 2,0cm och ROIref sfär blir inte värdefullt, då ROIref 2,0cm markeras i ett annat snitt. Även om ROIref 2,0cm hade ställts in på ett värde <2,0 cm diameter hade ROI behövt flyttas, då det inte visualiserades tillräckligt med grå- och vit hjärnsubstans i snittet där tumörupptaget var beläget.
Kärl kan få ett ökat FET-upptag [9-10]. Då pixlar i dessa områden, i vissa fall, har pixelvärden 90 % av SUVmax utlinjerades ROIthreshold över kärlupptaget. Det innebär att ROIthreshold inte utlinjerar tumörupptaget korrekt. Då ROIthreshold placerade sig i kärlupptag flyttades ROI manuellt till tumörupptaget. I vissa situationer kunde inte hela ROI placeras över endast tumörupptag, vilket gav upphov till att även bakgrundsupptag inkluderades i ROI. Detta gällde för patient 2, 3, 4, 10 samt 13 i några av snitten för ROIthreshold. Även ROIsfär är inte alltid representativt när tumörupptaget är väldigt litet. Det kan då inkludera
bakgrundsupptag. I denna studie representerade ROIsfär tumörupptaget bättre jämfört med ROIthreshold, då ROIsfär har en bestämd storlek och form.
Resultatdiskussion
Resultaten i figurer 4-6 visar att QC50 erhåller högst TBR-värde och QC600 erhåller lägst värde, det vill säga, ju mer β-värdet ökar, desto lägre blir TBR-värdet. Ju högre -värde desto högre brusreducering har applicerats på
bildvolymerna vid rekonstruktionen. Kontrasten i bildvolymen minskar, ju mer QC-värdena ökar. QC50 ger således högre kontrast i bildvolymerna.
Högre kontrast i bildvolymerna framhävs genom tydligare avgränsningar mellan upptag och bakgrundsupptag, medan bildvolymer med lägre kontrast ser
”utsmetade och mjukare ut”. Brus består av höga frekvenser, när -värdet ökar, ökar även brusreduceringen i bildvolymen [16]. Ökad brusreducering resulterar i en ökad filtrering av höga frekvenser, vilket leder till minskade SUV-värden i framförallt områden med högt FET-upptag. Därav sjunker även TBR-värdet med ökad brusreducering. Detta förklarar varför QC600 erhåller lägre TBR-värden. Enligt figurer 4-6 ligger TBR-värdena för OSEM, mellan QC-värdena. OSEM är en rekonstruktionsmetod som brusreducerar utifrån de filterinställningar som valts inför rekonstruktionen, medan med QC sätts en viktning (-värdet) på hur stor inverkan brusreducering ska få på bildvolymen. Eftersom QC och OSEM är två olika rekonstruktioner, med olika algoritmer som behandlar data, anses OSEM
inte vara jämförbart med QC. Då OSEM är en rekonstruktionsmetod som används på SUS i Lund och även på de flesta sjukhus i Sverige, inkluderas denna
rekonstruktionsmetod. QC ägs av företaget Philips vilket medför att andra sjukhus med andra kameror inte kan förhålla sig till resultaten om man endast studerar rekonstruktionsmetoden QC. Även på SUS i Lund är QC en relativt ny
rekonstruktionsmetod vilket kan vara svårt att förhålla sig till, jämfört med OSEM, där man har mer kunskap kring metoden.
I figurerna 4-6 markerades gränsvärdet 2,2 för TBRmax och 1,6 för TBRmedel ur visuellt syfte. Enligt ett flertal studier rekommenderas dessa gränsvärden som en riktlinje för att avgöra om en tumör är hög- respektive lågmalign [4,18-19]. Då TBR-värdet påverkas beroende på vilken rekonstruktionsmetod som används kan användandet av ett gränsvärde som är oberoende av rekonstruktionsmetod leda till att patienten blir feldiagnosticerad. Resultatet visade att ju lägre -värde, desto högre TBR-värde vilket då skulle innebära att tumören är mer malign. Gränsvärden anses därför inte som en optimal riktlinje att utgå ifrån vid
bedömning av FET-PET undersökningar. Denna studie motbevisar användandet av ett gränsvärde vid tumörklassifikation vid FET-PET.
Den procentuella skillnaden i tabell 3 för TBRmax alternativt TBRmedel för ROIsfär respektive ROIthreshold och alla patienter, mellan tiderna 30M, sista 20M och sista 15M, för rekonstruktionsmetod visar att medelvärdet av den procentuella
skillnaden ligger mellan 5-10 %.Detta innebär att oavsett vilket tidsintervall rekonstruktionerna är utförda under, påverkas inte TBR-värdena nämnvärt. Detta indikerar att optimeringsarbete skulle kunna utföras på metoden genom att sänka mängden injicerad aktivitet alternativt förkorta bildtagningstiden. Antingen kan mindre mängd aktivitet till patienten injiceras vilket i sin tur ger lägre effektiv dos och behålla undersökningstiden på 30 minuter, alternativt injicera samma mängd aktivitet som ges idag och förkorta bildinsamlingstiden. För att säkerställa påståendet krävs ytterligare optimeringsarbete vilket det inte fanns tidsutrymme för. En förkortad bildinsamlingstid är en fördel då problem med rörelseartefakter i större utsträckning kan undvikas. Det är även till fördel vid undersökning av patienter som lider av demenssjukdomar och klaustrofobi.
För att avgöra skillnaden för TBRmax respektive TBRmedel, för olika ROI (ROIthreshold och ROIsfär)beräknades den procentuella skillnaden mellan de sex olika rekonstruktionerna, som redovisas i tabell 4. Den procentuella skillnaden beräknades över alla tre tidsintervall samt alla patienter. Den maximala
procentuella skillnaden av TBRmax och TBRmedel för ROIthreshold respektive ROIsfär mellan de olika rekonstruktionerna ligger mellan 25-40 %. Medelvärdet för den procentuella skillnaden av TBRmax och TBRmedel för ROIthreshold respektive ROIsfär ligger mellan 15-25 %. Resultaten visade att maximala och medelvärden för den procentuella skillnaden för TBRmax jämfört med TBRmedel var högre. TBRmedel inkluderar alla pixlar i ROI och ger ett genomsnittligt värde, medan TBRmax är värden som representerar ett maxvärde över en pixel i ROI. I detta fall visade sig TBRmedel vara en pålitligare metod, då den procentuella skillnaden av TBR-värden för de olika rekonstruktionsmetoderna var mindre.
bakgrundsupptag om tumörupptaget är väldigt litet. Vid TBRmax för ROIsfär påverkas inte resultatet om ROI inkluderar bakgrundsupptag, då det bara inkluderar pixlar med maxvärden, medan vid TBRmedel för ROIsfär påverkas resultatet eftersom pixelvärden medelvärdesberäknas i ROI. För denna
patientgrupp utlinjerade ROIsfär tumörupptaget väl och det diskuterade problemet inträffade inte, vilket resulterar i att TBRmedel för ROIsfär visade sig vara det pålitligaste måttet i denna studie.
Antalet inkluderade patienter i studien som var opererade var 9 av 15. Resterande hade inte genomgått resektion. Majoriteten av de inkluderade patienterna i studien visade sig ha maligna tumörer. Enligt figur 3-6 hamnar majoriteten av patienter över gränsvärden för TBRmax och TBRmedel. Trots detta är det den procentuella skillnaden i TBR-värden för de sex olika rekonstruktionerna för respektive patient som är av intresse. Studien hade kunnat uppvisa andra resultat om en annan patientgrupp hade studerats med annan tumörklassifikation med samma
procentuella skillnad i TBR-värden. Samma procentuella skillnad i TBR-värden hade eventuellt kunnat ses med lägre TBR-värden i förhållande till de patienter vi studerat. För en sådan patientgrupp hade gränsvärdet på TBR, kanske haft större påverkan på diagnostisering av deras tumörklassifikation. Således spelar den procentuella skillnaden stor roll trots att TBR-värdet ligger över gränsvärdet, för majoriteten av patienterna, för alla rekonstruktionsmetoderna.
Begränsningar
Antalet inkluderade patienter i studien var begränsat då patienter som genomgått FET-PET undersökning i SUS Lund under ny kamera efter september 2017 inkluderades. Majoriteten av de inkluderade patienterna hade högmaligna tumörer och representerade inte så väl olika typer av hjärntumörer med varierande grad. Vid metodutförandets gång kunde inte ROIthreshold ritningen optimeras enligt tumörupptaget vilket medförde att ROIthreshold ritningen kunde formas utifrån kärlupptaget i det fall kärlupptaget erhöll pixelvärden 90 % av SUVmax.
SLUTSATS
Slutsatsen av rekonstruktionens påverkan av kvantitativ bedömning vid FET-PET är att det finns en risk för felaktig klassificering av tumör, eftersom TBR-värdet varierar med olika rekonstruktionsmetoder. Vid bedömning av FET-PET är det inte optimalt att ta hänsyn till gränsvärden. Optimeringsarbete krävs för att kunna minska mängden injicerad aktivitet till patienten alternativt bildinsamlingstiden för det protokoll som används på SUS.
REFERENSER
1. Berglund E, Jönsson B A, (2007) Medicinsk fysik. Lund, Studentlitteratur. 2. Hietala S O, Riklund Åhlström K, (2013) Nuklearmedicin. Lund,
Studentlitteratur.
3. Isaksson M, (2010) Grundläggande strålningsfysik. Lund, Studentlitteratur. 4. Dunet V, Prior J O, (2013) Diagnostic accuracy of F-18-fluoroethyltyrosine PET and PET/CT in patients with brain tumor. Clinical and Translational
Imaging 1, (2), 135-144.
5. Hutterer M, Nowosielski M, Putzer D, Jansen N L, Seiz M, Schocke M, McCoy M, Göbel G, La Fougère C, Virgolini I J, Trinka E, Jacobs A H, Stockhammer G, (2013) [18F]-fluoro-ethyl-l-tyrosine PET: A valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma.
Neuro-Oncology, 15(3), 341-351.
6. Heiss P, Mayer S, Herz M, Wester H J, Schwaiger M, Senekowitsch-Schmidtke R, (1999) Investigation of transport mechanism and uptake kinetics of O-(2- [18F]fluoroethyl)-L-tyrosine in vitro and in vivo. Journal
of Nuclear Medicine, 40(8), 1367-1373.
7. Wester H J, Herz M, Weber W, Heiss P, Senekowitsch-Schmidtke R, Schwaiger M, Stöcklin G, (1999) Synthesis and radiopharmacology of S-(2-18F-fluoroethyl)-L-methionine for tumor imaging. Journal of Nuclear
Medicine, 40, 205-212.
8. Avcıbaşı U, Ateş B, Ünak P, Gümüşer F G, Gülcemal S, Ol K K, Akgöl S, Tekin V, (2019) A novel radiolabeled graft polymer: Investigation of the radiopharmaceutical potential using Albino Wistar rats. Applied Radiation
and Isotopes, 154(7), 1-9.
9. Weckesser M, Langen K J, Rickert C H, Kloska S, Straeter R, Hamacher K, Kurlemann G, Wassmann H, Coenen H H, Schober O, (2005) O-(2-[18F]fluorethyl)-L-tyrosine PET in the clinical evaluation of primary brain tumours. European Journal of Nuclear Medicine and Molecular Imaging,
32(4), 422-429.
10. Stockhammer F, Prall F, Dunkelmann S, Plotkin M, Piek J, (2012)
Stereotatic Biopsy of a Cerebral Capillary Telangiectasia after a Misleading F-18-FET-PET. Journal of neurologickal surgery, 73(6), 407-409.
11. Piroth M D, Pinkawa M, Holy R, Klotz J, Nussen S, Stoffels G, Coenen H H, Kaiser H J, Langen K J, Eble M J, (2011) Prognostic value of early [ 18F]fluoroethyltyrosine positron emission tomography after
MRI-suspected low-grade glioma: Is there a need to perform dynamic FET PET? European Journal of Nuclear Medicine and Molecular Imaging,
39(6), 1021-1029.
13. Dunet V, Prior J O, (2013) FET PET in neuro-oncology and in evaluation of treatment response. PET Clinics, 8(2), 147-162.
14. Kunz M, Thon N, Eigenbrod S, Hartmann C, Egensperger R, Herms J, Geisler J, La Fougere C, Lutz J, Linn J, Kreth S, Von Deimling A, Tonn J C, Kretzschmar H A, Pöpperl G, Kreth F W, (2011) Hot spots in
dynamic18FET-PET delineate malignant tumor parts within suspected WHO grade II gliomas. Neuro-Oncology, 13(3), 307-316.
15. Boellaard R, (2009) Standards for PET image acquisition and quantitative data analysis. Journal of Nuclear Medicine, 50(5), 11-21.
16. Ross S, (2014) GE Healthcare: Q. Clear. GE Healthcare White Paper, 1-9. 17. Kinahan P E, Fletcher J W, (2010) Positron emission
tomography-computed tomography standardized uptake values in clinical practice and assessing response to therapy. Seminars in Ultrasound, CT and MRI, 31(6), 496-505.
18. Pauleit D, Floeth F, Hamacher K, Riemenschneider M J, Reifenberger G, Müller H W, Zilles K, Coenen H H, Langen K J, (2005)
O-(2-[18F]fluoroethyl)-L-tyrosine PET combined with MRI improves the diagnostic assessment of cerebral gliomas. Brain, 128(3), 678-687. 19. Pöpperl G, Götz C, Rachinger W, Gildehaus F J, Tonn J C, Tatsch K,
(2004) Value of O-(2-[18F]fluoroethyl)-L-tyrosine PET for the diagnosis of recurrent glioma. European Journal of Nuclear Medicine and Molecular
Imaging, 31(11), 1464-1470.
20. Pauleit D, Floeth F, Herzog H, Hamacher K, Tellmann L, Müller H W, Coenen H H, Langen K J, (2003) Whole-body distribution and dosimetry of O-(2-[18F]fluoroethyl)-L-tyrosine. European Journal of Nuclear
Medicine and Molecular Imaging, 30(4), 519-524.
21. Floeth F W, Sabel M, Ewelt C, Stummer W, Felsberg J, Reifenberger G, Steiger H J, Stoffels G, Coenen H H, Langen K J, (2011) Comparison of 18F-FET PET and 5-ALA fluorescence in cerebral gliomas. European
BILAGA 1
Bilaga 1 redovisar resultaten av medelvärden av TBRmax och TBRmedel för ROIthreshold respektive ROIsfär för sista 20M respektive sista 15M.
Figur 7. Figuren visar TBRmax för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmax på 2,2. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
Figur 8. Figuren visar TBRmax för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmax på
0 1 2 3 4 5 6 7 T BR m ax
ROI
threshold Gränsvärde 20M QC50 20M QC100 20M QC200 20M QC400 20M QC600 20M OSEM 0 1 2 3 4 5 6 7 T BR m axROI
sfär Gränsvärde 20M QC50 20M QC100 20M QC200 20M QC400 20M QC600 20M OSEMFigur 9. Figuren visar TBRmedel för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmedel på 1,6. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
Figur 10. Figuren visar TBRmedel för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmedel på 1,6. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
0 1 2 3 4 5 6 7 T BR m ed el
ROI
threshold Gränsvärde 20M QC50 20M QC100 20M QC200 20M QC400 20M QC600 20M OSEM 0 1 2 3 4 5 6 T BR m ed elROI
sfär Gränsvärde 20M Q50 20M QC100 20M QC200 20M QC400 20M QC600 20M OSEMFigur 11. Figuren visar TBRmax för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmax på 2,2. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
Figur 12. Figuren visar TBRmax för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmax på 2,2. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
0 1 2 3 4 5 6 7 T BR m ax
ROI
threshold Gränsvärde 15M QC50 15M QC100 15M QC200 15M QC400 15M QC600" 15M OSEM 0 1 2 3 4 5 6 7 T BR m axROI
sfär Gränsvärde 15M QC50 15M QC100 15M QC200 15M QC400 15M QC600 15M OSEMFigur 13.Figuren visar TBRmedel för 5 QC-rekonstruktioner med olika -värden och OSEM, för det 15 inkluderade patienterna i studien. Heldragen linje representerar gränsvärde för TBRmedel på 1,6. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
Figur 14. Figuren visar TBRmedel för 5 QC-rekonstruktioner med olika -värden och OSEM, för de 15 inkluderade patienterna. Heldragen linje representerar gränsvärde för TBRmedel på 1,6. M=minuter; OSEM=Ordered Subset Expectation Maximization; QC=QClear; TBR=tumör till bakgrundförhållande.
0 1 2 3 4 5 6 7 T BR m ed el
ROI
threshold Gränsvärde 15M QC50 15M QC100 15M QC200 15M QC400 15M QC600 15M OSEM 0 1 2 3 4 5 6 T BR m ed elROI
sfär Gränsvärde 15M QC50 15M QC100 15M QC200 15M QC400 15M QC600 15M OSEMBILAGA 2
Bilaga 2 representerar tabell för metod- samt tumörinformation för de inkluderade patienterna.
Tabell 3. Tabellen redovisar information vid eventuella metodförändringar och dess orsaker för respektive patient. Tabellen redovisar även om
patienterna genomgått resektion samt tumörens klassifikation.
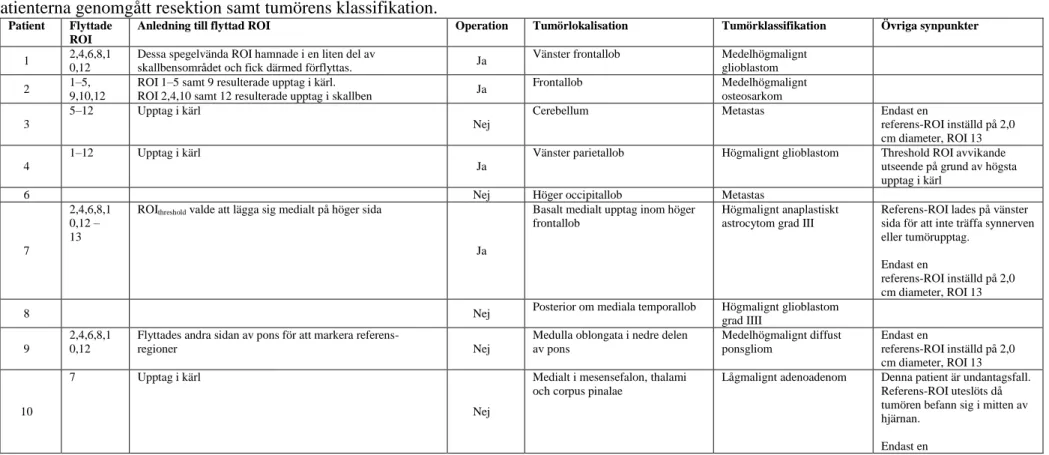
Patient Flyttade
ROI
Anledning till flyttad ROI Operation Tumörlokalisation Tumörklassifikation Övriga synpunkter
1 2,4,6,8,1 0,12
Dessa spegelvända ROI hamnade i en liten del av
skallbensområdet och fick därmed förflyttas. Ja
Vänster frontallob Medelhögmalignt glioblastom 2 1–5,
9,10,12
ROI 1–5 samt 9 resulterade upptag i kärl.
ROI 2,4,10 samt 12 resulterade upptag i skallben Ja
Frontallob Medelhögmalignt osteosarkom 3
5–12 Upptag i kärl
Nej
Cerebellum Metastas Endast en
referens-ROI inställd på 2,0 cm diameter, ROI 13 4
1–12 Upptag i kärl
Ja
Vänster parietallob Högmalignt glioblastom Threshold ROI avvikande utseende på grund av högsta upptag i kärl
6 Nej Höger occipitallob Metastas
7
2,4,6,8,1 0,12 – 13
ROIthreshold valde att lägga sig medialt på höger sida
Ja
Basalt medialt upptag inom höger frontallob
Högmalignt anaplastiskt astrocytom grad III
Referens-ROI lades på vänster sida för att inte träffa synnerven eller tumörupptag.
Endast en
referens-ROI inställd på 2,0 cm diameter, ROI 13
8 Nej Posterior om mediala temporallob Högmalignt glioblastom
grad IIII 9
2,4,6,8,1 0,12
Flyttades andra sidan av pons för att markera
referens-regioner Nej
Medulla oblongata i nedre delen av pons Medelhögmalignt diffust ponsgliom Endast en referens-ROI inställd på 2,0 cm diameter, ROI 13 10 7 Upptag i kärl Nej
Medialt i mesensefalon, thalami och corpus pinalae
Lågmalignt adenoadenom Denna patient är undantagsfall. Referens-ROI uteslöts då tumören befann sig i mitten av hjärnan.
referens-ROI inställd på 2,0 cm diameter, som motsvarar referens-ROI 7
11 Ja Vänster frontallob Singelmetastas
12 Ja Vänster frontotemporalt Högmalignt glioblastom
grad IIII
Högst upptag i temorallob 13 5–12 Upptag i kärl Ja Frontotemporalt på höger sida metastas 3 upptag
14
2,4,6,8,1 0,12–13
ROI 2,4,10 och 12 hamnade på tumören.
ROI 6 och 8 flyttades till vänster sida av upptaget. Eftersom ROI 5 och 7 la sig på höger sida enligt programmet placerades referens ROI 6 och 8 på höger sida.
Nej
Tumör i skallgropen Plasmocytom Endast en
referens-ROI inställd på 2,0 cm diameter, ROI 13
15 2,4,6,8,1
0, 12–15 Ja
Frontotemporalt i vänster sida Högmalignt anaplastisk astrocytom grad III 17 2,4,6,8,1
0,12
Upptag i skallbenet
Ja Vänster temporallob och parietallob
Högmalignt glioblastom grad IIII

![Tabell 4. Tabellen redovisar maxvärdet respektive medelvärdet av den procentuella skillnaden, i [%] för TBR max alternativt TBR medel mellan de olika](https://thumb-eu.123doks.com/thumbv2/5dokorg/3951634.75211/16.892.148.740.285.672/tabellen-redovisar-maxvärdet-respektive-medelvärdet-procentuella-skillnaden-alternativt.webp)