Epitelial ovarialcancer: U-CAN-databasens generaliserbarhet samt
prognos för neoadjuvant behandlade patienter i Uppsala
- Retrospektiv registerstudie i Region Uppsala
Författare: Lovisa Alarik
Handledare: Ingrid Glimelius & Camilla Sköld
Onkologkliniken, Akademiska sjukhuset Uppsala
Skriftlig rapport, Läkarprogrammet (30 hp)
2018-08-31
Innehållsförteckning
1. ORDLISTA ... 4 2. ABSTRACT ... 5 3. POPULÄRVETENSKAPLIG SAMMANFATTNING ... 6 4. BAKGRUND ... 7 4.1. EPIDEMIOLOGI ... 7 4.2 ETIOLOGI ... 7 4.3 KLINISK PRESENTATION/SYMTOM ... 8 4.4 UTREDNING ... 9 4.5 STADIEINDELNING ... 9 4.6 PROGNOS ... 9 4.7 PERFOMANCE STATUS ... 9 4.8 BEHANDLING ... 10 4.8.1 Kirurgi ... 10 4.8.2 Cytostatika ... 11 4.8.2.1 Neoadjuvant ... 11 4.8.2.2 Adjuvant ... 14 4.8.2.3 Palliativ ... 15 4.9 PLATINUM-RESISTENS ... 15 4.10 U-CAN ... 154.11 SYFTE MED STUDIEN ... 16
5. FRÅGESTÄLLNINGAR OCH HYPOTESER: ... 16
5.1 FRÅGESTÄLLNINGAR ... 16
5.2 HYPOTESER ... 17
6. METOD ... 18
6.1 STUDIEDESIGN OCH PATIENTPOPULATION ... 18
6.2 KVALITETSREGISTERDATA ... 18 6.3 U-CAN ... 19 6.4 STATISTISKA ANALYSER ... 21 6.5 ETISKT TILLSTÅND ... 22 7. RESULTAT ... 23 7.1 U-CAN VS INCA ... 23 7.1.1 Kliniska karakteristika: ... 23 7.1.2 Behandling ... 25 7.1.3 Behandlingsrespons ... 25
7.2 NEOADJUVANT TERAPI VS GOLDEN STANDARD ... 28
7.2.1 Patienter med avancerat stadium (IIIC och IV), neoadjuvant behandlade ... 28
7.2.2 Primär cytostatikabehandling jämfört med primärkirurgi, behandlingsintention ... 28
7.2.3. Primär cytostatikabehandling jämfört med primärkirurgi, erhållen behandling ... 31
7.2.4 Prognos för neoadjuvant behandlade patienter som ej kommer till operation ... 32
7.3 PROGNOS FÖR RESPEKTIVE FIGO-STADIUM ... 33
8. DISKUSSION ... 34
8.2 INCA VS U-CAN ... 34
8.3 NEOADJUVANT BEHANDLADE PATIENTER ... 36
8.4 METODANALYS ... 40 8.5 STATISTIKANALYS ... 41 9. SLUTSATS ... 42 10. FÖRFATTARENS TACK ... 42 11. REFERENSER ... 42
1. Ordlista
U-CAN: U-CAN är en biobank med tumörmaterial och annat biologiskt material I Uppsala och Umeå.
INCA: INCA är en nationell IT-plattform som innehåller kvalitetsregister för vård och forskning om cancer. Drivs och hanteras av Regionalt Cancercentrum.
Performance-status: Ett mått på patientens allmäntillstånd och används för att gradera symptom och allmäntillstånd hos cancerpatienter. Bedöms av läkare innan start av behandling, under behandling samt efter behandling. Graderas 0-5 enligt WHO.
Cytoreduktiv/debulking-kirurgi: Kirurgi som görs med syfte att reducera tumörmassa.
Adjuvant cytostatika: Cytostatika given efter operation för att minska risken för recidiv samt ta bort mikroskopisk tumörrest.
Neoadjuvant cytostatika: Cytostatika givet innan operation med syfte att krympa tumörbördan eller göra patienten i bättre skick inför operation.
Residualtumör: Kvarlämnad tumör efter kirurgi.
2. Abstract
Purpose: Firstly, to clarify whether patients included in the U-CAN-biobank represent a generalizable sample of all epithelial ovarian cancer patients included in the population-based ovarian cancer quality-register (INCA). Secondly, to illustrate the prognosis for patients with stage IIIC-IV epithelial ovarian cancer treated with neoadjuvant chemotherapy compared to golden standard (primary surgery).
Method: In this combined register and medical record based retrospective study, 191 patients diagnosed with epithelial ovarian cancer between 2009-2017 in Uppsala region were identified, 83 of them were also registered in the U-CAN-biobank. Stage IIIC-IV (n=131) patients were identified; among these, patients were either treated with neoadjuvant therapy or primary surgery. The studied groups were compared regarding clinical characteristics, treatment response and overall survival (visualized by Kaplan Meier plots). Statistical significance was tested with chi2 and log-rank tests (p<0.05).
Result: Patients in U-CAN were more often treated with curative intention p<0.001, and U-CAN-patients had a better survival (p=0.026) than U-CAN-patients only included in INCA. The neoadjuvant group (n=49) had a poorer performance status at diagnosis than the primary surgery group (n=64), p=0.002. Overall survival showed no significant difference between the studied groups (p=0.14).
Conclusion: The U-CAN-biobank seems to include a selected material of preferably patients treated with curative intention. Despite worse performance status at diagnosis for the neoadjuvant group, overall survival were similar in neoadjuvant treated patients and patients treated with primary surgery.
3. Populärvetenskaplig sammanfattning
I Uppsala och Umeå finns en biobank, U-CAN, som sparar biologiskt material från olika tumörformer för framtida forskning. Det är därför viktigt att materialet i biobanken är
representativt för hela gruppen patienter. Den här retrospektiva register- och journalstudien syftar till att presentera hur generaliserbar U-CAN är jämfört med patienter med äggstockscancer i Region Uppsala i stort. Resultaten i studien visar att U-CAN innehåller en större andel som fick en botande behandling än övriga populationen. Det ses en statistisk skillnad där patienterna i U-CAN lever längre än övriga populationen, men U-U-CAN har inte procentuellt fler avlidna. Den viktigaste faktorn för hur det kommer att gå för en patient med äggstockscancer är ifall det går att operera, och om det vid operation går att få bort all tumör. Äggstockscancer upptäcks ofta när den är långt gången, och blir följaktligen svår att få bort. En del patienter med spridd sjukdom får därför cellgifter innan operation. Vi tittade på hur många patienter det rörde sig om och hur det gick för de patienterna jämfört med de som fick den vanliga behandlingen (operation direkt med cellgifter efteråt). Resultaten visade att de patienter som erhållit cellgifter innan operation var i sämre skick vid diagnos än de som blev opererade direkt. Andelen som fick svåra
komplikationer efter operationen var större i gruppen som opererades direkt, men de som fick cellgifter innan operation utvecklade motståndskraft mot cellgifterna i större utsträckning. Det var även färre i gruppen som fått cellgifter innan operation som hade blivit av med hela sin tumörbörda när behandlingen avslutades. Det gick inte att se någon statistisk skillnad mellan grupperna avseende hur länge de levde. Studien visade inte heller på att det var sämre utfall för patienter som primärt fått cellgifter i hopp om senare operation än de patienter där planen aldrig varit att operera.
4. Bakgrund
4.1. Epidemiologi
Ovarialcancer utgörs till 90% av epitelial ovarialcancer och resten benämns som icke-epitelial. Ovarialcancer kan ha sitt ursprung i ovarierna, tuban, peritoneum, och i vissa fall okänt ursprung (1,2). I följande studie kommer epitelial ovarialcancer att avhandlas.
Enligt socialstyrelsens rapport om cancerincidens i Sverige diagnosticerades 696 fall av ovarialcancer år 2014, vilket motsvarar ca 3% av all kvinnlig cancer (3). Fördelningen av ovarialcancer skiljer sig mellan olika delar av världen, med högst incidens i de norra delarna av Europa och Nordamerika, och lägst antal insjuknande i södra delarna av Asien och Afrika (1). Kvinnor i alla åldrar kan drabbas, men före fyllda trettio år är diagnosen väldigt ovanlig. Av alla gynekologiska cancersjukdomar har ovarialcancer högst mortalitet. Både incidens och mortalitet har minskat succesivt sedan 1980-talet, dock mer uttalat för incidensen. Den relativa
överlevnaden har ökat, framförallt när det gäller korttidsöverlevnad. Både korttidsöverlevnad och femårsöverlevnad skiljer sig dessvärre åt mellan olika regioner i Sverige (1-års överlevnad ligger mellan 79.1%-85.6% i riket och 5-årsöverlevnad mellan 41.9%-47.8%) (1).
4.2 Etiologi
Ovarialcancer diagnostiseras oftast i sent stadium och prognosen är till följd av detta relativt dålig (4). I gruppen epitelial ovarialcancer ingår olika morfologiska typer; låggradig serös (LGSC), höggradig serös (HGSC), endometrioid, klarcellig och mucinös (1). Kliniskt ses ovarialcancer som en sjukdom, men på senare tid finns mer och mer indikation på att de olika morfologiska subtyperna har olika patogenes, naturalförlopp och prognos (5). Låggradig och höggradig serös ovarialcancer är inte olika grader av samma cancer, utan snarare två olika sjukdomar. I de låggradigt serösa cancrarna återfinns ofta B-RAF och K-RAS mutationer, medan höggradigt serösa cancrar nästan alltid har TP53 mutationer (6). Höggradigt serös är den absolut vanligaste formen av ovarialcancer (utgör 70%), är aggressiv och växer snabbt (1). Det finns mer och mer evidens för att stor andel av HGSC har sitt ursprung i tubarepitel (7), framförallt när det gäller de ärftliga formerna (8). HGSC är associerat med genetiskt instabilitet (6), och är den vanligaste sortens ovarialcancer hos kvinnor med ärftlig form (BRCA1 och BRCA2 mutationer) (9). Både
höggradigt serösa och låggradigt serösa är ofta i stadium III eller IV vid diagnos. Mucinösa cancrar är den ovanligaste formen av ovarialcancer. De upptäcks ofta i ett tidigt stadium och har i många fall utvecklats från mucinösa borderlinetumörer (4). Endometrioid och framför allt
klarcellig ovarialcancer kommer ofta ursprungligen från endometrioshärdar (4).
Det är viktigt att typa cancern eftersom det kan påverka den kliniska situationen. Klarcellig, mucinös och låggradigt serös cancer har sämre respons på traditionell cytostatikaregim (4). Studier har även visat att serös cancer oftare ger lymfkörtelmetastaser, även vid kliniskt lågt FIGO-stadium (10).
När det gäller riskfaktorer att utveckla ovarialcancer är ärftlighet den enskilt viktigaste. Övriga riskfaktorer som noterats är barnlöshet, hormonell behandling med östrogensubstitution, lång fertil ålder, endometrios (när det gäller klarcellig och endometrioid ovarialcancer). Mycket tyder dock på att riskfaktorerna skiljer sig mellan de olika morfologiska grupperna. Kända skyddande faktorer är amning, paritet och användande av kombinerade p-piller (1).
4.3 Klinisk presentation/symtom
Det förekommer ingen screening för ovarialcancer hos asymtomatiska kvinnor i Sverige idag. Det har inte gått att visa på att sceening leder till att färre kvinnor hittas i avancerat stadium eller till minskad dödlighet. Istället har det visats att screening är associerat med onödiga kirurgiska ingrepp med riskfyllda komplikationer (1).
Symptom och kliniska fynd som föranleder en skyndsam utredning avseende ovarialcancer innefattar postmenopausalblödning, urinträngningar, snabb mättnadskänsla, nytillkomna IBS-besvär hos kvinna över 50 år, pleuravätska, ascites samt ökat bukomfång/uppblåsthet (1,11). Framförallt sprider sig ovarialcancer genom att cancerceller växer längs peritoneum och i
bukvätska, vilket till viss del kan förklara symptomen som uppstår av cancern (1). En studie med 1725 amerikanska kvinnor visade att 89 % av alla kvinnor med stadium I-II och 97 % av de med stadium III och IV hade symptom före diagnos (12). För varje enskilt symptom är inte
sensitiviteten särskilt hög, men om flera symptom kombineras och håller i sig i mer än en vecka ökar den (13).
4.4 Utredning
Om läkaren misstänker ovarialcancer ska standardiserat vårdförlopp initieras för att möjliggöra snabb handläggning. Det innebär en ordentligt gyn-onkologisk anamnes, vanligt status (inklusive buk- och rektalpalpation) samt provtagning av CA 125 (gynekologisk cancermarkör). Om
misstanke kvarstår ska remiss skickas till en gynekolog. Gynekologen utgör en filterfunktion och utför gynekologisk undersökning med bimanuell palpation, vaginalt ultraljud, bedömning av CA 125 och RMI (risk of malignity-index där CA 125 värderas, postmenopausalitet samt
ultraljudsfynd). Om det efter undersökningen föreligger en välgrundad misstanke om
ovarialcancer (RMI >200, fynd vid vaginalt ultraljud, bilddiagnostiskt fynd som anger misstanke om avancerad sjukdom, histopatologiskt eller cytologiskt fynd) ska remiss till gynekologisk enhet/kvinnoklinik skickas för fortsatt utredning och behandling (14).
4.5 Stadieindelning
I Sverige används stadieindelning enligt FIGO (från 1988, reviderat 2013) (15).
Stadieindelningen innebär klassificering från I-IV (X innebär att stadieindelning ej fastställts) med respektive subindelning (1).
4.6 Prognos
Hur långt sjukdomen hunnit bre ut sig vid diagnos är den enskilt viktigaste prognostiska faktorn och ligger till grund för vilken behandling som ges (1). Data från regionalt cancercentrum väst mellan åren 2011-215 visar att femårsöverlevnaden för stadium I ligger på ca 90%, jämfört med ca 25% för stadium IV och strax under 40% för stadium III (16).
4.7 Perfomance status
Bedömning av WHO performance-status sker innan start av behandling (kirurgi eller cytostatika). Performance-status 0 betyder att patienten är asymtomatisk, 1 betyder symtomatisk men fullt rörlig, 2 betyder symtomatisk och tillbringar upp till 50 % av tiden i sängen, 3 betyder
symptomatisk och sängbunden mer än 50% av dagen och 4 betyder helt sängbunden och kan ej utföra någon självskötsel alls. Performance stadium 5 innebär att patienten avlidit (1).
4.8 Behandling 4.8.1 Kirurgi
De flesta fall med ovarialcancer i stadium II-IV behandlas enligt golden standard med kirurgi och efterföljande platinum-baserad cytostatika, så kallad adjuvant cytostatikabehandling (17). I vissa fall kan stadium I behandlas med enbart kirurgi (1). Primärkirurgi kallas för cytoreduktiv eller debulkingkirurgi och har som syfte att reducera tumörmassa. Om operationen sker efter given cytostatika kallas den för försenad primärkirurgi och cytostatika given innan operation kallas då för neoadjuvant. Om patienten opereras i två seanser, för att den första operationen ej blivit helt radikal, kallas det för intervallkirurgi (1).
Observera att det lätt kan uppstå förvirring vid läsning av internationell litteratur, då många studier benämner neoadjuvant terapi som cytostatika given efter suboptimal primärkirurgi och innan intervallkirurgi, medan andra benämner det som den första behandlingen given innan operation. En del benämner även försenad primärkirurgi efter given neoadjuvant cytostatika som intervall-kirurgi, trots att ingen tidigare operation utförts. I den här studien används konsekvent ovan nämnda termer som definierats enligt vårdprogrammet.
Den förste att visa på cytoreduktiv kirurgi som primärbehandling för ovarialcancer var Meigs, i sin bok Tumors of the Female Pelvic Organs år 1934 (18,19). En studie av Griffiths visade sedan på 70-talet att den viktigaste prognostiska faktorn för överlevnad var histologisk tumörgrad och storlek på resttumören efter cytoreduktiv kirurgi. Oavsett hur stor totalvolymen på tumören var från början var överlevnaden dålig om den största tumörmassan som kvarlämnats efter operation var större än 1,5 cm. Vid en residualvolym under 1,6 cm var överlevnadstiden omvänt
proportionell mot storleken på resttumören. Han visade även att operationer som trots extensiva försök kvarlämnade tumörmassa större än 1,5 cm ej förbättrade överlevnaden (20). Forskaren Hacker visade nästan tio år senare att storleken på intra-abdominella metastaser samt förekomst av ascites innan kirurgi försämrade överlevnaden, men inte storleken på primärtumören (21). Efter detta följde en debatt, först om huruvida det var tumörens inneboende biologiska
aggressivitet som påverkade överlevnaden. Om det var en aggressiv tumör resonerades det kring om det var av den anledningen som tumören var mer spridd vid diagnos och svårare att få radikal, samt hade en inneboende biologisk aggressivitet som föranledde sämre överlevnad (22). Därefter
fortsatte diskussionen om hur begreppen radikalitet samt optimal kirurgi skulle skulle definieras. Till en början definierades resttumörer mindre än 1 cm efter operation som radikal kirurgi. Definitionen ändrades sedan till ”ingen makroskopisk kvarvarande tumör” (23,24).
Flertalet kommande studier, retrospektiva och prospektiva, visade att kvarvarande tumörmassa efter kirurgi var en av de viktigaste faktorerna som påverkade överlevnaden hos kvinnor med avancerad ovarialcancer. En studie av Bristow visade 2002 att varje 10 % ökning av maximal cytoreduktion var associerat med en 5.5 % ökning i medianöverlevnad(25).
Förutom att förlänga överlevnaden för patienterna visades att ordentlig tumörreduktion förbättrade svaret på given adjuvant cytostatika (26). En förklaring till detta kan vara att cytostatikan då har en mindre mängd cancerceller att angripa (21,27). En annan förklaring kan vara att tumören i sig har en immuno-suppressiv effekt som efter extensiv kirurgi minskar (21,28). Ytterligare en förklaring kan vara att ju mindre tumör, desto mindre är chansen att det utvecklas en cytostatika-resistent tumörcell, och små tumörer kräver mindre mängd cytostatika vilket i sin tur leder till en lägre chans att få en cytostatika-inducerad resistens (29).
Eftersom storleken på residualtumören visats påverka prognosen för patienterna, är det eftersträvansvärt att på olika sätt öka det antal kvinnor som blir optimalt opererade. Därför började något som benämns intervallkirurgi. Det innebär att det görs ett första försök att operera patienten, sedan ges cytostatika. Sedan gör ytterligare ett försök till debulking-kirurgi om den första operationen ej blivit helt radikal. Två av tre randomiserade prospektiva studier kunde dock ej visa på överlevnadsvinst ifall intervall-kirurgi utfördes (30–32). En review-artikel från
Cochrane-databasen ligger till grund för vårdprogrammets inrådan att om den första operationen utförts av tumörkirurger med maximalt försök till cytoreduktion så finns det ingen nytta att genomgå intervall-kirurgi, även om primäroperationen ej blivit makroskopiskt radikal. Däremot om patienten opereras primärt av icke-tumörkirurger, och kirurgin ej uppnått makroskopisk radikalitet, kan det finnas ett värde i att utföra så kallad intervall-kirurgi (1,33).
4.8.2 Cytostatika 4.8.2.1 Neoadjuvant
För att optimera förutsättningarna för patienter med stadium IIIC och IV att bli radikalt opererade har det diskuterats att övergå till neoadjuvant kemoterapi, där cytostatika ges innan operation, för
att fler patienter ska ha möjlighet att bli radikalt opererade direkt, antingen på grund av att tumören krymper, eller för att förbättra performance-status hos patienterna som är primärt inoperabla (18,34). De fördelar som går att tänka sig med neoadjuvant terapi är att fler patienter kan bli radikalt opererade, mindre extensiv operation, mindre blodförlust, mindre morbiditet och kortare sjukhusvistelse, förbättrad livskvalitet samt att det på detta vis går att sålla ut patienter med platinum-resistens tidigare i behandlingen (18,35). De nackdelar som går att tänka sig med neoadjuvant cyostatika är försenat tumöravlägsnande som i sin tur kan påverka utfallet negativt, ökad mängd fibros i buken som i sin tur gör operationen svårare samt ökad risk för postoperativ kemoresistens (36). Litteraturen kring den neoadjuvanta cytosatikaregimens vara eller icke vara varierar kraftigt, vilket gör att det inte finns konsensus kring vilken roll som neoadjuvant cytostatika har vid stadium IIIC och IV. En del studier som tittat på neoadjuvant terapi har jämfört med primärkirurgi hos patienter i stadium IIIC och IV som är primärt operabla. Andra studier har tittat på hur det går för patienter som får neoadjuvant terapi på grund av att de inte går att operera primärt. Vissa studier har visat på att neoadjuvant terapi inte är sämre än
primärkirurgi, men frågan är om det är bättre.
En meta-analys gjord av Bristow och Chi från 2006 tittade på överlevnaden hos patienter som fått neoadjuvant cytostatika innan operation istället för primär kirurgi, då de var primärt inoperabla. Den studien visade på sämre överlevnad för gruppen som fått neoadjuvant cytostatika, samt att medianöverlevnaden sjönk med 4.1 månader för varje given neoadjuvant cykel över 3-4 (18). Författarna diskuterar huruvida detta resultat reflekterar en inneboende biologi hos tumören som lett till en stor tumörbörda från början, eller om ökat antal cykler neoadjuvant cyotstatika bidrar till ökad platinum-resistens (18). Återigen verkar dock makroskopisk radikalitet vara viktigast: Bristow och Chi visade i den metaanalysen att varje 10 % ökning av cytoreduktion vid försenad primärkirurgi ledde till en 1,9 månader längre medianöverlevnad (18).
En annan metaanalys publicerad tre år senare visade på att det var större chans att bli optimalt opererad om neoadjuvant cytostatika ordinerats innan operation jämfört med primäroperation hos patienter stadium IIIC och IV. Den studien visade dock att trots detta var inte överlevnaden bättre i den neoadjuvant behandlade gruppen. Tvärtemot Bristows och Chis metaanalys visade den här studien att antal neoadjuvanta cykler innan operation ej försämrade överlevnaden (17).
En randomiserad prospektiv FAS-III studie från 2010 av Vergote jämförde primär debulking-kirurgi följt av platinum-baserad cytostatika (golden standard) med neoadjuvant platinum-baserad cytostatika följt av försenad primärkirurgi och adjuvant cytostatika, hos kvinnor med epitelial ovarialcancer stadium IIIC och IV som var primärt operabla. Den studien visade på att både progressionsfritt intervall och den generella överlevnaden var lika i de båda grupperna (24). Vergotes studie visade även att en större andel patienter fick post- och perioperativa
komplikationer i gruppen som blivit primäropererade jämfört med den neoadjuvanta gruppen. Det gjordes dock inga statistiska tester på dessa resultat (24).
Ytterligare en randomiserad studie från 2015 jämförde neoadjuvant cytostatika med primärkirurgi vid avancerat stadium hos kvinnor som var primärt operabla. Den studien visade att överlevnaden var lika, men ovanligt låg, i de båda grupperna. Den visade även på att gruppen som
primäropererats hade fler allvarliga komplikationer postoperativt (37).
En retrospektiv kohortstudie från Danmark tittade bland annat på postoperativa komplikationer hos patienter som antingen behandlats med primärkirurgi eller neoadjuvant cytostatika med efterföljande kirurgi. Även den visade på att större andel patienter i gruppen som primäropererats fick allvarliga postoperativa komplikationer än i gruppen som fått neoadjuvant cytostatika först (38).
År 2012 publicerades en Cochraneöversikt där den ovan nämnda Vergote-studien var den enda inkluderade, där det konstaterades att makroskopisk tumörfrihet uppnåddes hos 21% av de som fått primäroperation och 53% hos de som fått neoadjuvant terapi. Båda grupperna hade dock en dålig överlevnad (36). Oavsett om patienten genomgått primär eller försenad kirurgi var storleken på residualtumören en väldigt viktig prognostisk faktor (24).
Sammanfattningsvis visade Cochraneöversikten från 2012 att neoadjuvant terapi kan vara ett alternativ vid stadium IIIC och IV, där faktorer som påverkar beslut om behandlingsval är respektabilitet, ålder, histologi, FIGO-stadium och performance-status (36). Detta är vad som ligger till grund för rekommendationerna från vårdprogrammet för epitelial ovarialcancer i
med neoadjuvant terapi, men det kan övervägas vid fall av avancerat stadium som är primärt inoperabla (1).
En nationell kvalitetsrapport från svenska kvalitetsregistret för gynekologisk cancer (SQRGC) mellan åren 2012-2016 visar att i Sverige idag behandlas 21% av patienterna med stadium IIIC och IV med neoadjuvant cytostatika och efterföljande kirurgi (16). Enligt samma rapport är sifforna för Uppsala-Örebro 26%.Det är idag inte känt hur tolerabel den neoadjuvatna behandlingen är eller hur prognosen ser ut för dessa kvinnor. Vidare är det inte känt hur prognosen ser ut för de patienter som behandlas med neoadjuvant cytostatika men aldrig blir föremål för kirurgi.
4.8.2.2 Adjuvant
Behovet av att ge kompletterande cytostatika efter operation påverkas av stigande FIGO-stadium, sjunkande differentieringsgrad samt histologisk subklassifikation. Syftet med att ge adjuvant cytostatika är att förhindra eller fördröja ett eventuellt recidiv genom att reducera mikroskopisk tumör (1). Den platinum-baserade cytostatikan introducerades på 1980-talet då två studier visade att om cisplatin adderades till rådande behandling (cyklofosamid eller doxorubicin) förbättrades överlevnaden (39–41). Dessförinnan hade cytostatika givits mot ovarialcancer sedan 1960-talet (1). Sedan 1980-talet råder det internationell enighet att cytostatikan ska vara platinum-baserad (detta gäller även den neoadjuvanta). Senare kom två studier att ligga till grund för bytet till paklitaxel som tillägg till den platinum-baserade cytostatikan istället för cyklofosamid eller doxorubicin (39,42,43). Det råder dock fortfarande oenighet kring om tillägg av paklitaxel är att föredra. En fas III-studie jämförde cisplatin i kombination med paklitaxel med kontroll (singel karboplatin, cyklofosamide, doxorubicin och cisplatin) vilket ej visade förbättrade överlevnad vid tillägg av paklitaxel (44).
Det finns även målinriktade cancerbehandlingar, targeted therapies, att tillgå vid behandling av ovarialcancer (1). Eftersom nybildandet av blodkärl är viktigt för ovarialtumörens tillväxt och spridning kan hämmande av angiogenesen i form av blockad av tillväxtfaktorn VEGF vara ett alternativ vid behandling. Bevacizumab är just en sådan antikropp som kan hämma angiogenesen (1). Det finns inget gediget vetenskapligt underlag till den behandlingen, men en dubbelblindad fas III-studie visar på ett förlängt progressionsfritt intervall för patienter som erhållit
bevacizumab jämfört med kontroll hos patienter med avancerat stadium (45). En nackdel med tillägg av bevacizumab kan vara hypertoni och försvårad sårläkning (1).
En annan målinriktadbehandling är enzymhämmarede (PARP-hämmare) som gör det omöjligt för celler att reparera enkelsträngsbrott. Den är därför framförallt använd vid kända BRCA1 och 2 mutationer (1).
4.8.2.3 Palliativ
I de fall där patienter har stor tumörbörda och/eller dåligt performance-status och utsikten att kunna få patienten operabel är minimal, brukar behandlingen baseras enbart på cytostatika (1). En retrospektiv studie från England tittade på hur det gick för patienter med avancerad ovarialcancer som fick inneliggande cytostatika primärt på grund av dåligt perfomance-status (>3) vid diagnos. Den studien visade att om patienterna lyckades få hela kuren (6 cykler) var median
totalöverlevnad 21 månader, jämfört med knappt två månader för patienter som inte klarade av att fullfölja behandlingen (46). Hur prognosen ser ut för patienter som är primärt palliativa i Sverige, är idag inte känt.
4.9 Platinum-resistens
I vårdprogrammet för epitelial ovarialcancer går att läsa att recidiv inom en
sex-månadersintervall räknas som ett platinum-resistent recidiv, medan recidiv efter sex månader bedöms vara fortsatt känsliga mot platinum-baserade cytostatikum. Om sjukdomen till och med progredierar under primärbehandlingen klassas det som platinum-refraktär. Tiden från avslutad primärbehandling (som enligt praxis innehåller platinum-baserad cytostatika) till ett eventuellt recidiv kallas för platinum-fritt intervall. Huruvida sjukdomen recidiverar inom en
sex-månadersintervall eller inte kommer således ligga till grund för vilken typ av behandling som väljs vid recidivet (1).
4.10 U-CAN
U-CAN är en relativt nystartad prospektiv biobank som innehåller tumörmaterial och annat biologiskt material (t.ex. blodprov) för flera cancerdiagnoser i Uppsala/Umeå region, där
Tidigare studier har visat att det föreligger selektion vilka patienter som inkluderas i U-CAN när det gäller andra cancerdiagnoser (mantelcellslymfom) (48). Huruvida det föreligger selektion till U-CAN av ovarialcancerpatienter är idag inte känt, inte heller om prognosen är annorlunda för patienter inkluderade i databasen.
4.11 Syfte med studien
Syftet med studien är att klargöra ifall U-CAN-kohorten är representativ för gruppen
ovarialcancer i region Uppsala i sin helhet. Vidare vill studien belysa hur prognosen för patienter som erhåller neoadjuvant cytostatika ser ut, samt hur tolerabel den behandlingen är. Studien ämnar också visa på hur prognosen ser ut för patienter som får neoadjuvant cytostatika men aldrig kommer till operation.
5. Frågeställningar och hypoteser:
5.1 Frågeställningar
1. Hur många ovarialcancerfall har diagnostiserats och registrerats i INCA i Region Uppsala mellan åren 2009-2017? Hur många har tackat ja till U-CAN? Föreligger selektion av patienter till CAN-biobanken? Hur är överlevnaden i respektive grupp (INCA vs U-CAN)?
För att svara på dessa frågor ska dessa variabler studeras:
Finns det någon skillnad i histologiskt ursprung, stadium samt performance-status vid diagnos mellan U-CAN och INCA? Hur ser andel kurativa respektive palliativa ut i INCA vs U-CAN (intention och erhållen behandling)? Hur stor andel i respektive grupp kommer till operation, och hur skiljer sig andel radikalt opererade och postoperativa
komplikationer mellan grupperna? Hur stor andel utvecklar platinum-resistens? Finns det någon skillnad mellan de båda grupperna när det gäller andel som uppnått komplett remission vid avslutande av primärbehandling eller andel avlidna? Prognosen över tid illustreras med överlevnadskurvor för respektive grupp och jämförs med varandra. Vi
tittar även på kurvor som jämfört palliativa patienter i respektive grupp samt kurativa patienter i respektive grupp.
2. Hur stor andel genomgår primär cytostatikabehandling och hur stor andel av dessa kommer till senare kirurgi? Hur tolerabel är den neoadjuvanta behandlingen?
För att svara på det studeras gruppen patienter med stadium IIIC och IV. Dessa patienter delas först upp i två grupper där intentionen var att ge neoadjuvant cytostatika och sedan genomgå försenad primärkirurgi, och där intentionen var att primärt operera och sedan ge efterföljande adjuvant cytostatika. I dessa två grupper tittar vi på performance-status vid diagnos, antal opererade, antal radikalt opererade och andel patienter som får svåra respektive milda postoperativa komplikationer, responsbedömning efter avslutad behandling, platinum-resistens samt andel avlidna. Sedan tittar vi på postoperativa komplikationer, recidiv och död för de patienter som erhållit ovan nämnda behandling. Hur tolerabel den neoadjuvanta behandlingen är jämfört med golden standard baseras framförallt på andelen svåra postoperativa komplikationer.
Hur ser prognosen ut över tid för:
a. Patienter som får neoadjuvant cytostatika och senare opereras
b. Patienter som får neoadjuvant cytostatika men aldrig opereras
c. Patienter som primärt planeras för palliativ cytostatika
För att titta på prognosen över tid tittar vi på överlevnadskurvor för respektive grupp. 5.2 Hypoteser
1. Selektion till U-CAN-biobanken föreligger och överlevnaden i denna kohort är bättre än den i regionen som helhet
a) Neoadjuvant cytostatika är väl tolerabel
b) Patienter med avancerat stadium som erhåller neoadjuvant behandling har likvärdig prognos som patienter i samma stadium som erhåller primär operation.
c) Patienter som får neoadjuvant cytostatika men aldrig opereras har sämst prognos av samtliga patienter.
6. Metod
6.1 Studiedesign och patientpopulation
Detta är en retrospektiv registerstudie innehållande patienter diagnostiserade med epitelial ovarialcancer, mellan åren 2009-2017 i Region Uppsala. Inkluderade i studien var alla patienter registrerade i INCA under givet datumintervall och region med diagnosen epitelial ovarialcancer. 6.2 Kvalitetsregisterdata
Först inhämtades data från det nationella kvalitetsregistret för ovarialcancer, det så kallade INCA-registret, via Regionalt Cancercentrum (RCC) (1). I originaldata förekom 284 fall. De variabler som ej var intressanta för detta projekts frågeställningar exkluderades.
För de fall som var registrerade två gånger (på grund av att de hade opererats vid två tillfällen) sparades den ursprungliga informationen (från primäroperationen). Tio fall selekterades således bort på förekommen anledning.
Tumörer kodas sedan år 2005 enligt International Classification of Diseases for Oncology (ICD-O/3) enligt WHOs klassificering. Dessa koder kallas SNOMED och innehåller uppgifter kring histologiskt ursprung på tumören samt malignitetsgrad (49). Patienter med SNOMED-kod som ej är kodade för epitelial cancer exkluderades i denna studie, dvs icke-epitelial ovarialcancer samt borderline/in situ cancer (50). Totalt exkluderades 82 sådana fall. Efter genomförd selektion kvarstod 192 patienter, som alla förekom en gång och som alla hade en epitelial ovarialcancer enligt SNOMED-kod. Senare uteslöts ytterligare en patient som av misstag hade registrerats som
ovarialcancer men som egentligen hade en corpuscancer. Sammanlagt innehåller studien data för 191 individer.
6.3 U-CAN
U-CAN är som tidigare nämnt en relativt nystartad prospektiv biobank innehållande tumörmaterial och annat biologiskt material (exempelvis blodprov) som finns för flera cancerdiagnoser i Uppsala/Umeå region. Ovarialcancer ingår sedan år 2012 med syfte att möjliggöra framtida forskning (47). INCA är ett kvalitetsregister där samtliga patienter med ovarialcancer diagnostiserade efter 2009 inkluderats (1). En del av dessa patienter har även tillfrågats om att vara med i U-CAN-biobanken. Samtliga patienter inkluderade i denna studies U-CAN-kohort återfinns således även i INCA-kohorten. Totalt noterades att 83 patienter registrerade i INCA också fanns registrerade i U-CAN, och U-CAN-kohorten i denna studie utgörs därför av 83 patienter.
Eftersom enbart 5 patienter var inkluderade i U-CAN under kalenderperiod 1 (2009-2011)1
baseras alla tabeller och statistiska tester på enbart kalenderperiod 2 och 3. I kalenderperiod 2 och 3 fanns totalt 144 patienter registrerade i INCA och 78 av dessa patienter var inkluderade i U-CAN.
När informationen angiven i U-CAN och INCA skiljde sig åt gjordes en genomgång av journalen och informationen harmoniserades. I de fall där INCA ej motsvarade informationen i journalen valdes journalinformationen.
Efter journalgranskningen jämfördes SNOMED-kod i INCA med angiven diagnos i journal och datafilen uppdaterades med SNOMED-kod motsvarade den diagnos som angivits i PAD-svaret i journal (49–51).
Variablerna definierades enligt nedan:
Diagnosdatum ändrades i de fall de ej stämde med journal. Enligt INCA-manualen ska först angivna datum för histologisk eller cytologisk diagnos anges. Diagnosdatum kan aldrig vara senare än start av behandling (52).
Figostadium definierades enligt vårdprogrammet (1) och ändrades i de fall som journaluppgifter ej stämde med informationen i INCA.
Recidiv/progress angavs som datum för radiologisk, cytologisk, histologisk eller klinisk verifierad recidiv/progress enligt INCA-manual. Vid osäkerhet angavs ett senare datum.
Platinum-resistens angavs som antingen progress under primärbehandling (egentligen platinum-refraktär) och/eller som recidiv/progress inom 6 månader från avslutad behandling.
Neoadjuvant behandling angavs för de patienter som fick cytostatika innan ställningstagande till kirurgi. Om patienten inte bedömdes vara gynnad av vidare operation utan endast fick cytostatika angavs slutdatum för neoadjuvant som sista dos given innan beslut om utebliven operation fattas, och start av primärt palliativa cytostatika som datum vid först givna
cytostatikakur efter att beslutet att ej operera fattats. Om patienten kom till operation angavs slutdatum för neoadjuvant terapi som datum då sista kuren innan operation givits.
Adjuvant behandling: De patienter som opererats och fått cytostatika efteråt angavs att ha fått adjuvant cytostatika även om operationen ej blivit radikal.
Operationsdatum och uppgifter kring operation angavs i de fall som patienten opererats för att göra tumörreducerande kirurgi. Ifall patienten bara opererats med biopsi, ileostomi eller liknande angavs de ej som opererade, utan detta räknades till diagnostiska ingrepp.
Icke radikalt opererade: Patienter som överhuvudtaget hade någon kvarvarande tumör efter operation angavs som ej radikalt opererade.
Postoperativ komplikation angavs enligt samma kriterier som tidigare definierats i U-CAN-biobanken där 1 motsvarade minor-komplikation (grad 1 och 2 komplikation) och 2 motsvarade major (grad 3 och 4 och 5 komplikation). Exempelvis räknas grad 1 som analgetika, diuretika och antiemetika. Grad 2 räknas som blodtransfusioner och TPN (total parenteral nutrition). Grad 3 inkluderar kirurgisk, endoskopisk eller radiologisk intervention. Grad 4 är livshotande
organdysfunktion och eller komplikation som kräver intensivvård, och grad 5 betyder att patienten avlidit (53).
Cytostatikatoxicitet definierades som oplanerad inläggning på sjukhus inom ett tvåmånadsintervall från given cytostatikados.
Behandling delades upp efter behandlingsintention, vilket definierades som vad det var för intention med behandling innan start (palliativ/kurativ) och erhållen behandling vilket angavs som vad patienten faktiskt fick. Om patienten ej opererats, eller ej opererats radikalt, angavs erhållen behandling som palliativ. Behandlingsintention angavs enligt journaltext och i de fall där det ej angivits i journal, baserades bedömningen på ifall det har gjorts försök till att operera radikalt alternativ ge cytostatika enligt vårdprogram.
Slutdatum för primärbehandling angavs som det datum som den sista cytostatikabehandlingen givits, eller i de fall då den sista behandling som givits var operation angavs datum för operation som slutdatum för avslutad behandling. Om patienten progredierade under primärbehandling och det föranledde byte av cytostatikaregim angavs det som start av palliativ behandling (ej under primärbehandling). Om byte av cytostatika skedde på grund av toxicitet/allergisk reaktion men ej på grund av uteblivet svar angavs det som given cytostatika i primärbehandlingen.
Uppföljningsdatum var sista datum för journalgenomgång, definierat som 2018-03-30 6.4 Statistiska analyser
Eftersom U-CAN startade år 2012, jämfördes enbart kalenderperiod 2 och 3 (kalenderperiod 1 motsvarar åren 2009-2011, kalenderperiod 2 åren 2012-2014 och period 3 åren 2015 till 2017) då U-CAN-kohorten och INCA-kohorten skulle analyseras. De patienter (5 i U-CAN och totalt 47 i INCA) som inkluderats under kalenderperiod 1 togs inte med i jämförelsen för att skapa
likvärdiga grupper över samma tidsintervall.Diagnostiska karakteristiska, behandling och behandlingsrespons beskrivs deskriptivt för patienter registrerade i INCA (hela kohorten), patienter registrerade i INCA men ej inkluderade i U-CAN och patienter i INCA som även inkluderats i U-CAN under kalenderperiod 2 och 3. Dessa beskrivs avseende antal fall och procent per grupp (tabell 1). För att titta på skillnader mellan U-CAN och INCA jämfördes de patienter som enbart var inkluderade i INCA men ej i CAN med patienter som inkluderats i U-CAN. Statistisk signifikans för dessa variabler kontrollerades med chi2 eller Fischers test.
Antal patienter med avancerat stadium (FIGO IIIC och IV) identifierades. Antal patienter med stadium IIIC och IV där intentionen var att ge neoadjuvant behandling med efterföljande operation samt antal av dessa som kom till operation beskrivs i tabell 2.
Patienterna med stadium IIIC och IV delades upp i två grupper baserat på vilken behandling som var planerad att ges (tabell 3). Denna tabell innehåller patienter med en kurativt syftande
behandling, och patienter med avancerad sjukdom som var primärt palliativa exkluderades. Gruppen patienter där intentionen var att ge neoadjuvant cytostatika, Intention Neo, jämfördes med gruppen patienter där intention var att ge golden standard-behandling (operation och adjuvant cytostatika, Intention Adj) avseende performance-status vid diagnos, behandling och behandlingsrespons. Dessa variabler presenteras i antal fall och procent per grupp. Skillnaden mellan dessa grupper kontrollerades avseende statistisk signifikans med chi2 test.
I tabell 4 jämfördes variablerna postoperativ komplikation, recidiv och död mellan gruppen patienter som erhållit neoadjuvant cytostatika med efterföljande operation Grupp Neo och gruppen patienter som erhållit operation med efterföljande adjuvant cytostatika Grupp Adj och presenteras i antal fall och procent per grupp. Statistisk signifikans kontrollerades enligt chi2 test. Kaplan-Meier estimat användes för att presentera överlevnadskurvor i form av overall survival. Figur 1 porträtterar överlevnad för totalt antal patienter inkluderade i INCA, patienter enbart inkluderade i INCA men ej i U-CAN och patienter inkluderade U-CAN (samtliga under kalenderperiod 2 och 3). Figur 2 visar overall survival för kurativa patienter i INCA, enbart INCA och ej U-CAN och U-CAN. Figur 3 visar overall survival för palliativa patienter i ovan nämnda grupper. Överlevnad för patienter med stadium IIIC och IV som erhållit behandling med noeadjuvant cytostatika och operation Grupp Neo samt patienter i samma stadium som opererats primärt och därefter fått cytostatika Grupp Adj presenteras i figur 4. Figur 5 visar överlevnaden för patienter behandlade med neoadjuvant cytostatika men som ej kom till operation och patienter som var primärt palliativa. Figur 6 visar överlevnaden för respektive FIGO-stadium.Med hjälp av Log-rank test säkerställdes statistiska skillnader.
Statistisk signifikans baserades på ett p-värde <0.05. 6.5 Etiskt tillstånd
Ett etiskt godkännande till att samla in och analysera kliniska data på samtliga patienter i regionen inhämtades innan start av studien via Uppsala etikprövningsnämnd (Dnr: 2017/003). Tillstånd till journalgenomgång inhämtades och godkändes av forskning och utbildningsdirektör på Uppsala Universitet 2018-01-22.
7. Resultat
Vi identifierade 191 patienter registrerade i INCA, där 83 (43.5%) av dem även var registrerade och inkluderade i biobanken U-CAN under samtliga kalenderperioder. Under enbart
kalenderperiod 2 och 3 återfanns 144 patienter registrerade i INCA och 78 av dessa var även inkluderade i U-CAN (66 var inte det). Tabell 1 och figur 1, figur 2 och figur 3 baseras endast på kalenderperiod 2 och 3 (2012-2017). Resterande tabeller (2,3,4,5) och figurer (4,5,6) presenterade nedan är baserade på samtliga kalenderperioder (2009-2017).
7.1 U-CAN vs INCA
7.1.1 Kliniska karakteristika:
Andelsmässigt och numeriskt ses inga stora skillnader mellan patienter enbart inkluderade i INCA och U-CAN avseende kliniska karakteristika. Det fanns ingen statistiskt signifikant skillnad mellan de båda grupperna avseende histologiskt ursprung på tumören eller stadie-indelning enligt FIGO, däremot var de båda grupperna statistisk skilda avseende performance-status (tabell 1) där det går att se en övervikt av patienter med högre performance-performance-status (dvs sjukare patienter) i gruppen som enbart registrerats i INCA.
Tabell 1 Kliniska karakteristika, behandling och behandlingsrespons för patienter med epitelial ovarialcancer registrerade i kvalitetsregistret INCA och i biobanken U-CAN i Region Uppsala under åren 2012-2017. För att ta fram statistisk signifikans jämförs gruppen som enbart inkluderats i INCA (ej U-CAN) med de som inkluderats i U-CAN.
Antal INCA (%) Antal INCA minus UCAN (%) Antal UCAN (%) Chi2-test
P-värde Totalt 144 66 78 Histologi samt SNOMED kod 0.69 Höggradigt serös= 84613 96 (66.7) 43 (65.2) 53 (68) Låggradigt serös =84603 7 (4.9) 1 (1.5) 6 (7.7) Mucinös=84703 10 (6.9) 5 (7.6) 5 (6.4) Klarcellig=83103 9 (6.3) 5 (7.6) 4 (5.1) Endometroid=83803 16 (11.1) 8 (12.1) 8 (10.3) Serös UNS=84413 2 (1.4) 1 (1.5) 1 (1.3) Epitelial UNS=81403 3 (2.1) 2 (3) 1 (1.3) Saknar subklassificiering 1 (0.7) 1 (1.5) 0 (0) Performance status vid diagnos <0.001 0 55 (38.2) 26 (39.4) 29 (37.2) 1 62 (43.1) 21 (31.8) 41 (52.6) 2 22 (15.3) 16 (24.2) 6 (7.7) 3+ 3 (2.1) 1 (1.5) 2 (2.6) Saknas/ej bedömd 2 (1.4) 2 (3) 0 (0) Stadie enligt FIGO 0.90 IA=2 15 (10.4) 9 (13.6) 6 (7.7) IB=5 2 (1.4) 1 (1.5) 1 (1.3) IC=8 12 (8.3) 6 (9.1) 6 (7.7)
2 Procent platinum-resistenta av de patienter det finns tillgänglig data för 3 Ej fått cytostatika, dött innan behandling, info saknas pga. att de behandlats på annan ort, dött av behandlingskomplikation efter 1 kur, ej bedömd 4 Baserat på dem som inte redan progredierat/recidiverat under primärbehandlingen 5 Ej fått cytostatika, dött innan behandling, info saknas pga. att de behandlats på annan ort, dött av behandlingskomplikation efter 1 kur, ej bedömd eller progredierat under primärbehandling 6 Både under primärbehandling och inom 6 mån IIA=10 4 (2.8) 2 (3) 2 (2.6) IIB=11 5 (3.5) 1 (1.5) 4 (5.1) IIC=12 1 (0.7) 0 (0) 1 (1.3) IIIA=14 3 (2.1) 1 (1.5) 2 (2.6) IIIB=15 3 (2.1) 1 (1.5) 2 (2.6) IIIC=16 54 (37.5) 26 (39.4) 28 (35.9) IVA=18 19 (13.2) 8 (12.1) 11 (14.1) IVB=19 25 (17.4) 10 (15.2) 15 (19.2) X=20 1 (0.7) 1 (1.5) 0 (0) Behandlingsintention <0.001 Kurativ 128 (88.9) 52 (78.8) 76 (97.4) Palliativ 16 (11.1) 14 (21.2) 2 (2.6) Erhållen behandling 0.008 Kurativ 95 (65.9) 36 (54.6) 59 (75.6) Palliativ 49 (34) 30 (45.5) 19 (24.4) Operation <0.001 Opererade 114 (79.2) 44 (66.7) 70 (89.7) Aldrig op 30 (20.8) 22 (33.33) 8 (10.3) Op radikalitet bland opererade 0.43 Utförd radikal 97 (85.1) 36 (81.8) 61 (87.1) Utförd ej radikal 17 (14.9) 8 (18.2) 9 (12.9) Ej opererad 30 22 8 Postopkomplikation bland opererade 0.49 Minor 86 (75.4) 35 (79.6) 52 (74.3) Major 27 (23.7) 9 (20.5) 18 (25.7) Ej opererad 30 22 8 Respons efter primärbehandling <0.001 Komplett remission 97 (67.4) 40 (60.6) 57 (73.1) Ej komplett remission 35 (24.3) 20 (30.3) 15 (19.2) Saknas/ej bedömt 12 (8.3) 6 (9.1) 6 (7.7) Platinumresistent under primärbeh2 0.58 Ja 10 (8.2) 5 (9.8) 5 (7.0) Nej 112 (91.8) 46 (90.2) 66 (93.0) NA3 22 15 7 Platinumresistent inom 6 mån4 0.17 Ja 23 (21.3) 12 (27.9) 11 (16.9) Nej 85 (78.7) 31 (72.1) 54 (83.1) NA5 36 23 13 Platinumresistenta totalt sett6 0.14 Ja 33 (28.0) 17 (35.4) 16 (22.9) Nej 85 (72.0) 31 (64.6) 54 (77.14) NA 26 18 8 Avliden 0.0505 Ja 49 (34) 28 (42.4) 21 (26.9) Nej 95 (66) 38 (57.6) 57 (73.1) Om Avliden- dödsorsak 0.49 Cancern=1 43 (87.8) 25 (89.3) 18 (85.7) Komplikation till behandling=2 4 (8.1) 2 (7.1) 2 (9.5) Annan malignitet=3 1 (2) 0 (0) 1 (4.8) Okänd orsak=4 1 (2) 1 (3.6) 0 (0)
7.1.2 Behandling
I gruppen patienter som enbart var inkluderade i INCA identifierades 52 utav totalt 66 patienter med en kurativ behandlingsintention. Det motsvarar 78,8% och i U-CAN identifierades 76 kurativa patienter av 78 (97.4 %) vilket visar att statistiskt fler individer med en kurativ behandlingsintention inkluderats i U-CAN (p<0.001). Även andelen patienter som erhöll en kurativ behandling var högre i U-CAN än i gruppen med enbart INCA. I enbart INCA var det 36 patienter (54.6%) och i U-CAN 59 patienter (75.6%) som fick kurativ behandling (p=0.008). Andelen patienter i de båda jämförda grupperna som kom till operation var också statistisk signifikant skiljt. I enbart INCA kom 44 patienter till operation (66.7 %)- motsvarande antal i U-CAN var 70 stycken patienter (89.7 %) (p<0.001). Av de patienter som kom till operation var andelen som blev radikalt opererade i enbart INCA 36 st av 44 st (81.8%) och i U-CAN 61 av 70 st (87.1%) men det var dock inte statistiskt signifikant skiljt mellan grupperna (p=0.43). Inte heller var andelen patienter som fick postoperativa komplikationer i enbart INCA (35 minor, 9 major av de 44 som opererats) jämfört med U-CAN (52 minor, 18 major av de 70 som opererats) statistiskt signifikant skiljt mellan grupperna (p=0.49).
7.1.3 Behandlingsrespons
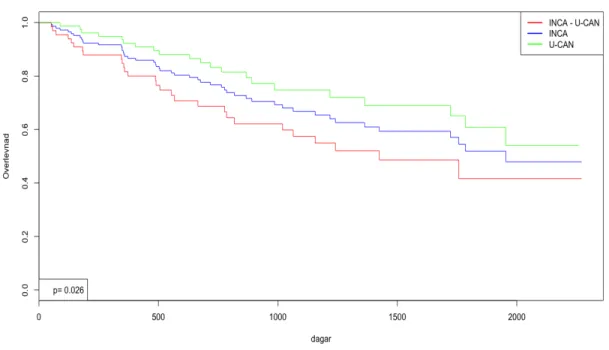
Vid responsbedömning efter avslutad primärbehandling fanns en statistisk signifikant skillnad där patienterna i U-CAN hade uppnått komplett remission (total tumörfrihet) i högre utsträckning än patienterna i enbart INCA (57st, 73.1 % vs 40 st, 60.6 %, p<0.001).Angående platinum-resistens var det däremot ingen statistiskt signifikant skillnad mellan grupperna, i enbart INCA fanns totalt 17 platinum-resistenta (35.4 %) och i U-CAN 16 (22.9 %) (p=0.14). Inte heller var andelen avlidna inom uppföljningsperioden med säkerhet statistiskt signifikant skiljt. 28 patienter i enbart INCA avled (42.4 %) och 21 avled i U-CAN (26.9 %) (p=0.051). Av de som avlidit var den vanligaste orsaken till dödsfallet ovarialcancern, detta var lika i båda grupperna (p=0.49). Överlevnadsprognos i form av overall survival presenteras nedan i figur 1. Den visar illustrativt och statistiskt hur grupperna förhåller sig till varandra där det går att se att prognosen i form av overall survival är signifikant bättre för U-CAN gruppen.
Figur 1. Log-rank test visar en statistisk skillnad i overall survival mellan INCA utan U-CAN och U-CAN (p=0.026). Vid 1500 dagar har 50 % avlidit i gruppen med enbart INCA, och vid samma tid har endast 30 % avlidit i U-CAN-kohorten.
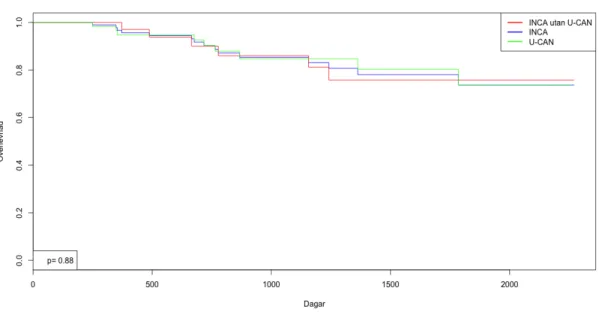
Då enbart de kurativa patienterna i Kaplan Meier kurvan jämfördes fanns ingen statistisk skillnad mellan grupperna (figur 2). Inte heller sågs statistisk signifikant skillnad då enbart de palliativa patienterna jämfördes, däremot finns en trend till att det går sämre för patienterna i enbart INCA, som illustreras i figur 3.
Figur 2 Log-rank test visar ej någon statistisk skillnad i overall survival mellan INCA utan U-CAN och U-CAN då enbart kurativa patienter jämförs (p=0.88). Vid 1000 dagar har ca 15 % avlidit i de båda grupperna.
Figur 3 Log-rank test visar ej någon statistisk skillnad i overall survival mellan INCA utan U-CAN och U-CAN då enbart palliativa patienter jämförs (p=0.095). Vid 1500 dagar har 80% avlidit i gruppen med enbart INCA, och vid samma tid har 60% avlidit i U-CAN-kohorten.
7.2 Neoadjuvant terapi vs golden standard
7.2.1 Patienter med avancerat stadium (IIIC och IV), neoadjuvant behandlade
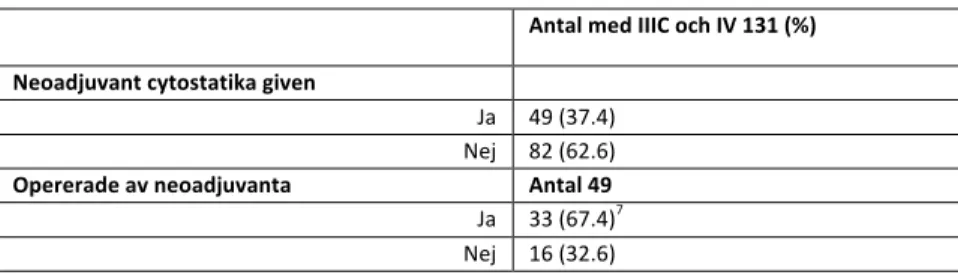
Andelen patienter med stadium IIIC och IV i hela INCA-kohorten var 131 av totalt 191 patienter (68.6%). Av dessa 131 erhöll 49 stycken neoadjuvant cytostatika (37.4%), och av dessa 49 kom 33 till operation (67.3%), vilket motsvarar 25.2 % av samtliga patienter i stadium IIIC och IV (tabell 2).
Tabell 2: Neoadjuvant behandlade patienter av alla med avancerat stadium (IIIC och IV)
Antal med IIIC och IV 131 (%) Neoadjuvant cytostatika given Ja 49 (37.4) Nej 82 (62.6) Opererade av neoadjuvanta Antal 49 Ja 33 (67.4)7 Nej 16 (32.6)
7.2.2 Primär cytostatikabehandling jämfört med primärkirurgi, behandlingsintention
Av de 131 patienter som återfanns med avancerat stadium planerades 113 patienter erhålla kurativ behandling, och dessa patienter kunde sorteras i två grupper beroende på vilken behandling de planerades för. De övriga 18 patienterna med avancerat stadium var primärt palliativa, vägrade behandling eller dog innan start av behandling. Gruppen där intentionen var att behandla med neoadjuvant cytostatika efterföljt av försenad primärkirurgi och sedan adjuvant cytostatika benämns här som grupp Intention Neo, (n=49). Gruppen där intentionen var att behandla med primärkirurgi och adjuvant cytostatika motsvarar grupp Intention Adj (n=64). Data för dessa två grupper presenteras i tabell 3.
Tabell 3 Stadium IIIC och IV, intention neoadjuvant cytostatika + försenad primärkirurgi (Intention Neo) jämfört med intention primärkirurgi och efterföljande cytostatika (Intention Adj)
Antal IIIC och IV intention neo + op
Intention Neo Antal (%) Antal IIIC+IV med intention op + adj Intention Adj Antal (%) Chi2-test P-värde
Alla patienter 49 64 Performance status vid diagnos 0.0023 0 12 (24.5) 26 (40.6) 1 23 (46.9) 34 (53.1) 2 13 (26.5) 2 (3.1) 3+ 1 (2) 0 (0) Saknas/ej bedömd 0 (0) 2 (3.1)
Antal neo IIIC och IV Antal (%) Antal adj+kir IIIC+IV Antal (%) Chi2-test
P-värde
Alla patienter 49 64
Opererad <0.001
Ja 33 (67.4) 64 (100)
Nej 16 (32.7) 0 (0)
Makroskopiskt radikalt Antal 33 (%) Antal 64 (%) 0.61
Ja 21 (63.6) 44 (68.8)
Nej 12 (36.4) 20 (31.3)
Kirurgisk komplikation Antal 33 (%) Antal 64 (%) 0.032
Minor 24 (72.7) 32 (50) Major 9 (27.3) 32 (50)
Antal neo IIIC och IV Antal IIIC+IV adj+kir Chi2-test
P-värde Alla patienter 49 64 Respons efter behandling 0.002 Komplett remission 22 (44.9) 47 (73.4) Ej komplett remisson 22 (44.9) 10 (15.6) Ej bedömbart/ej bedömt 5 (10.2) 7 (10.9) Platinumresistent primärbeh8 0.34 Ja 6 (12.8) 3 (4.9) Nej 41 (87.2) 58 (95.1) NA8 2 3 Platinumresistent inom 6 mån 0.0078 Ja 15 (39.5) 9 (15.5) Nej 23 (60.5) 49 (84.5) NA9 11 7 Platinumresistent totalt sett10 0.002 Ja 21 (47.7) 12 (19.7) Nej 23 (52.3) 49 (80.3) NA 5 3 Avliden 0.10 Ja 29 (59.2) 28 (43.8) Nej 20 (40.8) 36 (56.3) 8 Ej fått cytostatika, dött innan behandling, info saknas pga. att de behandlats på annan ort, dött av behandlingskomplikation efter 1 kur, ej bedömts 9 Ej fått cytostatika, dött innan behandling, info saknas pga. att de behandlats på annan ort, dött av behandlingskomplikation efter 1 kur, ej bedömts eller progredierat under primärbehandling 10 Både under primärbehandling och inom 6 mån
Avseende performance-status vid diagnos gick det att urskilja en statistisk signifikant skillnad mellan grupperna där det går att se en övervikt av patienter med högre performance-status (dvs sjukare patienter) i gruppen Intention Neo (p=0.0023).I grupp Intention Neo kom 33 st av totalt 49 patienter till operation (67.4%) och i grupp Intention Adj kom samtliga patienter i gruppen till operation (100%) (p<0.001). Av de som opererades i grupp Intention Neo (33 st) kom 21 st att bli radikalt opererade (63.6%), vilken ej skiljde sig markant från grupp Intention Adj där
motsvarande siffra var 44 av 64 st (68.8%) (p=0.61).I grupp Intention Neo fick 24 stycken av de opererade patienterna en minor postoperativ komplikation (72.7%) och 9 st en major
komplikation (27.3%) jämfört med grupp Intention Adj där 32 st fick minor och 32 st fick major komplikation (50% vardera) (p=0.032).
Avseende responsbedömning efter avslutad behandling fanns en statistiskt signifikant skillnad där 47 av totalt 64 patienter (73.4%) i grupp Intention Adj uppnådde komplett remission jämfört med 22 av totalt 49 patienter (44.9%) i grupp Intention Neo, p=0.0023. Det var ingen statistiskt signifikant skillnad avseende platinum-resistens under primärbehandling mellan grupp Intention Neo och grupp intention Adj (6 st i grupp Intention Neo, motsvarande 12.8% och 3 st i grupp Intention Adj, motsvarande 4.9%) p=0.34. Skillnaden i antal platinum-resistenta inom 6 månader från avslutad behandling var däremot statistiskt signifikant mellan de jämförda grupperna (15 i grupp Intention Neo, motsvarande 39.5 % och 9 i grupp Intention Adj, motsvarande 15.5%) p=0.0078. Totalt blev 21 st i grupp Intention Neo platinum-resistent (47.7%) och 12 i grupp Intention Adj (19.7%) (p=0.0023).
Det var ingen statistiskt signifikant skillnad mellan antal avlidna i de båda grupperna (29 st, 59.2% i grupp Intention Neo och 28 st, 43.8% i grupp Intention Adj), p=0.10.
7.2.3. Primär cytostatikabehandling jämfört med primärkirurgi, erhållen behandling
Tabell 4- Patienter med stadium IIIC och IV som erhållit behandling med neoadjuvant
cytostatika och försenad primärkirurgi (grupp Neo) samt primärkirurgi och adjuvant cytostatika (grupp Adj)
Antal neo IIIC och IV sant
op (grupp Neo) Antal (%) Antal IIIC+IV adj+kir beh (grupp Adj) Antal (%) Chi2-test P-värde
Alla patienter 33 62 Medelålder 63.5 60.8 Postoperativ-komplikation 0.046 Minor 24 (72.7) 32 (51.6) Major 9 (27.3) 30 (48.4) Recidiv 0.32 Ja 25 (75.8) 41 (64.1) Nej 7 (21.2) 19 (30.7) Info sakans 1 (3) 2 (3.2) Död 0.046 Ja 17 (51.5) 26 (41.9) Nej 16 (48.5) 36 (58.1)
Antal patienter med stadium IIIC och IV som erhöll behandling med neoadjuvant cytostatika och försenad primärkirurgi (efter operation erhöll alla utom en även adjuvant cytostatika) benämns som grupp Neo och innehåller 33 individer. Patienter i samma FIGO-stadium som erhöll primär kirurgi med adjuvant cytostatika var 62 st (grupp Adj). I grupp Neo fick 24 st en minor
postoperativ komplikation och 9 st en major (72.7% och 27.3%). I grupp Adj var motsvarande siffror 32 och 30 (51.6% och 48.4%). Detta var en statistiskt signifikant skillnad med ett p-värde på 0.046 med färre ”major” komplikationer i grupp Neo. Avseende recidiv var det ingen
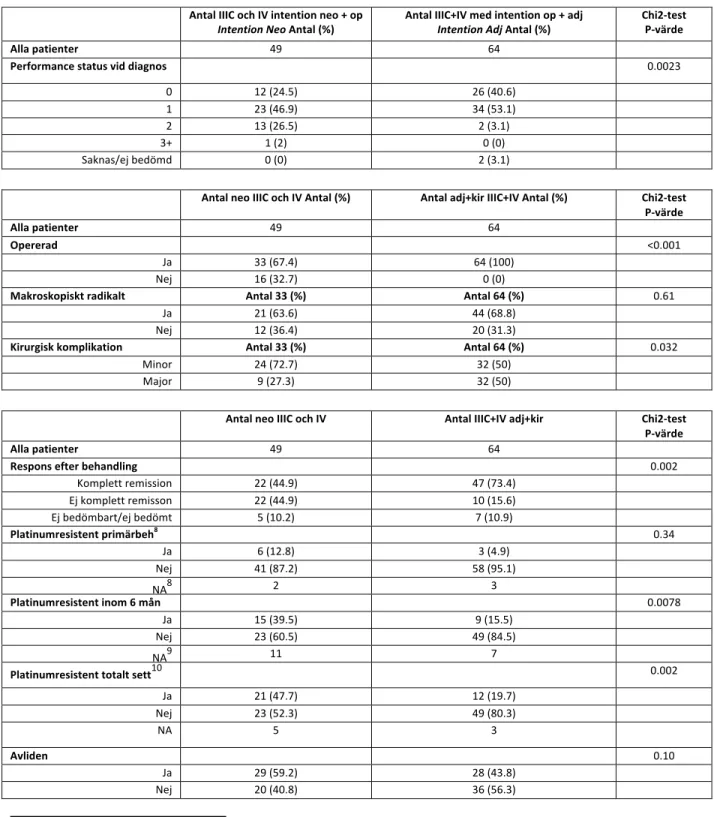
statistiskt signifikant skillnad mellan grupp Neo och grupp Adj. I grupp Neo fick 25 av 33 patienter recidiv vilket motsvarar 75.8% och i grupp Adj fick 41 av 62 patienter recidiv, 64.1% (p=0.32). Andel döda mellan de båda grupperna var dock statistiskt signifikant skilt, Grupp Neo hade 17 avlidna (51.5%) och i grupp Adj dog 26 st (41.9%) p=0.046. Däremot finns det ingen statistisk skillnad på överlevnadsprognosen i overall survival kurvan som porträtterar de båda grupperna (figur 4).
Figur 4. Efter 1250 dagar hade 50 % dött i grupp Neo, och motsvarande procent avlidna i grupp Adj inträffade vid 1700 dagar. Log rank test ger ett p-värde på 0.14.
7.2.4 Prognos för neoadjuvant behandlade patienter som ej kommer till operation
Överlevnadskurvan som jämför de patienter med stadium IIIC och IV som fått en primärt palliativ behandling med de som fått neoadjuvant cytostatika men sedan ej kommit till operation presenteras nedan i figur 5. Det finns ingen statistisk signifikant skillnad mellan överlevnaden för patienter som primärt fick en palliativ behandling jämfört med de som behandlats med
neoadjuvant terapi med syfte att operera men som sedan ej kommit till operation.
Figur 5. I gruppen primärt palliativa patienter kom 50 % att ha avlidit efter knappt 600 dagar, och liknande siffror ses för patienter behandlade med neoadjuvant terapi men som aldrig opererats.
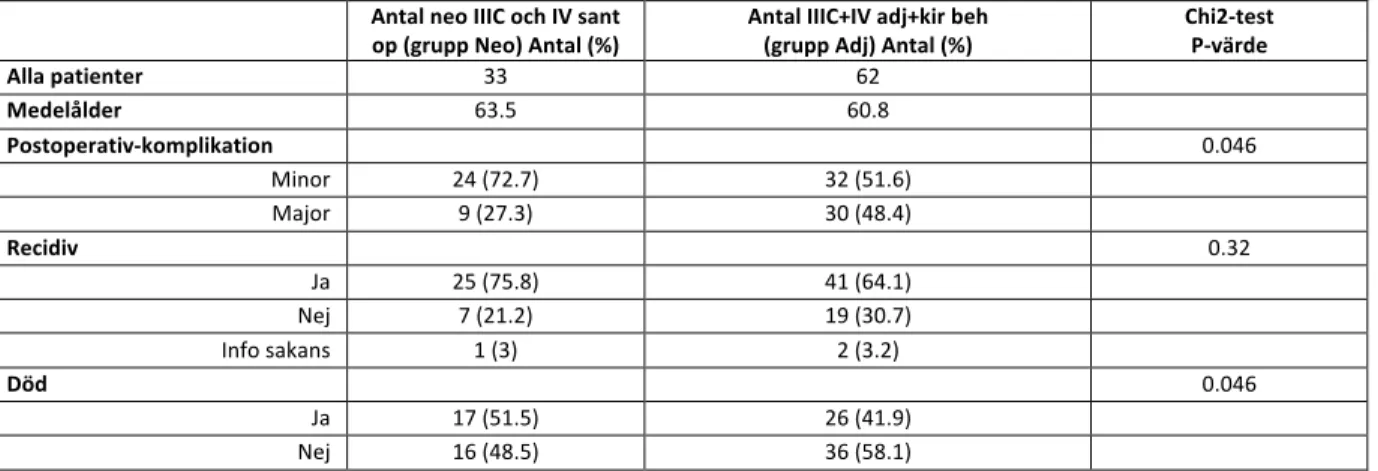
7.3 Prognos för respektive FIGO-stadium
Enligt figur 6 går det att avläsa att total överlevnad är olika för olika FIGO-stadium, där patienter som ej blivit stadieindelade (stadium x) har sämst prognos. Lite mindre än hälften av patienterna med stadium III levde efter 1500 dagar vilket var ungefär likvärdigt med patienter i stadium IV.
8. Diskussion
8.1 Sammanfattning av huvudresultat:
83 av 191 patienter med ovarialcancer i Uppsala är registrerade i databasen U-CAN.
Sammanfattningsvis pekar denna studie på att en större andel kurativa patienter (både intention och erhållen behandling) inkluderas i U-CAN jämfört med enbart INCA, att en större andel patienter kommer till operation i U-CAN jämfört med enbart INCA samt att en större andel patienter uppnår komplett remission i U-CAN jämfört med enbart INCA. Grupperna är likvärdiga varandra avseende FIGO-stadium och histologiskt ursprung, men skiljer sig avseende
performance-status vilket pekar på att patienterna inkluderade i U-CAN generellt är friskare, dvs. det är ett selekterat material. Andelen avlidna i U-CAN är ej med säkerhet statistiskt skiljt från andelen avlidna i enbart INCA, men overall survival är statistiskt bättre för U-CAN än för enbart INCA. Det är dock ingen statistisk skillnad mellan U-CAN och enbart INCA då endast kurativa respektive endast palliativa jämförs. U-CAN-kohorten kan således anses vara representativ för hela populationen för framförallt kurativa patienter, vilket är av värde för framtida studier. Andelen patienter med stadium IIIC-IV som erhållit neoadjuvant cytostatika i Region Uppsala är 37.4 %, och 25.2 % blev opererade. Trots sämre performance-status är inte överlevnaden
statistiskt sämre för de neoadjuvant behandlade patienterna vilket skulle kunna tyda på att neoadjuvant terapi lyfter högriskindivider, dock är andelen avlidna i gruppen som fått neoadjuvant terapi statistiskt större. Neoadjuvant behandlade patienter har lägre andel svåra postoperativa komplikationer vilket pekar på att behandlingen är väl tolerabel. Det går ej att entydigt uttala sig om prognosen skiljer sig mellan de båda studerade grupperna.
Patienter som erhåller neoadjuvant cytostatika men ej kommer till operation har ej sämre överlevnad än primärt palliativa patienter.
8.2 INCA vs U-CAN
Data överensstämde med litteratur där stadieindelning enligt FIGO visade på att majoriteten av patienterna hade stadium IIIC och IV vid diagnos samt att histologiskt ursprung på tumören huvudsakligen var höggradigt serös (1). U-CAN och INCA är även relativt likvärdiga
sinsemellan avseende histologiskt ursprung och FIGO-stadium. Däremot skiljde sig grupperna avseende perfomance-status vid diagnos där det fanns en spridning av olika stadier mellan de två jämförda grupperna, med övervikt för patienter i sämre skick i enbart INCA. Enbart INCA innehöll en större andel palliativa patienter än U-CAN.
En anledning till att färre palliativa patienter återfinns i U-CAN kan vara att till en början inkluderades endast patienter från kvinnokliniken till U-CAN-databasen. De primärt palliativa patienterna kom till onkologen där det först i december 2015 började inkluderas patienter i U-CAN.
Det var en större andel som kom till operation i U-CAN än i enbart INCA. Detta beror sannolikt på att det inkluderades fler kurativa patienter i U-CAN. När det gäller andel patienter som opererats radikalt eller som fått allvarliga postoperativa komplikationer var det dock ingen skillnad, där talar data för att grupperna är lika varandra.
Avseende måttet responsbedömning uppnådde en större andel patienter komplett remission i CAN än i enbart INCA. Även det skulle kunna tyda på att friskare individer inkluderats i U-CAN. Det var ingen skillnad avseende platinum-resistens eller andel avlidna mellan grupperna vilket talar för att grupperna har likheter avseende behandlingsutfall.
Kaplan Meier-kurvan visar på att overall survival är bättre för patienter inkluderade i U-CAN än i enbart INCA, även om U-CAN inte har statistiskt lägre andel avlidna. Intressant nog fanns det ingen statistisk skillnad mellan överlevnad när enbart de kurativa patienterna studerats i
respektive grupp. Detta talar alltså för att grupperna är lika varandra då samma typ av patienter jämförs, men att skillnaden ligger i att färre palliativa patienter inkluderas i U-CAN. Då enbart palliativa patienter jämfördes fanns det ej heller någon skillnad mellan grupperna, vilket ytterligare stärker teorin att orsaken till de observerade skillnaderna mellan U-CAN och enbart INCA är att U-CAN innehåller en lägre andel palliativa patienter, som i sig påverkar utfallet för gruppen positivt. Denna studies resultat kan tolkas som att U-CAN-kohorten är representativ för populationen kurativa patienter. Det vore intressant att göra en studie enbart baserat på kurativa patienter i de båda grupperna för att se om teorin stämmer att de observerande skillnaderna främst beror på inkludering av färre palliativa patienter i U-CAN men att grupperna i övrigt är lika.
Tidigare studier på andra cancerdiagnoser har visat att det föreligger selektion till U-CAN (48). Resultaten i denna studie stärker hypotesen om att det föreligger selektion till databasen U-CAN även för epitelial ovarialcancer, där patienterna i U-CAN tenderar att vara friskare och erhålla en kurativt syftande behandling i större utsträckning och att overall survival är bättre för patienter inkluderade i databasen, men att grupperna i flera av de studerade variablerna ej statistiskt skiljer sig från varandra. Detta bör hållas i åtanke när det görs studier baserade på U-CAN-kohorten. Ett intressant område för vidare studier skulle kunna vara att titta på hur U-CAN- och
INCA-kohorten skiljer sig under de senaste två åren. På så sätt går det att belysa om de observerade olikheterna i denna studie är på väg att fasas ut eller rentav redan försvunnit, eller om U-CAN fortfarande är en icke-representativ grupp för ovarial-cancerpatienterna i Region Uppsala i stort, som denna studie antyder. Ett annat område som vore intressant att titta på är orsaken till varför vissa patienter inte inkluderas. Exempelvis kan orsaken vara att frågan om inkludering ej ställts till patienter som har exceptionellt dålig prognos, och på så sätt bidragit till bias.
8.3 Neoadjuvant behandlade patienter
I en nationell kvalitetsrapport från svenska kvalitetsregistret för gynekologisk cancer (SQRGC) presenteras data kring andel patienter behandlade med neoadjuvant cytostatika och efterföljande operation. För riket är dessa siffror 231 stycken, motsvarande 21% under diagnos-år 2012-2016 (16). Vår studie presenterar data på att 49 st (37.4%) av patienterna med stadium IIIC och IV (131 st) behandlas med neoadjuvant regim i Region Uppsala, och 33 av dessa 131 (25.2 %) kom till operation efter sin neoadjuvanta behandling. Andelen patienter som erhållit neoadjuvant cytostatika och sedan kommit till operation i Region Uppsala (25.2%) skiljer sig således inte nämnvärt från övriga landet (21%).
Att det finns en statistisk signifikant skillnad i spridningen av performance-status mellan grupp Intention Neo och grupp Intention Adj där det går att se en övervikt av patienter med högre performance-status i grupp Intention Neo talar för att de är sjukare vid diagnos än de i grupp Intention Adj. Detta stämmer väl överens med de riktlinjer som finns i Sverige att enbart selekterade patienter som av någon anledning ej är i skick att primäropereras ska erhålla neoadjuvant cytostatika.
På samma sätt som Cochrane-databasens metaanalys som publicerades 2012 (36) baserad på Vergotes randomiserade studie (24) visar vår studie att andelen patienter som får svårare former av postoperativa komplikationer är större i den grupp som primäropererats jämfört med de som fått neoadjuvant cytostatika först (notera dock att Vergote ej gjorde statistiska analyser på dessa data). Även Markauskas studie visade på en större andel allvarliga postoperativa komplikationer i gruppen som primäropererats jämfört med den neoadjuvant behandlade gruppen (38).
Markauskas använde ett liknande (men ej samma) graderingssystem för postoperativa
komplikationer som i vår studie. Kehoes randomiserade studie från 2015 visade också på fler allvarliga komplikationer för de som primäropererats (37). Vår studie, tillsammans med ovan nämnda, pekar på att neoadjuvant cytostatika är väl tolerabelt, baserat på postoperativa komplikationer. Vår studie visar också på att det ej finns någon statistisk skillnad mellan grupperna avseende makroskopisk radikalitet, vilket antyder att själva operationen ej nödvändigtvis är mer komplicerad för de patienter som erhållit neoadjuvant cytostatika.
Bristows och Chis metaanalys från 2006 visade på att många preoperativa cytostatikakurer (fler än 3-4) sänkte medianöverlevnaden och författarna resonerade kring ifall detta berodde på en inducerad kemoresistens eller en inneboende aggressivitet hos tumören (18). Våra resultat visar på att det inte fanns en statistiskt signifikant skillnad mellan grupp Intention Neo och grupp Intention Adj under primärbehandlingen avseende resistens, dock var andelen platinum-resistenta inom 6 månader från avslutad behandling samt totalt sett, statistiskt signifikant större i grupp Intention Neo än i grupp Intention Adj. I och för sig handlade Bristows resultat om
patienter som fått fler än 3-4 kurer preoperativt, men det går att tolka resultaten i denna studie som att det kan finnas en möjlig koppling mellan given neoadjuvant cytostatika och ökad
platinum-resistens. Alternativt går det att tänka sig att precis som Bristow och Chi resonerar (18), har patienter som är primärt inoperabla en mer aggressiv tumör och att det är denna inneboende biologiska egenskap som påverkar platinum-resistensen.
Resultaten i vår studie visar på att statistiskt fler patienter uppnår komplett remission i gruppen där intentionen var att behandla med primäroperation och efterföljande cytostatika (grupp
Intention Adj), jämfört med gruppen där intentionen var att behandla med neoadjuvant cytostatika och efterföljande operation (grupp Intention Neo). Det skulle kunna indikera att patienterna i grupp Intention Adj också kommer att ha en bättre prognos. Våra resultat tyder även på att