Lokalisation av cathepsin B och
cystatin C i gingival vävnad från
patienter med kronisk parodontit
Eva-Liisa Svensson
Regina Thulin
Handledare: A. Ljunggren, H. Jansson
Masteruppsats (30hp) Malmö högskola
Tandläkarprogrammet Odontologiska Fakulteten Mars, 2012 205 06 Malmö
Lokalisation av cathepsin B och cystatin C i gingival
vävnad från patienter med kronisk parodontit
Eva-Liisa Svensson 1, 2*, Regina Thulin 1, 2*
1
Avdelningen för parodontologi, Odontologiska Fakulteten, Malmö Högskola, Carl Gustavs väg, Malmö, Sverige
2
Avdelningen för oral patologi, Odontologiska Fakulteten, Malmö Högskola, Carl Gustavs väg, Malmö, Sverige
*Dessa författare bidrog i samma utsträckning till detta arbete
Email-adresser:
E-LS: otl07021@student.mah.se
RT: otl07013@student.mah.se
Abstract
The cysteine protease cathepsin B has been shown to have a possible role in tissue destruction in chronic periodontitis, as it has been shown to degrade extracellular components. Cystatin C is a physiological inhibitor of cathepsin B and both are associated with periodontal disease. The aim with this study was to investigate the presence and localization of cathepsin B and cystatin C in gingival biopsies from patients with chronic periodontitis. Cathepsin B's and cystatin C’s presence and localization was demonstrated by immunohistochemical method of cryostat sectioned tissue from patients with chronic periodontitis. Polyclonal rabbit anti-human primary antibody for both the enzyme and the inhibitor were used. Identification of the primary antibodies were confirmed with Dako REAL ™ EnVision ™ Detection System. The sectioned tissue was analysed by using light microscopy. Our study indicates a presence of both enzyme and inhibitor in epithelial and connective tissue from patients with periodontal disease. Cathepsin B was localized mainly to the connective tissue, primarily to the perivascular space. In the epithelium only a few stained cells were identified. In the connective tissue, cystatin C had a diffuse distribution. Therefor it was difficult to distinguish the specific cell populations associated with the inhibitor. The epithelium showed a clear staining around/in dendritic cells. These cells were identified as probable Langerhans cells.
Sammanfattning
Cysteinproteaset cathepsin B har en trolig roll i vävnadsnedbrytningen vid kronisk parodontit då det visats kunna bryta ner extracellulära komponenter. Cystatin C är en fysiologisk inhibitor av cathepsin B och båda har kopplats till parodontal sjukdom. Syftet med studien var att undersöka närvaro av samt lokalisera cathepsin B och cystatin C i gingivala biopsier från patienter med kronisk parodontit. Närvaro och lokalisation av cathepsin Bs och cystatin Cs demonstrerades genom
immunohistokemisk metod av kryostatsnittad vävnad. Polyklonal kanin anti-human primär antikropp för både enzym och inhibitor användes. För identifiering av primära antikroppar användes Dako REAL™ EnVision™ Detection System. Granskning skedde i ljusmikroskop. Studien visar på en närvaro av både enzym och inhibitor i epitel och bindväv i parodontalt sjuk vävnad. Cathepsin B lokaliserades i stor utsträckning till bindväven, främst perivaskulärt. I epitelet lokaliserades endast ett fåtal infärgade celler. Cystatin C hade i bindväven en diffus utbredning vilket gjorde lokalisation till specifika cellpopulationer svår. I epitelet sågs en tydlig infärgning kring/i celler med dendritiskt utseende. Dessa celler identifierades som sannolika langerhanska celler.
Introduktion
Cathepsin B är ett cysteinproteas som bland annat finns i lysosomerna hos celler i ett flertal olika vävnader i kroppen där de har en essentiell funktion för den kontinuerliga proteinomvandlingen (1-4). Cathepsin B har även andra funktioner såsom MHC-II-medierad antigenpresentation, involvering i benremodellering och
keratinocytdifferentiering (5). Förhöjda nivåer av enzymet har noterats i vissa patologiska tillstånd såsom reumatoid artrit, premaligna lesioner och kronisk parodontit (4, 5).
Cystatin C är en känd endogen inhibitor till humant cathepsin B (2, 4, 6). Cystatin C är ett protein, tillhörande familjen cystatiner, som bland annat reglerar aktiviteten hos vissa cathepsiner (cathepsin L, S, H och B) (7, 8). Cystatiner är en familj proteiner som delas in i tre typer, typ 1 (cystatin A och B), typ 2 (cystatin- C, D, E/M, F, G, S, SN, SA, H) och typ 3 (kininogener) (2, 9). Dessa inhibitorer binder till sina målenzym genom en reversibel, tät, icke-kovalent bindning och kan skydda celler från ogynnsam endogen eller exogen proteolys (6, 10). Cystatin C produceras i en majoritet av
humana vävnader och har setts i flertalet olika kroppsvätskor. Både cathepsin B och cystatin C har studerats i orala vätskor och vävnader med koppling till parodontit (11-17).
Kronisk parodontit är en inflammatorisk sjukdom främst orsakad av mikroorganismer i det dentala placket (18, 19). De primära kliniska karakteristika för sjukdomen är närvaro av ödematös gingiva, patologiska tandköttsfickor och lokal bennedbrytning. Det immunologiska vävnadssvaret involverar en närvaro av ett flertal
ligga bakom ett flertal patologiska och immunohistologiska händelser med förlust av tandens stödjevävnader som följd (20, 21). Endogena proteaser, utsöndrade från de lokala inflammationscellerna, spelar en central roll i denna process (22, 23). En av dessa proteaser är cathepsin B som har visats kunna degradera ett flertal extracellulära matrixkomponenter bland annat kollagen- 2, 9, 11 samt laminin och proteoglykaner (24-26).
Ett flertal studier har visat på en korrelation mellan parodontit och cathepsin
B-aktivitet i gingivalexudat. Det har bland annat visats att cathepsin B finns närvarande i gingivalexudat vid parodontit hos vuxna, där ett samband sågs mellan ökade nivåer av cathepsin B och sjukdomens allvarlighetsgrad (1, 27). Eley och Cox (28) visade i en tvåårig uppföljningsstudie att cathepsin B i gingivalexudat hos patienter med kronisk parodontit skulle kunna användas som en möjlig prediktor för framtida fästeförlust. De visade att nivåerna av cathepsin B korrelerade väl med grad av fästeförlust. Vidare har även samma författare påvisat att det finns ett samband mellan cathepsin
B-aktivitet och benförlust hos patienter med obehandlad parodontit (29). Icke- kirurgisk och/eller kirurgisk behandling av parodontit hos individer med kronisk parodontit har visats ge en signifikant minskad mängd cathepsin B i gingivalexudat jämfört med före behandling (14, 30, 31).
Cysteinproteaserhämmare, och speciellt cystatin C, i saliv har föreslagits ha en eventuellt skyddande roll i samband med parodontit varför ett flertal studier har undersökt en möjlig koppling. Patienter med parodontit har visats ha en högre cystatinaktivitet och högre cystatin C-koncentrationer i hel- och parotissaliv, jämfört med parodontalt friska patienter (15, 32-34). Parodontal behandling har också visats
reducera cystatin C-nivåerna i saliv (35). Enstaka studier har konstaterat liten eller ingen mängd cystatin C i gingivalexudat från patienter med parodontal sjukdom (36, 37).
Både cathepsin B och cystatin C har undersökts i biopsier av gingival vävnad i ett fåtal olika studier. En studie fann en positiv korrelation mellan cathepsin B-aktivitet och grad av sjukdom i gingivala homogenater, från patienter med kronisk parodontit (38). Dessa resultat överensstämmer med en studie utförd av Eley och Cox (13) som visade signifikant högre aktivitet av enzymet i gingivala homogenater från parodontalt sjuk vävnad jämfört med frisk. Cathepsin B har även konstaterats genom
antikroppsinfärgning av humana gingivala biopsier från patienter diagnostiserade med kronisk parodontit (11, 12). Cystatin C i gingival vävnad har endast studerats i
enstaka försök (39). Syftet med vår studie var att genom immunohistokemi undersöka förekomst och möjlighet till lokalisation av cathepsin B och cystatin C i gingivala biopsier från patienter med kronisk parodontit.
Material och metod
Vävnadsinsamling och hantering
Vävnaden utgjordes av gingival vävnad från fyra patienter med diagnosen kronisk parodontit i samband med parodontalkirurgisk behandling, vid specialistkliniken för parodontologi Tandvårdshögskolan Malmö. Samtliga patienter var kvinnor i åldrarna 48-64 år. Patienterna hade tidigare genomgått icke kirurgisk parodontal behandling, och efter utvärdering kvarstod tandköttsfickor ≥6mm som samtidigt uppvisade blödning vid sondering. Patienterna erbjöds parodontalkirurgisk behandling. Innan
operationstillfället gavs patienterna information om studien vartefter de skriftligt medgav sitt deltagande. Studien godkändes av Odontologiska fakultetens
etikprövningsnämnd, Malmö högskola. Parodontalkirurgin utfördes genom tekniken modifierad Widman-lambå (40) av specialisttandläkare inom parodontologi. Vävnad inhämtades från fem operationstillfällen varav ett till två vävnadsprov togs från vardera patienten. Med varje vävnadsprov följde en remiss som kodades. Direkt efter kirurgiskt avlägsnande överfördes vävnaden under aseptiska förhållanden till en kyld korkplatta. Vävnaden fixerades temporärt i frysmedel (Tissue-Tek© O.C.T.™ Compound, Sakura Finetek, Alphen aan den Rijn, Nederländerna) och frystes i en isopentantank, minus 70 °C under 30 sekunder. Det fixerade vävnadsprovet lades sedan i en kodad provpåse. Därefter förvarades vävnadsproverna i en frys, minus 80 °C, till dess att snittning utfördes.
Vävnadspreparation
Snittningen av de frysta vävnadsproverna utfördes i en manuellt driven kryostat (Leica CM 1900 UV, Lecia Microsystem A/S, Herlev, Danmark), vid en temperatur på minus 20 °C. Vävnadsproven snittades till en tjocklek av 6 µm och applicerades på objektglas (Thermo scientific Polysine Slides, Gerhard Menzel GmbH,
Braunschweig, Tyskland) som märktes med tillhörande kod, datum och spädning. Objektglasen med vävnadssnitt fick lufttorka i en timme i rumstemperatur. Första vävnadssnittet färgades genom hematoxylin/eosin-infärgning för vävnadsorientering och jämförelse.
Immunohistokemi
I immunohistokemisk metod används primära antikroppar, uni- eller polyklonala, vilka reagerar med en eller flera sökta epitoper i vävnaden. Sekundära antikroppar, bundna till en polymer och märkta med peroxidasmolekyler, tillsätts därefter och fäster till de primära artspecifika antikropparna. I ett tredje steg tillförs ett substrat vilket klyver och infärgar antikroppskomplexet. Resultatet blir en visualisering av sökt epitop.
Cystatin C och cathepsin B identifierades genom immunohistokemi med Dako EnVision (Dako REAL™ EnVision™ Detection System, Peroxidase/DAB+,
Rabbit/Mouse, Dako A/S, Glostrup, Danmark). Polyklonal kanin anti-human cystatin C-antikropp tillhandahölls av docent Magnus Abrahamssons grupp, avdelningen för Klinisk kemi, Lunds universitet, Sverige (6). För identifiering av cathepsin B
användes polyklonal kanin anti-human procathepsin B-antikropp vilken tillhandahölls av professor John Mort, Genetics Unit, Shriners Hospital, Montreal, Kanada (41). De primära antikropparna späddes med BSA/PBS 1,5% innehållande: 0,3 g bovint serumalbumin (BSA) och 20 ml Phosphate Buffered Saline 10 mM med Tween 20 (PBS Tween 20) pH 7,4. PBS Tween 20 blandades enligt: 0,26g KH2PO4, 2,17g
Na2HPO4-7H20, 8,71g NaCl, 800ml dH20 samt 0,5 ml Tween 20. Cystatin
C-antikropp späddes till en koncentration av 1:1000 och primär C-antikropp för cathepsin B späddes till en koncentration av 1:500. Snitten fixerades i formaldehyd 4% under 1 minut och sköljdes i destillerat vatten (dH20) (Option 7 plus, AB Ninolab, Upplands
Väsby, Sverige). Snitten tvättades i buffert under 3x5 minuter i för att sänka ytspänningen och avlägsna monteringsklister. Bufferten som användes var PBS
Tween 20. Glasen med snitten torkades av och en paraffinring applicerades kring snitten innan 100 mikroliter per glas av 1,5% BSA/PBS applicerades i paraffinringen under tio minuter. Glasen inkuberades i en timme med primär antikropp cystatin C eller primär antikropp cathepsin B i separata försök. För att blockera endogent
peroxidas, och därmed reducera oönskad bakgrundsfärgning, behandlades snitten med väteperoxid 3% i 10 minuter, 100 mikroliter per glas (42). Snitten inkuberades i 20 minuter med peroxidaskonjugerad dextranbunden sekundär antikropp för cystatin C eller cathepsin B (Dako REAL™ EnVision™/HRP Rabbit/Mouse). Därefter
inkuberades de under 5 minuter med diaminobensidin-lösning, substratsystemet DAB (Dako REAL™ Substrate Buffer plus Dako REAL™ DAB+ Chromogen) blandat enligt leverantörens anvisningar, för visualisering av reaktionen.
Efter momentet då den primära antikroppen applicerats tvättades glasen mellan varje steg med 2x2 minuter med PBS Tween 20. All inkubation utfördes i rumstemperatur i en fuktig kammare. För visualisering av vävnadsmorfologin färgades snitten med hematoxylin (Dako REAL™ Hematoxylin, Dako A/S, Glostrup, Danmark), 100 mikroliter per glas i 2 minuter. Slutligen behandlades de med: dH20 2x2 minuter, 95%
etanol 2x1 minut, 99,5% absolut etanol 2x1 minuter, isopropanol 2 minuter. För metodsäkring utfördes en negativ kontroll där den primära antikroppen uteslöts för att kontrollera eventuell ospecifik vävnadsinbindning av sekundär antikropp.
Efter infärgning monterades täckglas (Deckgläser #1, Gerhard Menzel GmbH, Braunschweig, Tyskland) över snittet med monteringsmedel (Pertex®, HistoLab Products AB, Göteborg, Sverige). Analys av preparaten skedde i ljusmikroskop (Nikon Eclipse 80i, Nikon instruments Europe, Amstelveen, Nederländerna) av två
observatörspar. Granskningen skedde i tre steg, där varje par först granskade preparaten inom paret. Kalibrering skedde sedan mellan samtliga observatörer, vartefter preparaten åter granskades av det ena observatörsparet. Samtliga observatörer var överens. Vid fotografering användes dataprogrammet NIS (LRI Instrument AB, Lund, Sverige).
Resultat
Vid analys har observationer kring vävnadsmorfologi, infärgningsgrad- och lokalisation visuellt jämförts inbördes och mellan cathepsin B och cystatin C.
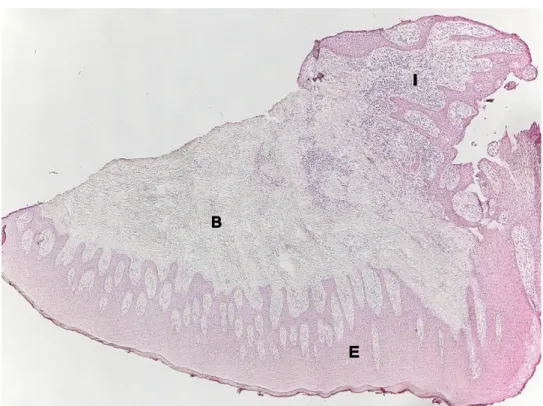
Vävnadsbiobsierna var av varierande storlek där det i vissa gick att påvisa fickepitel. I bindväven kunde varierande grad av inflammatoriska cellinfiltrat ses (Figur 1). Samtliga biopsier påvisade någon grad av inflammation. Den immunohistokemiska infärgningen med antikroppar riktade mot cathepsin B eller cystatin C uppvisade en ljusbrun bakgrundsfärgning med specifik infärgning som en något starkare färg. Inga tydliga skillnader för infärgning av cathepsin B eller cystatin C kunde ses mellan de olika biopsierna.
Cathepsin B-antikroppsinfärgning sågs mest frekvent i bindväven, men enstaka specifikt infärgade celler kunde även skönjas i epitelet. Ökad infärgning för cathepsin B kunde även ses som smala, avlånga band extracellulärt mellan celler. Antal
infärgade celler i epitelet var få och slutsatser kring celltyp kan ej dras. I bindväven sågs en hög kromoforkoncentration i sjok, oftast perivaskulärt där flertalet infärgade celler låg ordnade (Figur 2). De infärgade cellernas kärnor var här mest ovala till formen, men även rundade kärnor kunde ses. Distributionen och form av infärgade celler tyder på att det dock ej rör sig om infärgade endotelceller. I 400 gångers
förstoring av bindväv kunde en ökad kromoforkoncentration lokaliseras i direkt anslutning till dessa celler specifikt (Figur 3). Infärgningen kring dessa sågs som diffust avgränsade, något korniga, mörkfärgade områden. Liknande infärgningar kring/i celler kunde också ses i bindvävspapillerna i anslutning till epitelet. Vid immunohistokemi med antikropp för cystatin C sågs en något mörkare
bakgrundsfärgning jämfört med cathepsin B. Bakgrundsinfärgningen för cystatin C varierade mellan vissa av preparaten. En ökad infärgning för cystatin C sågs i/kring enstaka, utspridda celler i epitelet vilka främst var lokaliserade till stratum spinosum (Figur 4). Infärgningen kring/i cellerna i epitelet hade många gånger ett elongerat till dendritiskt utseende och cellkärnorna sågs som runda eller ovala (Figur 5). Cellernas placering, utseende och distribution tyder på infärgning av eventuella langerhanska celler. I bindväven kunde ökad infärgning av cystatin C konstateras lokalt kring celler i områden med ökad inflammationsgrad och kring kärl men även till enstaka
elongerade celler. Infärgningen kring/i cellerna har ett varierande utseende, från småkornigt till diffust avgränsade sjok. Infärgning i bindväven kan inte anknytas till specifik cellpopulation (Figur 6). Grad och lokalisation av infärgning i bindväven varierade mellan snitt från olika biopsier.
Negativ kontroll med sekundär antikropp visade ingen infärgning.
Diskussion
Denna studie har undersökt närvaro av samt lokaliserat cathepsin B och cystatin C i gingivala biopsier från patienter med kronisk parodontit genom immunohistokemisk metod. Metoden har bland annat evaluerats genom negativ kontroll, som visade att
metoden var tillförlitlig. Både cathepsin B och cystatin C återfanns både i epitel samt bindväv och kunde i viss mån lokaliseras kring/i vissa specifika cellpopulationer. Cathepsin B-specifik infärgning kunde i bindväven främst lokaliseras i sjok i
anslutning till blodkärl. Utifrån lokalisation och utseende hos cellerna kan antagas att dessa troligtvis inte är endotelceller. Distributionen av de cathepsin B-infärgade cellerna kring blodkärlen tyder på att rör sig om dendritiska celler, till exempel makofager, som finns lokaliserade där stationärt. Cathepsin B har tidigare påvisats i monocyter/makrofager i in vitro studier (43, 44). Våra resultat överensstämmer med resultat från tidigare studier av human gingiva, från patienter diagnostiserade med kronisk parodontit, där histokemiska och immunocytokemiska undersökningar
lokaliserade cathepsin B till monocyt/makrofag samt till elongerade celler i bindväven (11, 12). I en fortsättningsstudie visade samma författare även en mer specifik
lokalisation av cathepsin B med speciellt hög infärgning/guldmärkning av lysosomer i makrofager och fibroblaster. Viss infärgning kunde också skönjas extracellulärt kring dessa celler (12).
En extracellulär lokalisation av cathepsin B skulle kunna förklara den diffust avgränsade infärgningen i direkt anslutning till celler i bindväven i våra snitt. En troligare orsak till den diffusa spridningen av infärgningen är dock den korta fixeringstid i formalin som vår metod kräver. Detta kan ha bidragit till att enzymet kan ha flutit ut något. Enzymets specifika lokalisation är också svårtolkad på grund av snittjockleken som krävs vid fryssnittning.
Våra resultat påvisade närvaro av cathepsin B hos enstaka celler i epitelet, dessa var då främst ovala till rundade celler. En tidigare studie påvisade sekretion av cathepsin B från humana epidermala keratinocyter (45), en annan studie av oralt- och fickepitel fann likt våra resultat cathepsin B i rundade celler. Dessa celler identifierades då som monocyt/makrofag (11). Antalet cathepsin B-infärgade celler i epitelet i vår studie var mycket få vilket inte är helt förenligt med resultat från ovan nämnd studie (11). Migration av monocyt/makrofag genom epitel är en känt förekommande händelse vid plackinducerad gingival inflammation (20), en reducerad patogen biofilm skulle teoretiskt kunna vara en förklaring till den begränsade mängd cathepsin
B-producerande celler i epitelet i vår studie. Alternativt att cathepsin-B B-producerande celler varierar i antal mellan olika individer samt över tid. Med ett mindre material, likt i vår studie, finns också risken att individuella variationer inte upptäcks.
Antikroppsinfärgning för inhibitorn cystatin C visade en mycket specifik infärgning i dendritiska celler i epitelet, vilka identifierades som troliga langerhanska celler. Langerhanska celler ses normalt i oralt epitel där de har en stationärt
antigenpresenterande roll. Dendritiska antigenpresenterande celler, likt langerhanska celler, har i studier setts innehålla cystatin C samt vissa cathepsiner såsom cathepsin B. Cystatin Cs roll verkar där vara att lokalt modulera aktiviteten hos dessa
cathepsiner (46-48). Dessa resultat tillsammans med våra styrker att cystatin C har en roll i langerhanska celler. Den centrala placeringen i epitelet av de cystatin
C-infärgade langerhanska cellerna tyder på att cellerna troligtvis är i inaktiv form, således behöver cystatin C här inte ha någon koppling till den parodontala sjukdomen specifikt utan kanske normalt finns uttryckt i dessa celler. Dock kan de cystatin C-infärgade cellerna i våra resultat ej uteslutas vara stationära makrofager.
I bindväven har infärgningen med antikropp för cystatin C haft ett varierande utseende, dels mellan några av snitten men också mellan biopsierna från olika
patienter. Kronisk parodontit karakteriseras av inflammationscykler med olika grad av aktivitet (22, 49) vilket innebär att patienter över tid kan ha varierande tillgänglig mängd enzym och inhibitorer som skulle kunna förklara variationerna i infärgning. Denna variation skulle även kunna förklaras av olika individer normalt har
individuella nivåer av enzym och inhibitorer i vävnaden.
Valet av enzym och inhibitor i vår studie grundar sig på tidigare studerad koppling till varandra samt deras delaktighet i kroniska inflammationer (4, 50). Vi kan i vår studie bekräfta att båda finns närvarande i parodontalt sjuk gingival vävnad, men resultaten är för vagt underbyggda för att klargöra eventuell samlokalisation mellan enzym och inhibitor. Man bör också beakta att cathepsin B har ett flertal övriga inhibitorer och att cystatin C även inhiberar andra cathepsiner (4, 9). Samspelet mellan enzymer och dess inhibitorer vid parodontal sjukdom är som känt ett mycket komplext samspel där även andra variabler spelar in.
Vår studie är inte av den omfattning att vi kan dra vidare slutsatser kring närvaron av cathepsin B och cystatin C. Antalet patienter i vår studie var begränsat och positiv kontroll saknas vilket gör att resultaten inte är generaliserbara utan vidare studier krävs. Utformningen av studien tillåter ej heller en jämförelse av mängd eller
lokalisation av enzym och/eller inhibitor mellan olika grad av parodontal sjukdom. Ett större patientunderlag samt jämförelse med parodontalt frisk vävnad skulle vara önskvärt i framtida forskningsprojekt. Det skulle även vara av intresse att genom
immunocytokemi fastställa kring/i vilka specifika celler cathepsin B och cystatin C finns, till exempel genom dubbelinfärgning och samlokalisation.
Konklusion
Vi har med vald metod försökt undersöka om och var cathepsin B och cystatin C finns lokaliserade i gingival vävnad från patienter med kronisk parodontit. Våra resultat visar en närvaro av både enzymet och inhibitorn, det visar på en lokalisation i både bindväv och epitel.
Acknowledgements
Vi vill tacka personalen vid avdelningen för oral patologi, Odontologiska Fakulteten, Malmö Högskola, för handledning, hjälp och stöd. Speciellt tack till professor Gunnar Warfvinge för den hjälp du gett och det intresse du visat vid analys av resultaten. Ett stort tack också till personal vid avdelningen för parodontologi, Odontologiska Fakulteten, Malmö Högskola för ett gott samarbete kring patient- och
vävnadshantering. Tack till docent Magnus Abrahamsson, avdelningen för Klinisk kemi, Lunds universitet, som tillhandahöll antikroppar för cystatin C samt för att du introducerade oss för en tidigare obekant forskningsvärld. Professor John Mort, Genetics Unit, Shriners Hospital, Montreal skänkte vänligen antikroppar för cathepsin B.
Referenser
1. Ichimaru E, Tanoue M, Tani M, Tani Y, Kaneko T, Iwasaki Y et al. Cathepsin B in gingival crevicular fluid of adult periodontitis patients: identification by
immunological and enzymological methods. Inflamm Res. 1996; 45: 277-282. 2. Lah TT, Babnik J, Schiffmann E, Turk V, Skaleric U. Cysteine proteinases and inhibitors in inflammation: their role in periodontal disease. J Periodontol. 1993; 64: 485-491.
3. Howie AJ, Burnett D, Crocker J. The distribution of cathepsin B in human tissues. J Pathol. 1985; 145: 307-314.
4. Dickinson DP. Cysteine peptidases of mammals: their biological roles and potential effects in the oral cavity and other tissues in health and disease. Crit Rev Oral Biol Med. 2002; 13: 238-275.
5. Berdowska I. Cysteine proteases as disease markers. Clin Chim Acta. 2004; 342: 41-69.
6. Abrahamson M, Barrett AJ, Salvesen G, Grubb A. Isolation of six cysteine proteinase inhibitors from human urine. Their physicochemical and enzyme kinetic properties and concentrations in biological fluids. J Biol Chem. 1986; 261: 11282-11289.
7. Barrett AJ. The cystatins: a diverse superfamily of cysteine peptidase inhibitors. Biomed Biochim Acta. 1986; 45: 1363-1374.
9. Ljunggren A. Structural and functional studies of chagasin, a parasite protease inhibitor. Lund: Lund University; 2009.
10. Turk V, Bode W. The cystatins: protein inhibitors of cysteine proteinases. FEBS Lett. 1991; 285: 213-219.
11. Kennett CN, Cox SW, Eley BM. Comparative histochemical, biochemical and immunocytochemical studies of cathepsin B in human gingiva. J Periodontal Res. 1994; 29: 203-213.
12. Kennett CN, Cox SW, Eley BM. Ultrastructural localization of cathepsin B in gingival tissue from chronic periodontitis patients. Histochem J. 1997; 29: 727-734. 13. Eley BM, Cox SW. Cathepsin B- and L-like activities at local gingival sites of chronic periodontitis patients. J Clin Periodontol. 1991; 18: 499-504.
14. Cox SW, Eley BM. Cathepsin B/L-, elastase-, tryptase-, trypsin- and dipeptidyl peptidase IV-like activities in gingival crevicular fluid. A comparison of levels before and after basic periodontal treatment of chronic periodontitis patients. J Clin
Periodontol. 1992; 19: 333-339.
15. Henskens YM, Veerman EC, Mantel MS, van der Velden U, Nieuw Amerongen AV. Cystatins S and C in human whole saliva and in glandular salivas in periodontal health and disease. J Dent Res. 1994; 73: 1606-1614.
16. van Gils PC, Brand HS, Timmerman MF, Veerman EC, van der Velden U, van der Weijden GA. Salivary cystatin activity and cystatin C in experimental gingivitis in non-smokers. J Clin Periodontol. 2003; 30: 882-886.
17. Aguirre A, Testa-Weintraub LA, Banderas JA, Dunford R, Levine MJ. Levels of salivary cystatins in periodontally healthy and diseased older adults. Arch Oral Biol. 1992; 37: 355-361.
18. Marsh PD. Dental plaque: biological significance of a biofilm and community life-style. J Clin Periodontol. 2005; 32 Suppl 6: 7-15.
19. Madianos PN, Bobetsis YA, Kinane DF. Generation of inflammatory stimuli: how bacteria set up inflammatory responses in the gingiva. J Clin Periodontol. 2005; 32 Suppl 6: 57-71.
20. Lang NP, Karring T, Lindhe J. Clinical periodontology and implant dentistry. Oxford, UK; Ames, Iowa: Blackwell Munksgaard; 2008.
21. Berglundh T, Donati M. Aspects of adaptive host response in periodontitis. J Clin Periodontol. 2005; 32 Suppl 6: 87-107.
22. Smith M, Seymour GJ, Cullinan MP. Histopathological features of chronic and aggressive periodontitis. Periodontol 2000. 2010; 53: 45-54.
23. Ohlrich EJ, Cullinan MP, Seymour GJ. The immunopathogenesis of periodontal disease. Aust Dent J. 2009; 54 Suppl 1: S2-10.
24. Maciewicz RA, Wotton SF, Etherington DJ, Duance VC. Susceptibility of the cartilage collagens types II, IX and XI to degradation by the cysteine proteinases, cathepsins B and L. FEBS Lett. 1990; 269: 189-193.
25. Buck MR, Karustis DG, Day NA, Honn KV, Sloane BF. Degradation of
extracellular-matrix proteins by human cathepsin B from normal and tumour tissues. Biochem J. 1992; 282 ( Pt 1): 273-278.
26. Mai J, Sameni M, Mikkelsen T, Sloane BF. Degradation of extracellular matrix protein tenascin-C by cathepsin B: an interaction involved in the progression of gliomas. Biol Chem. 2002; 383: 1407-1413.
27. Kunimatsu K, Yamamoto K, Ichimaru E, Kato Y, Kato I. Cathepsins B, H and L activities in gingival crevicular fluid from chronic adult periodontitis patients and experimental gingivitis subjects. J Periodontal Res. 1990; 25: 69-73.
28. Eley BM, Cox SW. The relationship between gingival crevicular fluid cathepsin B activity and periodontal attachment loss in chronic periodontitis patients: a 2-year longitudinal study. J Periodontal Res. 1996; 31: 381-392.
29. Eley BM, Cox SW. Correlation of gingival crevicular fluid proteases with clinical and radiological measurements of periodontal attachment loss. J Dent. 1992; 20: 90-99.
30. Chen HY, Cox SW, Eley BM. Cathepsin B, alpha2-macroglobulin and cystatin levels in gingival crevicular fluid from chronic periodontitis patients. J Clin
Periodontol. 1998; 25: 34-41.
31. Eley BM, Cox SW. Cathepsin B/L-, elastase-, tryptase-, trypsin- and dipeptidyl peptidase IV-like activities in gingival crevicular fluid: a comparison of levels before and after periodontal surgery in chronic periodontitis patients. J Periodontol. 1992; 63: 412-417.
32. Henskens YM, Van der Velden U, Veerman EC, Nieuw Amerongen AV. Cystatin C levels of whole saliva are increased in periodontal patients. Ann N Y Acad Sci. 1993; 694: 280-282.
33. Henskens YM, van der Velden U, Veerman EC, Nieuw Amerongen AV. Protein, albumin and cystatin concentrations in saliva of healthy subjects and of patients with gingivitis or periodontitis. J Periodontal Res. 1993; 28: 43-48.
34. Henskens YM, van den Keijbus PA, Veerman EC, Van der Weijden GA,
Timmerman MF, Snoek CM et al. Protein composition of whole and parotid saliva in healthy and periodontitis subjects. Determination of cystatins, albumin, amylase and IgA. J Periodontal Res. 1996; 31: 57-65.
35. Henskens YM, van der Weijden FA, van den Keijbus PA, Veerman EC, Timmerman MF, van der Velden U et al. Effect of periodontal treatment on the protein composition of whole and parotid saliva. J Periodontol. 1996; 67: 205-212. 36. Blankenvoorde MF, Henskens YM, van der Weijden GA, van den Keijbus PA, Veerman EC, Nieuw Amerongen AV. Cystatin A in gingival crevicular fluid of periodontal patients. J Periodontal Res. 1997; 32: 583-588.
37. Soell M, Elkaim R, Tenenbaum H. Cathepsin C, matrix metalloproteinases, and their tissue inhibitors in gingiva and gingival crevicular fluid from periodontitis-affected patients. J Dent Res. 2002; 81: 174-178.
38. Lah T, Skaleric U, Babnik J, Turk V. Cathepsin D, L and B in inflamed human gingiva. J Periodontal Res. 1985; 20: 458-466.
39. Skaleric U, Babnik J, Curin V, Lah T, Turk V. Immunochemical quantitation of cysteine proteinase inhibitor cystatin C in inflamed human gingiva. Arch Oral Biol. 1989; 34: 301-305.
40. Ramfjord SP, Nissle RR. The modified widman flap. J Periodontol. 1974; 45: 601-607.
41. Rowan AD, Mach L, Mort JS. Antibodies to rat procathepsin B recognize the active mature enzyme. Biol Chem Hoppe Seyler. 1992; 373: 427-432.
42. Kumar GL, Rudbeck L. Education Guide, Immunohistochemical Staining Methods. Carpinteria, California: Dako North America; 2009.
43. Morland B. Cathepsin B activity in human blood monocytes during differentiation in vitro. Scand J Immunol. 1985; 22: 9-16.
44. Schmid H, Sauerbrei R, Schwarz G, Weber E, Kalbacher H, Driessen C.
Modulation of the endosomal and lysosomal distribution of cathepsins B, L and S in human monocytes/macrophages. Biol Chem. 2002; 383: 1277-1283.
45. Katz AB, Taichman LB. A partial catalog of proteins secreted by epidermal keratinocytes in culture. J Invest Dermatol. 1999; 112: 818-821.
46. Steinman RM. The control of immunity and tolerance by dendritic cell. Pathol Biol (Paris). 2003; 51: 59-60.
47. Zavasnik-Bergant T, Repnik U, Schweiger A, Romih R, Jeras M, Turk V et al. Differentiation- and maturation-dependent content, localization, and secretion of cystatin C in human dendritic cells. J Leukoc Biol. 2005; 78: 122-134.
48. Schluger S. Periodontal diseases :basic phenomena, clinical management, and occlusal and restorative interrelationships. Philadelphia: Lea & Febiger; 1990. 49. Socransky SS, Haffajee AD, Goodson JM, Lindhe J. New concepts of destructive periodontal disease. DENMARK; 1984.
50. Turk B, Turk D, Turk V. Lysosomal cysteine proteases: more than scavengers. Biochim Biophys Acta. 2000; 1477: 98-111.
Figurer
Figur 2. Cathepsin B-infärgning med immunohistokemi av human gingiva. Bild visar
bindväv (B) samt epitel (E). Infärgning med cathepsin B kan ses i sjok perivaskulärt (svarta pilar) i bindväven. (x100)
Figur 1. Hematoxylin- och eosininfärgat snitt av gingival vävnad som visar både epitel (E)
Figur 3. Cathepsin B-infärgning med immunohistokemi av human gingiva. Bild visar del
av bindväv. Något starkare cathepsin B-infärgning ses som diffust avgränsade sjok (svarta pilar) kring små blodkärl (K). (x 400)
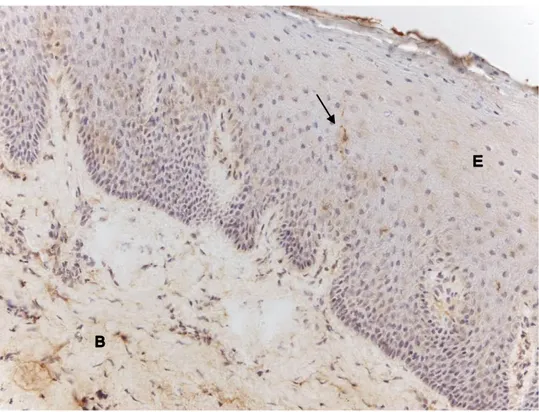
Figur 4. Cystatin C-infärgning med immunohistokemi av human gingiva. Bilden visar
epitel (E) samt bindväv (B). Enstaka specifikt cystatin C-infärgade celler (svart pil) kan ses spridda i epitelets mellersta lager. (x 200)
Figur 5. Cystatin C-infärgning med immunohistokemi av human gingiva. Bild visar epitel
med specifik cystatin C-infärgning av celler (svart pil) med elongerat till dendritiskt utseende. (x400)
Figur 6. Cystatin C-infärgning med immunohistokemi av human gingiva. Bild visar del av
bindväv. Ökad cystatin C-infärgning ses lokaliserat kring/i celler men kan inte knytas till någon specifik cellpopulation. (x400)