Examensarbete i biomedicinsk laboratorievetenskap 15 hp Malmö Universitet Biomedicinska analytikerprogrammet Hälsa och samhälle Institutionen för Biomedicinsk vetenskap 205 06 Malmö
VT 2020
VALIDERING AV SYSMEX
XN-550 ”BODY FLUID” VID
KONCENTRATIONS-BESTÄMNING AV
ERYTROCYTER I FÄRSK FRYST
PLASMA
VALIDERING AV SYSMEX
XN-550 ”BODY FLUID” VID
KONCENTRATIONS-BESTÄMNING AV
ERYTROCYTER I FÄRSK FRYST
PLASMA
DANIJELA BOKAN
Bokan, D. Validering av Sysmex XN-550 ”Body Fluid” vid
koncentrationsbestämning av erytrocyter i färsk fryst plasma. Examensarbete i biomedicinsk laboratorievetenskap, 15 högskolepoäng. Malmö Universitet: Fakulteten för Hälsa och Samhälle, Institutionen för Biomedicinsk vetenskap, 2020.
Färsk fryst plasma (FFP) är en blodkomponent som utvinns genom separation från helblod. FFP innehåller livsviktiga plasmaproteiner, immunoglobuliner och
koagulationsfaktorer. Produkten används främst till patienter med omfattande skador som lett till större blodförlust samt vid större kirurgiska blödningar vid operationer. Enligt riktlinjer stiftade av European Directorate for the quality of Medicines and healtcare (EDQM) bör samtliga plasmaenheter understiga 6,0 × 109/L erytrocyter för att produkten klassificeras som godtagbar för transfusion. Syftet med denna studie var att undersöka om Sysmex XN-550 med applikation ”Body Fluid” (BF) kan tillförlitligt koncentrationsbestämma erytrocyter i FFP och därmed ersätta Bürkerkammare som är den nuvarande metoden för dessa
mätningar. För detta ändamål utfördes en undersökning av linjäritet hos instrumentet, en statistisk jämförelse med mätning av 30 prover samt fem upprepade mätningar av en känd koncentration för undersökning av
reproducerbarheten. Resultaten visade en tydlig korrelation mellan analyserna med en jämn stegring av värden. Korrelationskoefficienten erhöll ett värde på 0,99. Bland Altmananalys visade att 95% av uppmätta värden förelåg inom konfidensintervallet vilket påvisar en överensstämmelse mellan metoderna med p-värde på 0,98. Mätningarna påvisade p-p-värden på 0,0005 vid analys av den lägsta koncentrationen (1 × 109/L), 0,5 vid anays av näst högsta koncentrationen (3 × 109/L) samt 0,9 vid analys av den högsta koncentrationen (6 × 109/L).
Nyckelord: Bürkerkammare, Erytrocyter, Färsk fryst plasma, Kvalitetskontroll, Sysmex XN-550, Transfusion.
VALIDATION OF SYSMEX
XN-550 BODY FLUID FOR
CONCENTRATION
DETERMINATION OF
ERYTHROCYTES IN FRESH
FROZEN PLASMA
DANIJELA BOKAN
Bokan, D. Validation of Sysmex XN-550 Body Fluid application for concentration determination of erythrocytes in fresh frozen plasma. Degree project in biomedical science, 15 credit points. Malmö University: Faculty of Health and Society, Department of Biomedical Science, 2020.
Fresh frozen plasma (FFP) is a blood component derived from separation of whole blood. FFP contains essential plasma proteins, immunoglobulins and coagulation factors. The product is mainly used for patients with extensive injuries which have led to major blood loss or for major bleeding due to surgical procedures. According to guidelines established by the European Directorate for the quality of Medicines and healtcare (EDQM), all plasma components should have an erythrocyte concentration of less than 6 × 109/L for the product to be classified as acceptable for transfusion. The purpose of this study was to investigate whether Sysmex XN-550 with the application “Body Fluid” (BF) could reliably determine the concentration of erythrocytes in FFP and thus replace the current method of Bürker chamber for these measurements. For this purpose, the linearity of the instruments was studied and a statistical comparison including measurements of 30 samples and five repeated measurements of a known
concentration for examination of the reproducibility. The results showed a clear correlation between the analyses with an even increase in value. The correlation coefficient provided a value of 0,99. Bland Altman analysis showed that 95% of the measured values were within the confidence interval, which shows a
correlation between the used methods and the calculated p-value was 0.98. The reproducibility measurements revealed a p-value of 0,0005 when measuring the lowest concentration (1 × 109/L), 0,5 when measuring the second to highest concentration (3 × 109/L) and 0,9 when measuring the highest concentration (6 × 109/L).
Keywords: Bürker chamber, Erythrocytes, Fresh frozen plasma, Sysmex XN-550, Transfusion, Quality control.
1
FÖRORD
Jag vill framföra mitt allra största tack och uppskattning till min handledare Sandra Pettersson (Processledare, Klinisk Immunologi och Transfusionsmedicin i Lund, Leg. Biomedicinsk Analytiker). Utan hennes hjälp, vägledning och
stöttning hade jag inte kunnat få ihop detta arbete. Jag vill även tacka Pia
Johansson (Enhetschef vid Klinisk Immunologi och Transfusionsmedicin i Lund, Leg. Biomedicinsk Analytiker) som kämpade för att detta arbetet överhuvudtaget skulle kunna ske på så kort tid.
Jag vill även yttra ett stort tack till Christina Valencuk (Verksamhetschef vid Klinisk Immunologi och Transfusionsmedicin, Leg. Biomedicinsk Analytiker) för hennes tillstånd att utföra mitt examensarbete i hennes verksamhet.
Slutligen vill jag rikta ett tack till min lärare Anette Gjörloff Wingren (Professor, PhD, Malmö Universitet) för hennes vägledning samt att hon tagit sig tiden att akademiskt granska mitt arbete. Jag vill även rikta ett tack till min vän och kurskamrat Sofie Larsson för hennes konstanta tålamod och hjälp med det skriftliga arbetet.
2
INNEHÅLLSFÖRTECKNING
BAKGRUND ... 3
Sysmex XN-550 ... 4
Sysmex XN-Body Fluid ... 5
Statistisk jämförelse mellan analysmetoder ... 5
Syfte ... 5
METOD OCH MATERIAL ... 5
Urval ... 5 Metod ... 5 Statistik ... 6 Etisk bedömning ... 7 RESULTAT ... 7 DISKUSSION ... 10 Metoddiskussion ... 10 Resultatdiskussion ... 11 KONKLUSION ... 12 REFERENSER ... 13
3
BAKGRUND
Transfusion av erytrocyt-, trombocyt- och plasmaenheter är vanligt
förekommande hos patienter med stora blödningar till följd av skada, vid blod- och cancersjukdomar samt hos patienter med uttalad anemi. Blodkomponenter framställs på blodcentraler genom helblod från friska blodgivare. Beredning av samtliga komponenter sker genom separation av helblod, alternativt genom aferesteknik. Helblodsseparation sker genom Reveos automatiska
blodbearbetningssystem med ett Reveos-blodpåsset där samtliga transfusionspåsar är sammankopplade. Separation sker därmed i slutet system för att minimera risken för bakteriekontamination hos produkterna. Efter centrifugering avlägsnas respektive komponent över i avsedd transferpåse som därefter delas med hjälp av en steril slangsvets för att kunna separera transferpåsarna sterilt [1,2].
Vid komponentberedning av färsk fryst plasma (FFP) sker ingen efterbehandling av produkten innan infrysning. Komponenten innehåller därmed naturligt
förekommande plasmaproteiner, immunoglobuliner och koagulationsfaktorer i kombination med största halt vatten. FFP används främst till patienter med omfattande skador som lett till större blodförlust samt vid större kirurgiska blödningar vid operationer. Det är klinisk bevisat att FFP bidrar till kroppens koagulationsförmåga vid stora blödningar och minskar därmed risken för dödsfall på grund av blodförlust, samtidigt som risken för transfusionskomplikationer är mycket låg [3,4].
Klinisk immunologi och Transfusionsmedicin vid Skånes Universitetssjukhus använder FFP för transfusion till patienter såväl som fraktionering till
läkemedelsverket. För verksamhet som bedrivs med avseende på produktion ägnat till patient ställs tydliga krav på kvalitén av komponenter som tillverkas.
Komponentframställning vid Skånes Universitetssjukhus följer riktlinjer
formulerade av European Directorate for the quality of Medicines and healtcare (EDQM). Enligt dessa riktlinjer bör samtliga plasmaenheter understiga 6,0 × 109/L erytrocyter för att produkten klassificeras som godtagbar för transfusion. 90 % av analyserade komponenter ska även understiga denna koncentration [5,6,7]. I nuläget görs koncentrationsbestämning av erytrocyter (RBC) i plasma
mikroskopiskt i Bürkerkammare. Det finns ingen standardiserad analysmetod för beräkning av koncentrationen. Flera tidigare studier har undersökt alternativa metoder för denna mätning [8,9,10]. Samtliga studier visar att Bürkerkammare är en tidkrävande och arbetsintensiv metod som är påfrestande på
laboratoriepersonal. Den nya applikationen Sysmex XN-550 ”Body Fluid” (BF) underlättar därmed med avseende på arbetsbelastning. Studierna påvisar även mycket god korrelation mellan manuell cellräkning och Sysmex XN-550 BF. Resultaten visade sig vara tillräckligt överensstämmande för att göra en ändring i arbetsrutiner [9-10].
På Klinisk Immunologi och Transfusionsmedicin i Lund används Sysmex XN-550 vid rutinkontroll av erytrocyt-, trombocyt- och plasmaenheter för att säkerställa att dessa håller kraven från EDQM. För samtlig kontroll av enheter används Sysmex XN-550 med standardprogram för mätning. Detta program visar begränsningar med avseende på koncentrationsgränser vid mätning av RBC, dessa är i nuläget 10–8600 × 109/L. Plasmaenheter där rutinkontroller regelbundet utförs
4
innehåller betydligt lägre koncentration RBC och måste därmed mätas manuellt i Bürkerkammare. Det finns samtidigt möjlighet att konfigurera Sysmex XN-550 för mätning av RBC i kroppsvätskor genom applikationen ”Body fluid” (BF) [5,6,10]. Med avseende på studier utförda med liknande metodik finns god grund att anta att denna applikation även kan analysera resterande erytrocyter i
reducerad plasma [9-10].
Sysmex XN-550
Sysmex XN-550 (se figur 1) är ett mindre hematologiskt analysinstrument som är bäst anpassat för små provvolymer. Instrumentet har förmåga att mäta blodstatus i helblod, som är en panel innehållande parametrarna hemoglobin, leukocyter (LPK), trombocyter (TPK), hemoglobinmassa, erytrocyter,
erytrocytvolymfraktion samt medelcellvolym. Även en differentialräkning av lymfocyter, monocyter, neutrofila-, basofila-, och eosinofila-granulocyter kan utföras i diagnostiska sammanhang. Samtidigt kan även retikulocytkoncentration (RET) mätas. För samtliga analyser krävs endast 25 L provvolym.
Trombocytvärde (PLT) kan samtidigt mätas genom två metoder, impedansmetod (PLT-I) eller optisk metod (PLT-O). Impedansmetoden innebär mätning av förändringen i spänningen som uppstår då en cell passerar mellan elektroderna, medan vid optiskmetod mäts istället trombocyter genom RET-kanalen där de märks med en fluorescens som binder till nukleinsyror i cellerna [11,12].
Sysmex XN-550 utnyttjar fluorescerande flödescytometri (FFC) för kvantifiering av celler [13]. FFC analyserar cellers fysiologiska och kemiska egenskaper där information erhålls om cellernas innehåll, storlek och morfologi. Prov aspireras i instrumentet och späds ut enligt förprogrammerade förhållanden. Därefter märks cellen med fluorescerande molekyler som binder till nukleinsyror. Cellerna passerar genom en smal kanal som belyses med laser. Samtidigt sitter detektorer som mäter ljusspridningen i olika riktningar vilket möjliggör kvantifiering av cellerna. ”Forward scatter” FSC mäter ljuset som sprid längst med laserstrålens längdriktning och ger information om cellens storlek. ”Side scatter” SSC däremot mäter spridningen av ljuset vinkelrätt mot laserstrålen och ger istället information om cellens innehåll, det vill säga cellens komplexitet, granulering och
kärnsegmentering. Utifrån dessa parametrar kan Sysmex XN-550 dela in cellerna och mäta deras koncentration i en cellsuspension [13-16].
5 Sysmex XN-Body Fluid
Applikation ”Body Fluid” (BF) används för analys av bland annat
cerebrospinalvätska och synovial vätska där RBC förväntas vara mycket lågt. Programmet kräver 70 L provvolymen och använder impedansmetod för
mätning av RBC [16]. Vid analys av RBC i kroppsvätskor med BF applikationen är koncentrationsgränserna 2–5000 × 109/L vilket innebär att en betydligt lägre koncentration kan mätas i plasmaenheter till skillnad från standardprogrammet som i nuläget är i drift [5].
Statistisk jämförelse mellan analysmetoder
För att utvärdera och validera en analysmetod används vanligtvis en metodjämförelse mot en tidigare bestämd referensmetod [17]. Statistikerna Altman och Bland publicerade 1986 för första gången tanken om ett nytt sätt att tillämpa statistisk analys mellan två kliniska mätmetoder och blev därefter den mest populära metoden att använda för statistisk undersökning. De menar att två analyser som är uppbyggda att mäta samma parametrar bör ha en god korrelation då ett specifikt antal prov valts ut. Bland-Altmananalaysen grundas på att när två analysmetoder jämförs mot varandra kan differensen beräknas där ett mått på överenstämmelsen mellan metoderna erhålls [17,18].
Syfte
Studiens syfte var att undersöka om Sysmex XN-550 med applikation ”Body Fluid” kan tillförlitligt koncentrationsbestämma erytrocyter i
komponentframställd blodplasma och därmed ersätta Bürker räknekammare på Klinisk Immunologi och Transfusionsmedicin vid Skånes Universitetssjukhus.
METOD OCH MATERIAL
Studiens utförande delades in i tre moment. Vid första delen undersöktes
linjäriteten hos Sysmex XN-550 genom en spädningsserie. Därefter mättes prover för en statistikjämförelse med Bland-Altmananalys. Till tredje delen användes prov som analyserades fem gånger vardera för att bestämma reproducerbarheten för respektive metod. Externa kontroller kördes dagligen och spindeldiagram tolkades innan respektive kontroll validerades [19].
Urval
Plasma- och erytrocytenheter valdes ut så att samtliga blodgrupper var
kompatibla. Så långt möjligt valdes plasmaenheter ut som varken skulle användas till transfusion eller fraktionering till läkemedelsverket. För analys av den statiska jämförelsen späddes totalt 30 plasmaprover.
Metod
För att undersöka linjäritet hos instrumenten poolades tre plasmaenheter av samma blodgrupp á 200g. Plasma centrifugerades vid 4999g i 8 minuter (ROTO SILENTA 630 RS. Hettich Labinstrument AB, Sigtuna, Sverige) och placerades i en manuell plasmaextraktor (Fenwal 4R444, Baxter International Inc, Illinois, USA) där 600 mL överfördes till en transferpåse. 400 mL av den cellreducerade plasman fördes sedan över i en 500 mL flaska medan resterande hälldes över i en 200 mL flaska. Plasma i 200 mL flaskan analyserades som blankprov. Prov togs
6
från erytrocytkoncentrat av motsvarande blodgrupp och analyserades med Sysmex XN-550 (Sysmex Corporations, Kobe, Japan) för att bestämma RBC. Till plasma tillsattes därefter 1 mL erytrocytkoncentrat. Slutkoncentrationen motsvarade cirka 16 × 109/L. Detta kontrollerades genom att ta ut ett prov från flaskan och
analysera i Sysmex XN-550. Ifall koncentrationen inte nådde upp till 16 × 109/L tillsattes erytrocytkoncentrat tills korrekt koncentration åstadkommits. Därefter gjordes en spädningsserie där plasma med tillsats av erytrocyter späddes ut med plasma utan någon tillsats. Samtliga prover analyserades i Sysmex XN-550 med BF applikationen enligt bruksanvisningar från tillverkaren [12]. Sedan beräknades koncentrationen manuellt i Bürkerkammare (Marienfeld Laboratory Glassware, Tyskland). Detta gjordes genom att tillsätta provet i Bürkerkammare med täckglas och placera i en fuktig kammare i fem minuter för att låta provet sedimentera. Därefter räknades celler mikroskopiskt och koncentrationen beräknades. Prov där antalet erytrocyter översteg 1000 stycken späddes med fosfatbuffert där
spädningsfaktorn sedan multiplicerades med antalet funna erytrocyter.
Statistisk jämförelse gjordes därefter mellan Bürkerkammare och Sysmex XN-550 BF. En plasmaenhet valdes ut och centrifugerades som ovan för att avlägsna alla celler. 40 mL plasma fördes över i ett 50 mL falconrör medan resterande hälldes över i en 200 mL flaska. 100 µL erytrocytkoncentrat av motsvarande blodgrupp tillsattes till falconröret och provet mäts sedan i Sysmex XN-550 för att bestämma koncentration. Enligt beräkning skulle koncentrationen erytrocyter i plasma då motsvara cirka 16 × 109/L. Därefter späddes totalt 30 prov så att den beräknade koncentrationen hamnade mellan 8,0 × 109/L och 0,5 × 109/L. Spädningarna gjordes med plasma från falconrör samt från flaska med ren plasma till önskad koncentration. Samtliga prover analyserades därefter både med Sysmex XN-550 samt räknades manuellt i Bürkerkammare. Prov där antalet erytrocyter översteg 1000 stycken späddes med PBS där spädningsfaktorn multiplicerades med antalet funna erytrocyter.
Slutliga delen gjordes för att studera reproducerbarheten hos respektive metod för att undersöka om samma resultat kunde erhållas vid upprepade mätningar. Prov valdes ut där koncentrationen erytrocyter var 1,0 × 109/L, 3,0 × 109/L samt 6,0 × 109/L. Respektive prov analyserades fem gånger vardera i Sysmex XN-550 sedan räknades fem gånger i Bürkerkammare.
Statistik
Samtlig statisk bearbetning gjordes med hjälp av Excel (Microsoft Office 2016). Från Bland-Altmananalys erhölls information om hur differensen mellan två kvantitativa analyser skiljer sig ifrån varandra. För att denna bedömning ska göras användes ett 95% konfidensintervall [17,18]. Utifrån Bland-Altmananalysen gjordes ett spridningsdiagram, så kallad Bland-Altmandiagram som beskriver differensen mellan två kvantitativa mätmetoder. X-axeln visar medelvärdet mellan de två analyserade metoderna medan y-axeln visar differensen mellan respektive metod. Utifrån samtliga differenser kunde ett biasvärde beräknas samt övre och nedre gräns för överrensstämmelsen bestämmas. Gränsvärdena beräknas genom formel: biasvärde ± 1,96 × SD [18,20-21].
Vid bedömning av reproducerbarheten hos respektive instrument utfördes fem upprepande försök av samma prov. Variationskoefficienten beräknades därefter i procent. Variationskoefficient är ett spridningsmått som belyser
7
CV = /, där är standardavvikelsen och är absoluta medelvärdet. Samtidigt gjordes även ett p-test där p-värdet som erhölls bör bli högre än 0,05 (p˃0,05). Ett p-värde över 0,05 innebar att valda metoder inte hade en statistisk signifikant skillnad på mätvärdena [21-23].
Etisk bedömning
Ingen etisk prövning krävdes då plasma- och erytrocytenheter som användes var avidentifierade och inte kan spåras tillbaka till blodgivaren. Samtliga blodgivare har även gett sitt samtycke till möjligheten att komponenter kan gå till
forskningsändamål. Detta gjordes genom hälsodeklaration som fylls i av givaren inför varje blodtappning.
RESULTAT
För validering av applikationen ”Body Fluid” för Sysmex XN-550 mättes linjäriteten hos instrumentet genom en spädningsserie. Därefter gjordes en statistisk jämförelse mellan Sysmex XN-550 BF och Bürkerkammare. Sist undersöktes reproducerbarheten för respektive metod. Resultaten presenteras i figurer och tabeller nedan.
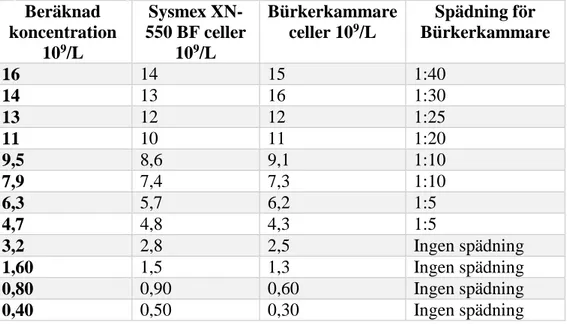
I figur 2 och tabell 1 presenteras resultaten spädningsserie som utfördes för att undersöka linjäriteten hos instrumentet. Spädningsserien visade ett tydlig linjärt samband mellan Sysmex XN-550 BF och Bürkerkammare där den beräknade korrelationskoefficienten är 0,99, detta presenteras även i figur 2. Samtliga beräknade och uppmätta koncentrationer presenteras i tabell 1 med tillhörande spädningar för Bürkerkammare. De erhållna värdena visar en jämn stegring av koncentrationer med likvärdiga värden mellan metoderna. Samtidigt går det att se hur spädningen påverkar koncentrationen då denna blir mer svårbedömd desto högre spädningsfaktor provet har.
Figur 2. Spädningsserie med koncentration erytrocyter i plasma uppmätt med Bürkerkammare jämfört mot uppmätta koncentrationer med Sysmex XN-550 BF för respektive spädning. X-axeln presenterar de uppmätta koncentrationerna med Sysmex XN-550 BF i 109/L och Y-axeln presenterar de uppmätta värden med Bürkerkammare i 109/L.
y = 1,1283x - 0,5319 R² = 0,975 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 B ürke rka mm are (10 9/L ) Sysmex XN-550 BF (109/L)
8
Tabell 1. Koncentrationer beräknade för samtliga spädningar med tillhörande resultat från mätningar med Sysmex XN-550 BF respektive Bürkerkammare, och tillhörande spädningar av suspension vid räkning.
Beräknad koncentration 109/L Sysmex XN-550 BF celler 109/L Bürkerkammare celler 109/L Spädning för Bürkerkammare 16 14 15 1:40 14 13 16 1:30 13 12 12 1:25 11 10 11 1:20 9,5 8,6 9,1 1:10 7,9 7,4 7,3 1:10 6,3 5,7 6,2 1:5 4,7 4,8 4,3 1:5 3,2 2,8 2,5 Ingen spädning 1,60 1,5 1,3 Ingen spädning 0,80 0,90 0,60 Ingen spädning 0,40 0,50 0,30 Ingen spädning För den statistiska jämförelsen användes 30 prover där den beräknade
koncentrationen erytrocyter var mellan 0,5 till 8 × 109/L. För samtliga prover gjordes en Bland Altmananalys som presenteras i figur 3. Bland Altmananalysen redogörs det för i ett spridningsdiagram med ett konfidensintervall på 95% som belyses av de röda linjerna. Den övre gränsen för konfidensintervallet beräknades till 0,57 och den nedre gränsen beräknades till -0,54. Den gröna linjen presenterar ett biasvärde på 0,02. En spridning av punkten kan observeras utifrån Bland Altmandiagrammet där två av punkterna ligger utanför konfidensintervallet (95%). Det erhållna p-värde blev 0,98. Detta tyder på att en bra överensstämmelse föreligger mellan Sysmex XN-550 BF och Bürkerkammare. Vidare visar figur 4 sambandet mellan Sysmex XN-550 och Bürkerkammare med avseende på de 30 analyserade proven. De röda linjerna belyser gränsvärdet 6 × 109/L för erytrocyter i plasma. Även här kan en spridning observeras mellan samtliga punkter, ett linjärt samband kan samtidigt skådas mellan de två utförda analyserna där den beräknade korrelationskoefficienten blev 0,99.
9
Figur 3. Bland-Altmananalys där x-axeln presenterar utvunna värden för medelvärde mellan analysen i Bürkerkammare och Sysmex XN-550 BF och y-axeln presenterar differensen mellan respektive metod. Grön linje presenterar bias-värdet (0,02) vilket är medelvärdet för alla differenser. De röda linjerna presenterar den övre gränsen (0,57) och nedre gränsen (-0,54) för konfidensintervallet på 95%. Konfidensintervall räknades ut genom formel Bias-värde ± 1,96 × SD, där SD är standardavvikelsen för alla differenser (SD = 0,28).
Figur 4. Spridningsdiagram som visar sambandet mellan Bürkerkammare och Sysmex XN-550 BF. X-axeln presenterar mätvärden för Sysmex XN-550 BF i 109/L medan Y-axeln presenterar mätvärden för Bürkerkammare i 109/L. Röda linjer belyser gränsvärde (6 109/L) för godkänd plasma.
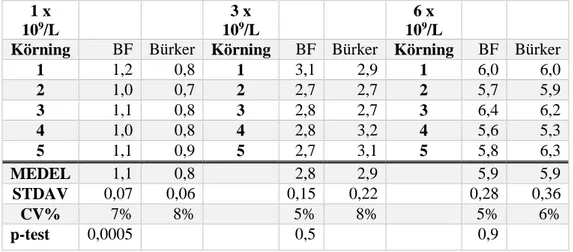
Slutligen utfördes fem upprepade analyser av tre kända koncentrationer (1 × 109/L, 3× 109/L samt 6 × 109/L) med respektive analysmetod. Detta för att mäta reproducerbarheten hos instrumenten. Tabell 2 presenterar medelvärde,
standardavvikelsen, variationskoefficienten och p-värde för samtliga mätningar.
-1,50 -1,00 -0,50 0,00 0,50 1,00 1,50 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 Dif fe re ns B ürke rka mm are oc h S y smex XN -550 B F
Medelvärde Bürkerkammare och Sysmex XN-550 BF
y = 1,0332x - 0,1363 R² = 0,9891 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 B ürke rka mm are (10 9/L ) Sysmex XN-550 BF (109/L) 1,96 SD Bias-värde -1,96 SD
10
Samtliga mätningar erhöll ett CV-värde på under 10%. Mätningarna påvisade p-värden på 0,0005 vid analys av den lägsta koncentrationen (1 × 109/L), 0,5 vid analys av näst högsta koncentrationen (3 × 109/L) samt 0,9 vid analys av den högsta koncentrationen (6 × 109/L).
Tabell 2. Resultat från respektive metods reproducerbarhet. Belyses genom beräknat medelvärde, standardavvikelse, variationskoefficient samt p-test för respektive prov och metod.
1 x 109/L 3 x 109/L 6 x 109/L
Körning BF Bürker Körning BF Bürker Körning BF Bürker
1 1,2 0,8 1 3,1 2,9 1 6,0 6,0 2 1,0 0,7 2 2,7 2,7 2 5,7 5,9 3 1,1 0,8 3 2,8 2,7 3 6,4 6,2 4 1,0 0,8 4 2,8 3,2 4 5,6 5,3 5 1,1 0,9 5 2,7 3,1 5 5,8 6,3 MEDEL 1,1 0,8 2,8 2,9 5,9 5,9 STDAV 0,07 0,06 0,15 0,22 0,28 0,36 CV% 7% 8% 5% 8% 5% 6% p-test 0,0005 0,5 0,9
DISKUSSION
Flera olika metoder är användbara för mätning av erytrocyter i FFP. Det finns samtidigt inte en nationellt fastställd metod för denna mätning i Sverige. Därav kan en ändring i rutinmässig kontroll göras så länge den nya metoden är validerad och utgör ett värdefullt verktyg för laboratoriet. Bürkerkammare har länge varit den standardiserade metoden för denna mätning på Klinisk Immunologi och Transfusionsmedicin vid Skånes Universitetssjukhus men är mycket tidkrävande och en stor arbetsbelastning för laboratoriepersonalen. Ett byte av analysmetod till Sysmex XN-550 Body Fluid skulle underlätta för personalen och möjliggöra en ökning av antalet kontrollerade FFP.
Metoddiskussion
Studien inleddes med att linjäriteten prövades för respektive metod för att undersöka om ett samband förelåg mellan analysmetoderna. Genom att göra en spädningsserie med gradvis sänkning av koncentration kunde detta analyseras. Den högsta koncentrationen som valdes att analyseras var 16 × 109/L då det ansågs att pålitliga värden skulle vara svåra att åstadkomma med Bürkerkammare vid högre koncentrationer. FFP som kommer att analyseras är samtidigt reducerad från RBC vilken innebär att dessa höga koncentrationer sällan kommer att
åstadkommas för koncentrationsbestämning med Sysmex XN-550 BF. Därav togs beslutet att fokusera på lägre koncentrationer som kommer att påträffas i
verksamheten. Tidigare har valideringar av XN-L serien från Sysmex utförts med avseende på koncentrationsbestämning av vita blodkroppar, RBC och PLT med BF applikationen [24]. Resultatet i studien fann att instrumentet visade
möjligheten för instrumentet att mäta koncentrationer för RBC vid 0–1000/µL. Detta trots begränsningarna angivna från tillverkaren där koncentrationsgränserna beskrevs vara 2–5000 × 109/L. Slutsatsen var samtidigt att Sysmex XL-serien
11
förbättrade arbetsflödet på laboratoriet utan att kompromissa med pålitlighet vid diagnostik av patientprover [24].
Vidare gjordes en statistisk jämförelse av 30 prover. Koncentrationsintervallet begränsades till att samtliga prov skulle ha en beräknad koncentration mellan 0,5 till 8 × 109/L. Motiveringen till detta beslut var att FFP som i framtiden skulle analyseras med BF applikationen oftast ligger inom detta intervall. 30 stycken prov valdes att analyseras då detta ansågs tillräckligt med avseende på studiens storlek samt tidsbegränsning. Det ansågs även vara tillräckligt med insamlade data för att göra en statistisk utvärdering av instrumentet. Däremot hade fler prover varit lämpligt för en mer omfattande studie. Vid undersökning av två kvantitativa mätmetoder är det vanligt att beräkna korrelationskoefficient och regressionslinje som ett mått på överensstämmelsen mellan metoderna. Enligt Bland och Altman [25,26] är detta felaktigt då korrelationskoefficienten inte mäter om det föreligger en systematisk avvikelse mellan valda metoder utan endast hur olika mätvärden samvarierar med varandra samt styrkan på sambandet [25,26]. Bland och Altman föreslog 1986 istället en alternativ metod för beräkning av överensstämmelse mellan två kvantitativa mätmetoder genom Bland Altmandiagram. Inom kliniska laboratorier anses ett 95% konfidensintervall vara tillräckligt för att en
uppskattning av överensstämmelse ska kunna göras [27]. Utefter detta kan ett p-värde även beräknas som samtidigt anses vara ett mått på överenstämmelsen mellan analysmetoderna.
Slutligen undersöktes reproducerbarheten hos respektive analysmetod för att undersöka hur väl instrumenten hade förmågan att visa pålitliga värden vid upprepade mätningar. Koncentrationer RBC som valdes att analyseras var 1 × 109/L, 3 × 109/L och 6 × 109/L. Anledningen till att dessa koncentrationer valdes var för att undersöka reproducerbarheten för en koncentration som befann sig under koncentrationsgränsen, och en som befann sig precis ovanför
koncentrationsgränsen samt en som var förhållandevis hög som även var på gränsen till EDQM riktlinjer för godkänd FFP. Vid en tidigare studie från 2016 utfördes hematologiska analyser med BF applikationen på cerebrospinalvätska samt synovialvätska. Vid undersökning av reproducerbarheten hos instrumentet fann de att variationskoefficienten beräknades till mindre än 10% för samtliga mätningar [28]. För att ett instrument ska tolkas som att ha en god precision bör värdet för variationskoefficienten understiga 10%, vilket tolkas som att
instrumentet uppger mindre spridning mellan uppmätta värden [28]. Samtidigt beräknades även samtliga p-värden för respektive koncentration för att undersöka pålitligheten av mätvärdena samt om skillnaden mellan dessa var signifikant.
Resultatdiskussion
Vid analys av spädningsserie erhölls en regressionslinje för att studera linjäriteten. Därigenom erhölls en korrelationskoefficient på 0,99 vilket tyder på ett positivt samband mellan Sysmex XN-550 BF och Bürkerkammare. Samtliga visades att Sysmex XN-550 BF hade möjlighet att mäta koncentrationer under de angivna koncentrationsgränserna (2–5000 × 109/L). Vid analys av värden där
koncentrationen RBC var under 2 × 109/L erhölls högre koncentrationer med Sysmex XN-550 än Bürkerkammare. Detta kan däremot bero på att
koncentrationerna var lägre och kunde räknas i Bürkerkammare utan spädning. Samtidigt upptäcktes svårigheter vid mätning av prover med höga koncentrationer i Bürkerkammare. För att kunna analyera prover där RBC översteg 2 × 109/L var dessa tvungna att spädas med PBS. En spädning av provet bidrar samtidigt till
12
förändring i cellernas struktur och kan vara en felkälla vid
koncentrationsbestämning av RBC. Detta observerades tydligast vid mätning av de två högsta koncentrationerna i spädningsserien med Bürkerkammare. Provet vars koncentration beräknades till 14 × 109/L erhöll resultatet 16 × 109/L med Bürkerkammare och 13 × 109/L med Sysmex XN-550 BF. Detta tyder på att Bürkerkammare har en större möjlighet för felkällor än Sysmex vid mätning av högre koncentrationer. Samtidigt är det mycket sällan som plasmaenheter på laboratoriet kommer upp i dessa höga koncentrationerna vid rutinmässiga kontroller av enheter.
Bland Altmandiagrammet visade en god korrelation mellan mätmetoderna där samtliga punkter faller inom gränserna för 95% konfidensintervall. Samtidigt sågs även en jämn spridning mellan punkterna där inget samband kunde ses ifall en metod mäter ett högre eller lägre värde. Det beräknade p-värdet för korrelationen var 0,98 vilket tyder på att det inte förekommer en signifikant skillnad mellan mätmetoderna. Korrelationskoefficienten beräknades till 0,99 vilket även tyder på ett positivt samband. Antalet analyserade prov ger däremot endast en
fingervisning om hur mätinstrumenten samvarierar med varandra. Skulle en mer omfattande validering göras krävs ett större antal analyserade prover.
Slutligen undersöktes reproducerbarheten som visade variationskoefficienten att samtliga värden för mätningar var under 10% vilket tyder på en liten spridning erhålls vid upprepning i mätningar. Beräkning av p-värde för respektive
koncentration visade även att p=0,5 för provet med koncentrationer 3 × 109/L och p=0,9 för provet med koncentration 6 × 109/L vilket innebär att dessa inte har en signifikant skillnad vid upprepning av mätningar av högre koncentrationer. P-värde vid undersökning av reproducerbarheten för den lägsta koncentrationen (1× 109/L) blev 0,0005 vilket innebär att det finns en signifikant skillnad mellan upprepning i mätningar. Vilket är en bekräftelse på
koncentrationsbegränsningarna som var angivna av tillverkaren. Däremot krävs fler upprepningar i mätningar med ett större antal prov av olika koncentrationer för att ett mer pålitligt och säkert resultat ska kunna erhållas vad gäller
reproducerbarheten.
KONKLUSION
Enligt resultat som erhölls från mätningar av linjäriteten i studien kan ett positivt samband ses för Sysmex XN-550 BF och Bürkerkammare där den erhållna korrelationskoefficienten var 0,99. Samtidigt är det möjligt att med Sysmex XN-550 BF analysera prov med koncentrationer under de angivna
koncentrationsgränserna för RBC. För att säkerställa detta bör däremot ett större antal prover med koncentration under 2 × 109/L mätas för att vidare utvärdera dessa gränser. Undersökning av reproducerbarheten erhöll ett p-värde vid 0,0005 vilket innebär att det finns en signifikant skillnad mellan värdena. För ytterligare bedömning av reproducerbarhet bör vidare studie göras där fler upprepningar i mätningar görs av ett större antal prov med olika koncentrationer. Bland Altmandiagram visade en god korrelation mellan mätmetoder där ett 95%
konfidensintervall uppnåddes, p-värde beräknades vara 0,98 som visar att det inte finns en signifikant skillnad mellan mätmetoderna.
13
REFERENSER
1. Johnson L, Winter KM, Kwok M, Reid S, Marks DC (2013) Evaluation of the quality of blood components prepared using the Reveos automated processing system. Vox Sanguinis, 105(3)225-235.
2. Lagerberg J, Salado-Jimena J, Löf H, Bontekoe I, Nielsen C, Verheggen C, van Waeg G, van der Meer P, de Korte D, Hansen M, Knutson F (2013) Evaluation of the quality of blood components obtained after automated separation of whole blood by the new multiunit processor. Transfusion, 53: 1798-1806.
3. Figueiredo S, Benhamou D (2017) Use of fresh frozen plasma: from the 2012 French guidelines to recent advances. Transfusion and Apheresis Science, 56:20-25
4. Puetz J (2013) Fresh frozen plasma: the most commonly prescribed
homostatic agent. Journal of Thrombosis and Haemostasis, 11:1794-1799. 5. Svensk Förening för Transfusionsmedicin (2014) Kapitel 5
Blodkomponenter: Kvalitetssäkring och Kontroll. Version 4.0. 6. Svensk Förening för Transfusionsmedicin (2014) Kapitel 4
Blodkomponenter: Framställning och användning. Version 4.0. 7. European Committee on Blood Transfusion (2017) Guide to the
preparation, use and quality assurance of blood components, 19th edition. Strasbourg, Council of Europe.
8. Ekblom K, Petersson A (2019) Evalutation of urine dipsticks for quality control of residual erythrocytes and leukocytes in leukocyte-depleted donor plasma. Scandinavian Journal of Clinical and Laboratory Investigations. 80(1):39-45
9. Cho Y, You E, Jang S, Park C (2018) Validation of reflex testing rules and establishment of a new workflow for body fluid cell analysis using a Sysmex XN-550 automatic hematology analyzer. International Journal of Laboratory Heamatology, 40:258-267.
10. Petersson A, Ekblom K (2017) Methods for counting residual leukocytes in leukocyte-depleted plasma – a comparison between rutine hematology instrument, the nageotto chamber, flow cytometry, and a fluorescent microscopy analyzer. Transfusion. 57:1192-1198.
11. Sysmex Corporation (2017) Automated Hematology Analyzer XN-L series XN-550/XN-450/XN-350 Allmän information. Kobe, Japan, Sysmex Corporations. >https://www.sysmex.se/n/< (2020-03-28)
12. Sysmex Corporation (2017) Automated Hematology Analyzer XN-L series XN-550/XN-450/XN-350 Grundläggande användning. Kobe, Japan, Sysmex Corporations.>https://www.sysmex.se/n/< (2020-03-28)
14
13. Tailor H, Mackie I, Mellick A, Machin S (2017) Evalutation of the
Sysmex XN-550, a Novel Compact, Heamatology analyser from the XL-L series, compared to the XN-20 system. International Journal of
Laboratory Heamatology, 39:585-589.
14. Blanco R, Cavagnetto C, Willmott L, Aydogdu E, Akinyemi N, Standring H, Procter S, Garner S, Shirakami A, Saker J, Linssen J, Cardigan R (2020) The use of the hematology analyser with a new generation of software as an alternative to flow cytometry for enumerating residual white blood cells in blood components. Transfusion, 60:155-164. 15. Buoro S, Peruzzi B, Fanelli A, Seghezzi M, Manenti B, Lorubbio M,
Biagiolo T, Nannini S, Ottomano C, Lippi G (2017) Two-site evalutation of the diagnostic performance of the Sysmex XN Body Fluid (BF) module for cell count and differential in Cerebrospinal Fluid. International
Journal of Laboratory Heamatology, 40:26-33.
16. Aguadero V, Cano-Corres R, Berlanga E, Torra M (2017) Evalutation of Biological Fluid Analysis Using the Sysmex XN Automatic Hematology Analyzer. International Clinical Cytometry Society, 94B:836-844.
17. Altman D.G (1999) Practical statistics for medical research. Chapman & Hall, London.
18. Shieh G (2018) The appropriateness of Bland-Altman´s approximate confidence intervals for limits of agreement. BMC Medical Research Methodology. 18:45.
19. Sysmex (2020) XN Check BF >https://www.sysmex.se/n/< (2020-03-17). 20. Panagiotakos D.B (2008) The value of p-value in Biomedical Research.
The open cardiovascular Medicine Journal. 2:97-99.
21. Dogan N (2018) Bland-Altman analysis: A paradigm to understand correlation and agreement. Turkish Journal of Emergency Medicine. 18: 139-141.
22. Liang K-Y, Zeger S (1993) Regression analysis for correlated data. Annual review of Public Health.14:43-68.
23. Brunzendorf J, Behrens R (2007) How to type test the coefficient of variation of an indication. Radiation Protection Dosimetry. 123:21-31. 24. Seo J, Lee S, Kim S (2014) Performance evaluation of the new
hematology analyzer Sysmex XN-series. International Journal of Laboratory Hematology. 37;155-164.
25. Bland J M, Altman D G (1999) Measuring agreement in method comparison studies. Statistical methods in medical research. 8:135-60.
15
26. Bland JM, Altman DG, (1986) Statistical methods for assessing agreement between two methods of clinical measurement. Lancent, 327(8476):307– 10.
27. Giavarina D (2015) Understandning Bland Altman analysis. Biochemia medica. 25:141–151.
28. Tanaka M, Shukuya K, Morita Y, Kageyama Y, Okubo S, Shimosawa T, Tatomi Y (2016) Performance Evaluation of the XN-550 Automated Hematology Analyzer Body Fluid Mode – Considerations for Operational Conditions for Cell Counting with Cerebrospinal and Synovial Fluids. Sysmex Journal International. 26:1-9.