Examensarbete i biomedicinsk laboratorievetenskap Malmö högskola
EN JÄMFÖRELSESTUDIE AV
PLAST- OCH
GLASHEMOCYTOMETRAR
FÖR BERÄKNING AV
BLODCELLER I VENÖST OCH
KAPILLÄRT HELBLOD
EN JÄMFÖRELSESTUDIE AV
PLAST- OCH
GLASHEMOCYTOMETRAR
FÖR BERÄKNING AV
BLODCELLER I VENÖST OCH
KAPILLÄRT HELBLOD
LINDA ISTREFI
Istrefi, L. En jämförelsestudie av plast- och glashemocytometrar för beräkning av blodceller i venöst och kapillärt helblod. Examensarbete i
biomedicinsk laboratorievetenskap 15 högskolepoäng. Malmö Högskola:
Fakulteten för hälsa och samhälle, Institutionen för biomedicinsk vetenskap, 2015.
Hematologiinstrument som analyserar blodceller kan vid specifika fall behöva kompletteras med manuell räkning med hemocytometer. Hemocytometern tillverkad i plast, som har ett fast täckglas och som är avsedd för engångsbruk tycks minska problem som uppkommer vid användning av den traditionella glashemocytometern, bl.a täckglas-appliceringssvårigheter och dammpartiklar. Kapillärt taget helblod kan vara användbart för patienter som ligger på
akutmottagning och dessutom tas en mindre blodvolym jämfört med
venprovtagning. Denna studie kommer fokusera på trombocyt- samt leukocyt partikelkoncentration (TPK och LPK) i venöst- samt kapillärt helblod, i syfte att jämföra plast- och glashemocytometrar med Sysmex XN-2000 (Sysmex
Corporation, Kobe, Japan), samt verifiera om kapillärt taget helblod kan användas för mätning av dessa hematologiska parametrar. Från 30 försökspersoner togs både kapillära- och venösa blodprover och analyserades med glas- samt
plasthemocytometer med Sysmex XN-2000 som referensmetod. Resultaten från studien uppvisade hög korrelation mellan referensmetoden och
plasthemocytometrar vid låga TPK men olämplig vid LPK-bestämning. Det kapillära helblodet uppvisade hög korrelation till referensmetoden vid LPK-bestämning men var oanvändbar vid TPK-LPK-bestämning. Glashemocytometern var närmare referensmetodens resultat än vad plasthemocytometern var.
Nyckelord: Hemocytometer, Kapillärt helblod, Leukocytpartikelkoncentration,
A COMPARATIVE STUDY OF
PLASTIC AND GLASS
HEMOCYTOMETERS FOR
CALCULATION OF BLOOD CELLS
IN VENOUS AND CAPILLARY
WHOLE BLOOD
LINDA ISTREFI
Istrefi, L. A comparative study of plastic- and glass hemocytometers for the calculation of blood cells in venous and capillary whole blood. Degree Project in
Biomedical Science, 15 Credit Points. Malmö University: Faculty of Health and
Society, Department of Biomedical Science, 2015
Hematology-instruments that analyze blood cells can at specific cases be followed by manual counting with a hemocytometer. The plastic
hemocytometer which has a fixed coverslip and is assigned for disposable use, appears to reduce the problems arising from the use of the traditional glass hemocytometer, for instance coverslip-application difficulty and dust particles. Capillary whole blood sampling may be useful for patients at the emergency department and in addition, a smaller volume of blood is taken compared to venous blood sampling. This study will focus on the platelet- and leukocyte count (PLT and WBC) in venous and capillary blood, in order to compare the plastic- and glass hemocytometers with Sysmex XN-2000 (Sysmex Corporation, Kobe, Japan), and verify if capillary whole blood sampling can be used for the
measurement of these hematological parameters. 30 subjects donated both
capillary- and venous blood samples and these blood samples were analyzed with glass- and plastic hemocytometers with Sysmex XN-2000 as the reference
method. The study results showed high correlation between the reference method and plastic hemocytometer at low PLT but were not suitable for
WBC-determination. The capillary whole blood showed high correlation to the reference method at WBC-determination, but was unusable at PLT-determination.Glass hemocytometer was closer to the reference method results than plastic
hemocytometer was.
Keywords: Capillary whole blood, Hemocytometer, Platelet count, Sysmex
INNEHÅLLSFÖRTECKNING
INTRODUKTION ... 5
Kapillärt helblod jämfört med venöst helblod ... 5
Trombocyter ... 6
Leukocyter ... 7
Syfte ... 7
MATERIAL OCH METOD ... 8
Material ... 8 Metod ... 8 Urval ... 8 Provtagning ... 8 Analysmoment ... 9 Bearbetning av data ... 9 Etisk bedömning ... 9 RESULTAT ... 10 DISKUSSION ... 12
Jämförelse mellan plast- och glashemocytometer ... 12
Jämförelse mellan kapillärt- och venöst helblod ... 13
Tidigare studier ... 13
Påverkan av metodik ... 13
KONKLUSION ... 14
INTRODUKTION
Manuell blodcellsräkning med hemocytometrar är idag en mindre brukbar metod för leukocyt- och trombocytcellsräkning i hematologiska laboratorier. Detta på grund av att den har ersatts av den datormaskinella utrustningen som uträttar mätning av blodceller med impedance-, optiskt- och flourokromatisk
mätningsprincip. Sysmex XN-serien (Sysmex Corporation, Kobe, Japan) används för datormaskinella hematologiska analyser på de flesta kliniska laboratorier i Skåne. Sysmex XN-serien har utvärderats i flera studier och har visats ha god precision samt bra reproducerbar förmåga och har bland annat utvärderats i studier som använt låga och höga koncentrationer av blodceller samt normala och abnormala patientprover [1,2].
Vid vissa specifika fall behöver den datormaskinella metoden kompletteras med manuell räkning med hemocytometer. Bürkers hemocytometer är referensmetoden bland manuella blodcellräkningsmetoder med glashemocytometer [3]. Problem uppkommer med användning av den glasframställda hemocytometern, bland annat svårigheter i korrekt täckglasapplicering och undvikning av dammpartiklar. Detta gör att engångshemocytometern i plast, som har ett fast täckglas, kan möjliggöra tidbesparing och lägre kontamineringsrisk. Glas- och
plasthemocytometrar har jämförts av Stone et al [4] som visade att
plasthemocytometern (NanoEnTek, Seoul, Korea) är lämplig för blodcellsräkning. Müller et al [5] har utfört en jämförelse av glashemocytometer och
hematologiapparaturen Abbott CD3500 (Abott Diagnostika GmBh, Wiesbaden-Delkenheim, Tyskland) på leukocytfiltrerat samt ofiltrerat helblod och visade bättre precision av hemocytometern vid låga leukocytpartikelkoncentrationer (0-300 celler/µl), men vid högre koncentrationer uppgav den automatiserade hematologiapparaturen bättre resultat.
Kirkman-Brown & Björndahl [6] utvärderade hemocytometrarnas förmåga vid spermiekoncentrationsbestämning, och visade att plasthemocytometrar uppvisade lägre spermiekoncentrationer jämfört med glashemocytometrar. En bidragande orsak till detta var att spermier som var lokaliserade i de uppljusnade linjerna i hemocytometern var svåra att urskilja. Yamanishi et al [7] evaluerade
plasthemocytometern vid bestämning av leukocytvärde i cerebrospinalvätska. Resultatet från studien stödjer plasthemocytometrar i avseende på bättre leukocyturskiljning samt en signifikant korrelation till glashemocytometrar.
Kapillärt helblod jämfört med venöst helblod
Idag används kapillär provtagning om venös provtagning inte är möjlig av olika anledningar. Även om venös provtagning alltid är att föredra, finns det fördelar med kapillär provtagning som t.ex. mindre blodvolym taget från patienter och en halverad kostnad för provrör [8]. Flera studier har jämfört hematologiska analyser
i kapillärt- och venöst helblod. Bland annat i studien gjort av Ponamapalam et al [9], värderades resultaten från kapillärt helblod jämfört med venöst helblod med hjälp av en automatiserad patientnära apparatur kallad Medonic CA 620 (Boule Medical, Dublin, Irland) på akutmottagning. Fördelar med den kapillära
provtagningen var enkelheten samt flexibiliteten vid provtagning av akutpatienter. Resultatet från studien visade att kapillärt helblod var ett passande sätt att
kontrollera blodstatus, med små icke signifikanta variationer. En annan studie av Yang et al [10] jämförde skillnaden igen med hjälp av Sysmex F-820 (Sysmex Corporation, Kobe, Japan). I kapillärt helblod fanns en ökning av leukocyter vilket kan förklaras genom att neutrofila granulocyter ansamlas vid
insticksområdet som ett svar på vävnadsskadan. Vid bestämning av trombocytkoncentrationen uppkom inte signifikant skillnad.
Erytrocytkoncentrationen var mest stabil i jämförelsen medan variation mellan LPK och TPK fanns.
En annan studie skriven av Conway et al [11] har belyst förmågan som krävs för korrekt kapillärprovtagning, bland annat genom att undvika klämning av
patientens finger och utföra en snabb provuppsamling. En jämförelse utfördes av olika yrkesgrupper som tog kapillära blodprov och resultatet visade att ostabila värden berodde på användarens teknik. Ytterligare en studie gjord av Schalk et al [8] har undersökt hypotesen att kapillärt och venöst helblod motsvarar samma hematologiska parametrar på Advia 120 (Siemens Healthcare, Bayer, Tyskland). Fördelen med studien var att inte bara friska patienter undersöktes. Resultatet som utkom var högre LPK i kapillära blodprover jämfört med venösa blodprover och ingen skillnad i TPK hos sjuka patienter, men hos friska individer fanns det en sänkning i TPK i kapillärt helblod.
Trombocyter
Trombocyter som är bidragande i hemostas och kärlväggsreparation, analyseras i helblod för att undersöka om en trombocytopeni eller trombocytos föreligger. De bakomliggande orsakerna till trombocytopeni härstammar oftast från en defekt i trombocytproduktion, vilket kan innebära benmärgshämmning där
megakaryocyterna påverkas, en ökad trombocytanvändning vid exempelvis infektion eller en befintlig splenomegali där en trombocytansamling sker i mjälten. Normal TPK i blodet ligger i 150-400 x 109/L intervallet [12]. Trombocytopeni kan bero på olika tillstånd, bland annat läkemedel som kan begränsa benmärgsproduktionen [13], cytostatikabehandling som
leukemipatienter genomgår [14], myelodysplastisk syndrom (MDS) där
hematopoesen är rubbad, disseminerad intravasal koagulation (DIC) där en ökad destruktion av trombocyter sker samt vid idiopatisk trombocytopen purpura som innebär att man oftast har antikroppar som är riktade mot glykoproteiner, vilket medför att makrofager i mjälten avlägsnar trombocyter från cirkulationen för tidigt. Trombocytos kan innebära att en tillfällig inflammation eller en
myeloproliferativ rubbning föreligger. Myeloproliferativ rubbning orsakas av en mutation, och innebär att benmärgen stimuleras till ökad celldelning och resulterar därför i detta fallet i trombocytos [12,15].
Den manuella räknemetoden med användning av hemocytometer används vid specifika fall som inte kan upptäckas i den automatiserade hematologisystemet. Pseudotrombocytopeni (PTCP) är ett falskt för lågt trombocytvärde som sker in
vitro. Tillståndet konstateras som en artefakt och har ännu inte fått en fullt
klarlagd patofysiologi [16-17]. Det finns en omtalad teori till varför PTCP kan uppstå, bland annat en trombocytaggregering som uppstår av antikoagulanten EDTA [18]. Förklaringen till EDTA-beroende PTCP (EDTA PTCP) är inte klargjord än, men hypoteser diskuteras i ett flertal studier [16-19]. Användning av trisodium-citrat har vid vissa tillfällen korrigerat trombocytvärdet [18]. Ett sätt att upplösa trombocytaggregaten in vitro har diskuterats och beprövats av Sakurai et
al [17] med hjälp av aminoglykosiden kanamycin, som gav bäst
upplösningsförmåga i 28 EDTA-blodprover från EDTA-PTCP patienter och gav ökning i trombocytantalet till cirka 90 % vid undersökande efter tillsatsen. Denna upplösande effekt bibehöll sin förmåga i minst 120 min.
Leukocyter
Leukocyter i helblod analyseras i syfte att veta om en leukopeni eller leukocytos förekommer. Leukocyternas huvudsakliga funktion är att agera som ett skydd mot infektion genom samarbete med immunoglobiner som kan binda till lymfocyter, och leukocyterna samarbetar även med komplementsystemet som med sina plasmaproteiner har förmåga till att lysera bakterier så att de fagocyteras. Ett normalt LPK för vuxna ligger mellan 3,5-8,8 x 109/L [12].
Den största förändringen som sker i det totala LPK-värdet, beror oftast på de neutrofila granulocyterna. Leukopeni kan drabba en individ genom tre olika händelser; vid ökad destruktion, benmärgsfel eller att cellerna vandrar från det perifera blodet. Ett problem kan uppkomma vid tolkning av LPK i
hematologiinstrument. När en infektiös leukopeni föreligger, är de neutrofila granulocyterna sänkta och ingen ökning av lymfocyterna sker (detta kan ske vid vissa bakteriella infektioner, HIV eller influensa). Fast i det fallet man undersöker differentialräkningens procenttal, tycks lymfocyterna ha ökat på grund av deras procentuella ökning [20]. Leukocytos orsakad av neutrofila granulocyter är ett tecken på antingen en pågående infektion eller inflammation. Akut leukemi som beror på benmärgsdysfunktion kan också leda till leukocytos. Automatiserad analys samt manuell analys krävs för att klassificera leukocytos [21].
Syfte
Denna studie kommer fokusera på trombocyt- samt leukocyt partikelkoncentration (TPK och LPK) på venöst samt kapillärt helblod, i syfte att jämföra plast- och glashemocytometrar med Sysmex XN-2000 (Sysmex Corporation, Kobe, Japan),
samt verifiera om kapillärt taget helblod kan motsvara det venösa helblodets återspegling av kroppens TPK och LPK.
MATERIAL OCH METOD
TPK och LPK i kapillärt- samt venöst helblod analyserades både automatiskt med XN-2000 hematologiinstrument samt med manuell blodcellsräkning med
hemocytometer.
Material
XN-2000 hematologiintrument (Sysmex Corporation, Kobe, Japan),
dubbelfiltrerat Leukoplate-lösning spädd 1:100 (Fiche Technique, Montbonnot, Frankrike), microcaps, 500 µl EDTA-microtainerrör (BD Medical, New Jersey, USA), 4 ml EDTA-vacutainerrör (BD Medical, New Jersey, USA), lancetter (Medline, Illinois, USA), Bürker hemocytometer i glas (In-vitro diagnostica, Marienfeld, Tyskland), täckglas av storlek 21x23 mm (Gerhard Menzel GmbH, Braunschweig, Tyskland), hemocytometer i plast kallad C-Chip Bürker-DHC-N01 (NanoEnTek, Seoul, Korea), blodprovsvagga (Triolab, Göteborg, Sverige) och faskontrast-mikroskop modelltyp Nikon Eclipse 50i (Nikon Instruments, Tokyo, Japan)
Metod
Nedan följer tillvägagångssättet för studiens provtagning och hematologiska analyser.
Urval
Studien inkluderade 33 försökspersoner på klinisk kemi-provtagningen vid Ängelholms sjukhus, varav 17 var män. Från varje försöksperson togs ett kapillärt- och ett venöst blodprov för TPK- och LPK-bestämning.
Inkluderingskriterier var en ålder på minst 18 år. Exkluderingskriterier innefattade de försöksindivider som uppvisade EDTA-PTCP, varav blodcellsräkning inte kunde utföras (vilket var 3 av 33 deltagare). Försökspersonerna bestod av sjukhusbesökande patienter samt laboratoriepersonal.
Provtagning
Ett kodnummer kopplad till en remiss utgjorde identiteten och igenkänningen av varje försöksperson. Provtagning utfördes på försöksindivider som hade vilat i 15 min. Kapillär- samt venös provtagning utfördes enbart av studieansvarig och på försöksdeltagarnas vänstra arm samt lång- eller ringfinger. Vid kapillär
blodtappning torkades första bloddroppen bort och blodet samlades upp i microtainerrör med tillsats av EDTA, utan klämning av fingret. Venös
och venösa prover samlades upp från individen vid samma tillfälle. Vidare angående teknik och beskrivning av provtagning, hänvisas till tidigare beskrivningar [8-10,22].
Analysmoment
Varje deltagares blodprover blandades direkt efter provtagning och fick därefter stå i rumstemperatur i 10-15 min och blandades igen inför analysering i Sysmex XN-2000, där LPK och TPK bestämdes maskinellt. Automatisk- och manuell analysering av varje patientprov genomfördes inom 1 timme. Innan blodproverna placerades in i maskinen, kontrollerades de efter eventuella koagel. Vid närvaro av larm för trombocytaggregat från Sysmex XN-2000 programvaran, bekräftades aggregaten via granskning i hemocytometrar. Från samma blodprov som
analyserades i Sysmex XN-2000 togs 25 µl helblod ur med microcaps för spädning med 475 µl Leukoplate-lösning i Eppendorfrör. Det spädda provet blandades sedan i 5 min med hjälp av en vagga. Leukoplate-lösning gör att erytrocyterna hemolyseras och trombocyter samt leukocyter färgas distinkt blå. Täckglaset observerades för att undvika repor eller dammpartiklar och monterades på hemocytometern. Fyllning av varje kapillärt- samt venöst blodprov utfördes i hemocytometerns två skilda volym-ytor. Samma sak gjordes med
plasthemocytometern. Hemocytometern fick sedan stå minst 20 minuter i sluten fuktighetskammare för sedimentering av trombocyter. Varje hemocytometer analyserades var för sig, för undvikning av lång sedimenteringstid och uttorkande av preparaten. 32 B-rutor räknades för bestämning av LPK och bestämning av TPK utfördes på 16 CD-rutor. Med faskontrast-mikroskop vid 10x40 förstoring analyserades TPK och LPK. Ytterkanter samt innehållet av hemocytometrar granskades efter trombocytaggregat. Vid manuell räkning, utfördes dubbelräkning av blodcellerna.
Bearbetning av data
All statistisk analysering utfördes med hjälp av datorprogrammet IBM SPSS Statistics Version 22.0 (IBM Corporation, New York, USA). Data i studien presenterades i form av medelvärde ± standardavvikelse för undersökning av hur stor skillnad det fanns mellan försöksdeltagarnas mätvärden vid användning av olika analysmetoder. Jämförelser genomfördes med parat t-test för granskande om skillnader var signifikant lika och korrelationssamband undersöktes med hjälp av Pearsons korrelationskoefficient och determinationskoefficienten R2 redovisas. Signifikansnivån sattes till 5 % och p-värde högre än 0,05 visar på signifikant likhet.
Etisk bedömning
Etiskt godkännande för genomförande av studien erhölls från Etiska rådet, vid fakulteten för Hälsa och samhälle, Malmö Högskola (Dnr: HS60-
2015/223:8). Vid godkännande av ett informerat samtycke, kunde deltagandet i studien påbörjades. Detta samtycke kunde dock avbrytas när som helst under studiens gång av deltagare genom email eller telefonkontakt med studieansvarig. Alla deltagare behandlades som ett kodnummer för hög konfidentiell arbetsgång och hanterades endast av studieansvarig.
RESULTAT
Resultatet som visas nedan är baserat på hematologianalyser utförda på 30 personer. LPK och TPK bestämdes i venöst- och kapillärt helblod med tre analysmetoder. Räkning med plasthemocytometrar och glashemocytometrar jämfördes med datormaskinell räkning i Sysmex XN-2000. Den automatiserade bestämningen uppvisade ett konstant högre medelvärde av alla parametrar, förutom vid beräkning av TPK i glashemocytometrar som gav något högre medelvärde än Sysmex XN-2000 i kapillära blodprover (se tabell 1).
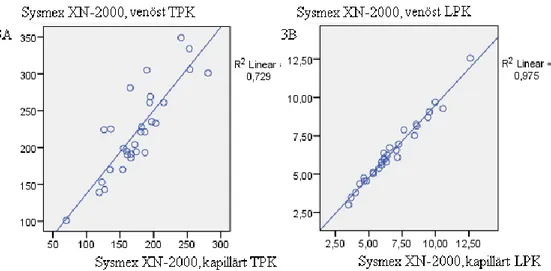
Vid i TPK- och LPK-bestämning mellan de tre olika analysmetoderna, uppnådde glashemocytometern närmre medelvärde till referensmetoden jämfört med plasthemocytometern när Sysmex XN-2000 användes som referensmetod. Vid jämförelse av automatiskt analyserade venösa- och kapillära blodprover fanns det en stor spridning i TPK-bestämning (se figur 3A).
Tabell 1. Beräknade medelvärden samt standardavvikelser på trombocytpartikelkoncentration
(TPK) och leukocytpartikelkoncentration (LPK) i helblod med Sysmex XN-2000, glashemocytometer (GH) samt plasthemocytometer (PH).
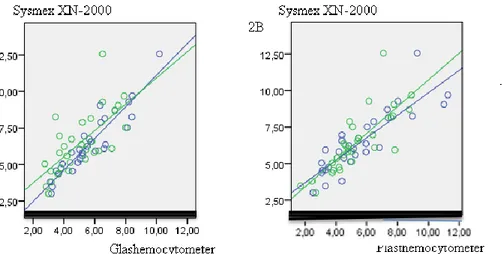
För att undersöka överenstämmelsen mellan de manuella metoderna och referensmetoden Sysmex XN-2000, användes Pearsons korrelation med redovisning av determinationskoefficienten (R2). Manuell bestämning av TPK uppvisade en hög signifikant korrelation med Sysmex XN-2000 med
glashemocytometer, R2= 0,922, p<0,09 för venöst helblod och och
icke-signifikant korrelation, R2 = 0,796, p<0,01 för kapillärt helblod (se figur 1A) och
TPK Medelvärde ± SD (x 109/L) LPK Medelvärde ± SD (x 109/L) Sysmex XN-2000, venöst helblod 222,7 ± 59,4 6,445 ± 2,09 GH, venöst helblod 217,4 ± 55,2 5,679± 1,79 PH, venöst helblod 191,4 ± 50,9 5,148 ± 1,87 XN-2000, kapillärt helblod 175,6 ± 44,9 6,749 ± 2,18 GH, kapillärt helblod 179,5 ± 46,2 5,011 ± 1,60 PH, kapillärt helblod 153,7 ± 42,3 4,940 ± 1,46
för räkning i plasthemocytometrar var R2=0,847, p<0,01 för venöst helblod och R2= 0,811, p<0,01 för kapillärt helblod (se figur 1B).
Figur 1. Korrelationssamband av automatisk och manuell metod vid TPK-bestämning med venöst
helblod (blå cirklar) och kapillärt helblod (gröna cirklar). Jämförelse med glashemocytometer visas i 1A och plasthemocytometer i 1B.
För bestämning av LPK mellan de manuella metoderna och Sysmex XN-2000, för glashemocytometrar var R2= 0,860, p<0,01 för venöst helblod och R2=0,473, p<0,01 för kapillärt helblod (se figur 2A) och för plasthemocytometrar var R2=0,738, p<0,01 för venöst helblod och R2=0,653, p<0,01 för kapillärt helblod (se figur 2B).
Figur 2. Korrelationssamband av automatisk och manuell LPK-bestämning med venöst helblod
(blå cirklar) och kapillärt helblod (gröna cirklar). Jämförelse med glashemocytometer visas i 2A och plasthemocytometer i 2B.
Icke-signifikant korrelation fanns mellan automatiskt analyserade kapillära och venösa blodprover vid TPK-bestämning, R2 =0,729, p<0,01 (se figur 3A) men stark signifikant korrelation fanns vid LPK-bestämning, R2=0,975, p<0,11 (se figur 3B).
Figur 3. Korrelationssamband av kapillära- samt venösa helblodsprover vid TPK- och
LPK-bestämning som analyserades med Sysmex XN-2000.
DISKUSSION
Resultaten i den föreliggande studien visade att plasthemocytometern inte gav lika god korrelation med den datormaskinella referensmetoden som
glashemocytometern vid TPK- och LPK-bestämning. Användningen av plasthemocytometern bedöms utifrån erhållna resultat som olämplig vid analyseringen av rutin hematologisk blodcellsräkning. Det förelåg ett starkt signifikant linjärt samband mellan kapillärt- och venöst helblod vid
LPK-bestämning men icke-signifikant korrelation för TPK-LPK-bestämning vid analysering med Sysmex XN-2000.
Jämförelse mellan plast- och glashemocytometer
Med Sysmex XN-2000 som referensmetod, uppvisade glashemocytometrar högre medelvärde vid vid bestämningen av de hematologiska parametrar jämfört med plasthemocytometrar. Vid TPK-bestämning fanns bättre överenstämmelse mellan plasthemocytometern och referensmetoden, i förhållande till LPK-bestämning som visade mycket lägre korrelationssamband med venösa prover. Vid
observationer kring mätvärden erhållna för TPK-bestämningar i både venösa- och kapillära blodprover, noterades bättre samband vid lägre mätvärden medan höga trombocytvärden orsakade mer utspridning av mätvärden (se figur 1A och 1B). Detta gällde även vid LPK-bestämning med koncentrationer som översteg 8-9 x 109/L (se figur 2A och 2B). Erhållna resultat tolkas och leder till att
plasthemocytometern inte bedöms lämplig för TPK- och LPK bestämningar, särskilt inte vid högt TPK. Utifrån resultaten kan plasthemocytometern vara användbar vid låga trombocytvärden, för exempelvis patienter med
Jämförelse mellan kapillärt- och venöst helblod
Som tidigare nämnts fanns icke-signifikant korrelation mellan kapillärt- och venöst helblod vid TPK- bestämning och bedöms som olämplig vid denna analys. Vid bestämning av LPK emellertid, fanns mycket stark signifikant korrelation mellan kapillära- och venösa blodprover analyserade av XN-2000, dock fanns inga höga LPK-värden hos försökspersonerna som kunde undersökas. Kapillära helblodsprover bedöms som lämpliga för låga LPK-bestämningar i denna studie, men eftersom höga leukocytvärden inte förekom, kan ingen slutsatser om höga LPK-värden dras.
Tidigare studier
Värderingen av plasthemocytometern som okvalificerad för TPK- och LPK
bestämning i denna studie stämmer med ett flertal tidigare studier som visat att det föreligger variationer i jämförelse med glashemocytometern, bland annat en bättre precision av glashemocytometrar vid låga LPK än vid höga [5]. Stone et al [4] bedömde dock plasthemocytometern lämplig för blodcellsräkning av leukocyter och trombocyter, vilket inte visar överenstämmelse med resultatet av denna jämförelsestudie.
Andra studier som har behandlat jämförelsen mellan kapillärt- och venöst helblod, har stött på olika resultat, bland annat en anmärkningsvärt ökning av LPK i
kapillärt helblod samt oförändrade TPK [10] eller en ökning av leukocyter i kapillärt helblod och stabila TPK i sjuka individer men sänkning av TPK i friska individer [8], eller oförändrade parametrar [9]. I alla fall tycks
erytrocytkoncentrationen ligga stabilast medan en variation i LPK- och TPK-bestämning föreligger. Resultatet från denna studie visar överenstämmelse med ett högre LPK i kapillärt helblod men visar en sänkning av TPK [10]. Det är svårt att bedöma denna sänkning eftersom hälsotillståndet hos försökspersonen var okänt. Det har tidigare förklarats att ökningen av LPK i kapillärt helblod uppkommer vid vävnadskada vid stickning, och de neutrofila granulocyterna ansamlas som svar på skadan.
Påverkan av metodik
Sysmex XN-2000 användes i studien på grund av dess kompetenta precision och jämfördes därför med glashemocytometer samt plasthemocytometer. Eftersom Sysmex XN-2000 analyserar ett större antal celler i blodet än hemocytometrar [4], användes därför denna metod som referensmetod i studien. Vid den kapillära provtagningen är det viktig en god metodik, och den påverkas av oerfarenhet hos studieansvarige. De kapillära- samt venösa provtagningarna utfördes på
försökspersoner med bra blodcirkulation och vid misstanke om dålig blodcirkulation, stacks försöksdeltagaren om vid behov. Den kapillära
provtagningen kunde ha påverkat resultaten på grund av oavsiktlig klämning av fingret på försöksdeltagare. Med användning av fas-kontrast mikroskop var det möjligt att studera provet i plasthemocytometern visuellt, men osäkerhet fanns då
leukocyter och trombocyter tenderade att hamna på de uppljusande linjerna i plasthemocytometern, likt studien som involverade
spermie-koncentrationsbestämning [7].
Skiftning med faskontrastet utfördes men förkastades eftersom det bidrog till en längre analyseringtid och uttorkning av preparaten riskerades. Dessutom bidrog det enbart till en liten förbättring då blodcellerna inte med säkerhet kunde urskiljas. Därför utfördes rutin mikroskopisk undersökning. Problemet återfanns inte i glashemocytometern då blodcellerna på linjerna ändå kunde urskiljas. Vid mikroskopisk räkning av blodceller hade plasthemocytometrar ett mycket
behagligare utseende med tydligare rutnät och tydligare leukocyter observerades. Leukocyterna tenderade att hamna på de uppljusnade linjerna, vilket kunde ha påverkat räkningen. Trombocyterna var dock mer distinkta i glashemocytometern, och hade bättre utspridning i rutorna, men många fler artefakter noterades vilket troligtvist härstammade från bristfällig rengöring eller dammpartiklar.
Täckglasmonteringen uppfattades inte som svår, men det tog lång tid innan rätt applicering kunde säkerställas.
Urvalet av försöksdeltagare bestod av patienter och laboratoriepersonal, vilket gör att det förekom variation mellan potentiellt sjuka och friska individer. Detta gjorde att hälsotillståndet var okänt och påverkningar av detta på resultatet kan inte diskuteras. Vidare studier kräver en större population, samt jämförelse mellan friska och sjuka, så att både höga och låga TPK kan granskas.
KONKLUSION
Plasthemocytometern har fördelar som kan förbättra kvaliteten vid en manuell blodcellsräkning, men bedöms i denna studie som olämplig vid rutin manuell analysering. Utifrån resultaten kan plasthemocytometern visa sig vara användbar vid låga TPK, för exempelvis patienter med trombocytopeni, men inte för
patienter med höga TPK. Vidare studier rekommenderas. Eftersom
hemocytometern är avgörande för en manuell blodcellsräkning, är det erforderligt att denna bibehåller hög kvalitet för undersökning av hematologiska parametrar såsom TPK och LPK. Kapillärt taget blodprov kan möjliggöra bland annat ett lättare tillvägagångsätt för inlagda patienter på akutmottagning, mindre blodtappningsvolym samt en kostnadsbesparing för hälso- och sjukvård, och bedöms som lämplig vid LPK-bestämning men oanvändbar vid TPK-bestämning i den föreliggande studien. Vidare studier behövs med fler försökspersoner samt jämförelse mellan kända sjuka och friska individer.
REFERENSER
1. Salignac S, Latger-Cannard V, Schlegel N, Lecompte T P, (2013) Platelet counting. Methods in Molecular Biology, 992, 193-205.
2. Seo J Y, Lee T S, Kim S H, (2015) Performance evaluation of the new hematology analyzer Sysmex XN-series. International Journal of
Laboratory Hematology, 37(2), 155-164.
3. Gunetti M, Castiglia S, Ruustichelli D, Mareschi K, Sanavio F, Muraro M, Signorino E, Castello L, Ferrero I, Fagioli F, (2012) Validation of
analytical methods in GMP: The disposable Fast Read 102 ® device an alternative practical approach for cell counting. Journal of Translational
Medicine, 10, 1-12.
4. Stone L R, Gray D R, Remple K L, Beaudet M P, (2009) Accuracy and precision comparison of the hemocytometer and automated cell counting methods. The FASEB Journal, 23, 827.
5. Müller T H, Döscher A, Döcsher A, Schunter F, Scott C S, (1997)
Manual and automated methods for the determination of leukocyte counts at extreme low levels: Comparative evaluation of the Nageotte chamber and the Abbott Cell Dyn 3500 analyzer. Transfusion Science, 18(4), 505-515.
6. Kirkman-Brown J, Björndahl L, (2009) Evaluation of a disposable plastic Neubauer counting chamber for semen analysis. Fertility and Sterility, 91(2), 627-631.
7. Yamanishi H, Imai N, Suehisa E, Kanakura Y, Iwatani Y, (2007)
Determination of leukocyte counts in cerebrospinal fluid with a disposable plastic hemocytometer. Journal of Clinical Laboratory Analysis, 21(5), 282-285.
8. Schalk E, Heim M U, Koenigsmann M, Jentsch-Ullrich K, (2007) Use of capillary blood count parameters in adults. Vox Sanguinis Journal
Compilation, 93(4), 348-353
9. Ponampalam R, Chong S M C, Tan S C, (2012) Comparison of full blood count parameters using capillary and venous samples in patients
presenting to the emergency department. ISRN Emergency Medicine,
10. Yang Z W, Yang S H, Chen L, Qu J, Zhu J, Tang Z, (2001) Comparison of blood counts in venous fingertip and arterial blood and their measurement variation. Clinical and Laboratory Haematology, 23(3), 155-159.
11. Conway A M, Hinchliffe R F, Earland J, Anderson L M, (1998)
Measurement of haemoglobin using single drops of skin puncture blood: is precision acceptable?. Journal of Clinical Pathology, 51(3), 248-250. 12. Hoffbrand A V, Moss P A H, Pettit J E, (2006) Essential Haematology.
Oxford, UK: Blackwell Publishing.
13. Royer D J, George J N, Terell D R, (2010) Thrombocytopenia as an adverse effect of complementary and alternative medicines, herbal remedies, nutritional supplements, foods, and beverages. European
Journal of Haematology, 84(5), 421-429.
14. Bhatia M, Davenport V, Cairo M S, (2007) The role of interleukin-11 to prevent chemotherapy-induced thrombocytopenia in patients with solid tumors, lymphoma, acute myeloid leukemia and bone marrow failure syndromes. Leukemia & Lymphoma, 48(1), 9-15.
15. Leitner GC, Stiegler G, Horvath M, Hoecker P, Sagaster P, Panzer S, (2003) Idiopathic autoimmune thrombocytopenia: evidence for redistribution of platelet antibodies into the circulation after
immunoadsorption treatment. American Journal of Hematology, 73(1), 44-47.
16. Yavasoglu I, Acar B, Kadikoylu G, Bolaman Z, (2010) Platelet
aggregation tests are affected in pseudothrombocytopenia. LabMedicine, 41(8), 483-485.
17. Sakurai S, Shiojima I, Tanigawa T, Nakahara K, (2003) Aminoglycosides prevent and dissociate the aggregation of platelets in patients with EDTA-dependent pseudothrombocytopenia. British Journal of Haematology, 99(4), 817-823.
18. Lin J, Lou Y, Yao S, Yan M, Li J, Ouyang W, Kuang M, (2014) Discovery and correction of spurious low platelet count due to EDTA-dependent pseudothrombocytopenia. Journal of Clinical Laboratory
Analysis, 2014, 1-8.
19. Casonato A, Bertomoro A, Pontara E, Dannhauser D, Lazzaro A R, Girolami A, (1994) EDTA dependent pseudothrombocytopenia caused by
antibodies against the cytoadhesive receptor of platelet gpIIB-IIIA.
Journal of Clinical Pathology, 47(7), 625-630.
20. Rodak B F, Fritsma G A, Keohane E, (2012) Rodak’s
Hematology: Clinical Principles and Applications. Missouri, USA:
Elsevier Health Sciences.
21. Chabot-Richards D S, George T I, (2014) Leukocytosis. International
Journal of Laboratory Hematology, 36(3), 279-288.
22. Alwan A G, Ismail Y Y, Gata A M, (2013) Comparison of the result of some hematological parameters in venous and capillary blood samples.