Vad har dopaminagonister för effekter vid behandling av Restless legs syndrome?
Elma Muhic
Farmaci 180 högskolepoäng
Högskolan i Kalmar, Naturvetenskapliga institutionen Examensarbete 15 högskolepoäng
Handledare: Naturvetenskapliga institutionen Anna Asplund Högskolan i Kalmar
Universitetslektor SE-391 82 Kalmar
Examinator: Naturvetenskapliga institutionen Dick Delbro Högskolan i Kalmar
Leg. läkare, docent SE-391 82 Kalmar
Abstract
Restless legs syndrome (RLS) är ett kroniskt neurologiskt tillstånd som karakteriseras av en intensiv oro och obehagliga krypningar djupt inne i benen som förekommer i vila. Besvären upplevs som svårast på kvällen och natten och lindras av att man rör på sig. Hos majoriteten av de som lider av RLS förekommer även ofrivilliga periodiska benrörelser i sömn (PLMS) vilket medför täta mikrouppvaknanden. Detta försvårar övergång i djupare sömn vilket kan i sin tur leda till allvarliga sömnstörningar. Man kan dela in RLS i en primär form och en sekundär form beroende på om syndromet kan klarläggas till någon bakomliggande orsak. Eftersom syndromets patofysiologi fortfarande är oklar finns inte någon botande behandling men det finns bra möjligheter att lindra symtomen.
Dopaminagonister har visat ha god effekt på både RLS-symtomen och PLMS vid behandling av primär RLS. Effekterna brukar man känna av redan vid låga doser. Vid behandling med dopaminagonister kan biverkningar förekomma så som illamående, huvudvärk, sömnighet etc. Dopaminagonister kan användas som monoterapi vid behandling av RLS-symtom eller i kombination med andra läkemedel.
Syftet med denna litteraturstudie var att undersöka vad de två ”icke-ergolina” dopaminagonisterna pramipexol och ropinirol har för olika effekter vid behandling av RLS. Metoden som använts i detta arbete har varit en litteraturstudie. Fem artiklar valdes ut från databasen PubMed samt att befintlig litteratur söktes på Kalmars Högskolebibliotek och Örebros sjukhusbibliotek. Samtliga studier visade signifikant förbättring på RLS-symtomen med pramipexol- och ropinirolbehandling jämfört med placebo. Däremot krävs fler randomiserade kontrollerade studier av hög kvalitet som bland annat undersöker den långsiktiga behandlingseffekten av dessa preparat och att man koncentrerar sig på de kvarstående problemen kring negativa effekter som kan uppstå vid behandling.
SUMMARY
Restless legs syndrome (RLS) is a chronic neurological condition that is characterized by the irresistible urge to move the legs. It is a common movement disorder, but remains relatively under-recognized and under-treated. Individuals affected with RLS describe the sensations as burning, creeping, crawling inside the legs etc. The motor-restlessness worsens during the evening and night and most RLS patients present periodic limb movements during sleep (PLMS), causing difficulty initiating and maintaining sleep. The syndrome can occur in two forms: as an idiopathic primary form (often familiary) and as a form that is secondary to other medical conditions and neurological disturbances (such as pregnancy, uraemia, iron deficiency, diabetes etc.). The exact pathophysiology of RLS remains unclear, but the involvement of central dopaminergic systems has been drawn from the fact that the RLS symptoms are relieved by dopaminergic treatment. Dopamine agonists have also been demonstrated to be efficacious in clinical trials of RLS. Common side effects of dopamine agonists that can occur are nausea, vomiting, dizziness, sleepiness etc. Dopamine agonists can be used as monotherapy or in combination with other medicines when treating RLS symptoms.
The purpose of this literature study was to examine a few chosen studies that investigate different effects of the two non-ergot dopamine agonists pramipexole and ropinirole on RLS. The methods that I have used are literature search in the database PubMed and at the Kalmar University library and at the Örebro University Hospital library. The first article evaluated a sustained efficacy of pramipexole against RLS during 3 months of placebo-controlled, dubbel-blind treatment of patients who had responded to a 6-month open-label trial. The second article evaluated the efficacy of pramipexole versus placebo in RLS for sex weeks. The objective of the third article was to investigate the long-term efficacy of ropinirole in patients with RLS and to assess the potential for relapse after discontinuation of active treatment. The fourth article tested the clinical efficacy of ropinirol in the treatment of RLS in a double-blind, short-term, placebo-controlled clinical trial. The aim of the fifth article was to evaluate the initial response to a standard low dose of pramipexole in a cohort of patients affected by idiopathic RLS by means of a controlled clinical polysomnografic study. All studies showed significant improvements on the severity of RLS symptoms versus placebo. However, more randomized clinical trials of high quality are needed that, among other things, investigate the long-term treatment effect of theses drugs in large patient populations.
INNEHÅLLSFÖRTECKNING
FÖRKORTNINGAR______________________________________________________ 4 INTRODUKTION________________________________________________________ 5
Dopaminagonister ____________________________________________________________ 5 Restless legs – Rastlösa ben ____________________________________________________ 5 RLS-symtomatologi___________________________________________________________ 6 Två olika former av RLS ______________________________________________________ 7 Diagnostisering av RLS _______________________________________________________ 8 Olika skattningsskalor_____________________________________________________________ 9 Behandling av RLS __________________________________________________________ 10 Dopaminerga läkemedel __________________________________________________________ 11 Övriga läkemedel________________________________________________________________ 12 Dopamin och RLS ___________________________________________________________ 13 SYFTE________________________________________________________________ 15 MATERIAL OCH METODER ____________________________________________ 15 RESULTAT____________________________________________________________ 16
A. Controlled Withdrawal of Pramipexole After 6 Months of Open-Label Treatment in Patients With Restless Legs Syndrome________________________________________ 17 B. Efficacy of Pramipexole in Restless Legs Syndrome: A Six-Week, Multicenter,
Randomized, Double-Blind Study (Effect-RLS Study) _____________________________ 20 C. Ropinirole Is Effective in the Long-Term Management of Restless Legs Syndrome: A Randomized Controlled Trial _______________________________________________ 23 D. Randomized, double-blind, placebo-controlled, short-term trial of ropinirole in restless legs syndrome________________________________________________________ 27 E. First night efficacy of pramipexole in restless legs syndrome and periodic leg
movements _________________________________________________________________ 29
DISKUSSION __________________________________________________________ 32
Slutsats ____________________________________________________________________ 37
TACKORD ____________________________________________________________ 39 REFERENSER_________________________________________________________ 40
FÖRKORTNINGAR
ANOVA CGI CGI-I ESS IRLSSG IRLS LM MOS PGI PLMS PLMSI PLMSAI PSG RLS RLS-QoL VAS SF-36 Analysis of variance
Clinical Global Impression (skala)
Clinical Global Impression-Improvement (subskala)
Epworth Sleepiness Scale (frågeformulär för självskattning av sömnighet på dagen) International Restless Legs Syndrome Study Group
International Restless Legs Scale (10-gradig bedömningsskala) Limb/Leg movement
Medical Outcomes Study (sömnskala) Patient Global Impression (skala)
Periodic Limb Movements during Sleep (periodiska benrörelser under sömn) PLMS Index (antalet benrörelser under sömn)
PLMS Arousal Index (antalet benrörelser med uppvaknande under sömn) Polysomnografi (neurofysiologisk sömnregistrering)
Restless Legs Syndrome
Restless Legs Syndrome Quality of Life (frågeformulär) Visual analogue scale
INTRODUKTION
Dopaminagonister
Dopamin har en viktig roll vid signalöverföringen mellan nervcellerna. En störning av denna funktion i hjärnans nedre delar (de basala ganglierna) verkar leda till utveckling av Restless Legs Syndrome (RLS) [1,2]. RLS-symtomen kan bero på antingen dopaminbrist i de basala ganglierna eller att dopaminet transporteras för långsamt mellan de olika dopaminerga nerverna [2]. Dopaminagonister har en stimulerande effekt på den dopaminupptagande nervcellen i synapsen (en speciell koppling mellan cellerna) i det centrala nervsystemet [3]. Till skillnad från levodopa omvandlas inte dopaminagonister till dopamin utan härmar bland annat dopaminets effekt på vissa mottagarceller exempelvis D2 och D3 receptorer [1,4].
Dopaminagonister delas in i två olika farmakologiska grupper: ”ergolinderivat” och ”icke-ergolinderivat” [6]. Eftersom icke-ergolinderivat ger färre biverkningar och upplevs mer toleranta av de flesta patienter betraktas denna grupp idag som förstahandsval i de flesta svårare fall av RLS [2,6]. Dopaminagonister används även som en alternativ medicinering till levodopa (en substans som omvandlas till dopamin i hjärnan) särskilt i de fall då levodopa inte ger önskad effekt [2]. Ropinirol och pramipexol är de två icke-ergolina dopaminagonister som ofta används vid behandling av RLS [6]. Även om dopaminagonisterna tillhör samma läkemedelsgrupp har var och en av dem sin egen profil. Det kan vara värt att byta till en annan agonist ifall ingen fördelaktig effekt uppnås genom en av dem [4].
Restless legs – Rastlösa ben
Restless legs syndrome är ett kroniskt neurologiskt tillstånd som troligen beror på en störning i något transmittorsystem i centrala nervsystemet vid omkopplingen mellan vila och aktivitet. Till skillnad från Parkinsons sjukdom eller Alzheimers demens förstör inte RLS hjärnvävnad. Då man har studerat hjärnceller under mikroskop från avlidna personer med RLS har man inte hittat några sjukliga förändringar [2]. Däremot har man lyckats visa, med hjälp av magnet-röntgen tekniken (MRT), en lägre halt av lagrat järn i de hjärnkärnor där RLS-symtomen uppkommer jämfört med dem som inte
har RLS [2]. Brist på järn kan därmed betraktas som en av de bakomliggande orsakerna till RLS eftersom järnet har en viktig roll vid dopaminsyntesen och påverkar den mängd dopamin som finns tillgänglig i synapsen [1,4].
RLS-symtomatologi
Rastlösa ben karakteriseras av obehagliga förnimmelser vanligen djupt inne i benen som gör det nästan omöjligt att sitta eller ligga still [7]. Vanligtvis sitter besvären djupt inne någonstans mellan knäna och fotlederna men kan ibland även förekomma i fötter, lår och armar [8]. Symtomen uppstår och förvärras i vila (framför allt vid sänggåendet) och lindras av att man rör på sig vilket kan leda till ett rastlöst beteende och sömnsvårigheter [1,9].
I västvärlden lider ungefär 10 procent av RLS och prevalensen ökar med åldern [10]. Över 70 års ålder är det cirka 30 procent som har sjukdomen och risken att drabbas är nästan dubbelt så stor för en kvinna som för en man [2].
Exempel på de sensationer som uppstår i samband med RLS som ofta beskrivs av patienter är [4]:
Vissa har symtom som bara uppträder några gånger om året medan andra har svåra problem hela dygnet varje dag [1]. RLS kan alltså yttra sig på olika sätt och det finns stora individuella variationer i hur personer upplever sin RLS. Under vissa perioder kan RLS-patienter uppleva att symtomen försvinner eller är mindre påtagliga [7]. Syndromet betraktas dessvärre som ett kroniskt tillstånd och kan debutera i alla åldrar [2].
PLMS (periodic limb movement in sleep) förekommer hos över 80 procent av individer med RLS. Det innebär att dessa individer får omedvetna muskelryckningar
Maskar under huden Krypningar
Klåda under huden ”Rinnande vatten” Nervösa ben Hugg ”Sockerdrickskänsla” Svidande Bränningar Domnande Elektriska chocker
och benrörelser under sömn i ökad mängd än normalt. Detta medför ofrivilliga korta mikrouppvaknanden som försvårar övergång i djupare sömn vilket kan i sin tur leda till allvarliga sömnstörningar [2,6]. Som följd av kronisk sömnbrist förekommer även flera andra psykiska symtom som till exempel koncentrations- och minnessvårigheter, depression, irritabilitet etc. PLMS kan också vara ett separat tillstånd under sömn utan koppling till RLS [1]. Vad som sker i vår kropp och i hjärnan medan vi sover kan visas med hjälp av polysomnografi som är en undersökning som kan mäta 18 olika funktioner under sömn [2].
Två olika former av RLS
Man brukar dela in RLS i en primär och en sekundär form beroende på om syndromet kan klarläggas till någon bakomliggande orsak. Den primära avser en tidigdebuterande form (före 45 års ålder) och här tycks det finnas ett ärftligt samband men än så länge vet man inte den exakta orsaken. Den sekundära är vanligen sendebuterande (efter 45 års ålder) och kan relateras till någon annan sjuklig process eller något tillstånd som är övergående [4]. Det kan vara fråga om t.ex. njursvikt, diabetes, järn- och vitaminbrist, graviditet, ledgångsreumatism mm [11]. Även intag av vissa läkemedel kan utlösa eller förvärra RLS-symtomen som t.ex. vissa antidepressiva medel, antiemetika (medel mot illamående), antihistaminer, H2-blockare, neuroleptika (lugnande medel), fenytoin (mot epilepsi) och litium [2]. Njutningsmedel så som alkohol, nikotin och koffein kan i vissa fall förvärra symtomen. Det är emellertid inte alltid lätt att skilja mellan dessa två former av RLS [4].
Diagnostisering av RLS
Diagnosen ”Restless legs syndrom” kan fastställas efter en noggrann utfrågning om patientens upplevelse av besvären. Denna bygger bland annat på att fyra grundläggande kliniska kriterier måste vara uppfyllda för att få diagnosen RLS ställd. Dessa kriterier är definierade av den kända forskargruppen International Restless Legs Syndrome Study Group (IRLSSG) [2].
Tabell I. The International Restless Legs Syndrome Study Groups (IRLSSG) fyra kriterier för diagnos
av restless legs syndrome [2].
1. Konstig och obehaglig känsla i ett eller båda benen och/eller armar som ger ett starkt behov av att röra på sig.
2. Oförmåga att hålla den påverkade kroppsdelen stilla när besvären uppstår.
3. Obehagskänslan uppkommer eller blir värre i vila och lindras eller upphör av aktivitet.
4. Symtomen blir som värst på kvällen och under natten.
För att säkerställa diagnosen finns ytterligare stödjande kriterier som man kan gå vidare med:
• Periodiska benrörelser (PLM) under vaket tillstånd eller sömn. • Sömnstörningar.
• Familjär historik om RLS.
• Positivt testsvar med levodopa eller dopaminagonister. Mer än 90 % får en initial lindring av sådana läkemedel [8].
Eftersom patienter med RLS har svårare än andra att ta upp och lagra järn i nervsystemet kan det vara bra att även ta blodprover för diagnosställandet. Där tittar man framför allt på koncentrationen ferritin som är en av de huvudsakliga lagringsformerna för järn i kroppen [2]. Flera studier har visat en koppling mellan låga ferritinkoncentrationer och RLS-symtomen [12].
I samband med provtagningen bör man även titta på vitamin B12, folsyra och njurfunktionen för att kunna utesluta andra bakomliggande orsaker. Neurologisk undersökning bör också göras för att undersöka reflexer, känselsinne och andra funktioner i nervsystemet. Hos de patienter som lider av den primära formen finner
man oftast inga anmärkningar, alltså kan man utesluta andra bakomliggande sjukdomar. Man finner heller inte några tecken på störning vid mer avancerade neurofysiologiska undersökningar [2].
Det finns många sjukdomstillstånd som ger liknande besvär som RLS (framför allt vid sekundär) men som måste uteslutas vid diagnostiken eftersom de har en annan orsak och därför måste behandlas på ett helt annat sätt [8].
Exempel på vissa sådana sjukdomstillstånd är: • Myokymier (ryckningar i benmusklerna).
• Akatisi (inre känsla av rastlöshet som oftast uppstår vid behandling med neuroleptika).
• ”Fönstertittarsjukan” (beror på dåligt blodflöde till benen). • Fibromyalgi (mjukdelsreumatism).
• Nattliga vadkramper (smärtsamma muskelsammandragningar i benet). • Oro och sömnstörningar vid depression.
• ”Växtvärk” och ADHD (Attention deficit hyperactivity disorder) hos barn [8].
Olika skattningsskalor
International RLS Study Group svårighetsskala
Eftersom upplevelsen och svårighetsgraden av RLS kan variera mellan olika individer har man försökt utveckla olika typer av skattningsskalor. IRLSSG har fastställt en subjektiv skala för bedömning av syndromets svårighetsgrad/besvär som visat sig ge ett relativt tillförligt mått i kliniska prövningar [13,14]. Numera används skalan över hela världen av patienter med RLS och i studier för att utvärdera olika behandlingar av RLS. Den består av 10 frågor där man väljer en siffra mellan 0 och 4 (ju högre siffra desto svårare symtom) [2]. Har man 1-10 poäng totalt så indikerar det minimal till mild form av RLS. Om man har 11–20 poäng så är ens besvär måttliga. Poäng mellan 21-30 antyder att man lider av svåra besvär och 31-40 poäng mycket svåra RLS besvär [15]. Man kan göra bedömningen igen t.ex. efter en behandling för att se hur tillståndet har förändrats. I regel krävs en skillnad på 10 poäng för att det ska betraktas som relevant [2].
Clinical Global Impressions scale och Patient Global Impressions questionnaire
CGI skalan är ett instrument som används mycket av kliniska prövare för att mäta hur störningar/rubbningar (t.ex. RLS eller Parkinsons) påverkar en människa eller vad en behandling har för effekt på olika sjukdomar (inklusive schizofreni och depression). CGI skalan har fyra subskalor där den vanligaste subskalan är CGI-I (Clinical Global Impressions-Improvement) vid bedömning av RLS. Med hjälp av subskalan intervjuar läkaren patienten och uppskattar sedan förändringen i symtomens svårighetsgrad. Alternativt kan patienterna själva bedöma sitt tillstånd genom att fylla i PGI (skala) där de svarar på en frågeenkät. Studier har visat att både CGI-I och PGI skalorna är ganska lika varandra [16].
Visuell analog skala (VAS)
VAS är ett mätinstrument som försöker mäta ett kännetecken eller attityd som tros sträcka längs en gradvis förändring med värden som sker utan avbrott. Till exempel mängden smärta som en patient känner längs en oavbruten följd från ingen till extrem smärta. Från patientens perspektiv framträder detta spektrum kontinuerligt, deras tillstånd gör inte diskreta hopp som en kategorisering av ”ingen, mild eller måttlig”. VAS är vanligen en 100 millimeters horisontell linje med ordförklaringar i varje ände där patienten ska markera den punkt på linjen som de känner representerar deras perception av det aktuella tillståndet. VAS-poängen uppskattas genom att mäta i millimeter från den vänstra sidan till den punkt som patienten markerade [30].
Behandling av RLS
Eftersom syndromets patofysiologi fortfarande är oklar finns inte någon botande behandling men det finns bra möjligheter att lindra symtomen [17]. Man kan dela behandlingen i två olika strategier, den farmakologiska och icke-farmakologiska [1]. Den icke-farmakologiska behandlingen rekommenderas som förstahandsval, där man bland annat råder patienten att ta promenader före sänggåendet, massage, upprätthålla en god sömnhygien, kosttillskott, undvika alkohol, rökning och koffein mm. Vid sekundär RLS bör den bakomliggande orsaken utredas och behandlas. Vid järnbrist (med eller utan anemi) skall patienten i första hand behandlas med perorala
järnpreparat i kombination med vitamin C. Intravenös järntillförsel kan förekomma i få fall då järnhalterna inte kan normaliseras med tabletter. Patienter, vars RLS beror på njursvikt, kan behandlas med dialys (rening av blodet) eller med några av de läkemedel som nämns nedan [6]. Dessvärre lindrar inte dialysbehandling symtomen och kan upplevas som väldigt plågsam hos patienter med svår RLS. Det har i flera fall visat sig att njurtransplantation har hejdat symtomen [10].
Den farmakologiska behandlingen kan vara nödvändig vid svårare fall av RLS [6]. De läkemedel som används idag kan indelas i olika grupper: dopaminerga läkemedel, opioider, antiepileptika och bensodiazepiner [11].
Dopaminerga läkemedel
Till den här gruppen hör levodopa och dopaminagonister. Redan på 1980-talet ansågs levodopa ha god effekt vid behandling av RLS [6]. Studier har visat att levodopa har tolererats väl och gett signifikant minskning i frekvensen av PLMS och förbättring i nattliga symtom och sömnkvalitén hos patienter med både primär och sekundär RLS [11]. Levodopa omvandlas huvudsakligen till dopamin utanför CNS så att bara en liten del av levodopa når in i den delen av hjärnan där den ska utöva sin effekt [5]. För att förhindra omvandlingen av levodopa till dopamin innan det kommit in i hjärnan har man tillsatt en dopadekarboxylashämmare som inte passerar blod-hjärnbarriären, och därmed ökar dopaminhalten i de basala ganglierna [2,5]. I levodopaläkemedlet Madopark heter hämmaren benserazid och i Sinemet heter den karbidopa [2]. I situationer då patienter vaknar upp på nätterna med svåra benbesvär kan man förslagsvis inta Madopark Quick som löses upp i vatten och som ger en snabbverkande effekt inom cirka 30 minuter [2,6].
Vid långvarig levodopabehandling och/eller överdosering av levodopa kan symtomförstärkning (augmentation) uppstå [2]. Risken att drabbas av detta fenomen ökar om dosen överskrider 200 mg/dag [6].
Ett förslag på att undvika symtomförstärkning kan vara att använda levodopa som tillfällig och inte regelbunden medicinering samt att eventuellt minska dosen [2]. Exempel på andra biverkningar som levodopa och dopaminagonister kan ge upphov till är illamående, kräkningar, insomnia, dagssömnighet, sömnlöshet, depressiva besvär mfl. I de fall då levodopa inte ger önskad effekt eller då patienter utvecklar symtomförstärkning bör man byta till en annan dopaminagonist [11].
Dopaminagonisterna kan användas som den enda terapin eller i kombination med levodopa [4]. De två icke-ergolina dopaminagonisterna pramipexol och ropinirol bör inledas som behandlig hos patienter som lider av svår eller mycket svår RLS (över 20 poäng enligt IRLSSG svårighetsskala). För ropinirol rekommenderar man en startdos på 0,25 mg/dygn och för pramipexol 0,18 mg/dygn och oftast räcker det med engångsintag på kvällen/natten [2]. Effekten brukar man känna efter 2 timmar och den håller i sig under 6-12 timmar. Vid dubbelblindade kontrollerade studier har både ropinirol och pramipexol visat sig ha god effekt vid behandling av RLS-symtom [2]. Patienter som lider av mycket svår RLS måste kanske inta en dopaminagonist flera gånger per dag [2]. Ropinirol visar aktivitet på både D2 och D3 receptorn medan pramipexol har god selektivitet på D3 receptorer [19,22]. Ropinirol har något kortare halveringstid än pramipexol [22].
De ergolina dopaminagonisterna är äldre läkemedel än de icke-ergolina och har en halveringstid på mer än 60 timmar vilket kan göra det svårt vid en individuell dosanpassning. De icke-ergolina ger möjlighet till en viss individuell anpassning. En nackdel med de ergolina agonisterna är att mag-tarmbesvär kan uppstå vid behandlingens början vilket gör att man samtidigt kanske måste ordinera läkemedlet domperidon för att motverka denna biverkan. Även pramipexol och ropinirol kan ge samma biverkan men det är ovanligt [1].
Övriga läkemedel
Opioider kan vara ett bra behandlingsalternativ vid svårare RLS-symtom med inslag av smärta eller om patienten inte kan använda ett dopaminergt läkemedel. Det är dock sällan att de används som monoterapi utan ges oftast som ett komplement till något dopaminergt medel. Exempel på de opioider som kan användas är kodein och tramadol, där kodein är en mildare variant. Opioider kan framkalla beroende och därför bör en noggrann riskbedömning göras för varje patient innan man ordinerar en opioid [1,6].
Förutom opioider kan vissa antiepileptika, främst Gabapentin (Neurontin), användas vid behandling av RLS-symtom. Gabapentin har visat sig ha en mycket god effekt på RLS-symtom och leder till förbättrad nattsömn [2]. Den har även visats vara effektiv vid behandling av sekundär RLS orsakad av neuropati [2].
Bensodiazepiner rekommenderas inte längre vid behandling av RLS-symtom [6]. Däremot kan tillförsel av exempelvis klonazepam (Iktorivil) bidra till en bättre sömn [2,11]. Iktorivil har däremot lång verkningstid och kan orsaka dagsömnighet [2]. I likhet med opioiderna kan bensodiazepiner framkalla beroende vid långtidsanvändning [2].
Dopamin och RLS
Dopaminets betydelse vid RLS demonstrerades av den svenske nobelpristagaren Arvid Karlsson i slutet av 1950-talet. Då han studerade signalsubstanser i hjärnan upptäckte han att dopamin är en substans i hjärnan och att den har en viktig betydelse för kontroll av våra rörelser. Han visade att dopamin produceras i de basala ganglierna och utvecklade även metoder för att mäta dopamin [2].
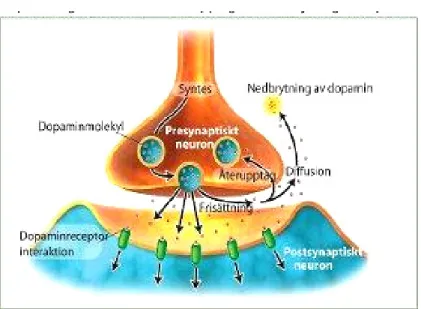
Figur 1 nedan visar hur tyrosin med hjälp av enzymet tyrosinhydroxylas omvandlas till levodopa i neuronet. Därefter hjälper enzymet dopadekarboxylas levodopa att omvandlas till dopamin som sedan lagras i vesiklar i nervterminalen och med hjälp av elektriska impulser frisätts ut i synapsen. Dopaminet är sedan kortvarigt bundet till dopaminreceptorerna på de postsynaptiska (mottagande) neuronen efter frisättningen [18].
Figur 2 nedan visar hur dopamin efter bindning bryts ner med hjälp av enzymerna monoaminooxidas (MAO) och katekol-O-metyltransferas (COMT). Dopamin kan med hjälp av så kallade dopamintransportörer återupptas till det presynaptiska neuronet, den sändande nervänden [18].
Figur 2. Återupptag och nedbrytning av dopamin mellan neuroner[18]
Vid dopaminsyntesen har järn en viktig funktion genom att den fungerar som en co-faktor i enzymet tyrosinhydroxylas. Detta enzym har en påskyndande roll vid dopaminproduktionen och bildas genom ombildning av speciella proteiner som finns i neuronet [2]. Järn är också viktigt för att dopaminreceptorer på det postsynaptiska neuronet ska fungera så bra som möjligt visar nyare forskning [2]. Eftersom järn påverkar mängden dopamin som finns tillgänglig i synapsen kan järnbrist leda till en minskad tillgång till dopamin. Detta kan i sin tur orsaka störningar vid signalöverföringen mellan hjärnceller [1]. Vidare har personer med detta syndrom svårare än andra att ta upp och lagra järn i den delen av hjärnan där dopaminsyntesen äger rum. De har även svårare att transportera järn från blodet in i nervsystemet. Att RLS-symtomen är som värst på kvällen och natten kan möjligen bero på att det kommer 30-50 procent mindre mängd järn i hjärnan på natten [2].
Man vet inte vad som exakt händer vid RLS men en allmän uppfattning är att en störning i det dopaminerga systemet inom de nedre hjärnkärnorna kan leda till en
utveckling av RLS-symtom. Något som stödjer detta är att användning av dopaminerga läkemedel vid behandling av dessa symtom har gett goda resultat [2].
SYFTE
Syftet med denna litteraturstudie har varit att undersöka vilka effekter dopaminagonisterna pramipexol och ropinirol har vid behandling av RLS.
MATERIAL OCH METODER
Metoden som använts i detta arbete har varit en litteraturstudie. De fem artiklar som valdes hämtades från databasen PubMed. Sökorden som användes var ”restless legs AND dopamine agonist” och de gav 257 träffar i PubMed 2008-02-20. Andra sökningen med begränsande sökord (”Randomized controlled trial”) resulterade i 34 träffar. Av dessa artiklar valdes fem artiklar eftersom inklusionskriterierna var att dopaminagonisterna skulle vara icke-ergolina. De skulle även undersöka dopaminagonisternas effekter vid RLS. Exklusionskriterier som ställdes upp var att artiklarna fick inte vara äldre än fem år.
Resultatdelen gjordes med fokusering på syfte, studiens studiedesign (patienter och metoder) och resultat.
RESULTAT
Översikt av de fem utvalda artiklarna som redovisas senare.
Studie Syfte Design Resultat
A. Controlled Withdrawal
of Pramipexol After 6 Months of Open-Label Treatment in Patients with Restless Legs Syndrome
(Trenkwalder C. et al., 2006)
Undersöka hur länge pramipexols effekt kvarstod under tre månader hos de patienter som hade svarat på pramipexol under den föregående öppna studien.
Öppen studie i sex månader med 224 deltagare. Randomiserad, dubbelblind, placebo-kontrollerad studie i tre månader med 150 deltagare.
Deltagarna var mellan 18-80 år med idiopatisk RLS samt över 15 IRLS-poäng.
Bedömningarna från IRLSSG skattningsskala och CGI-I visade pramipexols kvarstående effekt vid doserna 0.125 till 0.75 mg per dag vid behandling av RLS-symtom. Motsvarande förbättringar sågs i sömn och QoL. B. Efficacy of Pramipexole in Restless Legs Syndrome: A Six-Week, Multicenter, Randomized, Double-Blind Study (Effect-RLS Study) (Oertel W. H. et al., 2006) Utvärdera pramipexols effektivitet jämfört med placebo under sex veckor.
Randomiserad, dubbelblind, placebo-kontrollerad studie. 345 deltagare mellan 18-80 år med primär RLS och de hade över 15 IRLS-poäng.
Bedömningarna från IRLSSG skattningsskala, CGI-I demonstrerade signifikant förbättring i svårighetsgraden hos RLS-patienter som fick
pramipexol jämfört med placebo vid doserna 0.125 till 0.75 mg per dag. Liknande förbättringar sågs från PGI-bedömningen och VAS-bedömningen.
C. Ropinirole Is Effective in the Long-Term Management of Restless Legs Syndrome: A Randomized Controlled Trial (Montplaisir J. et al., 2006) Undersöka ropinirols långsiktiga effektivitet hos patienter med RLS och att bedöma potentiellt återfall efter den aktiva behandlingens avbrott.
Singelblind studie i 24 veckor med 202 deltagare. Randomiserad,
dubbelblind studie i 12 veckor med 92 deltagare. Deltagarna var mellan 18-80 år med primär RLS och de hade över 15 IRLS-poäng.
Signifikant färre patienter fick återfall på ropinirol än på placebo. Tiden för återfall var längre med ropinirol och fler patienter hoppade av pga. placeboeffekt. Patienterna visade förbättringar i IRLS- och CGI-I poängen, sömn och QoL parametrar med singelblind ropinirol. Dessa förbättringar bevarades bättre hos de som fortsatte ta ropinirol under den dubbelblinda fasen.
D. Randomized, double-blind,
Placebo-controlled, short-term trial of ropinirol in restless legs syndrome (Bliwise D.L. et al., 2005) Testa ropinirols kliniska effektivitet vid behandling av RLS.
Öppen studie i fyra veckor med 30 deltagare. Randomiserad, dubbelblind, placebo-kontrollerad studie i två veckor med 26 deltagare. Deltagarna hade primär RLS.
Ropinirol minskade signifikant PLMS som registrerades med nattlig polysomnografi och RLS-symtomen som bedömdes med IRLSSG skattningsskala.
E. First night efficacy of Pramipexole in restless legs syndrome and periodic leg movements
(Manconi M et al., 2007)
Undersöka de direkta effekterna av en låg dos pramipexol hos RLS-patienter som inte tidigare behandlats för sina symtom. Singelblind, randomiserad, placebo-kontrollerad studie (prospektiv kohort) med 32 deltagare (18 pramipexol och 14 placebo). Deltagarna hade idiopatisk RLS.
RLS-symtomen förbättrades direkt och snabbt med engångsdos pramipexol (0.25 mg) den första
administreringskvällen jämfört med placebo. Även en stor minskning i PLMSI och signifikant minskning i NREM i sömn observerades i
A. Controlled Withdrawal of Pramipexole After 6 Months of Open-Label Treatment in Patients With Restless Legs Syndrome
[19]
Trenkwalder C., et al., Movement Disorder Society 2006, 21, 1404-1410
Syftet med denna studie var att utvärdera om pramipexols effekt kvarstod under en tre månaders dubbelblind behandlingsfas (Period 2) hos patienter som hade svarat på pramipexol i en tidigare öppen studie som pågick sex månader (Period 1).
Patienter och metoder
Denna tyska studie indelades i två perioder, där Period 1 var en öppen-studie och pågick i 6 månader, medan Period 2 var en placebokontrollerad dubbelblind behandling som pågick under 3 månader.
Av 299 patienter som screenades var det 75 stycken som uteslöts från studien eftersom de uppfyllde exklusionskriterierna (har använt levodopa den föregående veckan eller andra preparat som påverkar RLS de föregående två veckorna, har medicinska tillstånd som kunde påverka bedömningen av RLS, har någon specifik sömnstörning, har misslyckats med tidigare pramipexolbehandling, var gravid eller hade risk för att bli gravid). Strax innan Period 1 uteslöts ytterligare 41 patienter på grund av administrativa skäl, avvikande händelser och annat. Det var 183 patienter som inledde studiens första fas (Period 1). Dessa patienter var män och kvinnor mellan 18 och 80 år som rekryterades från 13 centra i Tyskland. Alla uppfyllde de diagnostiska kriterierna för idiopatisk RLS och de hade symtom minst 2-3 dagar per vecka de föregående tre månaderna. Vid baslinjen (start Period 1) hade patienterna IRLS-poäng > 15.
Dessa patienter fick en individuell optimerad dos pramipexol (0.125, 0.25, 0.50 eller 0.75 mg en gång dagligen). De skulle ta läkemedlet 2-3 timmar strax innan sänggåendet. Behandlingsperioden pågick i sex månader. Vid slutet av denna period skulle de patienter som hade tillståndet ”mycket förbättrad” eller ”väldigt mycket förbättrad” enligt subskalan CGI-I samt en totalpoäng ≤ 15 på IRLSSG skalan, indelas slumpmässigt i två grupper. För att delta i Period 2 krävdes även att de svarat på pramipexol med följsamhet ≥ 80% samt att inga dosjusteringar förekom under de sista 12 veckorna under period 1. Det var 33 patienter som inte fullföljde Period 1 (26 patienter uppfyllde inte inklusionskriterierna för Period 2, två stycken ville inte fortsätta, två stycken hoppade pga. avvikande händelser och två av okänd orsak). Det
var 150 patienter som fullföljde Period 1 och hade alla fått ett var sitt behandlingsnummer i stigande numerisk ordning strax innan randomiseringen.
I placebogruppen var det 72 personer som fick placebo och i pramipexolgruppen var det 78 som fortsatte med den optimerade pramipexoldosen sedan tidigare. Det var 47 patienter i placebogruppen och 7 stycken i pramipexolgruppen som inte fullföljde Period 2.
Primär endpoint för Period 2 var den tid det tog för patienterna att känna sitt tillstånd som ”minimalt”, ”mycket” eller ”väldigt mycket sämre” jämfört med bedömningen strax innan Period 2. Denna tid uppskattades med Kaplan-Meier analysen och testades med log-rank test. Kaplan-Meier analys som även användes är en statistisk analys som fastställer överlevnadsfunktion av patienter som svarat på behandlingen. Den används till att analysera tid till första händelse (förbättring, försämring etc) [25].
Ytterligare en primär endpoint var en ökning till över 15 poäng på IRLSSG svårighetsskalan. Under studien användes PGI-skalan, John Hopkins Restless Legs Quality of Life (RLS-QoL) frågeformuläret, VAS (Visuell analog skala) och Epworth Sleepiness Scale (ESS) som sekundära mätningar.
Utifrån RLS-QoL frågeformuläret och patienternas svar bedöms vilken effekt RLS har på deras sömn, det emotionella välbefinnandet, det sociala livet och arbetslivet. RLS-QoL svaren kan användas för att beräkna ett poäng i en skala mellan 0-100. Detta ska representera RLS effekt på personens livskvalitet.
VAS användes av patienterna för att bedöma RLS-symtomens svårighetsgrad vid tre tillfällen (strax innan sänggåendet, under natten och under dagen). Ytterligare en skala, modifierad RLS-6 skala, användes under studien för att mäta tillfredsställelsen med sömnen.
Resultat
Bland de 183 patienter som fullföljde Period 1, deltog 82 % (150) i Period 2. Under Period 2 fullföljde 71 av 78 studien i pramipexolgruppen, medan 25 av 72 fullföljde i placebogruppen.
Tiden till en ”överlevnadsuppskattning” (försämring) på 0.85 var 5 dagar för placebo och tiden till en uppskattning på 0.50 var 7 dagar. För pramipexol var tiderna 42 dagar respektive över 84 dagar (P < 0.0001). Enligt Kaplan-Meier analysen uppnådde placebogruppen primär endpoint snabbare och oftare än pramipexolgruppen.
Patienterna som bytte till placebo uppnådde en försämring på både CGI-I skalan och IRLS-poängen (primär endpoint) signifikant oftare än de patienter som fortsatte ta pramipexol (85.5% mot 20.5%; P < 0.0001). Alltså uppnådde 85.5% i placebogruppen målet (försämring av sitt tillstånd) jämfört med 20.5% i pramipexolgruppen (P < 0.0001).
VAS och den modifierade RLS-6 skalan visade i början av Period 2 låg svårighet av RLS (< 10 mm) och hög tillfredsställelse av sömnen (< 15 mm). Dessa resultat var oförändrade i pramipexolgruppen.
I placebogruppen visade resultaten hög RLS svårighet under alla tre tillfällen (före sänggåendet var det genomsnittlig ökning med 48 mm, under natten var det en ökning med 47 mm, och under dagen var den genomsnittliga ökningen 9 mm) och vid tillfredsställelsen med sömnen minskade poängen med 41 mm.
Patienterna respons till punkterna 1 till 5, 7 till 10 och 13, summerades och inverterades för att ge poäng 0 till 100 i RLS-QoL skalan. Ju högre poäng desto bättre hälsostatus. I början av Period 2 var genomsnittet 85 för placebo och 90 för pramipexol. I slutet av Period 2 var resultatet oförändrat i pramipexolgruppen medan det var en minskning med 12.5 poäng i placebogruppen (P < 0.0001).
PGI-skalan visade vid slutet av Period 2 att 70.5% i pramipexolgruppen hade själva bedömt sitt tillstånd som oförändrat medan 10.3% ansåg att de blivit värre. I placebogruppen var 30.4% oförändrade och 63.8% var värre (P < 0.0001).
Enligt ESS var genomsnittspoängen 6.44 i placebogruppen i början av Period 2 jämfört med 5.31 i pramipexolgruppen. Inga signifikanta förändringar följde (P=0.3464, ANCOVA för behandling-grupp skillnad).
Under Period 2 och 48 timmar efter sista läkemedelsintaget upplevde 32% av patienterna biverkningar varav 23.6% i placebo- och 39.7% i pramipexolgruppen. Tabell II nedan visar de fem biverkningar som förekom mest i de båda grupperna vid behandlingen.
Tabell II. De fem mest förekommande biverkningarna i placebogruppen och pramipexolgruppen.
Biverkningar Placebogruppen Pramipexolgruppen
Diarré 1.4% 3.8%
Kräkningar 2.8% 2.6%
Övre buksmärtor 0% 3.8%
Inflammation i näsa och svalg 1.4% 3.8%
Försämrad RLS 5.5% 6.4%
Majoriteten av de patienter som upplevde biverkningar var milda eller måttliga i intensitet. Fem patienter (3.3%), varav tre i placebogruppen och två i pramipexolgruppen, upplevde biverkningar som klassas som svåra. En patient som åt 0.50 mg pramipexol upplevde en mycket allvarlig biverkan (definierades som livshotande eller signifikant handikappande) under Period 2. Andra signifikanta biverkningar som ledde till avbrott i kontinuitet eller minskning av läkemedlet rapporterades hos fyra i placebogruppen och fyra i pramipexolgruppen. Biverkningarnas frekvens bland dem som fick pramipexol var påtagligt lägre Period 2 (39.7%) jämfört med Period 1 (75.0%).
Bland de 71 patienter som fick pramipexol och 25 som fullföljde placebo var det ingen som klassades att ha symtomförstärkning (augmentation) vid slutet av studien. Detta utvärderades av erfarna utredare som använde ”The Augmentation Severity Rating Scale”.
B. Efficacy of Pramipexole in Restless Legs Syndrome: A Six-Week, Multicenter, Randomized, Double-Blind Study (Effect-RLS Study) [20]
Oertel W. H., et al., Movement Disorder Society 2006, 22, 213-219
Syftet med denna studie var att visa pramipexols effektivitet vid behandling av RLS jämfört med placebo under sex veckor.
Patienter och metoder
Denna multicenterstudie var randomiserad, dubbelblind och pågick i sex veckor. Av 435 patienter som screenades var det 345 som randomiserades och behandlades. 90
patienter uteslöts på grund av graviditet, amning, risk för graviditet, diabetes, signifikanta renala, hepatiska, mag-tarm-, lungrelaterade eller endokrina rubbningar. Även de patienter med någon annan form av neurologisk sjukdom exkluderades. Patienter med sömnstörningar orelaterade till RLS, psykotiska eller mentala störningar exkluderades också. 345 patienter deltog i denna studie och de var män och kvinnor mellan 18 och 80 år gamla från 37 olika centra i fem europeiska länder. Alla patienter hade diagnosen primär RLS enligt IRLSSG diagnostiska kriterier. De hade mer än 15 poäng på IRLSSG svårighetsskalan (måttliga till svåra symtom). De skulle ha sina symtom minst 2-3 dagar per vecka i tre månader innan de deltog i studien. Alla farmakologiska behandlingar för RLS avbröts hos patienterna 14 dagar innan studiens start. Av de 345 patienter tilldelades slumpmässigt 115 patienter placebo och 230 pramipexol. I pramipexolgruppen avbröt 12 patienter studien på grund av avvikande händelser (kan innebära bieffekter), protokollavvikelse, att de frivilligt hoppade av och annat. I placebogruppen var det 8 patienter som avbröt studien på grund av liknande skäl. Det var alltså 107 patienter i placebogruppen och 218 patienter i pramipexolgruppen som fullföljde studien.
Startdosen med pramipexol var 0.125 mg per dag eller anpassat placebo. Doserna togs en gång dagligen på kvällen 2 till 3 timmar innan sänggåendet. Under de första fyra veckorna kunde den dagliga dosen ökas av läkaren i veckointervall till 0.25, 0.50 eller 0.75 mg per dag med hjälp av PGI bedömningen och utifrån patientens tolerans till pramipexol. Vid biverkningar kunde dosen minskas till föregående dos-steg. Dosen hölls konstant under vecka 5 och 6.
Den primära endpoint bestod av två bedömningar: 1. ändringen i IRLS-poängen från baslinjen.
2. andelen patienter med CGI-I bedömningarna ”mycket förbättrad” och ”väldigt mycket förbättrad” vecka 6.
Flera sekundära effektivitetsparametrar specificerades också i studiens protokoll. Dessa parametrar inkluderar två responders:
1. IRLS responders (patienter med minst 50 % minskning på deras IRLS-poäng från baslinjen).
2. PGI responders, dvs. andelen patienter som bedömde sitt tillstånd vecka 6 som antingen ”mycket bättre” eller ”väldigt mycket bättre” jämfört med baslinjen. PGI responder rate beräknades vecka 1.
De primära endpoints och sekundära effektivitetsparametrar analyserades med intention-to-treat (ITT) och Cochran-Mantel-Haenszel test. VAS användes för att mäta RLS-symtomens svårighet under baslinjen veckan vid tre tillfällen: 1) då man gick till sängs, 2) under nattens gång, och 3) under dagens lopp. Patienterna markerade sitt tillstånd på en kontinuerlig 10 cm linje, där den vänstra delen längst ut (0) representerade ”inte närvarande” och den högra delen längst ut (100) företrädde ”svårt”. Vid bedömningen av tillfredsställelsen med sömnen, representerade den vänstra delen (0) ”väldigt tillfredsställd” och den högra delen (100) tydde på ”väldigt otillfredsställd”. Inkluderat med screening-besöket, så var det åtta studie/undersökningsbesök under den 6 veckors långa behandlingsperioden (screening, baslinje [dag 0], vecka 1, 2, 3, 4, 5 och 6). Patienterna utförde IRLS vid screening, baslinjen och vecka 6. CGI och VAS utfördes vid baslinjen och vecka 6, PGI utfördes varje vecka.
Resultat
I placebogruppen fullföljde 107 av 115 patienter studien och i pramipexolgruppen fullföljde 218 av 230. Vid behandling under den sjätte veckan fick 14.8% 0.125 mg/dag, 26.5% fick 0.25 mg/dag, 28.7% fick 0.50 mg/dag, och 30% fick 0.75 mg/dag. Vid baslinjen var IRLS-genomsnittspoängen 24.9 (SD; ±5.4) i placebogruppen och 24.7 (SD; ±5.2) i pramipexolgruppen vilket tydde på att patienterna led av svåra besvär. Efter sex veckors behandling var IRLS-genomsnittspoängen 18.8 (SD; ±10.0) i placebogruppen och 12.3 (SD; ±9.3) i pramipexolgruppen (P < 0.0001).
Då man analyserade CGI-I vecka 6 hade 32.5% av patienterna i placebogruppen och 62.9% i pramipexolgruppen bedömt sitt tillstånd som ”mycket förbättrat” eller ”väldigt mycket förbättrat” jämfört med baslinjen (P < 0.0001).
Vecka 6 hade 28.9% (placebo) och 52.2% (pramipexol) av patienterna en minskning ≥ 50% i deras IRLS-poäng från baslinjen (IRLS responder, P < 0.0001).
Andelen PGI responders var 31.6% (placebo) och 61.6% (pramipexol). Efter en veckas behandling, bedömde 7% i placebogruppen och 30.6% i pramipexolgruppen sitt tillstånd som ”mycket/väldigt mycket förbättrat” (PGI responders).
VAS-bedömningarna vecka 6 visade att pramipexol minskade RLS-symtomens svårighetsgrad både under kvällen och under dagen. De största minskningarna observerades medan patienterna skulle sova och under natten d.v.s. de tider då RLS symtomen egentligen är som svårast. Detta ledde till stora förbättringar i tillfredsställelsen av sömn och resulterade i minskad trötthet och sömnighet dagtid. Majoriteten av biverkningarna var milda i intensitet (32.2% i placebogruppen och 51.7% i pramipexolgruppen). De biverkningar som ansågs av studieprövarna vara relaterade till läkemedlet upplevdes av 21.7% i placebogruppen och 36.5% i pramipexolgruppen. De mest förekommande biverkningarna var illamående, huvudvärk, trötthet och de var mer frekventa i pramipexolgruppen jämfört med placebo. Yrsel förekom hos patienterna i lika stor utsträckning i båda grupperna (3.5%). Sömnighet rapporterades hos 2.6% av pramipexolpatienterna och 2.6% av placebopatienterna. Biverkningar med svår intensitet rapporterades av 7.8% i placebogruppen jämfört med 3.5% i pramipexolgruppen. Elva patienter (fem i placebo och sex i pramipexol) hoppade av från studien för tidigt pga. avvikande händelser. Symtomförstärkning rapporterades inte av någon behandlingsgrupp.
C. Ropinirole Is Effective in the Long-Term Management of Restless Legs Syndrome: A Randomized Controlled Trial [21]
Montplaisir J., et al., Movement Disorder Society 2006, 21, 1627-1635
Syftet med denna studie var att undersöka ropinirols långsiktiga effektivitet hos patienter med RLS och bedöma potentiellt återfall efter den aktiva behandlingens avbrott.
Patienter och metoder
Denna multicenterstudie var indelad i två perioder, där Period 1 var en singelblind behandlingsfas med ropinirol och pågick i 24 veckor, medan Period 2 var en placebokontrollerad dubbelblind behandling som pågick i 12 veckor.
Exklusionskriterierna i denna studie var patienter som led av en primär sömnstörning som kunde påverka RLS-symtomen, de med annan rörelsestörning, de med ett
medicinskt tillstånd som kunde påverka bedömningen av RLS eller toleransen av ropinirol, de som använde läkemedel som kunde påverka sömn, de med en känd intolerans mot ropinirol och de som missbrukade eller var beroende av läkemedel eller substanser. Även de patienter som krävde behandling för sina RLS-symtom under dagen, de med augmentation eller ”end-of-dose” rebound under föregående terapi, exkluderades.
I studiens första period medverkade 202 patienter med primär RLS enligt IRLSSG diagnostiska kriterierna och behandlades med ropinirol under 24 veckor och det var 106 patienter som fullföljde denna fas. Patienterna var av blandat kön mellan 18 och 80 år från 18 centra i Tyskland, Österrike, Australien, Kanada och Sydafrika. Patienterna skulle ha minst 15 poäng på IRLSSG skattningsskala för besvär vid RLS och de skulle ha upplevt RLS-symtom minst 15 kvällar under den föregående månaden. Patienterna fick genomgå en wash-out period innan baslinjen.
Vid baslinjen behandlades alla patienter med 0.25 mg ropinirol per dag. Patienterna tog sina doser 1-3 timmar innan sänggåendet. Efter två dagar kunde dosen titreras upp till 0.5 mg/dag. Mellan vecka 1 och 20 kunde dosen ökas till högst 4 mg/dag var sjunde dag eller mer. Då patienterna hade uppnått sin optimala behandlingsdos skulle de behålla den dosen till slutet av den singelblinda fasen. Alltså var inga fler ändringar i doseringen tillåtna mellan vecka 20 och 24. Vecka 24 fick totalt 18 patienter maxdosen 4 mg/dag ropinirol. De patienter som hade en minskning med minst sex poäng på IRLS-poängen jämfört med baslinjen randomiserades till en dubbelblind behandling med ropinirol eller placebo. Utav de 106 patienter som fullföljde studiens första fas (Period 1) var det 92 som uppnådde kriterierna för den återupptagande behandlingen (Period 2). Dessa randomiserades till en dubbelblind behandling med antingen ropinirol eller placebo i 12 veckor. I ropinirolgruppen var det 30 av 45 som fullföljde studiens andra fas. I placebogruppen fullföljde 19 av 47 patienter studiens andra fas. De som randomiserades till ropinirol fick samma dos som under den singelblinda fasen (Period 1) och inga dosjusteringar var tillåtna under den dubbelblinda fasen (Period 2). Hos patienterna i placebogruppen minskade man ropiniroldoseringen i två veckor så att de fick placebo endast från vecka 27 till 36. Kliniska besök tog plats dag 2, varje vecka från vecka 1 till 8, sedan var fjärde vecka från vecka 8 till 36. Vid varje besök bedömdes ropinirols effektivitet genom att använda IRLSSG och CGI skalorna och dessa gjordes färdiga av läkare. MOS
MOS Short Form (SF)-36 Health Survey fylldes i av patienterna vid baslinjen och veckorna 8, 12, 24 och 36.
Subskalan CGI-I är en 7 poängskala där 1 tyder på ”väldigt mycket förbättrad” och 7 tyder på ”väldigt mycket försämrad”.
MOS sömnskalan består av frågor som värderar flera sömnaspekter i patientpopulationer.
MOS SF-36 Health Survey är en generell mätning som avgör hälsokoncept som representerar elementära mänskliga värden (relevanta till allas funktionella status och välbefinnande). Den är mest lämplig för att bedöma ”cross-sectional” skillnader mellan grupper och den kan variera i förhållande till förändringarna i QoL.
Den primära effektivitetsvariabeln var andelen patienter som fick återfall under dubbelblind behandling. Återfall definierades som en ökning (försämring) med minst sex IRLS-poäng jämfört med den dubbelblinda fasens början (randomiseringen), eller som avhopp från studien pga. bristande effektivitet. Sekundära effektivitetsvariablar under den dubbelblinda fasen inkluderade:
1. tiden för återfall
2. andelen patienter som hoppade av på grund av bristfällig effektivitet
3. andelen patienter med ”mycket” eller ”väldigt mycket förbättrad” på CGI-I skalan vecka 36.
4. ändring i IRLS-poängen under dubbelblind behandling vecka 36 jämfört med poängen från randomiserad baslinje.
5. ändringar i sömn- och QoL parametrar från randomiserad baslinje. Resultat
Det var fler kvinnor än män som deltog i hela studien och det var fler kvinnor i placebogruppen än i ropinirolgruppen. Denna skillnad förväntades inte ha någon påverkan på behandlingens effektivitetsvariablar. Fyra patienter (två i varje grupp) uppfyllde inte kriterierna för återfall eller för prövningens fullbordande och därför exkluderades dem från den primära effektivitetsanalysen.
Under den dubbelblinda behandlingsfasen fick 14 av 43 patienter (32.6%) återfall i ropinirolgruppen i placebogruppen fick 26 av 45 patienter återfall (57.8%) (P=0.0156). Ytterligare tolv patienter (8 stycken i placebo och 4 stycken i ropinirol) uteslöts eftersom de inte uppfyllde kriterierna för återfallstiden.
Återfallstiden var längre med ropinirol och fler patienter hoppade av på grund av brist på effektivitet i placebogruppen (20 av 39; 51.3%) jämfört med ropinirolgruppen (12 av 41; 29.3%).
Tolv veckor efter randomiseringen (vecka 36) hade 68.9% patienter i ropinirolgruppen ”mycket eller väldigt mycket förbättrad” på CGI-I skalan jämfört med 46.7% i placebogruppen.
Patienter som fick ropinirol under den singelblinda behandlingsfasen hade en genomsnittsminskning med 12.8 poäng i IRLSSG skalan vecka 24 jämfört med baslinjen. Under den dubbelblinda fasen ökade (försämrades) IRLS-genomsnittspoängen med 4.1 i ropinirolgruppen och med 8.2 i placebogruppen jämfört med poängen vid randomiseringen.
Förbättringar i MOS sömnskalan visade att alla ropinirolpatienter under den singelblinda fasen upplevde minskning i sömnstörningar och sömnighet samt förbättring i sömnkvantitet och sömntillfredsställelse. De patienter som bytte till placebo upplevde en signifikant försämring i sömnstörningen och sömnigheten under dagen jämfört med dem som fortfarande tog ropinirol.
Totalt sätt visade poängen på RLS-QoL frågeformuläret en förbättring med 19.3 (2SE=3.16) under den singelblinda fasen. Poängen försämrades med 17.0 (2SE=5.58) i placebogruppen jämfört med 5.2 poäng (SE=5.76) i ropinirolgruppen. Likaså var det förbättringar i SF-36 Health Survey frågeformulärets alla åtta domäner under den singelblinda fasen. Under den dubbelblinda fasen var det vidare små förbättringar i poängen i två domäner i ropinirolgruppen och en liten försämring i resterande domänen. I placebogruppen sågs försämringarna i alla åtta domäner som var mycket större jämfört med ropinirolgruppen.
96 patienter hoppade av från den singelblinda fasen varav 14 hoppade av pga. otillräcklig terapeutisk effekt. 45 stycken hoppade av pga. orsaker som inte var relaterade till ropinirol och de kvarvarande 37 patienter hoppade av pga. biverkningar (illamående, sömnighet, trötthet, depression, kräkningar, yrsel, buksmärtor och insomnia).
I ropinirolgruppen hoppade 12 av 15 patienter av från den dubbelblinda fasen pga. otillräcklig terapeutisk effekt, medan 20 av 28 patienter i placebogruppen hoppade av pga. samma orsak. En patient i ropinirolgruppen hoppade av pga. biverkning.
I den dubbelblinda fasen var de vanligaste biverkningarna illamående och huvudvärk. Majoriteten av dessa biverkningar var milda eller måttliga i intensitet. Två patienter i ropinirolgruppen upplevde illamående som en svår biverkan och fyra patienter i placebogruppen upplevde hyperkinesi (motorisk hyperaktivitet i musklerna) som svår. Prövarna förser inte med ett definitivt omdöme av symtomförstärkning eftersom de inte gjorde någon specifik utvärdering av symtomförändringar.
D. Randomized, double-blind, placebo-controlled, short-term trial of ropinirole in restless legs syndrome[22]
Bliwise D. L., et al., Sleep Medicine 2005, 6, 141-147
Syftet med denna studie var att testa ropinirols kliniska effektivitet vid behandling av RLS.
Patienter och metoder
Denna amerikanska studie var indelad i två faser där första fasen var en öppen-studie som pågick i fyra veckor och den andra fasen var dubbelblind randomiserad placebokontrollerad och pågick i två veckor. Bland de 33 patienter som screenades från början misslyckades screening hos tre patienter (en hade anemi, en hade trombocytopeni och en vägrade ta kontakt efter screening). Alla patienter genomgick en komplett medicinsk, fysisk och neurologisk undersökning och serumprover togs för att avgöraCBC (complete blood counts), kreatinin, järn, ferritin och BUN (blood urea nitrogen). Patienter exkluderades från studien ifall deras RLS berodde på andra tillstånd (t.ex. diabetes), hade risk för att bli gravida, om de hade Parkinsons, sömnapné, obehandlad depression, systematiska sjukdomar inklusive hepatiska, renala eller endokrina störningar samt patienter med bevis på alkoholism eller läkemedelsberoende eller individer som intog över tre koffeininnehållande drycker per dag.
I den öppna studien deltog 30 patienter (tre screenades bort) med primär RLS och alla patienter fick IRLSSG bedömningsskalan vid screening/baslinjen och därefter varje vecka vid sex andra tillfällen (besöken 2 till 7). Patienterna fick sluta med all medicinering som de använde för att behandla RLS dagen innan baslinjens utvärdering
(besök 1). Alla patienter fick vid första besöket på kvällen 0.25 mg ropinirol vid sänggåendet. Under de följande två veckorna (besök 2 och 3) deltog de i en öppen studie där mängden ropinirol titrerades successivt till en maximal klinisk effektivitet. Dosen ökades med ökningar mellan 0.25 och 1.5 mg men maxdosen var 6 mg per dag. Patienterna fortsatte därefter den öppna studien i ytterligare 2 veckor fast med en oförändrad ropiniroldos. De fick göra bedömningar besök 4 och 5. Efter den öppna fasens slut blev 26 patienter (fyra patienter hoppade av) randomiserade (besök 5) till att få antingen placebo eller ropinirol i 2 veckor. Denna fas var dubbelblind och de fick behålla samma dos som de fick under den öppna effektivitetsfasen. Nattlig polysomnografi utfördes före randomiseringen under den öppna fasens sista vecka (besök 5) och på slutet av den dubbelblinda fasen (besök 7).
Den primära effektivitetsvariabeln var de benrörelser i sömn som registrerades med hjälp av elektromyogram (EMG) och PLMS som medförde uppvaknande (eng. arousal) mättes med elektroencefalogram (EEG). Sekundär outcome variabel var IRLSSG skattningsskalan.
PLMS Index (PLMSI) visar ”antalet rörelser per timma under sömn” och PLMS Arousal Index (PLMSAI) representerar ”antalet rörelser med uppvaknande per timma under sömn”. PLMSI och PLMSAI studerades med multivariat ANOVA (Analysis of Variance). Varje patients värden jämfördes med värden från baslinjen. Syftet med ANOVA modellen är att fastställa ifall ett läkemedel har några signifikanta effekter (eller i detta fall upphäva effekter av ett läkemedel). Man kan med hjälp av ANOVA se om det är några skillnader mellan ett läkemedel och placebo, ifall det är skillnader mellan baslinje och behandling och om dessa effekter interagerar med varandra. ANOVA (repeated measures) användes också vid analys av data från IRLSSG skattningsskala då man jämförde grupperna.
Resultat
33 patienter var kvalificerade för studien men 30 stycken deltog i den öppna studien. I den dubbelblinda fasen randomiserades 26 patienter och 22 fullföljde hela studien (9 stycken i ropinirolgruppen och 13 i placebo).
Den genomsnittliga PLMSI visade en icke-signifikant minskning från 9.9 till 0.9 ”händelser per timma” (Wilcoxon T=1, P=0.95) hos de 9 patienter som fick ropinirol och som senare randomiserades till att fortsätta ta ropinirol. Hos de 13 patienter som
fick ropinirol men som senare randomiserades till att ta placebo, visade den genomsnittliga PLMSI en dramatisk ökning från 7.3 till 85.6 ”händelser per timma” (Wilcoxon T=39, P=0.0005).
Även PLMSAI visade en icke-signifikant minskning hos de 9 som fortsatte ta ropinirol och en dramatisk ökning hos de 13 som fick placebo från 3.7 till 14.8 ”händelser per timma” (Wilcoxon T=33, P=0.007).
Den parvisa jämförelsen antyder att IRLSSG skattningspoängen besök 1 (X=22.6, SD=4.6) var signifikant högre (P < 0.0001 för alla jämförelser) jämfört med poängen från besöken 2-5 (reflekterar ropinirols gynnande effekter under den öppna fasen). Skattningsskalans poäng var signifikant högre besök 6 (post-randomisering) jämfört med besök 5 (pre-randomisering) för båda grupperna (för ropinirol, X=8.7 [pre] vs
X=14.3 [post]; för placebo, X=12.2 [pre] vs X=20.7 [post]) (t=2.68, P<0.05 och t=3.23,
P<0.01 respektive). Ingen skillnad sågs när besök 5 och 7 jämfördes separat. Skillnader mellan ropinirolgruppen och placebogruppen förekom bara vid besök 6 (t=2.46, P < 0.03).
Granskningen av IRLSSG skattningspoängens post-randomiseringseffekter gjordes genom att jämföra besök 5 kontra besök 6 och besök 7 separat med t-test. Prövarna granskade skillnader mellan placebo och ropinirolgruppen vid besök 5-7 med två-grupps t-test. Det var 22 av 26 patienter som fick genomgå polysomnografi två kvällar och därför gjorde man IRLSSG skattningsskala endast på de 22 patienterna.
Den mest förekommande biverkningen var illamående (n=17) hos de 26 patienter som deltog i studiens båda faser. Näst vanligast var sömnighet (n=11) och huvudvärk (n=6). Illamående förekom vid genomsnittsdosen 0.82 mg, sömnighet vid 0.66 mg och huvudvärk vid 0.46 mg.
E. First night efficacy of pramipexole in restless legs syndrome and periodic leg movements [23]
Manconi M., et al., Sleep Medicine 2007, 8, 491-497
Syftet med denna studie var att utvärdera initial respons på en låg standarddos pramipexol hos patienter med idiopatisk RLS i en kontrollerad klinisk PSG studie.
Patienter och metoder
Denna italienska studie var kortvarig singelblind placebokontrollerad där både män och kvinnor mellan 18 och 70 år deltog. Patienterna hade idiopatisk RLS med svåra symtom (hade minst 20 poäng på IRLSSG skattningsskalan för besvär). Endast de som var fria från medicinering innan baslinjen och de som aldrig tidigare varit behandlade för sina RLS-symtom inkluderades i studien. Symtomen hos dem skulle ha uppträtt i genomsnitt minst två gånger per vecka under senaste sex månaderna och deras PLMS index skulle vara större än 10 vid PSG baslinjen. Alla patienter fick genomgå klinisk och neurofysiologisk utvärdering, hematologisk screening och två polysomnografier (PSG) i följd. Rutin blodprover (inklusive järn och ferritin, B12 vitamin och folat) likaså EMG och elektroneurografi på de nedre benen var normala.
Patienter med en sömnapné-index över 5 eller med andra sömnstörningar som exempelvis narkolepsi eller parasomni exkluderades från studien. Exklusionskriterierna var också de patienter med känd orsak till sekundär RLS som exempelvis graviditet, anemi orsakat av järnbrist och ledgångsreumatism exkluderades. Patienter med övriga medicinska tillstånd som skulle kunna påverka bedömningen av RLS uteslöts också.
32 patienter randomiserades i två grupper varav 18 patienter fick pramipexol och 14 fick placebo. Ingen medicinering administrerades innan första kvällens PSG-registrering (baslinje). Innan den andra kvällens PSG-registrering fick patienterna 0.25 mg pramipexol eller placebo. På morgonen efter varje PSG-registrering fick patienterna utvärdera nattsymtomens svårighet på VAS.
Patienterna fick inte dricka drycker innehållande koffein sex timmar innan varje PSG började. De fick sova fram tills sitt spontana uppvaknande på morgonen. De signaler som registrerades var EEG, elektrookulogram (EOG), elektromyogram (EMG) och EKG.
Resultat
I pramipexolgruppen ändrades VAS-genomsnittspoängen från 7.4 ± 1.68 i standardavvikelse (SD) innan behandlingen till 1.3 ± 1.62 SD efter behandlingen (P < 0.00001).
I placebogruppen ändrades VAS-genomsnittspoängen från 6.8 ± 1.72 SD till 5.4 ± 2.33 SD (inte signifikant).
VAS-poängen förbättrades hos alla patienter och i pramipexolgruppen uppnådde 10 av 18 patienter värdet 0. Hos två placebopatienter ändrades inte VAS-poängen och blev sämre hos tre placebopatienter. För att jämföra olika sömn och LM parametrar med eller utan behandling vs placebo användes ANOVA.
PLMSI minskade från 45.8 ± 33.56 SD innan behandlingen till 9.4 ± 11.40 SD efter behandlingen (P < 0.0002). Resultaten visade att PLMSI minskade omedelbart hos alla patienter som tog pramipexol.
NREM (Non-rapid eye movement) förändrades från 38.7 ± 10.50 till 50.6 ± 12.3 (P < 0.02).
Samtliga testade parametrar så som PLMS change index, whole-night PLMSI, NREM sleep total LM och PLMSI var signifikant skiljt mot både baslinjen och placebo. En patient som behandlades med pramipexol och en annan som fick placebo rapporterade milt illamående på morgonen. Inga andra signifikanta biverkningar rapporterades hos resten av patienterna.
DISKUSSION
Symtomen vid RLS kan bero på av en störning i det så kallade dopaminerga systemet inom de basala ganglierna. Ett övertygande tecken på detta är att dopaminerga läkemedel fungerar mycket bra hos de flesta patienter med RLS [2]. Dopaminagonister anses av forskare vara första linjens behandling för patienter med svår RLS [3].
Mina studier demonstrerade pramipexols och ropinirols effektivitet och säkerhet vid behandling av RLS-symtomen samt deras effekt på sömn. De mest förekommande biverkningar var milda till måttliga hos majoriteten av patienterna.
I artikel A framgick det i resultaten att pramipexol har en bibehållen effektivitet vid doserna 0.125-0.75 mg per dag mot RLS-symtom upp till nio månader. Detta bedömdes av både patienterna själva (IRLS) och kliniska prövare (CGI-I). Patienter som behandlades med en optimerad individuell dos pramipexol kände även förbättringar i subjektiv sömnkvalitet (modifierad RLS-6 skala) och livskvalitet (QoL). I den här prospektiva studien var pramipexol säker och vältolererad med förväntade biverkningstyper som allmänt var milda eller måttliga i intensitet. Hos fem patienter förekom biverkningar som klassades som svåra (två i pramipexolgruppen) medan mycket svåra biverkningar förekom hos två pramipexolpatienter. Biverkningsfrekvensen var påtagligt lägre bland pramipexolpatienterna under Period 2 jämfört med Period 1, vilket kan bero på att betydligt fler behandlades med det aktiva läkemedlet Period 1. Personer som är vana vid att använda pramipexol kan känna av ett byte till placebo vilket kanske skapar bias gentemot utträde från en randomiserad prövning tror prövarna.
Det som var intressant för mig är att artikel A nämner liknande rön i en annan studie gjord av Stiasny-Kolster et al. (2004) fast med cabergolin (ergolin dopaminagonist). I denna dubbelblindade placebokontrollerade multicenterstudien randomiserades patienter med svår RLS i fyra grupper där de tilldelades antingen 0.5 mg, 1 mg eller 2 mg cabergolin respektive placebo en gång dagligen. Resultaten från denna studie visade förbättringar av symtomen under dagen, vid sänggåendet och under natten av alla cabergolindoserna jämfört med placebo. Under denna studie som pågick ett år påverkades sex patienter av mild symtomförstärkning.