HUVUDOMRÅDE: Biomedicinsk laboratorievetenskap FÖRFATTARE: Mehalet Nigussie & Sabrin Thwainy HANDLEDARE:Magnus Karlsson
JÖNKÖPING: 2020 – 06
Hudtemperaturens
inverkan på sensorisk
nervledningshastighet
i nervus medianus
2
Sammanfattning
Kännedom om effekten av temperaturvariationer på det perifera nervsystemet ger en djupare förståelse för de fysiologiska mekanismerna som ligger till grund för funktionen av neuromuskulär påverka vid patologiskt och friskt tillstånd. Syftet med den här studien är att redogöra för hur den sensoriska nervledningshastigheten, distal latens och amplitud en i nervus medianus påverkas vid temperaturförändringar på handryggen från 26 till 33 °C. Studien omfattade 19 deltagare mellan 20– 40 år. Mätningarna utfördes vid tre temperaturintervaller; kall (26–27° C), ljummen (28–29° C) och varm (32–33° C) för varje deltagare.
I denna studie observerades sensorisk nervledningshastigheten och distal latens visade ett signifikant samband med p-värde<0.001. Temperaturökningen leder till ökad nervledningshastighet med 1,61 m/s/° C och distal latensen reduceras med 0,1 ms/° C. Däremot sågs inget samband mellan amplitud med p-värde=0.87 och temperaturökningen. Temperaturförändringen har en påverkan på perifera nerver, detta bör uppmärksammas vid elektroneurografisk undersökning.
Det är viktig att uppnå den standardtemperaturen (31–34°C) vid en elektroneurografisk undersökning för att ställa rätt diagnos. Vid svårigheter med att upp nå den standardtemperaturen kan en korrektionsfaktor användas.
3
Impact of skin temperature on sensory nerve conductivity in the median
nerve
Summary
Understanding the effect of temperature on the peripheral nervous system helps to have a better knowledge of the physiological mechanisms and functionality of the neuromuscular system. This study aimed to analyze the effect of temperature change, from 26 to 33°C at the dorsal side of the hand, on the sensory conduction velocity, distal latency, and amplitude of the median nerve. The study consists of 19 individuals between 20–40 years. The measurement was carried out at three temperature ranges: cold (26–27°C), intermediate (28–29°C), and warm (32–33°C).
Sensory conduction velocity and distal latency were significantly correlated to temperature with a p-value <0.001. Sensory nerve conduction velocity and distal latency changes by 1,61 m/s and 0.1 ms with a temperature change of 1°C, respectively. In this study, the author did not observe a significant correlation (p-value of 0.82) between temperature and amplitude due to the large variability of amplitude in the temperature range used in this study. It is important to perform electroneurographic diagnosis at a temperature of over 31-34°C, otherwise, a correction factor must be used for a reliable diagnosis.
4
1. Innehållsförteckning
Inledning ... 5
Bakgrund ... 6
Nervsystemet ... 6
Aktionspotential ... 7
Nervus medianus ... 8
Patologi ... 9
Sensorisk nervledningshastighet vid elektroneurografi undersökning ... 9
Artefakter ... 11
Påverkan av elektroneurografiparametrar i samband med
temperaturförändring på huden ... 12
Den biomedicinska analytikerns roll ... 12
Problemformulering ... 13
Syfte ... 15
Material och metod ... 16
Urval av deltagare ... 16
Utrustning ... 16
Metod ... 16
Statistisk analys ... 18
Etiska överväganden ... 18
Resultat ... 20
Samband mellan temperatur och distal latens ... 20
Samband mellan temperatur och nervledningshastighet ... 21
Samband mellan temperatur och amplitud ... 22
Diskussion ... 23
Metoddiskussion ... 23
Resultatdiskussion ... 26
Slutsatser ... 29
Referenser ... 31
Bilaga 1 ... 34
Bilaga 2 ... 37
5
Inledning
Patienter med nedsatt perifer cirkulation brukar ofta ha kalla händer och/eller ben vilket kan påverka vissa kliniska undersökningar så som elektroneurografi (ENeG). Några av de vanligaste patientgrupperna som ofta brukar ha nedsatt perifercirkulation är patienter med perifer arteriell sjukdom, diabetiker men också äldre (Cameron & Cotter, 2001). Vid elektroneurografisk undersökning är då viktigt att hudtemperaturen ska ligga över 32°C på övre extremitet (Katirji, 2007; Burnham & Burnham 2009; Whittaker, 2012). Eftersom vid minskad temperatur i extremiteterna påverkas det viktigaste ENeG- parametrarna (nervledningshastighet, distala latens och amplitud). Både motoriska och sensoriska nerver påverkas av en låg temperatur men särskilt den sensoriska nervledningen är känslig för temperaturförändringen (Whittaker, 2012; Caress, 2007, Herrera, Sandoval, M., Camargo, & Salvini, 2010). Den rekommenderad temperaturen vid ENeG är 33 – 340C under hela undersökningen. Neurofysiologer använder 31-340C som arbetstemperatur. Om temperaturen sjunker med en grad så minskas nervledningshastighet med 1,5–2,5 m/s (Burnham & Burnham, 2009, Caress, 2007) medan distala latensen ökar med 0,3 ms (Kane & Oware, 2012; Rutkove, 2001; Morris, 2013). Därför är det av viktigt att hålla extremiteterna varma under hela ENeG- undersökningsprocessen för att undvika feltolkning (Rutkove, 2001). Nervus medianus (n. medianus) är en viktig nerv som tillhör de övre extremiteterna och som innerverar handen. Genom att undersöka n. medianus vid ENeG- undersökning kan en rad neurologiska sjukdomar diagnostiseras. Den vanligaste sjukdomen som förekommer vid skada är karpaltunnelsyndrom (carpal tunnel syndrome; CTS). Det kan uppkomma till följd av andra sjukdomar (Keri, Kles1, & Aaron, 2006; Grefberg, 2013) men även av trauma eller ökad belastning mot handen/ handleden (Grefberg, 2013; Tortora & Derrickson, 2017; Cakir, 2003; Grefberg, 2013). Detta i sin tur leder till en försämrad funktion av handen (Grefberg, 2013; Fagius & Nyholm, 2013; Norrving, 2015). Elektroneurografisk undersökning är den vanligaste undersökningen inom en neurofysiologisk verksamhet. Undersökningen utförs av en biomedicinsk analytiker (BMA) som utför undersökningen självständigt vilket innebär ett stort krav på kunskap och utförande av undersökningen (Persson & Wilhelmsson, 2008). En biomedicinsk analytiker är skyldig att ta hänsyn till det etiska principerna under undersökningsprocessen. Detta innebär respekt och skydd av patientens integritet, autonomi samt inte orsaka skada och värna om patientens säkerhet (Ribeiro & Grodzinsky, 2010).
6
Bakgrund
Nervsystemet
Människans nervsystem brukar delas in i centrala nervsystemet (CNS), som består av hjärnan och ryggmärgen och perifera nervsystemet (PNS), som bland annat består av spinalnerver, och ett flertal kranialnerver. Detta arbete kommer enbart att omfatta n. medianus. Denna nerv ingår i PNS (Tortora & Derrickson, 2017).
Perifera nervsystemet kan delas in i två typer, somatiska och autonoma nervsystemet. Somatiska nervsystemet delas i sin tur i sensoriska och motoriska nervsystem. Det sensoriska nervsystemet förmedlar nervimpulser från receptorer till CNS. Motoriska nervsystemet förmedlar impulser från CNS till muskelfibrer (Tortora & Derrickson, 2017).
Nervvävnader består av två celltyper, gliaceller och neuroner. Gliaceller indelas i astrocyter, oligodendrocyter, schwannceller och mikroglia. Gliacellerna är cirka tio gånger fler än våra neuroner i kroppen och har till uppgift att stödja neuroner genom att ge näring åt dessa och skydda dem. De bidrar även till att forma och reglera nervcellssignaleringen (Tortora & Derrickson 2017).
Neuronen består av en cellkropp (soma), dendriter och axon. Dendriter leder information in till somat. Nervledningshastigheten beror på axonets diameter och myelinskidan. Axon delas in till två grupper, myeliniserade och omyeliniserade. Nervfibrer delas in i tre olika grupper A, B och C. Grupp-A är tjocka och myeliniserade fibrer, de i sin tur delas i under grupper Aa (A-alfa), Aβ (A- beta), Aγ (A- gamma) och Aδ (A- delta). Gruppindelningen beror på nervfiberns tjocklek och ledningshastighet. A- alfa är tjockast och har snabbast ledningshastighet medan A- delta är tunnast och har lägst ledningshastighet. B- gruppen är nervfibrer som är något tunnare än A-gruppen men är också myeliniserade. C- gruppen är tunnaste nervfibrer och är omyeliniserade (Fagius & Nyholm, 2013; Lännergren, Westerblad, Ulfendahl, & Lundeberg, 2017).
De grova axonen är myeliniserade och de tunna axonen är omyeliniserade. Tjockleken på axonet är det som avgör om ett axon ska vara myeliniserade eller inte. Grova axon har möjlighet att ha myelin, vilket sedan leder till att det går fortare att leda aktionspotentialen. Tunna axon skulle inte fungera med myelinskidor och därför kan de inte ha det. Myelinet har en viss längd och tjocklek. Tunna axon har högre resistens för att leda Na+ jämfört med grova axon. Därför kan tunna axon inte vara myeliniserade, eftersom det blir svårare att leda Na+. Detta kommer att leda till en långsammare aktionspotential vid myelinisering av tunna axon, medan grova axon har förmåga att leda Na+ lättare längst axonet då det har lägre resistens (Tortora & Derrickson 2017).
Genom ett stort antal receptorer sänds sensoriska nervimpulser, dessa impulser registrerar tillståndet i och utanför kroppen. Afferenta (inåtledande) axon är sensoriska och leder signaler från kroppens sinnesorgan till CNS, där det sker omkoppling av signaler som sedan fortlöper vidare till hjärnan där
7
det sker en tolkning av dessa signaler (Lännergren, Westerblad, Ulfendahl, & Lundeberg, 2017). Information som skickas kan vara värme, kyla, tryck, beröring med mera, som omvandlas till elektriska signaler, där varje receptor är specifik för en typ av retning. Exempelvis termoreceptorer i huden reagerar just för värme och/eller kyla men inte för tryck eller beröring (Fagius & Nyholm, 2013; Tortora & Derrickson 2017).
I myeliniserade axon kan ledningshastigheten komma upp till ca 100 m/s. Detta beror bland annat på att myelinskidan isolerar axonets elektricitet och att läckaget av positiva laddningar blir mycket mindre. Den lokala strömmen i axonet har därmed betydligt större räckvidd än i ett omyeliniserade axon, vilket gör att aktionspotentialen leds snabbare till nervens andra ände (Lännergren, Westerblad, Ulfendahl, & Lundeberg, 2017). Däremot sker i ett myeliniserade axon läckage av en positiv laddning vid noderna och en svag ström kan depolarisera dessa membranområden tills tröskelvärdet uppnås. Natriumjoner strömmar in i axonet genom spänningssttyrda kanaler. Nervimpulsen kommer att hoppa från en nod till nästa nod (Nicolaysen & Holck, 2014).
Aktionspotential
Alla celler i kroppen är negativt laddade på grund av att antalet elektroner i intracellulära och extracellulära vätskan skiljer sig åt. Koncentrationen av natriumjoner (Na+) och kloridjoner (Cl-) är höga extracellulärt och låga intracellulärt, medan förhållandet för kaliumjoner (K+) är det omvända. Diffusion strävar efter att utjämna skillnaden i koncentration. Cellmembranets permeabilitetsegenskap gör att i vila är membranet genomsläppligt för kaliumjoner på grund av att kaliumkanaler är mer öppna än natriumkanaler. Därför läcker det fler K+ ut ur cellen än det läcker Na+ in i cellen. Det här skapar en spänningsskillnad, membranpotentialen. Potentialen balanseras av inflöde och utflöde av kalium. Då cellen är i vila, det vill säga då den inte utsätts för några stimuli uppstår det som kallas
vilomembranpotential på -70mV (Figur 1). Ett stimuli öppnar Na+ kanaler och Na+ joner diffunderar in
i cellen och förändrar membranpotentialen så att insidans negativitet minskar, depolarisering. Vid ett visst värde (ofta ca -55mV) öppnas spänningskänsliga Na+- kanaler och fler Na+ rusar in i cellen. Därmed minskar spänningen över cellmembranet, nervcellen depolariseras (Figur 1). På grund av att spänningen förändras (ofta ca +3omV) kommer kaliumkanaler snabbt öppnas och Na+ kanalerna stängs. Därmed diffunderar mer K+ ut ur cellen. Resultatet av full öppning av kaliumkanalerna samtidigt som natriumkanalerna stängs är att det strömmar tillräckligt mycket K+ ut ur cellen för att vilomembranpotentialen ska återupprättas, repolarisering (Figur 1). Under repolarisering går även membranpotentialen längre ner än vilomembranpotentialen, detta kallas hyperpolarisering (Figur 1). Detta beror på att K+ kanalerna är långsammare på att stänga och då fortsätter K+ strömmar ut ur cellen. Vid ca -80mV stängs K+ kanalerna och membranpotentialen återställs till ursprungligt läge. Natrium/Kalium-pumpar transporterar Na+ joner tillbaka till utsidan och K+ joner tillbaka till insidan av cellen (Nicolaysen & Holck, 2014; Tortora & Derrickson, 2017).
8
Figur 1. Aktionspotentialen ” nervimpulsen” utgörs av en snabb depolarisation - repolarisation av membranpotentialen. Stimulering av neuronet öppnar Na-kanaler och om stimuleringen är tillräcklig och når tröskelvärdet, sker depolarisation av cellen. Därefter, samtidigt som natriumkanalerna stängs, öppnas kaliumkanaler vilket leder till utströmning av kalium från cellen. Detta leder till en hyperpolarisering. Vilomembranpotentialen återställs av Na/K-pumpar.
Nervus medianus
Nervflätan som utgår från C5–T1 heter plexus brachialis och innerverar övre extremiteter och de flesta av nack- och axelmusklerna. Från denna nervfläta utgår n. axillaris, n. musculocutaneus, n. radialis, n. medianus och n. ulnaris. Nervus medinus är en viktig nerv i handen och är en blandad sensorisk – motorisk nerv som ger känsel i handens greppyta (större delen av handflatan, tumme, pekfinger, långfinger och halva ringfingret) samt ovansidan av motsvarande fingertoppar. Nervus medianus innerverar också motoriskt större delen av tenarmuskulaturen. Nerven grenar sig till två nerver n.digitales palmares communes och nn. Digitales palmares propriae. Nervus digitales palmares communes innerverar tummen (dig-I) medan nn. digitales palmares propriae innerverar pekfingret (dig-II). Nervus digitales palmares communes innerverar dessutom lång- och ringfingret (dig-III- dig IV). Nervus medianus innerverar de flesta flexormusklerna och handflatan (Lundborg & Björkman, 2015; Tortora & Derrickson, 2017). En medianusnervskada ger därmed känselbortfall inom större delen av handens greppyta samt bortfall eller nedsättning av oppositionsförmåga, en undersökningsmetod som används för att utvärdera funktion av handen (McPhee,1987). Genom att undersöka n. medianus vid elektroneurografiundersökning kan en rad neurologiska sjukdomar diagnostiseras (Andersson, Jeppsson & Rydholm, 2012; Kane & Oware, 2012).
9
Patologi
Den vanligaste sjukdom som förkommer vid skada på n. medianus är karpaltunnelsyndrom (Grefberg, 2013). Karpaltunneln är en kanal anteriort vid handleden och där igenom löper n. medianus. Pålagringar och svullnader i kanalen kan orsaka tryckskada på nerven vilket kan försämra funktionen (Grefberg, 2013). Vid trauma, rygg- och handskador uppstår det ett ökat tryck mot nerven och detta leder till en försämrad nervfunktion. Vid måttligt och kortvarigt tryck mot nerven sker det en lätt demyelinisering av myelinet runt nervtråden. Däremot så är axonet intakt, detta gör att funktionen fullständigt kan återställas inom några veckor. Om trycket varar längre och är kraftigare mot nerven, kan det även orsaka en skada på axonet. Vid trauma där nerven slits av är läkningsförmågan dålig. Nerven kan återställas fullständigt men det tar mycket lång tid (Grefberg, 2013). Karpaltunnelsyndrom uppkommer i 47 % av fallen som idiopatisk men kan även uppstå av inflammation (Lännergren, Westerblad, Ulfendahl, & Lundeberg, 2017). Det finns vissa sjukdomar som kan ge en ökad risk att utveckla karpaltunnelsyndrom, till exempel diabetes mellitus (Keri, Kles1, & Aaron, 2006), hypotyreos, reumatism och lymfödem (Grefberg, 2013). Karpaltunnelsyndrom kan även utvecklas av vissa arbeten, där individen utsätts under en längre tid för en ökad belastning av handleden/handen med till exempel vibrerande verktyg eller belastning av handledleden (Cakir, 2003; Grefberg, 2013; Tortora & Derrickson, 2017). Vanligtvis drabbas fler kvinnor än män av karpaltunnelsyndrom. Karpaltunnelsyndrom kan även förekomma hos kvinnor under graviditeten, men efter förlossningen går oftast symtomen tillbaka (Lundborg & Björkman, 2015). Symtomen börjar oftast med domningar och svaghet i handen, som sedan kan sprida sig genom hela armen och upp till axeln (Fagius & Nyholm, 2013; Grefberg, 2013; Norrving, 2015).
Perifera nerver såsom n. medianus, kan drabbas i samband med polyneuropati. Det finns flera olika orsaker till polyneuropati, den vanligaste orsaken till sjukdomen är diabetes mellitus (Keri, Kles1, & Aaron, 2006). Men det finns även andra viktiga orsaker till perifer polyneuropati, såsom näringsbrist, alkoholism, systemisk sjukdom och exponering för toxiner. Några vanliga symtom på polyneuropati är svaghet, domningar, stickningar och förlust av känsel. Symtomen är vanligtvis symmetriska och påverkar händer och fötter (Jonson & Wollmer, 2011). Polyneuropati är en heterogen sjukdomsgrupp som medför en symmetrisk, oftast distal, funktionsnedsättning i de perifera nerverna (Morris, 2013).
Sensorisk nervledningshastighet vid elektroneurografi undersökning
Elektroneurografi är en noninvasiv undersökningsmetod som används för att bedöma funktion både i motoriska och sensoriska nerver i PNS. Detta görs genom att placera en elektrod på hudytan och sedan stimulera nerven med en elektrisk impuls. Om stimuleringen är tillräckligt kraftig kommer axonet att depolariseras och en aktionspotential genereras. Depolarisationsvågen registreras med en annan elektrod från en annan punkt. Vid sensorisk neurografi används stimulationsstyrkor som är lägre (oftast mellan 10 och 20 mA) än vid motorisk neurografi. Det vill säga vid stimulering av den motoriska nerven10
sker en maximal stimulering där amplituden inte längre ökar. Svaret av stimuleringen mäts därefter ifrån musklerna (Katirji, 2007; Kane & Oware, 2012).
Vanliga parametrar vid sensorisk aktionspotential (sensory neuron action potential; SNAP) är sensorisk ledningshastighet (sensory conduction velocity; SCV), distala latens (DL) och amplitud. Ledningshastigheten beskriver hur fort en nervimpuls färdas genom ett axon. Detta kräver stimulering på en enda plats eftersom latensen endast består av nervledningstiden från stimuleringspunkten (katoden) till registreringselektroden. För att beräkna ledningshastigheten mäts latensen mellan stimulansen och reaktionens början (Katirji, 2007; Whittaker, 2012). Den distala latensen mäts från stimulusartefakt till början av SNAP (Figur 2). I början av SNAP kan det observeras en bakgrundsstörning och vågig baslinje vid en chockartefakt. Bakgrundsstörningar kan leda till att latens inte reflekterar de snabbaste sensoriska fibrerna. Bakgrundstörningen kan lätt definieras jämfört med startlatens (Katirji, 2007).
I figur 2 syns distal latensen 2,66 millisekund (ms), medan avståndet är 145 millimeter (mm), så ledningshastigheten är 54,6 meter/sekund (m/s) (Figur 2). Ledningshastigheten är central för att särskilja en axonal från en fokal demyelinseringsneuropati. Ledningshastigheten kan sjunka vid en axonal neuropati eftersom de större, snabbaste ledningsfibrerna går förlorade, men hastigheten är aldrig lägre än 70% av normalvärdet. Följaktligen kan en hastighet så låg som 35 m/s i de övre extremiteterna och 28 m/s i de nedre extremiteterna orsakas av enbart axonal förlust. Ledningshastigheter under dessa värden indikerar en demyelinisering av axon. Ledningshastighet är också grundläggande för att lokalisera platser för nervkomprimering eftersom den resulterande fokala demyelinisering orsakar en minskning av ledningshastigheten i det drabbade segmentet. I karpaltunnelsyndrom exempelvis, är den första förändringen långsammare än vanligt i medianusnervens fibrer över handleden. Det sker ofta innan det sker någon minskning av amplituden (Katirji, 2007).
Sensorisk amplitud är ett mått på antalet sensoriska axon som leder mellan stimulerings- och registreringsplatserna (Katirji, 2007; Kane & Oware, 2012). Vanligtvis beräknas den från baslinjen eller från den initiala positiva toppen (om den är närvarande) till den negativa toppen (baslinje till toppamplitud) (Katirji, 2007) (Figur 2). I figur 2 syns det att SNAP amplituden var 33,9 mikrovolt (µV) vid handleden.
I en blandad sensorisk och motorisk nerv i övre extremiteter är nervledningshastigheten ca: 50 m/s och i nedre extremiteter ca: 40 m/s (Whittaker, 2012). Vid skador eller sjukdomstillstånd, antingen generellt eller lokalt, påverkas neurografiparametrarna. Då används ENeG för att påvisa, lokalisera, gradera samt karakterisera nervskadan (Kane & Oware, 2012). Om antalet fungerande nervfibrer är reducerat, på grund av degeneration av alfa-motorneuron eller direkt axonal skada, syns ofta en reducerad amplitud av nerv- och muskelpotentialerna. Många sjukdomar kan även ge upphov till demyelinisering, där reducerade ledningshastigheter i nerven eller förekomst av konduktionsblockeringar kan iakttas.
11
Amplituden kan minska samtidigt som potentialen blir längre och bredare (temporal dispertion) (Whittaker, 2012).
Figur 2. figuren visar den sensoriska distala latenstiden och antalet nerver (amplitud) vid en sensorisk elektroneurografi (ENeG) registrering. Observera den distal latensen mäts från stimulusartifakt till början av sensorisk aktionspotential (SNAP). Amplituden beräknas vanligtvis från den initiala positiva toppen till den negativa toppen. Den högra bilden i tabellen visar nervus medianus mätning och det registrerade på amplitud, nervledningshastighet och distal latens på dig- III.
Artefakter
En sensorisk ENeG-undersökning är känslig för artefakter och svaren kan bli svårtolkade. De vanliga artefaktfaktorerna är stimuleringartefakter, chockartefakter och strömartefakter. Vid ökning av stimuleringsstyrka kan signalen bli svårtolkad (Katirji, 2007; Caress, 2007; Jonson & Wollmer, 2011). Spridning av överskottsström längs huden och djupare vävnader resulterar i en stimuliartefakt, eftersom en ökad stimuleringsstyrka vid SNAP kan leda till ökade stimuleringsartefakter. En sådan artefakt kan dölja potentialer med mycket korta latenser, särskilt fingrar eller handflatan-till-handledsregistreringar. Chockartefakterär en vanlig artefakt vid sensorisk ENeG-undersökning som gör det svårt att bestämma starten på svaret. Vid sensorisk elektromikrografi registreras endast svar från de stora, myeliniserade fibrerna. Även om de små, omyeliniserade fibrerna också är stimulerade, är deras ledningshastigheter så varierande att responsen av svaren försvinner till den punkten som inte går att urskilja dem från baslinjen. Så att skicka patienter till ENeG- undersökning för att utesluta tunnfiberneuropati är svårt (Whittaker, 2012). Sensoriska svar är små, och då är det viktigt att ta ett genomsnittsvärde på detta genom att samla in flera svar för SNAP. Genom att insamla ett genomsnittsvärde av SNAP reduceras artefakter och en tydligare svar registreras (Katirji, 2007; Whittaker, 2012).
12
Påverkan av elektroneurografiparametrar i samband med
temperaturförändring på huden
Kyla fördröjer inaktiveringen av natriumkanalerna, vilket förlänger depolariseringstiden, vilket i sin tur kan påverka distala latenser och ge långsamma ledningshastigheter (Rutkove, Kothari, Shefner, & Rutkove, 1997; Rutkove, 2001; Herrera, Sandoval, Camargo, & Salvini, 2010; Gavanozi, Veltsista, Polychronopoulos, & Chroni, 2020). Både motoriska och sensoriska nerver påverkas av låga temperaturer, men sensoriska nervledningar är mer känsliga för temperaturförändring (Whittaker, 2012; Caress, 2007, Herrera, Sandoval, M., Camargo, & Salvini, 2010). Den rekommenderade hudtemperaturen vid ENeG-undersökning är 33 till 34 °C under hela undersökningen. Detta är särskilt viktigt vid repetitiva stimuleringsstudier, det vill säga sjukdomar i neuromuskulär övergång såsom myastenia gravis. Neurofysiologiska avdelningar använder 31 - 34°C som arbetstemperatur. Om temperaturen sjunker med en °C minskar nervledningshastigheten med 1,5–2,5 m/s medan distala latensen ökar med 0,3 ms/°C (Kane & Oware, 2012; Caress, 2007; Burnham & Burnham, 2009). Hudtemperatur kan mätas med hjälp av en ytelektrod på handryggen. Det är viktigt att bibehålla denna temperatur under hela undersökningen, eventuellt genom att värma vid behov för att undvika feltolkningar. Uppvärmningen kan ske med hjälp av värmefilt eller värmedyna. Om denna måltemperatur inte är omöjlig eller för svår att uppnå, kan en korrektionsfaktor på 1,5 till 2,5 m/s/°C för SCV och 0,3 ms/°C för DL användas vid en ENeG- undersökning (Kane & Oware, 2012; Rutkove, 2001; Morris, 2013).
Om det inte går att uppnå mer än 32°C vid en ENeG- undersökning kan en enkel matematisk ekvation användas för korrektion av SCV och DL på övre extremitet enligt följande (Halar, DeLisa, & Brozovich, 1981);
SCV2 = 𝐾𝑜𝑟𝑟𝑒𝑘𝑡𝑖𝑜𝑛𝑓𝑎𝑘𝑡𝑜𝑟 (𝑚
𝑠) x |32 − hudtemp. (°C) | + SCV1
där SCV2 är den korrigerade nervledningshastighet och SCV1visar hastigheten innan det korrigeras DL2 = (𝐾𝑜𝑟𝑟𝑒𝑘𝑡𝑖𝑜𝑛𝑓𝑎𝑘𝑡𝑜𝑟 (𝑚𝑠))x |32 − hudtemp. (°C) | + DL1
där DL2 är den korrigerade distala latensen och DL1 visar distala latensen innan det korrigeras
Den biomedicinska analytikerns roll
Biomedicinska analytiker är specialister inom olika undersöknings- och analysmetoder samt har en viktig roll för patientsäkerheten och kvalitén. De är ansvariga, utifrån sina kunskaper och kompetens, för att bidra till välbefinnande, hälsa och samhälles utveckling (Institutet för biomedicinsk laboratorievetenskap, IBL, och Vårdförbund, 1996). Elektroneurografi är en undersökningsmetod som utförs vid en neurofysiologisk klinik på regionsjukhus och vissa länssjukhus. Undersökningsmetoden
13
räknas till laboratoriedisciplin då undersökningen analyserar kroppens nerver. En biomedicinsk analytiker kan ha utbildning med inriktning inom klinisk fysiologi vilket ger BMA behörighet att arbeta inom neurofysiologisk klinik (Persson & Wilhelmsson, 2008; Jonson & Wollmer, 2011). En elektroneurografisk undersökning är den vanligaste undersökningen inom en neurofysiologisk verksamhet, som utförs av en biomedicinsk analytiker (Persson & Wilhelmsson, 2008). Biomedicinsk analytiker utför ENeG-registreringar, utifrån ENeG-undersökningsmetoden, som senare kommer att tolkas av en neurofysiologisk specialist (Jonson & Wollmer, 2011). Biomedicinsk analytiker utför undersökningen självständigt vilket innebär ett stort krav på kunskap och utförande av undersökningen (Persson & Wilhelmsson, 2008).Under undersökningen är BMA ansvarig för att ta hänsyn till de etiska principerna som innebär att respektera och skydda patientens integritet, autonomi och inte orsaka skada samt värna om patientens säkerhet (Ribeiro & Grodzinsky, 2010).
Problemformulering
Elektroneurografi är en undersökningsmetod som ingår i arbetet för en BMA med inriktning inom klinisk fysiologi (Bjuväng, Kjellberg, Rehle, & Åkesson, 2014). Undersökningsmetoden bygger på att nerven leder elektriska signaler. Detta sker genom att utsätta nerven med en starkare och mer kontrollerad ström som överstiger kroppens egen aktionspotential som produceras med en stimuleringselektrod (Whittaker, 2012). Nervledningshastigheten påverkas av temperaturförändring (Burnham & Burnham, 2009). När nerven utsätts för kyla sker en kraftigare och förlängd depolarisering vilket leder till att SCV sänks med mellan 1,5–2,5 m/s/ grad Celcius. Kylan leder även till en förlängd latens och ökat svar på nervens amplitud och duration. Nervens ledningsförmåga blir långsammare vid en hudtemperatur som ligger under 31 grader (Morris, 2013; Kasius, Riphagen, Verhagen, & Meulstee,
2014). Därför rekommenderas att huden värms upp och hålls varm vid utförandet av undersökningen.
Att uppnå den önskade hudtemperaturen på vissa patienter kan vara svårt vilket kan leda till underdiagnostik av dessa patienter. Eftersom vissa sjukdomar diagnostiseras med hjälp av amplitud, DL och SCV är det viktigt att hålla extremiteterna tillräckligt varma under undersökningsprocessen (Morris, 2013; Kasius, Riphagen, Verhagen, & Meulstee, 2014). Enligt tidigare studie har värmeökning på friska individer bekräftat den nervledningshastighet som behövs för att kunna sätta rätt diagnostik (Gavanozi, Veltsista, Polychronopoulos & Chroni, 2020). Men även har det visat sig att temperatursänkningen på friska individer ger en långsammare nervledningshastighet (Burnham & Burnham, 2009; Gavanozi, Veltsista, Polychronopoulos & Chroni,2020).
Genom att successivt öka temperaturintervall kan undersökas hur nervens ledningshastighet påverkas. Enligt den kliniska handledaren (specialist inom neurofysiologi i sjukhuset Ryhov) kan BMA ibland underskatta vikten av rätt temperatur vid undersökningsprocessen. Enligt den yrkesetiska kodex som finns inom BMA-yrket har biomedicinska analytikern ett ansvar till att förbättra och utveckla folkhälsan globalt. Detta genom att utveckla befintliga metoder samt följa ny forskning (Ribeiro & Grodzinsky, 2010). Därför viktigt att undersöka hur temperaturförändring kan påverka nervens ledningshastighet.
14
Detta medför en ökad kunskap och förståelse för BMA om vikten att hålla rätt temperatur under utförande av undersökningen för att ställa rätt diagnos.
15
Syfte
Syftet med den här studien är att redogöra för hur den sensoriska nervledningshastigheten, den distala latensen och amplituden i n. medianus påverkas vid temperaturförändringar på handryggen från 26 till 33 °C.
16
Material och metod
Urval av deltagare
Studien omfattade 19 deltagare, 9 kvinnor och 10 män i åldersgruppen 20–40 år. Medelålder var 29 ± 6 år och 167± 5 cm längd. Individer över 40 års ålder har exkluderats eftersom åldrandet kan påverka nervfunktionen (Palve & Palve, 2018). I studien inkluderades endast frivilliga personer och deltagare med kända hand- eller ryggskador uteslöts. Kända nervsjukdomar som kan påverka nervledningshastighet är karpaltunnelsyndrom (Burnham & Burnham, 2009), polyneuropati (Kane & Oware, 2012), diabetes (Cameron & Cotter, 2001; Keri, Kles1 & Aaron, 2006; Katsuda et al., 2015), njursjukdomar och sköldkörtelsjukdomar (Cakir, Samanci, Balci, & Balci, 2003). Information gällande deltagarens hälsotillstånd insamlades genom ett frågeformulär. Detta frågeformulär tillsammans med samtyckesblankett utdelades till alla deltagare innan undersökningstillfället. En skriftlig informations samtycke erhölls av alla deltagare och etisk egengranskning genomfördes (bilaga 1 och bilaga 2). En muntlig fråga angående om pacemaker ställde till samtliga deltagare. Alla deltagare undersöktes på samma klinik samt enligt samma elektrodiagnostiska testprotokoll.
Utrustning
De elektroneurografiska undersökningarna utfördes med Carefusion Nicolet EDX® (Natus USA) med filterinställning 20Hz - 1,5kHz och en svephastighet på 1 ms/division. Pulsduration var 0,2 ms och stimuleringsfrekvens och stimuleringsstyrka var 2 Hz respektive mellan 0 – 100 mA. Material som användes i studien var stimuleringselektrod, registreringselektrod, jordelektrod, termometerelektrod, display (skärm), måttband, markeringspenna, värmedyna (Andersson STW 2.0 med 42 x 31 cm storlek), kallt vatten, bomullstussar (fästes på registreringselektroden). Tejp användes för att fästa lösa elektroder.
Metod
Elektrod placeringen och nervstimuleringen som utfördes i denna studie bygger på metoden som används i länssjukhuset Ryhov. Sensorisk nervledningshastighet och amplitud registreras i ortodromriktning i handledsnivå över nerven (Mallik & Weir, 2005; Katirji, 2007). I den här studien stimulerades n.medianus vid dig-III. Temperatur mättes med en termometer som fästes med tejp ovanför corpus ossis metacarpale, proximalt om dig-III. Temperaturmätaren kopplades precis innan stimuleringsutförandet och var påkopplad under stimuleringen. Detta gjords för att kunna kontrollera att temperaturen låg i det önskade temperaturintervallet. Ringelektroder (aktiv och referenselektrod) placerades runt dig-III där aktivelektroden(katod) placerades på mediala falangen och referenselektroden (anod) på distala falangen runt dig-III. Enligt rekommendationen med och Jonson
17
& Wollmer (2011) och Norrving (2015) placerades jordelektroden mellan katoden (stimuleringselektroden)- och registreringsringselektroden. I denna studie registrerades nervsvaret med registreringelektrod som placerades på handleden där n. medianus löper. Det minsta avståndet mellan stimulatorn och den aktiva elektroden ska vara 14 cm (Figur 3) enligt metodbeskrivning i Mallik & Weir (2005); Jonson & Wollmer, 2011; Norrving (2015). Precis innan stimulering utförandet förflyttades alla strömkällor ca. 1,5 meter bort från undersökning apparaten, vilket skulle annars medföra en strömartefakt. Stimuleringen av nerven utfördes på höger arm. Undersökningen utfördes med deltagarna i sittande läge med armen vilande på ett armstöd. Handflatan och fingrarna riktades uppåt i avslappnat läge. För att identifiera nerven startades stimuleringen med 5 mA och sedan ökades styrkan upp till 15 mA. Sensorisk n. medianus i dig III stimulerades med en stimuleringsstyrka på 15 mA och med en pulsduration på 0,2 ms. Enligt Länssjukhuset Ryhovs metodbeskrivning vid SNAP-undersökning samlades nervsvaret av åtta stimuleringar och därefter togs ett medelvärde. Insamlingen av medelvärdet på nervsvaret skedde automatiskt genom ENeG- undersökningsapparaten men krävde att undersökaren aktiverade ”AVR” knappen på apparaten. Mätningen gjordes vid tre olika temperaturintervall i följande ordning: kall 26–27° C, ljummen 29–30°C och varm 32–33°C. Uppvärmning av handen genomfördes i 10–15 minuter före varje temperaturintervall. I studien uppvärmdes handen i genomsnitt 10–15 minuter innan varje mätning genomfördes vid den önskade temperaturen. Mellan uppvärmningsmomenten kopplades alla elektroder av. Undersökningen startade med att försökspersonens högra hand kyldes ned under kallvatten till under 24 grader. Sedan uppvärmdes handen i ca 10–15 minuter med en värmedyna tills den uppnådde den önskade temperaturen (26–27 °C). Sedan togs värmedynan bort och en stimulering utfördes samt registrering av nervsvar. För att registrera den andra och tredje mätningen vid temperatur 29 - 30°C respektive 32– 33 °C upprepades proceduren igen enligt ovanstående. Alla elektroder kopplades av från handen mellan uppvärmningsmomenten.
Figur 3. Nervus medianus (dig III) sensorisk ortodrom ringstimulering (notera att den gröna är jordelektrod och temperaturmätaren på handryggen är grå, den svarta är stimuleringselektrod eller katoden, den röda är referenselektroden eller anoden och den vita är registreringselektroden). Avståndet mellan stimulering- och registreringselektroden bör vara minst 14 cm. Jordelektroden placeras mellan katoden och registreringselektroden. Bilden är tagna av författarna.
18
Statistisk analys
Statistiska analyser utfördes med SPSS statistics 26 för dataanalys (IBM, Kista, Sverige). För att kunna se om det finns ett signifikant samband i SCV, DL och amplitud mellan de olika temperaturområdena gjordes ett Kruskal-Wallis test (icke-parametriskt). Ett p-värde <0.05 ansågs vara statistiskt signifikant. För att kunna se sambandet i de två variablerna genomfördes korrelationstester. I korrelationtestet presenterades informationen med Spearman's rho test som visade på om det fanns samband mellan variablerna och för att statistiskt beräkna om ett signifikant samband av SCV, DL och amplitud för temperaturförändringar förekom mellan de olika hudtemperaturerna. Detta gjordes med en parvis observation, dvs. för varje observation fanns två mätvärden. De registrerade värdena av temperaturförändring med andra parametrar som SCV, DL och amplitud presenterades som korrelationskoefficient (-1 ≤ r ≤ 1) och signifikant värde (p≤0.05). Korrelationskoefficient anger sambandets styrka mellan två variabler och lutning (Ejlertsson, 2019).
Etiska överväganden
Författarna fick ett godkännande från varje deltagare. Information angående studien samt deltagarnas rättighet gavs både muntligt och skriftligt (Bilaga 2). Den etiska principen som togs hänsyn till under arbetet var den autonoma principen, vilket innebär att deltagarna själva bestämde om de ville delta i studien. För att bestämma sig fick varje deltagare tydlig information om arbetet, hur undersökningen går till samt vilka upplevelser som kan förekomma vid elektrisk stimulering på handen via elektroder. De fick informationen om att de kunde avbryta undersökningen eller dra sig ur studien när som helst. Det var viktigt att respektera deltagarnas åsikt och vilja, så att de inte blev tvingade eller övertalade (Stafström 2017). Personuppgifter som identifierar deltagarna hanterades eller sparades inte i undersökningen utan information som användes i undersökningen (kön, längd och ålder på deltagarna), kodades. Uppgifter om enskilda individer förs inte vidare utan de uppgifter som inte behövs längre har tagits bort (Hermerén, 1996).
Även om ENeG- undersökning anses vara en riskfri undersökning, möjligen med undantag för patienter med defibrillatorer där högfrekventa strömstötar kan orsaka ventrikulär takykardi (Whittaker, 2012). I denna studie förekom varken högfrekventa strömstötar eller försökspersoner med pacemaker och denna information togs muntligt innan undersökningen på börjades. Att öka temperaturen till 33°C kan hos vissa deltagare ge en obehagskänsla eller rodnad på handen. Att kyla ner handen och handleden kan upplevas som smärtsamt för visa individer, men eftersom hudtemperaturen inte understiger 22 °C bedömdes risken för köldskador som minimal (DiPasquale, Kolkhorst, & Buono, 2015). Dessutom fick försökspersonerna kyla ner handen i sin egen takt och avbryta i korta perioder vid behov. Vid elektroneurografiundersökning upplever patienter den elektriska elstöten på olika sätt, vissa upplever obehag medan andra inte känner av den alls. Undersökningen orsakar definitivt ingen skada för deltagaren, men om deltagaren upplever att det är jobbigt eller obehagligt hade denne möjlighet att avbryta undersökningen omedelbart.
19
Det är vanligt att nervledningshastigheten hamnar under 40 m/s när hudtemperaturen ligger under 27 grader. Innan insamling av data från försökspersoner påbörjade så beslutades att om datainsamling för en individ avviker och är misstänkt patologisk ska deltagaren tillfrågas om hen upplever några typiska symtom som kan relateras till nervsjukdomar, exempelvis domningar, stickningar i benen eller handen (Keri, Kles1, & Aaron, 2006). Vid bekräftade symtom och/eller avvikande mätning rekommenderas deltagaren att uppsöka sjukvården för ytterligare utredning.
20
Resultat
Tabell 1 presenterar insamlade data som visar medianen av de tre temperaturintervallerna kall, ljummen och varm. Resultatet visade att SCV ökade i samband med ökat temperaturintervall och DL minskade vid ökad temperatur. Det icke-parametriska testet Kruskal-Wallis Test genomfördes på variablerna SCV, DL och amplitud inom faktorerna kall, ljummen och varm. Testet visade att variablerna SCV och DL har en statistik signifikant samband (p <0.001) mellan temperaturskalorna, vilket bekräftar att det finns ett samband mellan dessa två variablerna i samband med temperaturförändring. När det gäller variabeln amplitud visades inget statistiskt samband (p=0. 817).
Tabell 1. Nervledningshastighet (SCV), distala latens (DL) och amplitud i förhållande till temperaturintervall.
Temperaturintervall [0C]
SCV [m/s] Distal latens [ms] Amplitud [µV] Median (kvartilavstånd) Median (Kvartilavstånd) Median (Kvartilavstånd) 26- 27 (kall) 45,6 (10) 3,23 (0,81) 14,8 (11,6) 29-30 (ljummen) 50,7 (7,6) 2,81 (0,52) 16,1 (11,5) 32-33 (varm) 53 (7,1) 2,76 (0,42) 15,2 (6,8)
Samband mellan temperatur och distal latens
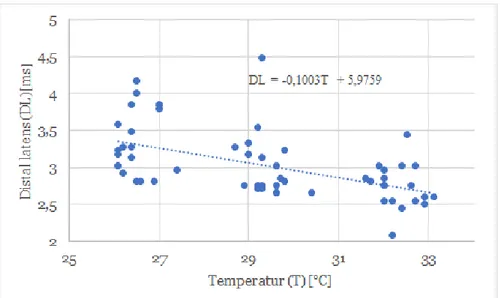
Korrelation mellan temperatur och DL (Spearman´s rho test) visade på ett signifikant samband (p<0.001). Ett negativt samband med 99% (r=-0,599) säkerhet visar att det finns korrelation mellan temperatur och distal latens. Sambandet mellan temperatur och distal latens kan uppskattas med en matematisk ekvation DL(T)= -0,1003 × T + 5,9759, där T är temperaturen i °C.
21
Figur 4. Sensorisk nervledningshastighet uppmättes vid tre temperaturintervaller; kall (26–27°C), ljummen (29–30°C) och varm (32–33°C). Grafen visar ett starkt negativ samband mellan distal latens (DL) och temperatur, dvs att vid temperaturökning minskar den distal latensen.
Samband mellan temperatur och nervledningshastighet
Sambandet mellan SCV och temperatur visade ett signifikant samband (p<0.001) i SCV mellan de olika temperaturintervallen. Testet visade med 99% säkerhet (r=0 ,645) att det finns ett
samband mellan SCV och temperatur. Det positiva lineära förhållandet mellan temperatur och nervledningshastighet kan beskriva med en matematisk ekvation SCV(T)=1,6088 × T+ 2, 2714, där T är temperatur i °C.
Figur 5. Grafen illustrerar ett samband mellan sensorisk nervledningshastighet (SCV) och temperatur som visar att det finns en stark korrelation mellan de variablerna, när temperaturen ökar på handen ökar nervledningshastigheten också.
22
Samband mellan temperatur och amplitud
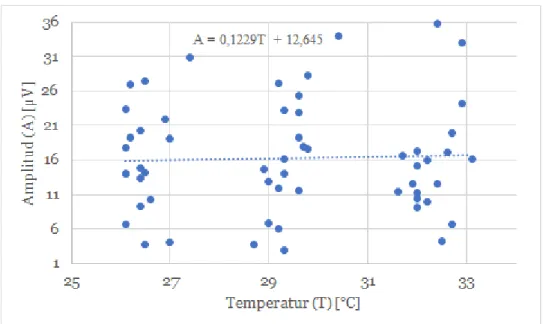
Studiens undersökning visar ingen signifikant samband mellan temperatur och amplitud (Figur 6).
23
Diskussion
Syftet med denna studie var att studera hur temperaturen påverkar SCV, DL och amplitud vid ENeG-undersökning. Nervledningsundersökning genomförs för att bedöma det neuromuskulära systemet (Kane & Oware, 2012; Preston & Comte 2013). Detta innebär att karakterisera en nervskada exempelvis vid axonal förlust eller demyelinisering, lokaliserar skadan och bestämmer sjukdomens svårighetsgrad (Jha, Shamra, Nepal & Bade 2017). Nervus medianus undersöks oftast för att diagnostisera CTS och polyneuropati (Kane & Oware, 2012; Grefberg, 2013).
Metoddiskussion
I denna studie deltog totalt 19 individer (9 kvinnor och 10 män). Könsfördelningen blev nästan jämnfördelad med en spridning över den inkluderade åldersgruppen 20–40 år. På grund av begränsad tid studerades inte sambandet mellan ENeG-parametrarna (SCV, DL och amplitud) och längd, kön samt ålder.
Författarna gjorde en etisk granskning som skickades till handledaren för bedömning. Elektroneurografiundersökning är en icke-invasiv undersökning som anses vara en riskfri. Därmed undersökningen har inga kontraindikationer. Av den anledning besvarades delfråga fyra som berörde ämnet om fysisk och psykisk påverkan på deltagare på etisk granskning, som ”nej” (bilaga 1). Bedömning gjordes tillsammans med handledaren under projektplanarbetet. Denna bedömning kan dock ifrågasättas då undersökningsmetoden innebär att nerver stimuleras och därmed utsätts försökspersonen för en fysisk påverkan. Som konsekvens av detta har vi varit mycket tydliga med information till deltagarna om undersökningsprocessen samt om eventuella upplevelser av undersökningen (vid el-stöt, nedkylning och uppvärmning). Undersökningen utfördes först efter att deltagarna fick information och samtyckte till deltagandet. Detta genom att deltagarna hade rätten till att neka/avbryta deltagandet i studien och att författarna skulle ta hänsyn/respektera deltagarnas integritet och autonomi.
I studien exkluderades individer med kända sjukdomar och traumaskador som kan påverka nervfunktionen och dessutom exkluderades även vissa åldersgrupp (deltagare under 20 år och över 40 år). Detta beror på att vissa sjukdomar, traumaskador och ålder har direkt eller indirekt påverkan på nerver. Enligt tidigare studier har åldern en påverkan på nervledningshastigheten (Caress, 2007; Morris, 2013; Palve & Palve, 2018). Ju äldre individen är desto långsammare blir nervledningshastigheten. I denna studie inkluderades individer mellan 20–40 års ålder. Anledningen till detta var att nervledningshastigheten förändras i samband med ålder. Det vill säga små barn redan vid 3–5 ålders har nervledningshastigheten kommit upp till vuxen nivå. Därefter både motorisk och sensorisk nervledningshastighet i armen ökar succesivt upp till 19 års ålder medan i benet så sker en minskning (Katirji, 2007). Nervledningshastigheten börjar dock reducera vid 40 års ålder (Palve & Palve, 2018; Katirji, 2007). Detta kan innebära att individen får försämrade sensoriska komponenter
24
såsom längre distal latens, mindre amplitud och långsammare ledningshastigheter (Palve & Palve, 2018). Sensoriska nervledningshastigheten i n. medianus försämras även av vissa sjukdomar och skador (Grefberg, 2013), Exempelvis brukar diabetes försämra funktionen i det perifera nervsystemet (Cameron & Cotter, 2001). Det uppstår förändringar i myelinskidorna och atrofier av axonen. Troligen uppstår det skador i de små blodkärl som försörjer nerverna, men även metabola förändringar i cellerna som kan leda till försämrad nervfunktion (Kane & Oware, 2012; Cameron & Cotter; 2001). Individer med sköldkörtelsjukdomar framförallt hypotyreos kan drabbas av störningar i rörelseapparaten. Detta leder till muskelsvaghet och långsammare reflexer hos dessa individer, men kan även orsak en försämrad nervfunktion (Grefberg, 2013; Cakir, 2003). Ett annat tillstånd som kan försämra nervfunktion är nedsatt njurfunktion. Onormala jonkoncentrationer i den extracellulära vätskan påverkar den elektriska aktiviteten hos nerv- och muskelceller, detta kan förekomma vid försämrad njurfunktion (Assadsangabi, Hajmomenian, Nabavizadeh, & Vossough, 2014; Tortora & Derrickson, 2017).
Individer med pacemaker inkluderades inte i studien, detta beror på att en hög elektrisk stöt kan generera ventrikeltakykardi. Informationen om pacemaker tillfrågades muntligt för alla deltagare innan undersökningen påbörjades. Detta på grund av en senare uppmärksamhet om vikten av frågeställningen, som inte fanns med i samtyckesblanketten, gällande pacemaker.
Validitet och reliabilitet har en stor vikt vid en kvantitativ mätning och analys. För att undersökningsmetoden, mätinstrumenten, olika mätvärden, parametrarna, undersökningen skall vara användbar. Den insamlade data ska vara pålitlig och inte variera slumpmässigt (Ejvegård, 2003). För att öka reliabiliteten har alla deltagare undersökts med samma utrustning och i samma klinik. Reliabilitet skulle även kunna förstärkas genom att mäta individerna flera gånger vid samma temperatur, vilket ej utfördes. Detta i syfte att bekräfta studiens resultat. Men eftersom undersökningsprocessen ger en negativ upplevelse för patienterna skulle det var påfrestande för patienter om det utförs en och samma tillfälle. En annan tanke kan vara att undersökningen utförs vid ett annat tillfälle och det skulle ses var tidskrävande för patienter samt anser inte finnas en mening med upprepning, ur patientens synvinkel, och utsätta sig för samma upplevelse. Därför ansågs upprepning av momenten inte lämplig.
För att öka validiteten i denna studie genomfördes undersökningen enligt länssjukhusen Ryhovs undersökningsmetodik (Caress, 2007; Jonson & Wollmer, 2011; Mallik & Weir, 2005; Norrving, 2015). Litteratursökning har även ökat validiteten genom att studera på vilket sätt felkällor och artefakter kan minimeras. Artefakt reducerades genom att begränsa stimuleringsstyrkan till 15 mA och att placera jordelektroden mellan stimulerings- och registreringselektroden (Burnham & Burnham, 2009). Avståndet ökades mellan stimuleringselektroden och registreringselektroden för att reducera risken för artefakt (Caress, 2007). Registreringen upprepades åtta gånger, i syfte att reducera risken för artefakt och uppnå ett tillförlitligt nervsvar, och ett medelvärde registrerades (Caress, 2007; Whittaker, 2012; Katirji, 2007). Strömartefakter minimerades genom att förflytta alla omgivande elektriska strömkällor till cirka 1,5 meters avstånd från ENeG-utrustningen. Risken för rörelseartefakter reducerades genom
25
att deltagarna fick sitta på en bekväm undersökningsstol med armstöd. Artefakter reducerades även genom att bomullstussar blöttes med kranvatten och sedan fästes på registreringelektroden. Stimuleringselektroderna och jordelektroderna blöttes med kranvatten för att få bättre kontakt med huden och på så sätt reducerades artefakter.
I denna studie mätes vad författarna avser att mäta, genom att använda en undersökningsmetod för att mäta alla deltagare. För att öka validiteten har alla deltagare mätts inom samma temperaturintervall och under samma uppvärmningstid. Författarna erhåller samma procedur för nedkylningen, uppvärmningen och stimulering. Författarna har strävat efter att upprätthålla en hög reliabilitet och validitet under hela studiens gång. Att mäta avstånd och använda markering vid instrumentplacering för att kunna placera elektroden i samma position vid nästa försökstillfälle kan öka trovärdigheten av resultat. Det är viktigt för amplituden att placera elektroden på rätt position, men genom att koppla av elektroderna inför varje uppvärmningsmoment kan det troligen orsaka låg validitet och därmed skulle det påverka amplitud. Det ger inte rätt amplitud (Devon & Rubin, 2012).
Under studien fann några svårigheter och begränsningar som kan påverka resultateten validitet och reliabilitet, så som variationen mellan individerna i exempelvis handomkrets, initial temperatur, individens vasodilatation och muskelmassa. Dessa faktorer har en påverkan på uppvärmningsmomentet (Herrera, Sandoval, Camargo & Salvini 2010, Rutkove, 2001). Individvariationen uppmärksammades vid värme- eller kylningsteknik, då vissa individer kunde uppnå den önskade temperaturen snabbare än andra individer. Validiteten kan påverka även på grunde av att det var svårigheter med att kunna stimulera vid den exakta punken där stimuleringen skedde vid första gången efter att elektroderna frånkopplades. Detta kan leda till låg validitet eftersom det föredras att elektroderna inte förflyttas mellan stimuleringarna. Det fanns flera faktorer som kunde påverka amplituden negativt som exempelvis individvariationen. Det vill säga att det krävs olika stimuleringsstyrka för att aktivera nerven hos olika individer, vilket inte denna studie anpassades för utan användes en standardiserad stimuleringsstyrka på 15 mA för alla deltagare. Valet av en stimuleringsstyrka på 15 mA bygger på att en ökad stimuleringsstyrka kan leda till artefakter (Devon & Rubin, 2012).
Ordningen på mätningarna randomiserades inte utan alla deltagare mättes i samma ordning, det vill säga att mättningen startade med kalla temperaturintervall sedan ljummen och sist varm. En tanke kan vara att en eventuell nervutmattning kan ha uppstått som påverkat nervledningshastigheten. Men utifrån vår kännedom finns inga vetenskapliga data som berör uttröttningseffekt på nerven. Därför kan det vara svårt att dra en slutsats om en eventuell förekomst av nervutmattning som ligger till grund för minskad nervledningshastighet. Men användning av en icke randomiserad mätning kan var en svaghet i denna studies metod.
En annan faktor som kan påverka resultatet är effektiviteten av uppvärmningstiden och uppvärmningsmetod som används i studien. Tidigare studier har även studerat olika metoder som kan vara lämpliga för uppvärmning av extremiteterna. Några exempel på dessa är värmepaket, värmedynor, värmelampor och hårtorkar. Vilken metod som används för att värma upp extremiteterna kan bero på
26
kostnaden, utrustningens tillgänglighet och personliga preferenser i klinik (Rutkove, 2001; Bonfiglioli et al., 2013; Morris, 2013). Valet av värmedynan i denna studie bygger på att den inte är för dyr samt att den kan täcka ett större område av extremiteten beroende på dynans storlek. Det finns olika metoder för att kyla ner extremiteterna. Det kan vara genom att använda ispaket, ismassage och kallvatten (Rutkove, 2001; Herrera, Sandoval, Camargo, & Salvini, 2010). I denna studie valdes kallvatten då det var lätt tillgängligt och inte kostsamt samt att det enligt tidigare studier har samma effektivitet som andra metoder (Herrera, Sandoval, Camargo, & Salvini, 2010).
Hudtemperaturen avlästes med en termometer på hudytan i denna studie. Huden uppvärms snabbare än nerven, detta kan ge felkällor i resultatet, då hudtemperaturen inte återspeglar nervtemperaturen. Hudtemperaturen förändras och påverkas mycket snabbare medan nervtemperaturen anpassas långsammare (Herrera, Sandoval, Camargo & Salvini 2010). Uppvärmnings momentet genomfördes i 10–15 minuter och den korta uppvärmnings tiden kan troligen har också påverkat resultatet. Whittaker (2012) skrev däremot att en lagom uppvärmningstid för nerven kan ligga mellan 15 och 20 minuter, rekommenderas det även att öka uppvärmningstiden upp till 30 minuters.
Fördelen med denna metod var att författarna använt sig av kallvatten vid nedkylningen vilket var en lättillgänglig och effektiv metod. Däremot var värmedynan mindre effektiv då alla elektroder måste avlägsnas för att lindningen ska genomföras på ett säkert sätt, detta kunde medföra vissa felkällor. Värmedynan kunde istället ersättas med en värmelampa såsom en annan studie rekommenderat (Morris, 2013).
Resultatdiskussion
Den insamlade datan vid de elektroneurografiska undersökningarna visade att vid låg temperatur syns en minskad SCV och en fördröjning av DL (Tabell 1). Däremot framträder stora variationer i amplituden hos flera individer och inget signifikant samband visades mellan de olika temperaturintervallerna (Figur 6).
Den ökande SCV i samband med ökningen av temperatur (Figur 5) har även visats av andra studier (Gavanozi, Veltsista, Polychronopoulos, & Chroni, 2020). Denna studie visar en SCV ökning med 1,61 m/s/ 0C temperaturökning. Detta resultat överensstämmer med tidigare studier som har fått 1,4– 1,7 m/s (Halar, DeLisa, & Brozovich, 1980; Halar, DeLisa, & Soine, 1983). Däremot har en annan studie fått ett högre resultat med en SCV på 2,5 m/s/0C temperaturökning (Burnham & Burnham, 2009). Dock hade denna studie en längre uppvärmningstid (30 minuter) och fler deltagare jämfört med denna studie. En förklaring kan vara att i studien av Burnham & Burnham (2009) uppnåddes en noggrann uppvärmning av nerven, i och med att uppvärmningen av huden sker snabbare än nerven (Herrera, Sandoval, Camargo & Salvini, 2010). Förmodligen kan skillnaden mellan denna studies resultat (1,61 m/s) och tidigare studiers maximala resultat (2,5m/s) förklaras av att olika svårigheter vid uppvärmning, felkällor, individvariationer och att det inte var stora variationer på den undersökta
27
populationen. Det linjära förhållandet mellan temperatur och SCV kan uppskattas, (SCV(T)=1,6088 × T+ 2, 2714) (Figur 5). Korrektion faktor ligger mellan 1,5–2,5 m/s (Rutkove, 2001; Kane & Oware, 2012; Morris, 2013) och i denna studie uppnåddes en korrektion faktor på 1,61m/s vilket innebär att den ligger inom ramen av den vanliga korrektion faktorn.
Gavanozi et al. (2020) jämförde både friska individer och patienter med CTS där korrelationsfaktor observerades. Resultatet visade att friska individer hamnade inom korrektionsfaktorn 1,5–2,5 m/s. Detta resultat kan påverka diagnostiken av patienter, då de kan friskförklaras på grund av denna korrektionsfaktor, eftersom denna korrektionsfaktor i stort sett bygger på friska individer. Även i denna studie överensstämmer denna korrektionsfaktor. Detta är viktigt att uppmärksamma vid diagnostiseringen av patienter, framför allt de patienter som ligger vid gränsvärdet.
Temperaturvariation har stora effekter på det perifera nervsystemet (Herrera et al., 2010). Detta är inte förvånande med tanke på att temperaturkänsligheten hos många av underliggande strukturer i cellen påverkas, såsom jonkanaler, acetylkolin (signalsubstans) och den kontraktila anordningen för muskler (Nicolaysen & Holck, 2014). Eftersom varje komponent visar en unik profil för temperaturkänslighet och varje temperaturförändring kommer att påverka flera komponenter samtidigt kan de totala effekterna av kylning eller uppvärmning vara ganska komplicerade (Rutkove, 2001). Vid låga temperaturer kommer både öppning och stängning av natrium- och kaliumkanaler bromsas upp, men stängning av natrium-kaliumkanalen påverkas på ett säkert sätt. När kanalen står öppen under en längre tid, ökar jonflödet och producerar en större depolarisering (Herrera, Sandoval, Camargo & Salvini, 2010). En motsvarande ökning inträffar i amplitud och duration. Långsam depolarisering ger en långsammare ledningshastighet. Vid mycket låga temperaturer (vanligtvis under 150C) kan ledningsblock uppstå (Herrera, Sandoval, Camargo & Salvini 2010). Ökad temperatur (44-470C) vid djurförsök där nerver studeras har visat att reversibelt konduktionblock inträffar. Detta beror på att natriumkanaler öppnas och stängs så snabbt och den inre strömmen är otillräcklig för att väcka följande nod (Rutkove, Kothari, Shefner & Rutkove, 1997; Rutkove, 2001; Caress, 2007).
Denna studie visade en reduktion av DL och minskning av SCV i samband med nedkylning av huden. Det kan bero på att vid ENeG- undersökning så registreras svar från endast de stora och grova axonerna, A-fibrer (Whittaker, 2012). Detta kan förklaras med att en minskning av temperaturen påverkar nervfibergrupperna på olika sätt och att de är beroende av nervfiberns diameter. Nervfibrer med stor diameter, exempelvis A-fibrer, är mer temperaturkänsliga än C-fibrer. På så sätt åstadkommer A-fibrer en snabbare blockeringsverkan jämfört med C-fibrer (Dhavalikar, Narkeesh, & Gupta, 2009). Stora nervfibrer är mer känsliga för kyla jämfört med små nervfibrer. En annan påverkandefaktor för SCV och DL förändring i samband med nedkylning vid en ENeG-undersökning är hudens motstånd. Eftersom hudmotstånd också ökar med en temperatursänkning kan detta leda till en ökning av latensen som i sin tur leder till en minskning av ledningshastighet (Dhavalikar, Narkeesh, & Gupta, 2009). Vid temperaturökning ökar SCV men det observerades även en reducerad DL (Figur 4). Denna relation stämmer överens med andra studier (Rutkove 2001; Herrera, Sandoval, Camargo & Salvini 2010;
28
Gavanozi, Veltsista, Polychronopoulos & Chroni,2020). I denna studie syns en reducering av DL med 0,1 ms vilket skiljer sig från exempelvis en annan studie då de har fått 0,3 ms (Morris, 2013). Denna skillnad kan förklaras med att det finns flera faktorer som kan påverka DL. Orsaker som kan ge upphov till förkortad DL kan vara chockartefakt, bakgrundstörning eller en vågig baslinje (Katirji, 2007) vilket i denna studien var minimal. Det linjära förhållandet mellan temperatur och DL skulle uppskattas med, (DL(T)= -0,1003 × T + 5,9759) (Figur 4). Distal latens och SCV påverkas av en temperaturförändring. Ju längre uppvärmningstid för nerven desto ökad nervledningshastighet uppnås, dock sker en minskning av distal latens vid ökad temperatur. Korrektionsfaktor beräknades på 0,3 ms/0C (Kane & Oware, 2012; Rutkove, 2001; Morris, 2013) och i denna studie uppnåddes en korrektionsfaktor på 0,1 ms/0C.
Denna studie visar en stor variation av amplituden (figur 6) och därmed syns inget samband mellan amplitud och temperaturförändring. Däremot har tidigare studier påvisat ett amplitudfall på cirka 50% per 10 graders temperaturökning (32-420C) (Rutkove, Kothari, Shefner & Rutkove, 1997). I en annan studie observerades 25,2% amplitudfall vid samma temperaturintervall (Wang, Raynor, Blum, & Rutkove, 1999). Resultatet i denna studie kan ha påverkats av flera olika faktorer såsom stimuleringsartefakter, dåligt hudmotstånd och muskelartefakter. Vilket blir ett betydande problem vid låga sensoriska svarsamplituder som är en vanlig registrering svårigheter vid individer med CTS (Katirji, 2007).
I denna studie påträffades, vid temperaturintervall 32-330C, tre individer med SCV <50 m/s, vilket kan misstänkas vara patologiskt. För att utreda fyndet tillfrågades dessa deltagare ytterligare om de har känt av de vanliga symtom som tyder på patologi såsom svaghet, domningar, stickningar och förlust av känsel (Jonson & Wollmer, 2011). Dessa tre deltagare upplevde inget besvär och därmed ansåg författarna att det inte var något patologiskt fynd och en vidare utredning ansågs inte nödvändig. Den avvikande resultat kan bero på andra felkällor.
Förslag till fortsatt studie inom detta ämne kan vara att undersöka om hudtemperatur kan påverka motorisk ledningshastighet och distal motorisk latens samt om det finns kön, längd och åldersskillnader i ledningshastighet i samband med temperaturförändring. Andra faktorer som kan vara intressanta att studera vid liknande studier är exempelvis dominerande hand, om den skiljer sig ifrån den andra handen och kroppsmasseindex (BMI). Vid vidare studier inom ämnet kan även exklusionskriterier utökas såsom alkohol, rökning och graviditet. Det kan även vara tänkvärt att studera och följa upp individer i längre förlopp, för att kunna se hur temperatur påverkar vid olika åldersintervaller.
29
Slutsatser
Vid ökad temperatur ökade SCV med 1,61 ms/0C däremot minskade den DL med 0,1 ms/C. Amplituden var däremot varierande i samband med ökad temperatur. Det är viktigt att bibehålla rätt temperatur vid ENeG-undersökning för att uppnå rätt diagnostisering. Om den standardiserad yttemperatur (320 C på övre extremitet) inte uppnås bör extremiteten värmas upp för att undvika fel diagnostisering. Vid svårighet att uppnå det standardiserad yttemperatur kan en korrigeringsfaktor på 1,61 ms/0C för SCV och 0,1 ms/0C för distal latens användas för att säkerställa diagnostisering.
30
Tackord
:Vi vill tacka alla som har stöttast oss med denna uppsats. Ett tack till Dan Lund som hjälpte oss med statistisk bearbetning (SPSS) och tack till vår mediciniska handledare Cornelia Lauermann. Ett stort tack till alla deltagare som valde att ställa upp i vår studie trots den svåra situationen med COVID-19 pandemin. Sist men inte minst vi vill särskilt tacka vår vetenskapliga handledare Magnus Karlsson som stöttat och väglett oss under studiens gång.
31
Referenser
1. Andersson, R., Jeppsson, B., & Rydholm, A. (2012). Kirurgiska sjukdomar. Lund: Studentlitteratur.
2. Bjuväng, A., Kjellberg, M., Rehle, H., & Åkesson, U. (2014). Klinisk kemi och klinisk fysiologi :
analyser och undersökningar (4. [uppdaterade] uppl.). Studentlitteratur.
3. Bonfiglioli, R., Mussoni, P., Graziosi, F., Calabrese, M., Farioli, A., Marinelli, F., & Violante, F. (2013). Effects of 90min of manual repetitive work on skin temperature and median and ulnar nerve conduction parameters: A pilot study in normal subjects. Journal of Electromyograktionspotentialhy and Kinesiology, 23(1), 252–259.
4. Burnham, R., & Burnham, T. (2009). Effect of Hand Warming on Electrodiagnostic Testing Results and Diagnosis in Patients With Suspected Carpal Tunnel Syndrome. Archives of Physical Medicine and Rehabilitation, 90(12), 2062–2065.
5. Cakir, M., Samanci, N., Balci, N., & Balci, M. (2003). Musculoskeletal manifestations in patients with thyroid disease. Clinical Endocrinology, 59(2), 162–167.
6. Cameron, N., & Cotter, M. (2001). Diabetes causes an early reduction in autonomic ganglion blood flow in rats. Journal of Diabetes and Its Complications, 15(4), 198–202.
7. Caress, J., Blum, A., & Rutkove, S. (2007). Technical, Physiological and Anatomic Considerations in Nerve Conduction Studies. In The Clinical Neurophysiology Primer (pp. 217-227). Totowa, NJ: Humana Press.
8. Caress, J. B. (2007). Technical, physiological and anatomic considerations in nerve conduction studies. In The clinical neurophysiology primer (pp. 217-227). Humana Press.
9. Devon, I. & Rubin. (2012). Clinical Elektromyography. Neurologic clinics. 30(2012),685-710
10. Dhavalikar, M., Narkeesh, A., & Gupta, N. (2009). Effect of skin temperature on nerve conduction velocity and reliability of temperature correction formula in Indian females. 11. DiPasquale, D. M., Kolkhorst, F. W., & Buono, M. J. (2015). Acute normobaric hypoxia reduces
body temperature in humans. High altitude medicine & biology, 16(1), 61-66.
12. Ejlertsson, G. (2019). Statistik för hälsovetenskaktionspotentialerna (Tredje upplagan). Lund: Studentlitteratur.
13. Ejvegård, Rolf, Vetenskaplig metod, Studentlitteratur, Lund, 2003 14. Fagius, J., & Nyholm, D. (2013). Neurologi (5. uppl.). Stockholm: Liber.
15. Foldes, F., Kuze, S., Vizi, E., & Deery, A. (1978). The influence of temperatute on neuromuscular performance. Journal of Neural Transmission, 43(1), 27-45.
16. Gavanozi, E., Veltsista, D., Polychronopoulos, P., & Chroni, E. (2020). The optimum hand temperature to study nerve conduction in patients with carpal tunnel syndrome. Journal of Electromyograktionspotentialhy and Kinesiology, 51, 102410.
17. Grefberg, N. (2013). Medicinboken : orsak, symtom, diagnostik, behandling (5., [rev.] uppl. / Nils Grefberg (red.)). Stockholm: Liber.
18. Health and Medicine; Findings from Jozef Stefan Institute in High Altitude Medicine Reported (Acute Effects of Normobaric Hypoxia on Hand-Temperature Responses During and After Local