Ersättning av Verhoeffs manuella elastinfärgning
Optimering samt implementering
av
Harts
automatiserade
färgningsmetod
HUVUDOMRÅDE: Biomedicinsk laboratorievetenskap FÖRFATTARE: Jonathan Lundström, Joel Skagersten
HANDLEDARE: Metodhandledare: Jeanette Karlsmo och Andrea Lindh. Vetenskaplig handledare: Elvira Hukasova
Sammanfattning
Elastinfibrer ger blodkärl och andra vävnader deras flexibilitet. Elastinfärgning är relevant när man misstänker melanom, temporalis artrit, venös invasion och efter blodkärlsoperationer. Syftet var att med hjälp av olika vävnadstyper optimera och implementera den automatiserad elastinfärgningen enligt Hart, för att ersätta den nuvarande manuella elastinfärgning enligt Verhoeff vid patologilaboratoriet på länssjukhuset Ryhov, Jönköping. Colon, njure, hud samt navelsträng färgades med den automatiska metoden enligt Hart för att hitta optimala inställningar. Vävnader från samma områden färgades med den manuella metoden enligt Verhoeff samt den automatiska metoden enligt Hart för att jämföra dem. Snitten bedömdes av en läkare så allt färgades som det skulle. Optimeringen av Harts metod resulterade i en inkubationstid på tolv minuter samt en optimal färgningsbehandling utan xylen. Resultaten av jämförelsen mellan den automatiska metoden enligt Hart och den manuella metoden enligt Verhoeff visar att den automatiska metoden enligt Hart ger bättre kontrast samt bakgrundsinfärgning. Slutsatsen blev att den automatiska metoden enligt Harts var bättre än den manuella metoden enligt Verhoeff, att i framtida studier studera möjligheten att byta ut läskningen mot till exempel ytterligare ett etanoldop samt att byta ut snitten av navelsträngen mot snitt av lever.
Summary
Optimisation and implementation of Harts automated staining
method.
Replacement of Verhoeffs manual elastic staining method.
Elastic fibres ensure blood vessels and other tissues flexibility. Elastic staining of tissue is relevant when there is suspicion of melanoma, temporalis arteritis, venous invasion and after operations on blood vessels. The aim of the study was with the help of different tissue samples optimize and implement Hart´s elastic staining method as a substitute for Verhoeff’s at pathology lab at county hospital Ryhov, Jönköping. Colon, kidney, skin, and umbilical cord cross section got stained with Hart´s automated elastic staining method to evaluate the optimal staining procedure. Same region of the tissues was stained with Verhoeff´s manual elastic staining method and Hart´s method. All cross section were assessed and compared with the help of a pathologist doctor. Optimization of Hart´s method resulted in an incubation period of twelve minutes and optimal staining procedure without xylene. Result of comparison between Hart´s staining method and Verhoeff´s staining method showed that Hart´s staining method had a better contrast and background. Conclusions of the study was that Hart´s staining method was better than Verhoeff´s staining method, further studies could include research about a substitution of the blotting step with an extra ethanol bath as an example and liver tissue instead of the umbilical cord.
Innehållsförteckning
1.
Inledning ... 1
2.
Bakgrund ... 1
2.1 Histotekniska processen ... 1
2.2 Elastin ... 1
2.3 Elastininnehållande vävnader samt klinisk relevans... 2
2.4 Elastinfärgningar ... 3
2.4.1 Verhoeff ... 3
2.4.2 Hart ... 3
3. Syfte ... 5
4. Material och metod ... 6
4.1 Urval, dehydrering, klarning, paraffininbädning samt snittning ... 6
4.2 Optimering av elastininfärgning enligt Hart ... 6
4.3 Elastinfärgning enligt Hart ... 6
4.4 Elastinfärgning enligt Verhoeff ... 6
4.5 Bedömning samt statistisk analys ... 7
4.6 Etiska överväganden ... 7
5 Resultat ... 8
5.1 Optimering av elastininfärgning enligt Hart ... 8
5.2 Implementering av automatisk elastininfärgning enligt Hart ... 11
6. Diskussion ... 15
6.1 Metoddiskussion... 15 6.2 Resultatdiskussion... 157. Slutsatser ... 17
8. Omnämnande ... 17
9. Referenser ... 18
10. Bilagor ... 20
1
1. Inledning
Den histotekniska färgningsmetoden av elastin utförs manuellt enlig Verhoeffs metod på länssjukhuset Ryhov. Verhoeff-metoden är en av de vanligaste metoderna vid elastinfärgning av blodkärl i världen (1). Metoden har dock högre förbrukning av kemikalier samt tar längre tid i jämförelse med en automatiserad infärgning. Rutinarbetet optimeras även med en automatisk elastinfärgning då utövaren kan utföra andra uppgifter istället för manuellt förflytta preparaten mellan kyvetter. En automatisk färgningsmaskin av typen Roche VENTANA BenchMark Special Stains (Roche Diagnostics GmbH, Basel, Schweiz) finns på sjukhuset för andra specialfärgningar, men elastinfärgning enligt Hart vilket är en ekvivalent färgningsmetod till Verhoeffs elastinfärgning kan även maskinen användas till. Harts metod övervägs därför som en ersättning av Verhoeffs, dock måste Harts metod optimeras. Harts metod måste optimeras för att det finns förslag på tiderna 8, 12, samt 16 min som tiden snitten färgas in med elastinfärglösningen. Dehyderingssteget måste också optimeras för att antingen kan steget genomföras med etanol och xylen eller med bara etanol. Optimeringen genomfördes med olika vävnader för att utvärdera den optimala tiden i färglösningen från kittet. För att implementera en ny infärgningsmetod behövde resultatet jämföras med den tidigare använda metoden så att resultatet inte försämras.
2. Bakgrund
2.1 Histotekniska processen
Histotekniska processen delas in i fixering, utskärning, dehydrering, klarning, impregnering, inbäddning, snittning och färgning. Fixering innebär att vävnader placeras i en fixeringslösning, vanligtvis formaldehyd för att motverka autolys av vävnaden. De cellulära strukturerna bevaras genom att formalinet binder in i vävnaden. Utskärningen innefattar en makroskopisk bedömning av vävnaden där intressanta bitar skärs ut och dehydreras. Dehyderingen görs maskinellt där vävnaden avvattnas med stigande koncentrationer av etanolbad. Klarningen görs med xylen för att förtydliga vävnadstrukturerna samt impregnering innebär att vävnadsstrukturen fylls med paraffin. Inbäddning utförs genom att vävnaden orienteras i klossar med ytan som ska snittas neråt samt påfyllning av ytterligare paraffin så att vävnaden enkelt kan snittas i en mikrotom. Snittning innebär att vävnaden snittas i tunna skivor vanligen på 4 µm för att sedan placeras på ett objektglas och färgas. Generella steg inom histologisk färgning är ett uppvärmningssteg för att smälta allt paraffin innan vävnaden rehydreras med sjunkande koncentration av etanolbad. Färgningsprocessen varierar beroende på metod. De flesta metoderna slutar med dehydrering följt av montering. Monteringen innefattar att pertex läggs på vävnaden och ett täckglas limmas fast ovanpå vävnaden. Täckglaset skyddar vävnaden från att skadas under den mikroskopiska bedömningen samt hanteringen (2).
2.2 Elastin
Extracellulär matrix består av olösliga polymerer vilka bildar elastiska fibrer. Dessa fibrer bidrar till den strukturella integriteten samt elasticiteten hos vävnaden. Elastin är den vanligast förekommande typen av fiber vilka bildar nätverk genom korsbindningar mellan varandra (3). Kondrocyter, keratinocyter, fibroblaster, endotelceller, luftvägsepitel samt celler i glatt muskulatur utsöndrar förstadiet till elastin monomeren tropoelastin (4-8). Genom varierad splicing uppnås varierade proteiner vilka saknar en tydligt fastställd koppling till specifik vävnad, alternativt funktion (3). Tropoelastin samlas på cellytan så att entropiskt fördelaktiga aggregaten som bildas kan korslänka mikrofibrillerna till elastiska fibrer, se figur 1. Korslänkningen sker med hjälp av enzym samt lysinrika områden (9).
2
Figur 1. En schematisk figur över hur tropoelastin samlas på cellytan korslänkar till mikrofibriller för att sedan bilda elastiska fibrer. Tropoelastinet samlas i entropiskt fördelaktiga aggregat (A). Aggregaten samlas på cellytan (B) för att växa till (C). Aggregaten binder till mikrofibriller (D) där korslänkning med hjälp av enzym sker (E) till färdig elastin (F)
(10)
. Figuren är ej skalenlig.Elastin binder till celler med hjälp av elastin binding protein (EBP) genom att de 17 sista C-terminala aminosyrorna binder till glukosaminoglykaner på cellens yta (11-13).
2.3 Elastininnehållande vävnader samt klinisk relevans
Provvävnader som används vid metodoptimeringen av elastinfärgning är colon, njure, hud och navelsträng. Alla vävnader har blodkärl i sig. Blodkärl exempelvis aorta och artär är generellt uppbyggda av vävnadstyperna glatt muskelceller, elastiska samt kollogena fibrer. Artärer består av 3 lager tunica interna/intima, tunica media samt tunica adventitia skildrat inifrån och ut. Tunica interna består av kollogena och elastiska fibrer med inslag av glattmuskelatur, tunica media består av jämnt antal av tidignämnda vävnader. Tunica adventitia domineras av kollagena fibrer, dock med inslag av glatt muskulatur och elastiska fibrer (1, 14). Vid temporalis artrit drabbas stora samt mellanstora artärer med tydliga elastiska membran av inflammation. Inflammationen är vanligtvis kraftigast i tunica media i närheten av den trasiga elastiska strukturen mellan tunica interna/intima samt tunica media. Vid temporalis artrit är temporalisbiopsi den gyllene standarden för diagnos med fynd av diskontinuerligt elastin alternativt neutrofila granulocyter i kärlväggen (15). Vid undersökningar blodkärl som skadats efter operationer används elastinfärgning (14).
Hematogen spridning ökar risken för dödligt utfall vid kolorektalcancer. Hematogen spridning är när tumörceller kommer ut i blodcirkulationen. En bra metod för att avgöra risken för hematogen spridning är att bedöma venös invasion (16-18). Spridning av kolorektalcancer kan ske genom hematogen spridning alternativt med hjälp av det lymfatiska systemet. Kärlväggar kan förstöras alternativt förändras av operationsförberedande strålningsbehandlingar. Detta försvårar upptäckandet av venös invasion vid rutinfärgningen hematoxylin och eosin (H&E). Ofta krävs aktivt sökande efter tydliga morfologiska tecken för detektion. Exempel på morfologiska tecken är tumörvävnad med fett runt artärer ”protruding tongue sign”, samt tumörvävnad som är sammankopplad till muskelförsedda artärer utan närliggande vener ”orphan arteriole”. Vid upptäckt av någon av tecknen utan tydliga kärlväggar rekommenderas elastininfärgning (16). Studier inom ämnet tyder på att korrekt behandling av kolorektalcancer ökar den nuvarande med 100–200% när morfologiska bedömningar komplimenteras med elastinfärgning jämfört med endast H&E bedömning (19).
Då huden utsätts för längre perioder av solljus bryts elastinfiberer ner till grötliknande klumpar succesivt och vid solskador i yngre ålder ökar risken för olika hudcancer så som malignt melanom i senare ålder. Vid elastinfärgning av hudvävnad syns melanom genom att elastin fiber saknas mellan maligna melanocyter för att de har blivit nedtryckta samt ansamlade under tumörvävnaden. Vid solelastos skadas elastin fibrer av solljus samt komprimeras vilket är skillnaden mellan melanomer och skadad hud, men skillnaden är svårtolkad. När melanom återbildas syns skillnaden dock. Regressionen av melanom kvarlämnar tunnare stråk av komprimerade elastinfibrer vilket skiljer ut dem från
3
kirurgiska borttagna melanom samt vävnad med solar elastos. Typen melanocytisk nevi är en variant av melanom där benigna melanocyter har elastinfibrer mellan sig. Dessutom har elastinet i papillära dermis förflyttat sig till epidermis samt antagit ett gaffellikande utseende (20).
Navelsträngen består till en början av 2 artärer samt 2 vener. Mellan vecka 6 och 7 tillbakabildas en av venerna samt att resterande ven expanderar, vilket minskar elastininnehållet. Runt kärlen finns bindväv alltsammans täcks av fosterhinnan (21). Fosterhinnan består ytterst av epitelceller följt av 4 lager av kollagen (22).
2.4 Elastinfärgningar
2.4.1 Verhoeff
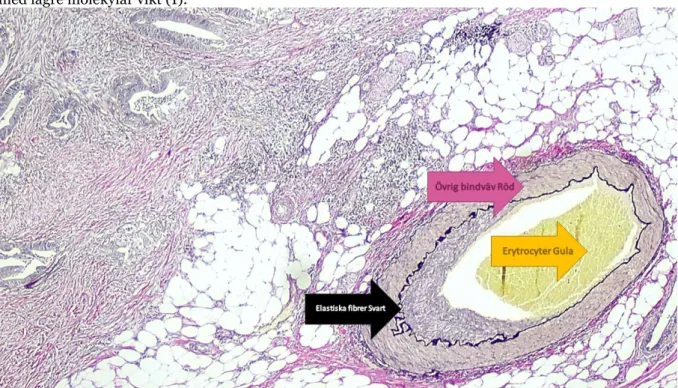
Elastinfärgning används främst vid patologiska vävnader för att utvärdera skador och förändringar efter ingrepp i blodkärl eller likande vävnad med elastinrik vävnad. Sjukdomar så som temporalis artrit, solar elastos, extramural venös inversion samt melanom är exempel på frågeställningar där elastinfärgning krävs. Exempel på infärgningarna är elastinfärgning enligt Verhoeff samt elastinfärgning enligt Hart där båda är regressiva färgmetoder. Regressiv färgning är att vävnaden överfärgas och tonas sedan ner med exempelvis natriumtiosulfat. Verhoeff-metoden inleds med att Bouins lösning som innehåller pikrinsyra differentierar elastinfibrerna innan elastinfärgningslösningen tillsätts. Elastinfärgningslösningen består av 3 dellösningar. Första lösning är en hematoxylin-lösning, vilket färgar vävnadens cellkärnor lila och elastin svart. Andra lösningen består av en sur järnkloridlösning vilket agerar som betmedel till hematoxylinet och oxidera ämnet till hematein. Saltsyra sänker pH:et och underlättar selektiva kollageninfärgningen. Tredje lösningen är en jodlösning som har samma funktion som järnkloridlösningen och järnhematoxylinkomplexet har en hög affinitet till elastiska fibrerna så att de bli svarta. Natriumtiosulfatet används för bortsköljning av överskottet med jod (1). Van Gieson består av syrefuksin (23) i mättad pikrinsyra, vilket tillsammans kontrastfärgar vävnaden. Muskler och erytrocyter blir gula och bindväv rött. Mättad pikrinsyra krävs för att annars blir kollagen svagt rosa eller orange med samma infärgning i övriga vävnader, se figur 2. Syrefuksin har hög molekylär vikt och är anjonisk, vilket binder lätt till positivt laddad vävnad men konkurreras bort i elastin av hematoxylin med lägre molekylär vikt (1).
Figur 2. Färgerna på resultatet vid manuell infärgning enligt Verhoeff. Vid färgning blir de elastiska fibrerna svarta, övrig bindväv rött, muskler samt erytrocyter blir gula. Kollagen blir svagt rosa eller orange om omättad pikrinsyra används.
2.4.2 Hart
Vid elastinfärgning enligt Hart måste vävnaderna oxideras så att kromoforerna ska kunna binda in. En kaliumpermanganat-lösning används för ändamålet. Elastinfärgningslösning krävs för infärgningen av elastiska fibrer där resorcin-fuksin färgar de elastiska fibrer svarta till mörklila, se figur 3. Komplexet av resorcin-fuksin är positivt laddad vilket binder hårt in till negativt laddad elastin i vävnaden. Då
4
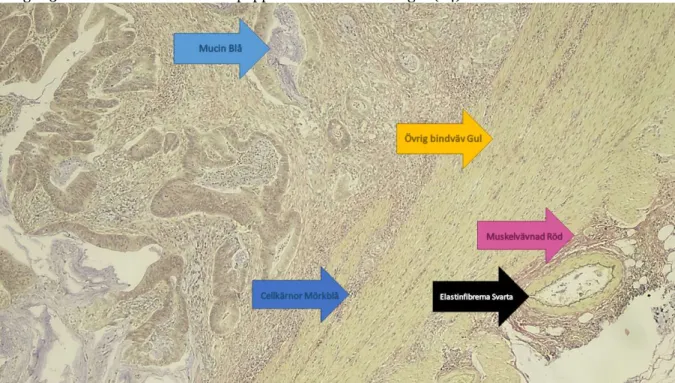
vävnaden överfärgas måste färgen tonas ner. Oxalsyran tar bort existerande färgämnens bindningar samt låter hårt bundna kromoforer vara. Elastic clarifier tonar ner infärgningen av vävnaden där tween 20 sköljer bort obundna kromoforer av resorcin-fuksin. Van Gieson-lösning innehåller syrefuksin och mättad pikrinsyra. Pikrinsyra och syrefuksin färgar kollagen rosa-röd, muskler och erytrocyter blir gult, se figur 3. Snitten torkades med läskpapper för att inte överfärgas (24).
Figur 3. Färgerna på resultatet vid automatisk infärgning enligt Hart. Elastinfibrerna blev svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått.
5
3. Syfte
Syftet var att med hjälp av olika vävnadstyper optimera och implementera den automatiserad elastinfärgningen enligt Hart, för att ersätta den nuvarande manuella elastinfärgning enligt Verhoeff vid patologilaboratoriet på länssjukhuset Ryhov, Jönköping.
6
4. Material och metod
4.1 Urval, dehydrering, klarning, paraffininbäddning samt snittning
Vävnaderna som valdes ut var colon med tumörvävnad, njurvävnad, ung samt äldre hudvävnad samt navelsträng. Alla vävnader hade blivit formaldehydfixerade under minst 8 veckor samt var alla utsvarade patientfall från patologilaboratoriet, Länssjukhuset Ryhov Region Jönköpings län. Det tillverkades 6 klossar med colonvävnad, 4 klossar med vävnad från njure, 4 klossar från ung hudvävnad, 2 klossar från äldre hudvävnad samt 4 navelsträngsklossar. Två klossar togs från varje patientfall förutom navelsträng, där alla klossar togs från samma patientfall. Dehydrering samt klarning av vävnaderna utfördes i Tissue-Tek® V.I.P.™ Vakuum Infiltration Processor VIP E150/E300 (Sakura Finetek Europé B.V., AJ Alpen aan den Rijn, Nederländerna) innan de paraffininbäddades manuellt. Colonpreparaten samt Hud D kördes i Program 5, 6 Feta storsnitt och resterande preparat kördes i Program 3,4 Rutinprogram, för hela dehydreringsprogrammen se bilaga 1. Till optimeringen togs 6 snitt per kloss. Till implementeringen togs ett snitt per kloss samt färgningsmetod. Vävnaderna snittades till 4 µm samt placerades på objektglas. Innan snitten användes vid optimeringen samt jämförelsen mellan färgningsmetoder. Vid Harts elastinfärgning användes TOMO IHC Adhesive Glass Slides laddade objektglas (Matsunami Glass Ind., Ltd, Osaka, Japan) och vid Verhoeffs manuella elastinfärgning användes VWR Microscope Slides Cut Edges Frosted oladdade glas (VWR Intenational, Leuven, Belgien).
4.2 Optimering av elastininfärgning enligt Hart
Till elastinfärgning enligt Hart användes det automatiserade färgningsinstrument Roche VENTANA BenchMark Special Stains (Roche Diagnostics GmbH, Basel, Schweiz) med färgkitet Elastic Staining Kit (Roche). De 4 µm tjocka snitten från hud (n=6), njure (n=6), colon (n=6) samt navelsträng (n=6) avparaffinerades och rehydrerades innan bakning i 30 min i 70◦C. Snitten fick svalna i 5 min innan de
täcktes av oxidizer-lösningen (Roche) i 5 min. Snitten sköljdes noggrant med destillerat vatten. Vid elastinfärgning med elastic tissue stain-lösning (Roche) färgades 2 snitt av varje preparat med inkuberingarna 8, 12 respektive 16 min. Efter sköljning med avjoniserat vatten och kranvatten täcktes snitten av decolorizer (Roche) i 2 min. Snitten sköljdes därefter i 95% etanol (KiiltoClean, Malmö, Sverige). Snitten täcktes med elastic clarifier i 5 min. Efter sköljning med destillerat vatten täcktes snitten med Van Gieson-lösning (Roche) i minst 4 min. Snitten avlägsnades från Roche VENTANA BenchMark Special Stains (Roche). Samtliga snitt läskades av med filterpapper (Munktell Ahlstrom, Helsingborg, Finland). Samtliga snitt doppades 2 gånger i 99,5% etanol (KiiltoClean) innan den ena av paret doppades 2 gånger i xylen (Solveco, Rosersberg Sverige). Täckglasen monterades med VENTANA HE 600 (Roche).
4.3 Elastinfärgning enligt Hart
Till elastinfärgning enligt Hart användes det automatiserade färgningsinstrument Roche VENTANA BenchMark Special Stains (Roche Diagnostics) med färgkitet Elastic Staining Kit (Roche). De 4 µm tjocka snitten från hud (n= 4), njure (n=2), colon (n=3) samt navelsträng (n=1) avparaffinerades och rehydrerades innan bakning i 30 min i 70◦C. Snitten fick svalna i 5 min innan de täcktes av oxidizer-lösningen (Roche) i 5 min. Snitten sköljdes noggrant med destillerat vatten. Vid elastinfärgning med elastic tissue stain-lösning (Roche) inkuberades alla snitt i 12 min. Momentet efter sköljning med avjoniserat vatten och kranvatten täcktes snitten av decolorizer (Roche) i 2 min. Snitten sköljdes därefter i 95% etanol (KiiltoClean, Malmö, Sverige). Snitten täcktes med elastic clarifier i 5 min. Efter sköljning med destillerat vatten täcktes snitten med Van Gieson-lösning (Roche) i minst 4 min. Snitten avlägsnades från Roche VENTANA BenchMark Special Stains (Roche). Samtliga snitt läskades av med filterpapper (Munktell Ahlstrom). Snitten gavs 2 dopp i 99,5% etanol (KiiltoClean) som dehydreringssteg. Täckglasen monterades med VENTANA HE 600 (Roche).
4.4 Elastinfärgning enligt Verhoeff
De 4 µm tjocka snitten avparaffinerades och rehydrerades i 3 kyvetter med Tissue clear (Sakura Finetek Europé, Alphen aan den Rijn, Nederländerna) 5 min vardera, 3 min i 99,5% etanol (KiiltoClean) följt av 2 min i 99,5% etanol. Vävnadssnitten doppades 5 gånger i 95% etanol (KiiltoClean) samt 5 gånger i avjoniserat vatten avslutningsvis. Verhoeffs elastinfärgning inleddes med att snitten placerades i 60◦C
Bouins lösning i 10 min. Bouins lösning beståndsdelar var 225 ml 2% pikrinsyra (Histolab, Västra Frölunda, Sverige), 75 ml 37% formaldehyd (Histolab) och 15 ml koncentrerad ättiksyra (VWR international, Lyon, Frankrike). Lösningen upphettades under 15 min i 60◦C innan användning. Snitten
7
sköljdes därefter noggrant med kranvatten följt av avjoniserat vatten. Arbetslösningen för färgning av elastin tillreddes med hjälp av 3 lösningar. Den första lösningen var en 30 ml 2% (w/v) hematoxylin-lösning (Sigma-Aldrich, Saint Louis, Missouri, USA). Den andra hematoxylin-lösningen framställdes genom att 7 g järnklorid löstes upp i 300 ml avjoniserat vatten tillsammans med 7 ml 5 M saltsyra (VWR international). Till arbetslösningen användes 20 ml av lösningen. Den tredje lösningen framställdes genom att 4 g kaliumjodid (Merck, Kenilworth, New Jersey, USA) löstes i 100 ml milliporevatten följt av att 2 g jod (VWR international) löstes i blandningen. Volym av lösningen som användes var 10 ml. Snitten placerades i arbetslösningen för färgning av elastin i 45 min. Sedan sköljdes snitten i kranvatten följt av avjoniserat vatten. Snitten placerades i en 5% natriumtiosulfatlösning (Merck) i 2 min samt sköljdes på samma sätt som tidigare. En Van Gieson-lösning bereddes genom att 57 ml 2% mättad pikrinsyra (Histolab) späddes med 3 ml 1% syrefuksin (Merck). Snitten badades i Van Gieson-lösning i 1 min följt av ett dopp i avjoniserat vatten. Snitten dehydrerades genom att doppas 3 gånger i 95% etanol, 3 gånger i ny 95% etanol, 3 gånger i 99,5% följt av ytterligare 3 gånger i ny 99,5% etanol. Täckglasen (Citoglas, Jiangsu, Kina) monterades med pertex (Histolab).
4.5 Bedömning samt statistisk analys
Resultaten bedömdes tillsammans med patologläkare. Snitten från optimeringen jämfördes sinsemellan, beskrevs verbalt samt det bästa resultatet bestämdes. Elastinfärgningarna jämfördes med hjälp av 2 snitt per vävnadspreparat (n=10). Den populäraste av metoderna inom histopatologi är vid åsiktsbaserad visuella bedömningar ”Score method”, vilket innefattar indelning av preparaten i kategorier vid bedömningen. Exempel på kategoriseringar är bra, bättre och bäst infärgning eller ej godkänt, godkänd och optimal infärgning. Svagheten i metoden är att extremgrupperna brukar generellt bli små medan mellangrupperna blir stora, eftersom fler värden faller inom dem (25). Vävnaderna bedömdes med hjälp av parametrarna elastinfärgning, bakgrundsfärg samt kontrast med en skala från 1–3 där 1 var ej godkänd, 2 var godkänd och 3 var optimal. Bedömningarna presenterades i figur 7–11. Wilcoxon-Mann-Whitney test är ett flexibelt statistiskt test som användas vid jämförelse av parametrar mellan 2 grupper. Testet möjliggör att 2 grupper med olika bedömningar jämförs med varandra samt arrangeras värdemässigt. En asymptotisk signifikans samt Z-värden genereras då efter arrangemanget av värden. Z-värdet är en form av konfidensintervall och spridningsmått. Resultatet analyserades med International Business Machines Statistical Package for the Social Sciences (IBM SPSS) statistiska test Wilcoxon Mann-Whitney-test. Signifikansen finns om värdet är under 0,05 (26). Signifikansnivån som användes var 95 %.
4.6 Etiska överväganden
Vävnader som hade svarats ut och skulle kasseras avidentifierades och användes i studien. Biobankslagen har beaktats vid genomförandet (27). Etisk egengranskning enligt Hälsohögskolans anvisningar har gjorts se bilaga 2.
8
5 Resultat
5.1 Optimering av elastininfärgning enligt Hart
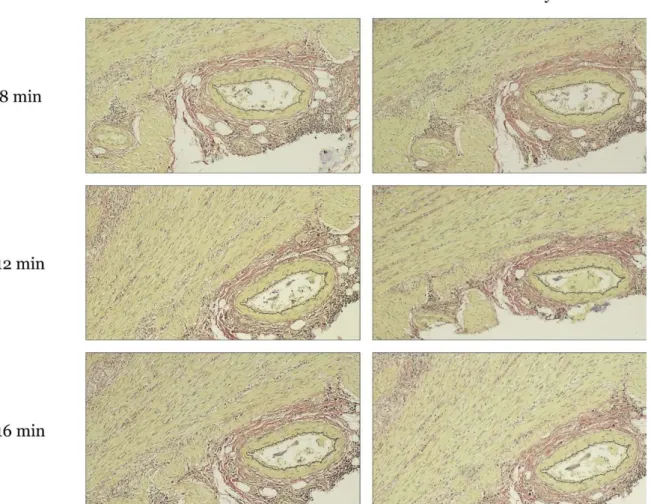
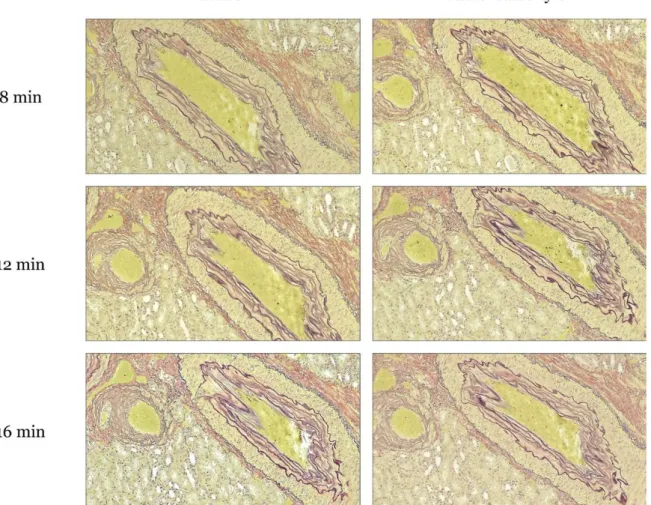
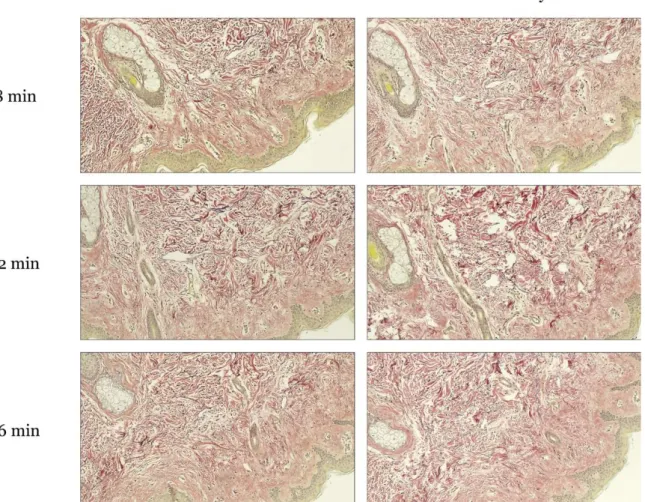
I syfte att optimera elastininfärgning enligt Hart färgades colon med kärl (n=6; figur 3), njurvävnad (n=6; figur 4), hudvävnad (n=6; figur 5) samt navelsträng (n=6; figur 6) i 8, 12 respektive 16 min. Dehydreringssteget med etanol alternativt etanol samt xylen jämfördes även, se figur 3–6.
Figur 3. Vävnad samt kärl från colon färgad i Roche VENTANA BenchMark Special Stains med 100x förstoring. Bilderna visar snitt med elastinfärgning som applicerats i 8, 12 och 16 min. Snitten till vänster läskades av samt doppades i etanol. Snitten till höger doppades även i xylen. Vid färgning blev elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått.
9
Figur 4. Kärl i njurvävnad färgad i Roche VENTANA BenchMark Special Stains med 100x förstoring. Bilderna visar snitt med elastininfärgning som applicerats i 8, 12 och 16 min. Snitten till vänster läskades av samt doppades i etanol. Snitten till höger doppades även i xylen. Vid färgning blev elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått.
10
Figur 5. Hudvävnad färgad i Roche VENTANA BenchMark Special Stains med 100x förstoring. Bilderna visar snitt med elastininfärgning som applicerats i 8, 12 och 16 min. Snitten till vänster läskades av samt doppades i etanol. Snitten till höger doppades även i xylen. Vid färgning blev elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått.
11
Figur 6. Kärl i navelsträng färgad i Roche VENTANA BenchMark Special Stains med 100x förstoring. Bilderna visar snitt med elastinfärgning som applicerats i 8, 12 och 16 min. Snitten till vänster läskades av samt doppades i etanol. Snitten till höger doppades även i xylen. Vid färgning blev elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått.
En läkarbedömning gjordes vilket resulterade i att infärgning i 12 min utan xylenanvändning bedömdes som optimal. Hela läkarbedömningen sammanställdes i tabell 1.
Tabell 1. Sammanställning av läkarens bedömning av helheten av optimeringsinfärgningen.
Etanol Etanol samt xylen
8 min Godkänd Godkänd
12 min Optimal Optimal
16 min Godkänd Optimal
5.2 Implementering av automatisk elastininfärgning enligt Hart
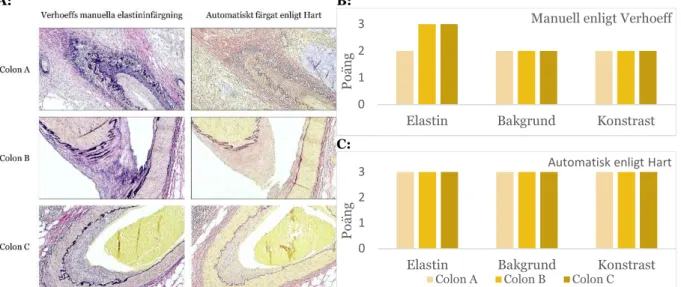
I syfte att implementera den automatiska elastininfärgning enligt Hart färgades 10 vävnadsprov in med Verhoeffs manuella elastininfärgning samt Harts automatiska elastininfärgning. Vävnadsprov från colon med kärl (n=3), njurvävnad (n=2), hudvävnad (n=4) samt navelsträng (n=1) användes. Läkarens bedömning av snitten med kriterierna elastinfärgning, bakgrundsfärgning samt kontrasten emellan färgerna med skal 1-3 (där 3 är maximal poäng och 1 är minimal poäng) presenteras tillsammans med bilder på snitten i figur 7–10. Colon med kärl nära tumör ses i figur 7, njurvävnad med kärl ses i figur 8, hudvävnad ses i figur 9 av samt figur 10 visa navelsträng med kärl. Figurerna visar Verhoeffs infärgning till vänster samt Harts infärgning till höger.
12
Vid manuell färgning enligt Verhoeff fick de 3 colonvävnaderna betyget 3 i 2 fall samt betyget 2 i 7 fall. Vid automatisk färgning enlig Hart fick de 3 colonvävnaderna betyget 3 i samtliga 9 fall.
A: B:
C:
Figur 7. Kärl nära tumör i colon. A: Snitt till vänster manuellt färgade enligt Verhoeffs manuella elastinfärgning. Vid färgning blir de elastiska fibrerna svarta, övrig bindväv rött, muskler samt erytrocyter blir gula. Kollagen blir svagt rosa eller orange om omättad pikrinsyra används. Snitt till höger färgade automatiskt enligt Hart. Vid färgning med Hart blir elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått. Samtliga bilder togs med 100x förstoring. B: Läkarens bedömning av de individuella snitten med skala mellan 1-3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för manuella elastinfärgning. C: Läkarens bedömning av de individuella snitten med skala mellan 1–3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för automatiska elastinfärgningen.
Vid manuell färgning enligt Verhoeff fick de 2 njurvävnaderna betyget 3 i 2 fall samt betyget 2 i 4 fall. Vid automatisk färgning enlig Hart fick de 2 njurvävnaderna betyget 3 i samtliga 6 fall.
A: B:
C:
Figur 8. Kärl nära njure. A: Snitt till vänster manuellt färgade enligt Verhoeffs manuella elastinfärgning. Vid färgning blir de elastiska fibrerna svarta, övrig bindväv rött, muskler samt erytrocyter blir gula. Kollagen blir svagt rosa eller orange om omättad pikrinsyra används. Snitt till höger färgade automatiskt enligt Hart. Vid färgning med Hart blir elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått. Samtliga bilder togs med 100x förstoring. B: Läkarens bedömning av de individuella snitten med skala mellan 1-3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för manuella elastinfärgning. C: Läkarens bedömning av de individuella snitten med skala mellan 1-3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för automatiska elastinfärgningen.
0 1 2 3
Elastin Bakgrund Konstrast
P
oä
n
g
Manuell enligt Verhoeff
0 1 2 3
Elastin Bakgrund Konstrast
P
oä
n
g
Automatisk enligt Hart
Colon A Colon B Colon C
0 1 2 3
Elastin Bakgrund Kontrast
Manuell enligt Verhoeff
P oä n g 0 1 2 3
Elastin Bakgrund Kontrast
Automatisk enligt Hart
Po
än
g
13
Vid manuell färgning enligt Verhoeff fick de 4 hudvävnaderna betyget 3 i 6 fall samt betyget 2 i 6 fall. Vid automatisk färgning enlig Hart fick de 4 hudvävnaderna betyget 3 i 10 fall samt betyget 2 i 2 fall.
A: B:
C:
Figur 9. Hud. A: Hud A och B hade utsatts för långvarig solexponering. Huden C hade utsatts för mindre solexponering. Snitt till vänster manuellt färgade enligt Verhoeffs manuella elastinfärgning. Vid färgning blir de elastiska fibrerna svarta, övrig bindväv rött, muskler samt erytrocyter blir gula. Kollagen blir svagt rosa eller orange om omättad pikrinsyra används. Snitt till höger färgade automatiskt enligt Hart. Vid färgning med Hart blir elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått. Samtliga bilder togs med 100x förstoring. B: Läkarens bedömning av de individuella snitten med skala mellan 1-3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för manuella elastinfärgning. C: Läkarens bedömning av de individuella snitten med skala mellan 1-3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för automatiska elastinfärgningen.
Vid manuell färgning enligt Verhoeff fick navelsträngen betyget 3 i 1 fall samt betyget 2 i 2 fall. Vid automatisk färgning enlig Hart fick navelsträngen betyget 3 i 2 fall samt betyget 2 i 1 fall.
A: B:
C:
Figur 10. Kärl från navelsträng. A: Snitt till vänster manuellt färgade enligt Verhoeffs manuella elastinfärgning. Vid färgning blir de elastiska fibrerna svarta, övrig bindväv rött, muskler samt erytrocyter blir gula. Kollagen blir svagt rosa eller orange om omättad pikrinsyra används. Snitt till höger färgade automatiskt enligt Hart. Vid färgning med Hart blir elastinfibrerna svarta, kärnorna mörkblå, muskelvävnaden röd, övrig bindväv gult samt mucinet blått. Samtliga bilder togs med 100x förstoring. B: Läkarens bedömning av de individuella snitten med skala mellan 1-3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för manuella elastinfärgning. C: Läkarens bedömning av de individuella snitten med skala mellan 1–3 i kategorierna elastinfärgning, bakgrundsfärg och kontrasten mellan färgerna för automatiska elastinfärgningen.
0 1 2 3
Elastin Bakgrund Kontrast Manuell enligt Verhoeff
P oä n g 0 1 2 3
Elastin Bakgrund Kontrast
Automatisk enligt Hart
P
oä
n
g
Hud A Hud B Hud C Hud D
0 1 2 3
Elastin Bakgrund Kontrast
P
oä
n
g Manuell enligt Verhoeff
0 1 2 3
Elastin Bakgrund Kontrast
P
oä
n
g
Automatisk enligt Hart
14
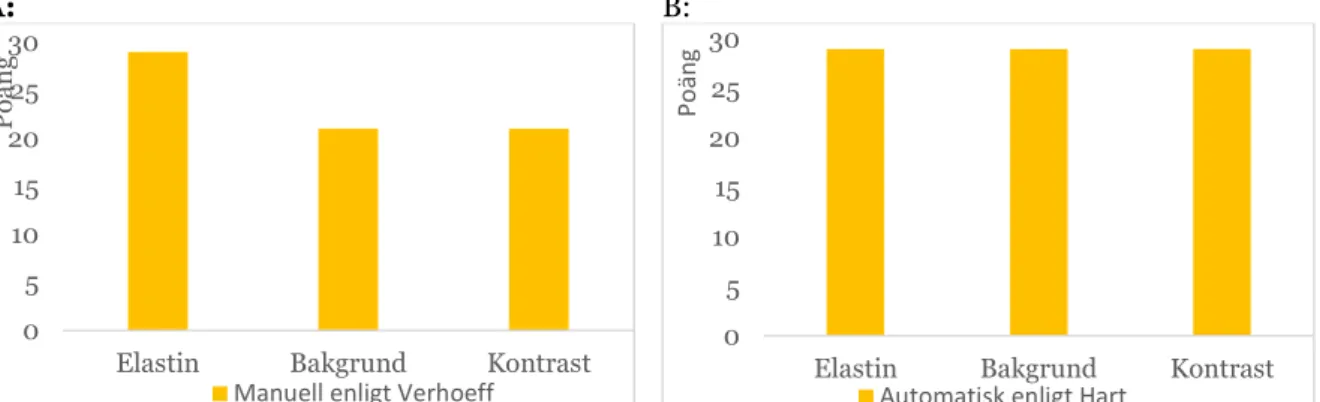
Wilcoxon Mann-Whitney-testet användes för jämförelsen och gav att 17 av 30 parametrar hade positiva ranker, 12 var lika och en parameter hade negativ rank. Värdet på Z var -3,771 (medelvärdet av Harts bedömning subtraherat med Verhoeffs bedömning) med en asymptotisk signifikans (p=0,000). En summering av läkarens bedömning enligt skalan 1-3 för samtliga snitt kan ses i figur 11. Sammanlagda poängen per kategori som snitten bedömdes med visas i figur 11 och kunde vara max 30 poäng per kategori.
A: B:
Figur 11. Summering av läkarens bedömning för samtliga snitt. Maximal kunde 30 poäng delas ut per de tre kategorierna elastinfärgning, bakgrundsfärgning och kontrasten mellan färgerna. A: Manuella elastinfärgning. B: Automatiska elastininfärgningen. 0 5 10 15 20 25 30
Elastin Bakgrund Kontrast
P
oä
n
g
Manuell enligt Verhoeff
0 5 10 15 20 25 30
Elastin Bakgrund Kontrast
Po
än
g
15
6. Diskussion
Syftet var att med hjälp av olika vävnadstyper optimera och implementera den automatiserad elastinfärgningen enligt Hart, för att ersätta den nuvarande manuella elastinfärgning enligt Verhoeff vid patologilaboratoriet på länssjukhuset Ryhov, Jönköping. Optimeringssteget innefattade att ett snitt av colon, hud, njure samt navelsträngsvävnad färgades in med elastinfärgningslösning i 8, 12 och 16 min för att se vilken tid som var optimal. Dessutom doppades snitten i etanol alternativt etanol samt xylen som dehydrering. Optimala tiden var 12 min och dehydrering som valdes var endast etanol. Till implementeringssteget användes colon (n=3), njure (n=2), hud (n=4) samt navelsträngssnitt (n=1) (totalt antal vävnader n=10) för jämförelsen mellan Verhoeffs och Harts metod. Snitten bedömdes vid jämförelsen mellan färgmetoderna i kategorierna elastinfärgning, kontrastfärgning samt kontrasten vilka bedömdes i skalan 1–3. Harts metod fick högre bedömning än Verhoeff på 17 av de 30 jämförelserna av infärgningarna vilket har gjort att användning av den automatiska färgningen enligt Hart har implementerats. Jämförelserna är de sammanlagda bedömning i de 3 kategorierna på alla 10 snitt färgade med samma metod, vilket betyder 30 jämförelse.
6.1 Metoddiskussion
Valet av vävnader gjordes baserat på tillgängliga samt utsvarade vävnader innehållande elastin som skulle kasseras. Navelsträngens kärl var annorlunda från kärlen i övrig vävnad då mindre elastin var närvarande, vilket försvårade bedömningen av infärgningen. Till nästkommande metodoptimering av elastinfärgning rekommenderas en annan vävnad användas i stället, så som lever med mer distinkta kärl med elastin (28). Sensitiviteten kan dock visas med användandet av navelsträngspreparatet, då preparat med mindre elastininnehåll ska kunna färgas in, där navelsträngen är en exempelvävnad (1). Att de specifika metoderna som valdes berodde på Verhoeffs manuella elastininfärgning användes sedan tidigare samt att Roche valt att använda elastininfärgningen enligt Hart i kittet till VENTANA BenchMark Special Stains. Vid läskningen av vävnaderna kunde mänskliga faktorn påverka kvalitén på infärgningen något, hur hårt filterpapperet trycktes mot vävnaden gav förändrad absorptionen av mängder färglösning. Även vävnaden i sig kunde repas alternativt skadas vid hårt tryck med filterpapperet. Framtida metodbeskrivning föreslås kompletteras med att filterpapperet trycks lätt för att undvika skada av vävnaden och variationen av infärgningen. Till framtida studier föreslås en undersökning av alternativ till läskning, så som ett ytterligare etanolbad. Målet bör vara en reducering av manuell hantering med ett mer reproducerbart resultat. Själva bedömningen av snitten gjordes av en läkare med subjektiva erfarenheter av vävnadsbedömning vilket eventuellt kan bytas ut mot ett digitalt objektivt analysverktyg för att minska den humana variationen i bedömningarna i framtida studier (29). Detta skulle även bidra till en mer likvärdig bedömning. Om två läkare skulle bedöma infärgningar skulle bedömningen också bli mer likvärdig.
6.2 Resultatdiskussion
Vid jämförelserna av de olika längderna på elastinfärgningslösningens infärgningstid på 8, 12 respektive 16 min vilket visas i figur 3–6 drogs slutsatserna att 8 min var för kort tid. Elastinfibrerna fick svagare färg i hud, colon samt njurvävnaden jämfört med 12 min exponering till elastinfärgningslösningen. Programmet som exponerade snitten för elastinfärglösningen i 12 min gav elastinfibrerna en mörkare färg med tydligare kontrast mot van Giesons bakgrundsfärgning med gula bindväv samt röda muskelstrukturer i blodkärlen. Exponering av vävnaderna till elastinlösningen i 16 min resulterade i att artefakter som färgrester fanns vid avläsningen. Elastininfärgningen var lika och kontrastfärgen blev mörkare, vilket resulterade i sämre kontrast mellan färgerna i jämförelse med 12 min. Beslutet blev att 12 min av infärgning med färglösningen var det optimala. Blodkärl är vad som framför allt färgas in med elastinfärgningsmetoder, vilket innebära att resultatet kan generaliseras (30). Xylenet är hälsofarligt med följden att användning bör undvikas. Vid optimeringen observerades att all infärgning blev lite mörkare samt färgresterna efter 16 min hade minskat något. Ingen större skillnad mellan vävnaderna med samt utan xylen kunde ses utöver detta vid jämförelse. Bedömningen blev att hälsorisken med xylen var större än nyttan av användning (31). Utfallet av optimeringssteget blev att vävnaderna färgades in med elastinfärgningslösningen i 12 min utan att doppas i xylen före monteringen.
Efter läkarens bedömning stod det klart att båda metoder gav en tydlig infärgning av elastinet. Detta var det viktigaste eftersom den medicinska bedömningen är beroende av en tydlig elastininfärgning. Jämförs de individuella värdena har den automatiska infärgningen en lite fördel. Navelsträngen fick dock sämre betyg i den automatiska färgningen. Den medicinska användningen av elastininfärgning av navelsträng i rutinarbetet är okänd. Studier och forskning om transplantationer av blodkärl från
16
navelsträngar till områden med skadade blodkärl vid exempelvis bypass operationer är aktuella användningsområden för vävnaden. Elastininfärgning förekommer vid denna forskning (32). Det omvända gäller för colon i rutinarbetet. Elastininfärgning av vävnad runt colon, speciellt runt kolorektalcancer har en viktig medicinsk funktion för att upptäcka venös invasion (33, 34). Emellertid fans endast små skillnaden i infärgning av elastinet samt att ingen infärgning underkändes, bör andra faktorer fälla avgörande i valet av färgning.
Kontrastinfärgningen samt kontrasten bedömdes oftast som optimal vid den automatiska infärgningen samt godkänd vid dem manuella. I dessa fall beskrevs bakgrunden som kraftigare vilket försvårade detektion av elastin. Vidare maskerades ofta musklernas gula färg vid den manuella färgningen. En förklaring skulle kunna vara att koncentrationen på pikrinsyran var för låg. Kriterierna bedömdes lika på 2 av hudarna. Huden där den automatiserade infärgningen endast nådde godkänd gjorde det på grund av solorsakad nedbrytning av strukturer, solelastos. Dessa resulterade i ospecifika färgförändringar som påverkade den automatiska infärgningen mer än vid den manuella. Huden med optimal kontrastinfärgningen med båda metoderna hade lägre mängden melanin jämfört med hud A samt B. Hud D innehöll järnpigment. En hypotes uppkom under arbetet i om Verhoeffs manuella elastininfärgning är känsligare för andra pigment än Hart, då en variation mellan de olika färgningsmetoderna uppkom när hud D infärgades. En undersökning av detta skulle vara mer av akademiskt intresse i nuläget då Harts automatiska infärgning totalt sett presterade bättre än Verhoeffs manuella elastininfärgning.
Vid statistiska analysen med Wilcoxon Mann-Whitney-test betecknades 17 parametrar med positiva ranks, vilket betyder att bedömningen av Harts var bättre än bedömningen av Verhoeffs elastinfärgning, bakgrundsfärgning och kontrast. Bedömningen av Harts metod subtraherades med bedömningen av Verhoeffs metod, vilket resulterade i positiva ranks. Bedömningen av 12 parametrar var lika samt bara en parameter hade negativ rank, alltså bara en parameter var bättre med Verhoeffs metod i jämförelse med Harts metod. Observationen blev att Harts metod var bättre statistiskt sett och till övrigt med tiden och hanteringen av kemikalier.
17
7. Slutsatser
Slutsatserna av optimeringen av Harts automatiska metod blev att snitten fick färgas in under 12 minuter i elastinfärgningslösningen samt att snitten ska läskas av samt doppas i etanol. Vid jämförelse var elastinfärgning enligt Hart bättre än elastinfärgning enligt Verhoeff. Färgmässiga förbättringen visades genom att 17 parametrar av 30 som jämfördes var bättre hos Hart än Verhoeff och hanteringsmässig förbättring visar att tidsåtgång för utföraren minskade samt antalet färgningstillfällen kan ökas vid användning av Hart. Den automatiserade metoden används nu därför på länssjukhuset Ryhovs patologavdelning. I framtida studier föreslås det att undersöka om Verhoeffs metod är känsligare för olika pigment än Harts metod. Vidare föreslås även att substituera läskningen med ett extra etanolbad samt att navelsträngspreparatet bytas ut mot ett leverpreparat.
8. Omnämnande
Författarna vill tacka all personal på patologilaboratoriet vid länssjukhuset Ryhov i Jönköping för överseende och hjälpsamhet under de veckor detta projekt genomfördes. Ett särskilt tack till Jeanette Karlsmo samt Andréa Lindh som tagit sig tiden att förklara och bedöma histotekniska processen och infärgningarna. Dessutom ska Thorun Frennvall ha ett stort tack för att hon jobbat med att professionellt bedöma samtliga snitt färgade med elastinfärgningarna. Slutligen vill vi tacka vår vetenskapliga handledare på Hälsohögskolan vid Jönköping university Elvira Hukasova för hennes tankar, idéer samt tålamod med det vetenskapliga skrivandet. Utan er skulle studien inte kunnat genomföras och lyckats. Tack!
18
9. Referenser
1. Percival KR, Radi ZA. A modified Verhoeff's elastin histochemical stain to enable pulmonary arterial hypertension model characterization. European journal of histochemistry. 2016;60(1):2588-. 2. Bronsert P, Weißer J, Biniossek ML, Kuehs M, Mayer B, Drendel V, et al. Impact of routinely employed procedures for tissue processing on the proteomic analysis of formalin-fixed paraffin-embedded tissue. Proteomics Clinical applications. 2014;8(9-10):796-804.
3. Vindin H, Mithieux SM, Weiss AS. Elastin architecture. Matrix biology. 2019;84:4-16. 4. Mecham RP, Levy BD, Morris SL, Madaras JG, Wrenn DS. Increased cyclic GMP levels lead to a stimulation of elastin production in ligament fibroblasts that is reversed by cyclic AMP. The Journal of biological chemistry. 1985;260(6):3255-8.
5. Kajiya H, Tanaka N, Inazumi T, Seyama Y, Tajima S, Ishibashi A. Cultured Human Keratinocytes Express Tropoelastin. Journal of investigative dermatology. 1997;109(5):641-4.
6. Narayanan AS, Larry BS, Russell R, Don LL. The Smooth Muscle Cell. III. Elastin Synthesis in Arterial Smooth Muscle Cell Culture. The Journal of cell biology. 1976;68(3):411-9.
7. Mariani TJ, Dunsmore SE, Li Q, Ye X, Pierce RA. Regulation of lung fibroblast tropoelastin expression by alveolar epithelial cells. The American journal of physiology. 1998;274(1):L47-L57.
8. Brown-Augsburger P, Broekelmann T, Rosenbloom J, Mecham RP. Functional domains on elastin and microfibril-associated glycoprotein involved in elastic fibre assembly. Biochemical journal. 1997;323(3):863-.
9. Li B, Alonso DOV, Daggett V. The molecular basis for the inverse temperature transition of elastin. Journal of molecular biology. 2001;305(3):581-92.
10. Vindin H, Mithieux SM, Weiss AS. Elastin architecture. In: tropoelastin. Ssocaco, editor. Matrix biology. Netherlands: Elsevier B.V; 2019. p. 10 Figure 3. Simplified schematic of coacervation and crosslinking of tropoelastin.
11. Blanchevoye C, Floquet N, Scandolera A, Baud S, Maurice P, Bocquet O, et al. Interaction between the elastin peptide VGVAPG and human elastin binding protein. The Journal of biological chemistry. 2013;288(2):1317-28.
12. Wachi H, Sugitani H, Murata H, Nakazawa J, Mecham RP, Seyama Y. Tropoelastin Inhibits Vascular Calcification via 67-kDa Elastin Binding Protein in Cultured Bovine Aortic Smooth Muscle Cells. Journal of atherosclerosis and thrombosis. 2004;11(3):159-66.
13. Thomas JB, Beth AK, Hideaki I, Claudio CW, Fred WK, Lijuan Z, et al. Tropoelastin Interacts with Cell-surface Glycosaminoglycans via Its COOH-terminal Domain. The Journal of biological chemistry. 2005;280(49):40939-47.
14. Percival K, Radi Z. Comparison of five elastin histochemical stains to identify pulmonary small vasculature. Journal of histotechnology. 2017;40(3):73-8.
15. Salvarani CD, Cantini FMD, Hunder GGMD. Polymyalgia rheumatica and giant-cell arteritis. The Lancet (British edition). 2008;372(9634):234-45.
16. Dawson H, Kirsch R, Driman DK, Messenger DE, Assarzadegan N, Riddell RH. Optimizing the detection of venous invasion in colorectal cancer: the ontario, Canada, experience and beyond. Frontiers in oncology. 2014;4:354-.
17. Petersen VC, Baxter KJ, Love SB, Shepherd NA. Identification of objective pathological prognostic determinants and models of prognosis in Dukes' B colon cancer. Gut. 2002;51(1):65-9.
18. Morris M, Platell C, de Boer B, McCaul K, Iacopetta B. Population-based study of prognostic factors in stage II colonic cancer. British journal of surgery. 2006;93(7):866-71.
19. Roxburgh CSD, McMillan DC, Anderson JH, McKee RF, Horgan PG, Foulis AK. Elastica Staining for Venous Invasion Results in Superior Prediction of Cancer-Specific Survival in Colorectal Cancer. Annals of surgery. 2010;252(6):989-97.
20. Kazlouskaya V, Malhotra S, Lambe J, Idriss MH, Elston D, Andres C. The utility of elastic Verhoeff-Van Gieson staining in dermatopathology. Journal of cutaneous pathology. 2013;40(2):211-25. 21. Krzyżanowski A, Kwiatek M, Gęca T, Stupak A, Kwaśniewska A. Modern Ultrasonography of the Umbilical Cord: Prenatal Diagnosis of Umbilical Cord Abnormalities and Assessement of Fetal Wellbeing. Medical science monitor. 2019;25:3170-80.
22. Parry S, Strauss JF. Premature Rupture of the Fetal Membranes. The New England journal of medicine. 1998;338(10):663-70.
23. Shefali, Sethi A, Tandon A, Shetty DC, Juneja S. Staining efficacy assessment of a differential routine and special stains for pathological stromal calcifications in maxillofacial lesions. Journal of histotechnology. 2020;43(3):118-24.
19
24. Fullmer HM, Lillie RD. THE STAINING OF COLLAGEN WITH ELASTIC TISSUE STAINS. The journal of histochemistry and cytochemistry. 1957;5(1):11-4.
25. Holland T, Holland C. Analysis of Unbiased Histopathology Data from Rodent Toxicity Studies (or, Are These Groups Different Enough to Ascribe It to Treatment?). Toxicologic Pathology. 2011;39(4):569-75.
26. Gibson-Corley KN, Olivier AK, Meyerholz DK. Principles for Valid Histopathologic Scoring in Research. Veterinary pathology. 2013;50(6):1007-15.
27. Lag om biobanker i hälso- och sjukvården m.m. (SFS 2002:297), 2002:297. Stockholm: Socialdepartementet.
28. Demetris AJ, Bellamy COC, Gandhi CR, Prost S, Nakanuma Y, Stolz DB. Functional Immune Anatomy of the Liver—As an Allograft. American journal of transplantation. 2016;16(6):1653-80.
29. Hernández-Morera P, Travieso-González CM, Castaño-González I, Mompeó-Corredera B, Ortega-Santana F. Segmentation of elastic fibres in images of vessel wall sections stained with Weigert's resorcin-fuchsin. Computer methods and programs in biomedicine. 2017;142:43-54.
30. Gudiene D, Baltrusaitis K, Rackauskas M. Features of elastic tissue staining and its arrangement in the wall of human basilar artery. Medicina (Kaunas, Lithuania). 2003;39(10):946-50. 31. Aydin I, Yörükoglu K, Cingöz S, Agilkaya S. The effect of the alternative solutions to formaldehyde and xylene on tissue processing. Indian journal of pathology & microbiology. 2013;56(3):221-30.
32. Mallis P, Gontika I, Poulogiannopoulos T, Zoidakis J, Vlahou A, Michalopoulos E, et al. Evaluation of Decellularization in Umbilical Cord Artery. Transplantation proceedings. 2014;46(9):3232-9. 33. Vass DG, Ainsworth R, Anderson JH, Murray D, Foulis AK. The value of an elastic tissue stain in detecting venous invasion in colorectal cancer. Journal of clinical pathology. 2004;57(7):769-72.
34. Ale Ali H, Kirsch R, Razaz S, Jhaveri A, Thipphavong S, Kennedy ED, et al. Extramural venous invasion in rectal cancer: overview of imaging, histopathology, and clinical implications. Abdominal radiology (New York). 2019;44(1):1-10.
20
10. Bilagor
Bilaga 1 – Dehydreringsprogram
Steg Reagenser Koncent
ration Program 1, 2 Kortprogram (små dosor) Program 3, 4 Rutinprogram (små dosor) Program 5, 6 Feta storsnitt (feta/ magra storsnitt
och feta små dosor)
Tider Temp Tider Temp Tider Temp
1 Formalin* 10% 5 m - 30 m 35˚ 30 m 40˚ 2 Kranvatten 5 m - 10 m - 10 m 40˚ 3 Alkohol 70% 5 m - 45 m - 2 h 30 m 40˚ 4 Alkohol 95% 5 m - 45 m - 2 h 30 m 40˚ 5 Alkohol 95% 10 m - 45 m - 2 h 30 m 40˚ 6 Alkohol** 100% 5 m - 50 m - 1 h 40˚ 7 Alkohol** 100% 10 m - 50 m - 2 h 40˚ 8 TissueClear 100% 5 m - 1 h - 1 h 30 m 40˚ 9 TissueClear 100% 10 m - 1 h - 2 h 40˚ 10 TissueClear 100% 15 m - 1 h - 2 h 40˚ 11 Paraffin - 5 m 63˚ 10 m 63˚ 20 m 63˚ 12 Paraffin - 10 m 63˚ 20 m 63˚ 40 m 63˚ 13 Paraffin - 20 m 63˚ 40 m 63˚ 2 h 63˚ 14 Paraffin - 25 m 63˚ 50 m 63˚ 3 h 63˚ Beräknad tid*** 2 h 15 m 9 h 35 m 22 h 40 m
* Formalin 10% motsvarar formaldehydlösning 4%
** Alkohol 100% motsvarar 99,5% etanol
21