INTRAORAL INJEKTION AV AKTIV OCH
ICKE-AKTIV LOKALANESTETIKA
- Normalt gensvar och gensvar i relation till upplevd
bedövningskänsla
Asadi Julia
Eriksson Louise
Handledare: Maria Pigg
Masteruppsats (30 HP)
Malmö universitet
Tandläkarprogrammet
Odontologiska fakulteten
2
Sammanfattning
Syfte
Det behövs mer forskning inom diagnostik för orofacial smärta. Syftet med studien är att undersöka om den subjektiva bedövningsupplevelsen som erhålls vid aktiv anestesi kan jämföras med den som erhålls vid injektion av aktiv placebo, samt om aktiv placebo påverkar smärttröskel samt smärtkänslighet vid stickstimuli hos friska individer.
Material och metod
31 friska deltagare randomiserades i tre grupper. En grupp fick aktiv injektion (Xylocain 2,0 %), en grupp fick aktiv placebo injektion (Xylocain 0,1%) och en grupp fick icke aktiv placebo (fysiologisk koksaltlösning). Deltagarna utsattes för tre intraorala tester före och efter injektion som mätte mekaniskt beröringsstimuli, smärta vid stickstimuli, smärttröskel samt stimuluskvalitet. Deltagarna fick efter injektion gradera sin bedövningsupplevelse på en 0-10 NRS skala.
Resultaten analyserades med parat T-test, ANOVA One-Way, post-hoc T-test med Bonferronickorrektion samt Fishers exakta test. P<0,05 ansågs vara statistiskt signifikant.
Resultat
Bedövningsupplevelsen i gruppen aktiv placebo skilde sig signifikant från aktiv injektion (p<0,001) men inte från icke-aktiv placebo (p=0,980). Sticksmärttröskeln vid aktiv placebo skilde sig signifikant från aktiv injektion (p<0,001) men inte från inaktiv placebo (p = 0,052). Smärtintensitet vid stickstimuli skilde sig signifikant mellan före och efter injektion inom gruppen aktiv injektion (p=0,035) men inte för aktiv placebo (p = 0,690) och icke-aktiv placebo (p = 0,726).
Slutsats
Ingen skillnad sågs mellan icke-aktiv placebo och aktiv placebo i förmågan att förändra friska deltagares smärttröskel samt smärtkänslighet för stickstimuli och samtidigt ge en upplevelse hos deltagaren om att vara bedövad. Aktiv placebo gav alltså ingen fördel framför icke aktiv placebo. 0,1 % Xylocain uppfyller inte de krav som kan ställas på en bra aktiv placebo.
INTRAORAL INJECTIONS OF
ACTIVE/NON-ACTIVE LOCAL
ANESTHETIC AGENTS
- Normal response and response in relation to
perceived numbness.
Asadi Julia
Eriksson Louise
Supervisor: Maria Pigg
Master Thesis in Odontology (30 ECTS)
Malmö University
Dentistry Program
Faculty of Odontology
4
Abstract
Aim
More research is needed in diagnostics of orofacial pain. Investigating whether the subjective anesthetic experience obtained in active anesthesia can be compared to that obtained with the injection of active placebo, and whether active placebo affects pain threshold and pain sensitivity under a piercing stimulus in healthy individuals.
Materials and Methods
31 healthy subjects were randomized into three groups. One group received active injection (Xylocain 2.0 %), one group received active placebo (Xylocain 0.1 %) and one group received non-active placebo (physiological saline). The participants were subjected to three intraoral tests before and after injection, which measured allodynia, pain sensitivity under a piercing stimulus, pain threshold and stimulus quality. Participant appreciated their anesthetic experience on a 0-10 NRS scale after injection.
Results
The anesthetic experience in the active placebo group was significantly different from active injection (p <0.001) but not from non-active placebo (p=0.980). The pain threshold at active placebo was significantly different from active injection (p <0.001) but not from non-active placebo (p = 0.052). Pain intensity in stick stimuli was significantly different between pre- and post-injection within the active post-injection group (p =0.035) but not for active placebo (p = 0.690) and non-active placebo (p = 0.726).
Conclusion
The study found no difference between non-active placebo and active placebo in the ability to alter healthy participant's pain threshold and pain sensitivity under a piercing stimulus and at the same time give the participant an experience of being anesthetized. 0.1% Xylocain does not meet the requirements for a good active placebo.
5
Innehållsförteckning
Sammanfattning 2 Abstrakt 4 Introduktion 6Smärta
6Diagnostik av intraorala känselförändringar 9
Lokalanestesi som ett diagnostiskt hjälpmedel 13
Placebo och placeboeffekten 14
Syfte 15
Vetenskaplig frågeställning 15
Material och metod 16
Deltagare 16 Inklusions-/exklusionskriterier 16 Etiska hänsynstagande/sekretess 16 Pilotstudie 16 Studiedesign 16 Försöksprotokoll 16 Utrustning 16
Antal deltagare och randomisering 17
Experimentgrupper 17 Plats för experiment 17 Anatomisk lokalisation 17 Arbetsgång 17 Hälsoanamnes 18 Injektionsprocedur 18 Utfallsmått 18 Statistiska metoder 19 Resultat 20
Beskrivning av deltagares egenskaper 20
Beröringsuppfattning 20
Bedövningskänsla 21
Stimuluskvalitet (vasst/trubbigt) 22
Smärtintensitet stickstimulus med Pin-Prick 22
Smärttröskel 23
Diskussion 24
Material och metod 24
Statistiska metoder 24
Resultat 25
Kliniska aspekter 26
Diagnostik och placebo, dess etiska aspekt? 26
Framtida studier 27
Konklusion 28
6
Introduktion
Smärta DefinitionSmärta definieras, enligt International Association for the Study of Pain (IASP), som en obehaglig sensorisk och känslomässig upplevelse förenad med vävnadsskada eller hotande vävnadsskada eller beskriven i termer av sådan skada (1, 2, 3). Smärta är alltid subjektivt och varje individ lär sig betydelsen av ordet genom egna erfarenheter av vävnadsskada. Oftast försvinner smärtan när läkning av en vävnadsskada skett. I en del fall kan smärtan bli långvarig. Akut smärta är ett symptom, till skillnad från kronisk, långvarig smärta som mer är ett tillstånd i sig då det inte kan kopplas direkt till en sjukdom eller vävnadsskada. Definitionen av långvarig smärta är en smärta som kvarstår efter 3-6 månader, då en vävnadsskada förväntas ha läkt ut (2, 3).
Perifer och central sensitisering
Efter en skada kan primär eller sekundär hyperalgesi (ökad känsla av smärtsamt stimuli) ske. Den primära hyperalgesin upplevs i skadeområdet det vill säga lokalt. Detta kallas för perifer sensitisering som karaktäriseras av en ökad känslighet för stimuli. Denna ökade smärtkänslighet uppstår efter en skada som lett till en nociceptiv respons med frisättning av ett stort antal neuropeptider. Den sekundära hyperalgesin innebär en så kallad central sensitisering som innebär en ökad känslighet hos neuron på ryggmärgsnivå nivå som följd av en perifer skada. Smärtan övergår till att vara långvarig (4). Neuron får en ökad känslighet som följd av den perifera skadan vilket förändrar själva smärttransmissionen i det centrala nervsystemet – s k neuronal plasticitet. Detta gör att smärtdurationen förlängs, och smärthämmande mekanismer (som finns centralt och utgår från kärnor i hjärnstammen), nedregleras och bidrar till den kroniska smärtan. Resultatet blir en sensitisering som kvarstår i det nociceptiva systemet, trots att inflödet från nociceptorerna slutat och skadan har läkt. En enkel beskrivning kan vara att smärtsystemet reagerar mer än vanligt med avvikande känslighet från det normala (5).
Begreppet smärttröskel innebär den lägsta stimulansnivå där individen uppfattar ett stimulus som smärtsamt. Smärttröskel för tolerans, toleranströskel, innebär den stimulansnivå som medför den högsta smärta patienten kan tolerera (6).
Perifer sensitisering kan göra att smärttröskeln sänks vid akuta smärttillstånd men toleranströskeln är oförändrad eller eventuellt sänkt. Vid långvariga smärttillstånd är smärttröskeln ofta sänkt, p g a central sensitisering, medan toleranströskeln ofta är höjd allteftersom patienten finner olika strategier för att hantera sin ständigt pågående smärta, man ”vänjer sig vid smärtan” (6).
Smärtutredning
När man ska behandla smärta är den centrala delen vid smärtbehandling att försöka diagnostisera och åtgärda orsaken till smärtan. En smärtanalys ska göras, och helst ska den leda till en diagnos som leder till rätt behandling, det vill säga orsaksinriktad behandling. Man behöver då fastställa om smärtan beror på en vävnadsskada som fortfarande är oläkt, om den underhålls av skada eller sjukdom i nervsystemet, eller kanske fortgår på grund av sensitisering smärtsystemet inklusive störd smärtinhibition. För bedömning av prognos kan det vara av värde att smärttillståndet bedöms
7 med hjälp av en smärtanamnes utifrån smärtintensitet som kan indelas i kategorier – lätt, måttlig, svår, eller med skalor exempelvis numerisk skattningsskala (NRS), visuell analog skala (VAS), eller indelning utefter smärtans tidsmässiga förlopp – akut eller långvarig smärta (3).
Nociceptiv smärta
Nociceptiv smärta uppstår när nociceptorer – högtröskliga receptorer – aktiveras. Dessa finns i kroppens vävnader speciellt i hud, slemhinnor, ögats hornhinna, trumhinnan och tandpulpan. Smärtan uppstår efter en vävnadsskada och det kan finnas olika fysiologiska förklaringar till den nociceptiva smärtan. När en vävnadsskada sker kan en inflammatorisk reaktion ske med mål att stimulera läkning. Nociceptiv smärta i kliniken är oftast relaterad till vävnadsskada och inflammation. Nociceptiv smärta i sig innebär att nociceptorer i normal funktion är inblandade, dvs det är inget fel på dem och reaktionerna är helt normala (2, 5).
Inflammation och smärta
Vid en inflammatorisk reaktion i samband med vävnadsskada bildas det mer arakidonsyra från skadade cellmembran som sedan metaboliseras till prostaglandiner, leukotriner och tromboxaner. Denna transformation stimuleras av enzymer som kallas cyclooxygenaser (COX). De två huvudsakliga typerna är COX-1 som ständigt bildas samt COX-2 som induceras av inflammation. Prostaglandiner har både algogena och sensitiserande funktioner i och med att de aktiverar nociceptorer samt sänker retningströskeln vilket gör att det inte behövs en lika stark stimulering för att skapa en smärtimpuls än vad som är normalt – perifer sensitisering. Tillväxtfaktorer, cytokiner och serotonin är exempel på andra algogena substanser som immunceller släpper ut vid en inflammation. Frisättning av exempelvis prostaglandiner och neuropeptider leder till dilation av arterioler, och då uppstår värme och rodnad. Mastceller frisätter histamin vilket vidare leder till kontraktion av endotelceller. Ett s k endotelgap bildas varifrån plasmaproteiner sprids ut i vävnaden och svullnad sker. Dessa plasmaproteiner kan transformeras till bradykinin som är algogen det vill säga smärtalstrande (2).
Nervernas del i den inflammatoriska reaktionen är att föra vidare smärtan samt hålla igång den inflammatoriska reaktionen vilket i sin tur leder till läkning. I smärtfibrernas nervändslut finns det neuropeptider och dessa släpps iväg när nociceptorerna stimuleras. Exempel på dessa är substans P och CGRP som bidrar till inflammationssymptomen. Smärtneuronen har även ett nära samspel med immunsystemet. Immunceller, exempelvis lymfocyter och makrofager, samlas i området och cytokiner frisätts vilket håller i gång inflammationen och aktiverar smärtfibrer. När det senare är dags för läkning släpps andra cytokiner som låter nervändsluten att uttrycka opioida receptorer samt triggar immunceller att frisätta opioider. Smärtfibrer släpper färre transmittorer när opioider binder till opioida receptorer och då upphör inflammationen och därmed dess symptom (2).
Neuropatisk smärta
Neuropatisk smärta definieras enligt IASP som ”smärta orsakad av skada eller sjukdom i det somatosensoriska nervsystemet”(7). Den här typen av smärta kan uppstå efter trauma, en iatrogen skada t ex efter ett kirurgiskt ingrepp eller ha sin grund i en sjukdom, oftast virusinfektion eller en neurologisk sjukdom. I nervsystemet finns det en hel del neurobiologiska mekanismer både perifert (afferent nerv, ganglion) och centralt (hjärna, hjärnstam och ryggmärg) som kan leda till att smärta bildas och fortlöper. Neuropatisk smärta är en klinisk beskrivning och inte en diagnos. Man utgår
8 från kliniska fynd och tillstånd som man sen bedömer vara mer eller mindre sannolika att ha neuropatiskt ursprung. Om smärtorsaken anses vara neuropatisk måste det finnas en lesion eller sjukdom bakom, som kan härledas till det neuropatiska tillståndet (8, 9, 10). Den kliniska bilden hos patienter med en neuropatisk smärta är en smärta som är mer eller mindre konstant. Smärtan är ofta brännande och molande, vanligen av mycket hög intensitet och det är svårt att uppnå smärtlindring. Patienten har både spontan smärta samt smärta som framkallas av stimuli. Med detta menas att patienten kan uppleva extra mycket smärta vid vanliga vardagliga funktioner som tuggning, intag av kalla och varma drycker, och liknande (2). I smärtområdet upplever patienten ofta förändrade känselintryck. Exempel på detta är obehag, spänning eller känsla av avdomning som uppstår spontant (parestesi/dysestesi) eller smärta som utlöses vid stimuli som normalt inte ska utlösa smärta (allodyni). Här har känselfunktionen förändrats kvalitativt vilket kan härledas från patologi perifert och centralt i det somatosensoriska systemet. Även smärtsummation är vanligt, då en viss typ av nervceller de så kalladeWide Dynamic Range (WDR) neuronerna i hjärnstammen förstärker smärtan vid upprepade stimuli. Dessa neuron har synapser med perifera neuron, både i ytliga och djupa strukturer, vilket kan förklara svårigheter att lokalisera smärta samt refererad smärta – upplevd smärta i ett område som ej utsatts för smärtstimuli. Dessa neuron är även känsliga för upprepade stimuli med korta mellanrum, vilket ger en ökad känslighet och retbarhet (2, 11). Kvantitativa förändringar gällande känsel är även vanligt. Exempel på kvantitativa förändringar är en minskad eller ökad känslighet för beröring och temperatur (hypo- eller hyperestesi). Även hypo-eller hyperalgesi kan förekomma som innebär sänkt- eller ökad känslighet för smärtsamma stimuli (2).
Det finns tillstånd i det orofaciala området som kan ha orsak i en nervskada. Symptom hos patienter med trigeminusneuralgi är en intensiv smärta som kommer i attacker under upp till ett par minuter. Attackerna kan komma flera gånger per dygn och det är även vanligt att perioder utan attacker uppstår, men med en svagare, molande värk (12). De typiska attackerna för trigeminusneuralgi kan förväxlas med dental smärta, då smärtan från tänder och käkar är svåra att definiera till ett specifikt område. Det är förgreningar av trigeminusnerven som skadats i gangliet, oftast N maxillaris eller N mandibularis. Beröring i området av den skadade förgreningen utlöser smärta vilket gör att vardagen påverkas då smärta utlöses vid vanlig funktion som att prata och äta (2).
Ett kirurgiskt ingrepp kan orsaka orofacial neuropatisk smärta om en perifer nerv skadas vid operationen. Nerven kan läka men dess struktur och funktion ändras om läkningen eller återbildande av nerven inte sker korrekt. Normalt ligger läkningstiden på cirka 3-6 månader och om smärtan kvarstår längre än så efter ett trauma eller en operation så kan man misstänka att smärtan har blivit kronisk och är av neuropatisk etiologi (2, 5).
Smärtor i en region där en tand extraherats eller fått rotbehandling, kallas atypisk odontalgi. Andra benämningar kan vara idiopatisk tandsmärta eller ihållande dentoalveolär smärta (PDAP) (13, 14) Främst upplever patienterna vid klinisk undersökning kontinuerlig eller nästan kontinuerlig spontan smärta som ofta är av hög intensitet, i genomsnitt NRS 5-6 (14). Även smärta vid perkussionstest, palpation och beröring av området är vanligt. I dessa fall är det viktigt med en noggrann anamnes samt undersöka närvaro av eventuella patologiska fynd som kan tyda på andra diagnoser som apikal parodontit eller patologiska cystor. Hos de flesta patienter med atypisk odontalgi saknas patologiska fynd i hård- och mjukvävnad. I anamnesen finner man vanligen en historik av tidigare tandbehandlingar som inte gett smärtlindring, och ofta debuterade smärtan i samband med tandbehandling. Eftersom lokal orsak till smärtan saknas, kommer ytterligare tandbehandling i området inte leda till smärtlindring då de mekanismer som underhåller smärtan huvudsakligen är centrala och/eller av neuropatisk typ. Därför är det viktigt att inga irreversibla
9 odontologiska ingrepp utförs om det inte finns en klar dental orsak och en diagnos för smärtan som indicerar behandling (2, 5). Det finns kunskapsluckor gällande neuropatisk smärta, dess orsaksfaktorer och diagnostik. Betydelsen av att förstå tillståndet och få ökad kunskap om hur det diagnosticeras och behandlas är betydande. Feldiagnosticerade patienter riskerar både över- och underbehandling vilket i förlängningen skapar negativa följder för individ, vården och samhälle (14).
Diagnostik av intraorala känselförändringar
Orofacial smärta har i studier visat sig vara ett vanligt förekommande problem i samhället (15). Den bakomliggande sjukdomsmekanismen kan vara av neuropatiskt och/eller nociceptivt ursprung. Diagnostiken vilar mycket på patientens symptombild samt subjektiva upplevelse vilket gör differential diagnostiken komplicerad eftersom att liknande beskrivning av symptom och klinisk bild förekommer hos flera av de olika smärttillstånden i det orofaciala området (15). Detta kräver tillförlitliga diagnostiska test som förmår att skilja smärta med olika ursprung från varandra eftersom att behandlingsstrategierna samt prognos skiljer sig beroende på ursprung och subjektiv upplevelse av smärtan (14, 15).
Förändringar av somatosensorisk funktion är karaktäristiskt för neuropatiska smärttillstånd (16) och förekommer även orofacialt, till exempel vid atypisk odontalgi som anses vara ett neuropatiskt smärttillstånd (14, 17). Quantitative sensory testing (QST) är en metod där en rad olika tester mäter olika aspekter av somatosensorisk funktion (16, 18). QST är till sin natur ett psykofysiskt test där sambandet mellan standardiserade fysiska retningar av sinnesorganen och uppfattningen, upplevelsen och urskiljning av dessa kartläggs vilket innebär att testen är objektiva men rapporteras subjektivt (19, 20).
2006 publicerade ett tysk forskningslag, lett av professor Roman Rolke, ett tillförlitligt QST-protokoll som ger en komplett somatosensorisk profil (20). Protokollet har fått stor
genomslagskraft och har i senare studier även bekräftats lämpligt för intraoral tillämpning, med acceptabel inter- och intra-reliabilitet (tillförlitlighet) (15). Protokollet består av tretton tester som mäter relevanta nervfunktioner (20,15):
• Tröskel för uppfattning av kyla (CDT): Mäter termisk funktion vid kylstimuli. En termod anläggs mot mätplatsen på slemhinna/hud och sjunkande temperatur förmedlas via
termoden från en termotestapparat. Då patienten uppfattar kyla signalerar patienten att avsluta mätningen. Den registrerade temperaturen antecknas som deltagarens köldtröskel. Medelvärdet av tre mätningar beräknas som köld-tröskel.
• Tröskel för uppfattning av värme (WDT): Mäter termisk funktion vid värmestimuli. En termod anläggs mot mätplatsen på slemhinna/hud och stigande temperatur förmedlas via termoden från en termotestapparat. Då patienten uppfattar värme signalerar patienten att avsluta mätningen. Den registrerade temperaturen antecknas som patientens värme-tröskel. Medelvärdet av tre mätningar beräknas som deltagarens värme-värme-tröskel. • Sensorisk uppfattning av termiska stimuli (TSL): Mäter termisk funktion vid
alternerande värme- och kylstimuli. En termod anläggs mot mätplatsen på slemhinna/hud och avger alternerande stigande/sjunkande temperatur via termoden från en
termotestapparat. Deltagaren signalerar vid värme och kyla och ett intervall skapas. Detta registreras som inom vilket intervall deltagaren förmår uppfatta kyla och värme.
10 • Paradoxal uppfattning av värme (PHS): Mäter termiska funktioner. En termod anläggs
mot mätplatsen på slemhinna/hud och avger sjunkande temperatur via termoden från en termotestapparat. Deltagaren signalerar vid uppfattning av värme.
• Tröskelvärde för smärta vid kyla (CPT): Mäter termisk funktion. En termod anläggs mot mätplatsen på slemhinna/hud och avger sjunkande temperatur via termoden från en termotestapparat. Då deltagaren uppfattar köldsmärta signalerar deltagaren att avbryta mätningen och den registrerade temperaturen antecknas som patientens köldsmärt-tröskel. Medelvärdet av tre mätningar antecknas.
• Tröskelvärde för smärta vid värme (HPT): Mäter termisk funktion. En termod anläggs mot mätplatsen på slemhinna/hud och avger stigande temperatur via termoden från en termotestapparat. Då deltagaren uppfattar värmesmärta signalerar deltagaren att avbryta mätningen och den registrerade temperaturen antecknas som patientens värmesmärt-tröskel. Medelvärdet av tre mätningar beräknas.
• Tröskelvärde för uppfattning av mekaniskt stimuli (MDT): Mäter mekanisk funktion. Mäts med ett standardiserat set av modifierade von Frey filament som applicerar krafter på en skala mellan 0,25–512 mN mot en mätplats på slemhinnan/huden.
• Tröskelvärde för smärta vid stickstimuli (MPT): Mäter mekanisk funktionen. Mäts med hjälp av viktade Pin Prick stimuli med standardiserade krafter i en skala (8–512 mN). • Smärtkänslighet vid mekaniska stimuli (MPS): Mäter mekanisk funktion där
känsligheten mot ett vasst stimuli uppmäts hos deltagaren. Mäts med samma teknik som för MPT men är registreras smärtintensitet enligt en numerisk skala 0-100 (”0” indikerar ingen smärta och ”100” motsvarar den värsta tänkbara smärtan).
• Allodyni vid dynamiskt mekaniskt stimuli (ALL/DMA): Mäter mekanisk funktion. Smärta vid försiktig strykning med ett lätt tryck mot gingivan (DMA) är ett tecken på central sensitisering. Mäts genom taktila instrument med krafter ca 3 mN, 100 mN samt 200 mN.
• Wind-up ratio (WUR): Mäter stimulus respons-funktion genom upprepad pinprick stimulering på en plats på slemhinnan. Metoden registrerar förekomst av temporal smärtsummation, wind-up ratio.
• Tröskelvärde för uppfattning av vibration (VDT): Mäter stimulus respons-funktion. Mäts genom att en vibrationsgivande stämgaffel placeras mot mätstället, och vibrationerna avtar gradvis. Då deltagaren inte längre uppfattar vibration registreras vibrationströskeln. Medelvärdet av tre tester beräknas och är deltagarens vibrationströskel.
• Tröskelvärde för smärta vid tryck (PPT): Mäter stimulus respons-funktion och testar den djupa smärtförnimmelsen. Mäts med en digital tryckalgometer (SOMEDIC Algometer, SOMEDIC Sales AB, Sweden) genom att man ökar trycket mot mätstället gradvis tills deltagaren uppfattar trycket som smärtsamt vilket motsvarar trycksmärttröskeln. Medelvärdet av tre mätningar beräknas som deltagarens trycksmärttröskel.
11 Figur 1 – QST-protokoll (20).
Ett annat instrument som kan användas vid mätning av MPT och MPS på mucosa intraoralt är Elektroniskt von Frey (EvF, Somedic AB, Hörby, Sweden). EvF uppmäter somatosensoriska funktioner på kortare tid än viktad Pin Prick och är ett användbart verktyg för att mäta intraoral smärtupplevelse (21, 22) men metoden måste valideras innan den kan rekommenderas för generell användning.
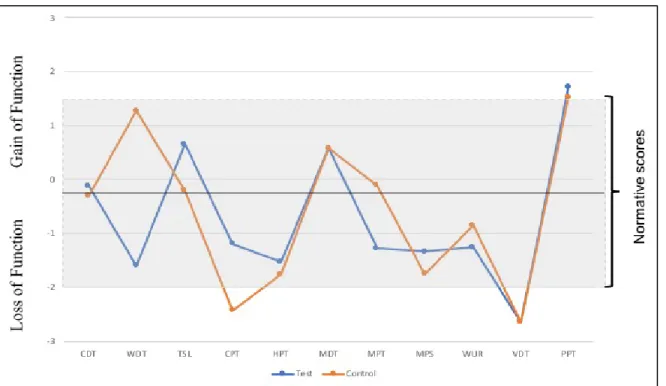
En QST-profil skapas genom att jämföra med tidigare insamlade normala referensvärden hos friska kontroller, och på så sätt kan man se vilka somatosensoriska funktioner som eventuellt är avvikande för patienten. Ett exempel på detta ses i figur 2 där en patient har undersökt på Tandvårdshögskolan i Malmö. QST är en metod som kräver speciell utrustning och kompetens för att kunna tolka värdena av testet vilket gör att enbart ett fåtal universitetskliniker kan erbjuda utredningen till patienter. En enklare screening-undersökning rekommenderas därför att användas då man misstänker neuropati som smärtorsak, en så kallad undersökning. I en QualST-undersökning används inte normalintervallet som referens utan ett friskt kontrollområde, exempelvis gingiva på motsatt sida om det smärtdrabbade området vid intraoral undersökning,
12 används som referens vid undersökningen. QualST-undersökning har använts i studier men kan inte jämföras med en fullständig QST-undersökning (17).
Figur 2 – QST-profil skapad efter fullständig QST-utredning utförd på en patient. Det grå fältet motsvarar normalintervallet (medelvärde ±2 standardavvikelser för friska individer) och värden som ligger utanför detta innebär abnorm känseluppfattning. Tillstånd att publiceras av M. Pigg.
QST-protokollet är en utredningsmetod som kan bidra till diagnosen men kan inte ensamt ställa neuropatisk diagnos (15, 20). Om utredningen på patienten visar tecken på somatosensoriska förändringar är den neuropatiska diagnosen trolig, vilket i sin tur kan användas för att vidare utreda patienten. Även om det finns diagnostiska kriterier för neuropatisk smärta så omfattar de inte alla tillstånd då många patienter har smärttillståndet utan en känd bakomliggande orsak. Kunskaperna om dessa idiopatiska tillstånd, både i det orofaciala området och i övrigt, är otillräckliga och föremål för mycket forskning (14).
Känselundersökning är en metod som kan påvisa förändrad känseluppfattning i smärtområdet samt ge viss antydan ifall perifera eller centrala smärtmekanismer är de mest bidragande. Till exempel anses förekomst av allodyni och temporal smärtsummation (wind-up) indikera central sensitisering (14). En annan metod som kan ge upplysning om perifer respektive centralt engagemang är perifer nervblockad med lokalanestesi. Om smärtmekanismerna har ett perifert ursprung underhålls smärtan av smärtimpulser från periferin vars impulser eventuell skulle kunna hindras av lokalanestesi. Men om smärtan är centralt betingad uppstår ingen blockad av smärtimpulser genom perifer lokalanestesi. Detta innebär att injektion med lokalanestetika skulle kunna vara ett viktigt diagnostiskt hjälpmedel vid till exempel kronisk tandsmärta som misstänks ha neuropatiskt ursprung (14). Men metoden är inte utförligt studerad eller validerad. För att undersöka hur en injektion med lokalanestetika i diagnostiskt syfte påverkar känselfunktionen i området skulle man kunna använda sig av de somatosensoriska testen i QST som utfallsmått, till exempel de test som påvisar förändringar i smärtuppfattning exempelvis smärttröskel eller smärtkänslighet för stick.
13
Lokalanestesi som ett diagnostiskt hjälpmedel
Efter en vävnadsskada, vid exempelvis ett kirurgiskt ingrepp då nociceptorer aktiveras, inflammation uppstår och i en del fall nervskador sker, domineras den kliniska bilden av smärta vid området för vävnadsskadan. Ofta är regionen extra känslig för stimuli som normalt ej framkallar smärta. De flesta patienter svarar bra på opioider och COX-hämmare, det vill säga smärtlindrande analgetika. Om nervskada skett kan en neuropatisk komponent av smärta utvecklas direkt och sen persistera i frånvaro av annan perifer vävnadsskada eller pågående perifera inflammationer. Denna smärta, när den väl etablerats, kommer troligen vara resistent mot COX blockerare, och mer eller mindre även för lokalanestetika som används inom tandvården (5). Tandläkaren har en viktig uppgift när det gäller orofacial smärta. Eftersom orofacial smärta kan ha flera olika orsaker gäller det för behandlaren att via en ingående anamnes samt klinisk och radiologisk undersökning fastställa om smärtans ursprung ligger lokalt dvs beror på något dentalt tillstånd som tandfraktur, apikal parodontit, pulpit, TMD och så vidare. Om det inte går att bekräfta lokala orsaker till smärtbilden måste neuropatisk etiologi övervägas. Neuropatisk smärta kräver annorlunda behandling än annan orofacial smärta, vilken betonar vikten av att kunna skilja på dem (10).
Vid bedövning av ett specifikt område det vill säga lokalbedövning så är verkningsmekanismerna lokala vilket innebär att de är perifert verkande. Därför kan lokal anestesi vara ett bra hjälpmedel för att avgöra om smärtan är perifer eller om centrala mekanismer är involverade. Vid smärta som underhålls på en central nivå kommer lokal anestesi därmed ha måttlig verkan eller ingen effekt alls på smärtan (23).
Exempel på detta finns i en studie som granskat den analgetiska effekten av lokal anestesi hos patienter med atypisk odontalgi. Deltagarna i studien upplevde en signifikant men inte total smärtfrihet efter administration av lokalanestesi jämfört med placebo. Dessa fynd indicerar att den spontana smärtan till viss del beror på perifera afferenta inslag men även att sensitisering av neuroner på högre (centrala) nivåer kan vara involverade i patofysiologin (14). Tandbehandlingen åstadkommer troligen nervskada på till exempel pulpala afferenter, som sedan kan läka på ett felaktigt sätt och/eller att förlängd postoperativ smärta via neural plasticitet åstadkommer permanent förändrad funktion i smärtbanan på hjärnstamsnivå dvs en permanent central sensitisering eller kanske störd smärtinhibition. De exakta mekanismerna är ännu okända och kan troligtvis variera inom patientgruppen (14). Lokal anestesi kan vara en bra metod för att finna källan till smärta och dess mekanismer (24).
Lokal anestesi definieras som ”förlust av känsel i ett begränsat område orsakad av sänkt excitation av nervändar eller blockering av fortledningsprocessen i perifera nerver” (25).
Vid bedövning av ett område blockeras impulsledningen i nervfibrerna reversibelt genom att hämma transporten av natriumjoner genom cellmembranet. Dessa läkemedel kan appliceras på hud och slemhinnor det vill säga ytanestesi eller injiceras i vävnader s.k. infiltrationsanestesi (2). Lokalanestetika minskar eller motverkar den ökning av natriumjonspermabiliteten som sker i och med membrandepolariseringen. Natriumjoner som strömmar in i axonet hämmas, excitabiliteten minskar och impulsfortledningen försvåras. Molekylstrukturen i lokalanestetikan innehåller både lipofila och hydrofila områden vilket påverkar passagen genom cellmembranet. De är svaga baser med pKa-värden kring 7-8. Därför gynnar ett område med lågt pH, tex ett infektionsområde med hög mängd sura metaboliter, en ökad jonisering av lokalanestesimedlet. Injektion av lokalanestesi i ett inflammerat område lär därmed ha sämre effekt (26).
14 Lokalanestesimedel minskar alltså natriumjonspermabiliteten som behövs för den initiala fasen av aktionspotentialen. Depolariseringar som passerar längs med nerven hindras, och om den redan är igång så hindras den från att fortsätta vidare. Ju närmre bedövningsmedlet är nerven ju snabbare börjar dess verkan. Ju mindre diameter nerven har, ju snabbare är diffusionshastigheten in till nerven (27).
Placebo och placeboeffekten
Placebo innebär en behandling som rent biologiskt inte har någon effekt på sjukdom eller sjukdomens symptom. Om denna placebobehandling ändå genererar positiva effekter hos den som får behandlingen har det uppkommit en placeboeffekt (28). Placeboeffekten är relaterad till förväntningar hos patienten. Studier har visat att vid smärtbehandling har samma områden i hjärnan aktiverats vid behandling med den farmakologiskt aktiva substansen som då en icke verksam substans har givits. De två mest involverade delarna i hjärnan vid placeboeffekt är amygdala och hippocampus (29). Amygdala behandlar informationen sett till dess emotionella påverkan av stimuli medan hippocampus är hjärnans minnescentrum. Därför ser man amygdala som den aktiva komponenten bakom hur förväntningar påverkar placeboeffekten, medan hippocampus är involverad i hur patienten reagerar på behandlingen. Betydelsen av placeboeffekten är stor. Då nya läkemedel skall testas måste deras effekt vara så pass stor att de överskrider effekten hos placebobehandlingen i kontrollgruppen. Detta ställer även krav hos den som testar den ”nya behandlingen” att veta effekten av andra faktorer på behandlingens resultat. Placeboeffekten är till en stor del beroende av psykologisk påverkan där deltagarens tidigare erfarenheter, inställning, förväntningar, personlighet samt vilken information som ges och på vilket sätt den ges påverkar upplevda behandlingseffekter (29).
I en dubbelblindad randomiserad kontrollerad studie (RCT) gjord på kroniska smärtpatienter diagnosticerade med atypisk odontalgi undersökte man bland annat lindringen av kronisk spontan smärta efter injektion av lidokain (20 mg/ml Xylocain och 12.5 mg/ml adrenalin) eller placebo (fysiologisk koksaltslösning) (14). Studiens syfte var att utvärdera hur lokalanestesi påverkar smärtlindringen hos patienter med atypisk odontalgi för att få reda på i vilken utsträckning perifer aktivitet bidrar till smärtbilden hos dessa patienter. Patienterna randomiserades i en aktiv grupp och en placebogrupp och injicerades två gånger vid två olika tillfällen. I studien sågs en
signifikant skillnad i upplevd smärtlindring efter injektion av aktivt medel jämfört med placebo upp till 120 min efter injektion. Smärtlindringen var signifikant högre vid injektion av lidokain. Studiens resultat är svårtolkade eftersom kunskap om den neuropatiska smärtans bakgrund och hur dess exakta uttryck ter sig till viss del fortfarande saknas. I studien togs inte hänsyn till faktorer som hur den verbala instruktionen som ges i samband med experimentet påverkar patienternas förväntningar på injektionen och hur patienternas upplevelse i samband med injektionen sett till upplevd bedövningskänsla eventuellt kunnat påverka utfallet. Eftersom att kunskapen är liten om hur placebo påverkar diagnostiska procedurer och därmed hur dess utfall skall tolkas är detta ett viktigt mål för fortsatta studier.
I en experimentell studie (30) visade man att friska deltagare som innan injektion fick instruktioner om att det var en 50/50 chans att de fick aktivt medel (2 ml lidokain (Xylocain, AstraZeneca, Södertälje Sverige, 10 mg/ml utan vasokonstriktor) eller placebo (2 ml fysiologisk koksaltlösning (9 mg/ml NaCl)), kunde samtliga deltagare korrekt ange vilket injektionsmedel de givits dagen efter. Resultatet kan tyda på att deltagarna antingen upplevde en tydlig närvaro av bedövningskänsla eller en tydlig avsaknad av bedövningskänsla, vilket i sin tur påverkade deras
15 förväntan på bedövningseffekten. Studien föreslog att vidare forskning bland annat kan utreda om en annan typ av placeboinjektion kan användas, en så kallad aktiv placebo. Istället för fysiologisk koksaltslösning bör ett medel som ger viss känsla av att vara bedövad testas, som gör att
individen inte utifrån upplevelsen av bedövningskänsla kan avgöra om de fått aktiv injektion eller kontrollmedel. Detta medel utgör den så kallade aktiva placebon och är idealt en substans som saknar eller endast har svaga terapeutiska effekter men som ger upphov till bieffekter som liknar dem hos en aktiv substans (31). Ett exempel på en sådan bieffekt är upplevelse av
bedövningskänsla som ges vid administration av lidokain. Om aktiv placebo och den aktiva injektionen genererar samma upplevelse av bedövningskänsla hos deltagarna och gör det omöjligt för deltagaren att urskilja vilken av injektionerna de fått, bör placeboeffekten vara lika stor i båda grupper. Skillnaden i utfallet, om samma placeboeffekt uppnås, motsvarar då den verkliga
farmakologiska effekten av det aktiva medlet man använt. I tidigare studier där vissa aktiva placebo kombineras med vilseledande information har dess placeboeffekter potentierats ytterligare. Aktiv placebo har trots fördelar sällan använts eller jämförts med inaktiv placebo i tidigare studier.
Syfte
Att undersöka om den subjektiva bedövningsupplevelsen som erhålls vid aktiv anestesi kan jämföras med den som erhålls vid injektion av aktiv placebo, samt om aktiv placebo påverkar smärttröskel samt smärtkänslighet vid stickstimuli hos friska individer. Studien är ett led i utvecklingen av en diagnostisk procedur med maximal tillförlitlighet där placeboeffekten är kontrollerad.
Frågeställning
Kan intraorala aktiva placeboinjektioner på friska individer skapa en upplevelse av att vara bedövad utan att samtidigt påverka smärttrösklar och smärtkänslighet för stick?
Hypoteser
1. Deltagare som injicerats med aktiv placebo får en upplevelse av att vara bedövade men har oförändrad smärttröskel och känslighet för stick jämfört med före injektion och jämfört med icke-aktiv placebo.
2. Deltagare som injicerats med icke-aktiv placebo får ingen upplevelse av att vara bedövade och har oförändrad smärttröskel och känslighet för stick jämfört med före injektion.
3. Deltagare som injiceras med aktivt bedövningsmedel får en upplevelse av att vara bedövade och har högre smärttröskel och lägre smärtkänslighet jämfört med före injektion och jämfört med icke-aktiv placebo.
16
Material och metod
Deltagare
31 studiedeltagare, nitton kvinnor och tolv män, rekryterades löpande bland studenter på tandvårdsutbildningarna på Odontologiska fakulteten, Malmö universitet under hösten 2018. Medelåldern var 26,3 år. Urvalet skedde personligt samt genom affischering.
Inklusionskriterier Friska vuxna individer. Exklusionskriterier
Känd kronisk orofacial smärtdiagnos, spruträdsla, allergi mot lokalanestesimedel. Etiska hänsynstaganden/sekretess
Studien godkändes av regionala etikprövningsnämnden i Lund som en delstudie i ett större projekt. Samtliga deltagande fick information om studien muntligt och skriftligt, inklusive eventuella risker, och skrev under ett medgivande innan försök utfördes.
Under försöken avidentifierades deltagarna och tilldelades en kod som användes på undersökningsprotokollen. Insamlade data förvarades inlåst och separat från förteckningen över deltagarna.
En pilotstudie för att avgöra lämplig koncentration av Xylocain för en aktiv placeboinjektion utfördes som underlag inför huvudstudien. Under pilotstudien deltog tre frivilliga personer ur personalen vid Malmö universitet. I pilotstudien prövades en muntlig testinstruktion,
datainsamlingsprotokoll, procedur samt utprovning av dosintervall av den aktiva placebon. Koncentrationen hos aktiv placebo prövades genom att deltagarna fick olika koncentrationer av Xylocain 2 % utspätt med fysiologisk koksaltslösning: 0,1 %, 0,2 % samt 0,25 %. Resultaten jämfördes och koncentrationen som gav en god bedövningkänsla utan att påverka fysiologiska faktorer var 0,1 % Xylocain. Lösningen jämfördes sedan med 2 % Xylocain för att jämföra resultaten på bedövningsupplevelsen och somatosensoriska faktorer i området. Manus och protokoll justerades och försöksledare (författarna JA och LE) kalibrerades inför de kliniska försöken.
Studiedesign
Studien är en experimentell, dubbelblindad, randomiserad studie. Under studien hjälpte en tredje person till att förbereda injektionerna.
Försöksprotokoll Utrustning:
Undersökningsbricka med spegel och bomullstops. Pinprick instrument 512 mN
Electronic von Frey (EvF) Manus (bilaga 1)
17 Protokoll (bilaga 2)
Engångskanyl för injektion. Injektionsmedel enligt följande: 2 % Xylocain (2 ml Xylocain)
0,1 % Xylocain (0,1 ml Xylocain + 1,9 ml 0,09 % NaCl) 0,09% NaCl (2 ml 0,09% NaCl)
Antal deltagare och randomisering: Studien är experimentell och på grund av studiens
utformning beslutades det att inte utföra en poweranalys. För att få ett resultat som kunde analyseras statistiskt och få en jämn blockindelning beslutades det att ursprungligen rekrytera 36 deltagare. I september 2018 randomiserades deltagare i grupper via randomiseringsprogrammet
https://www.sealedenvelope.com/simple-randomiser där en blockrandomisering utfördes enligt följande: 36 deltagare delades in i tre block à 12 deltagare samt i ytterligare tre block à fyra gånger tre injektionsmedel (A, B, C). Randomiseringen gjordes av handledare MP. Deltagarna tilldelades konsekutivt en kod löpande med tillhörande randomiserad injektionsmedel (A, B eller C). En tredje person blindade sedan försöksledarna genom att utifrån kodlistan förbereda injektionsmedel inför varje försök.
Experimentgrupper:
Aktivt medel: 10 personer fick injektion med anestesimedlet Xylocain 2% (2 ml; 20 mg/ml Xylocain, AstraZeneca, Södertälje Sverige) dvs. den farmakologiskt aktiva koncentration som normalt används vid dentala ingrepp
Aktiv placebo: 10 personer fick injektion med anestesimedlet Xylocain 0,1% (2 ml; 0,1 ml 20 mg/ml Xylocain, AstraZeneca, Södertälje Sverige + 1,9 ml fysiologisk koksaltlösning; 9 mg/ml NaCl),
Icke-aktiv placebo: 11 personer fick injektion med fysiologisk koksaltlösning (2ml; 9 mg/ml NaCl) som saknar farmakologisk aktivitet.
Plats för experiment: Tandvårdshögskolan i Malmö, avdelningarna för Orofacial smärta och
käkfunktion samt Endodonti.
Anatomisk lokalisation:
Testområde: Fasta gingivan 2 mm från gingivalranden regio tand 14. Kontrollområde: fasta gingivan 2 mm från gingivalranden över tand 24. Injektionsplats: Buccala omslagsvecket i höjd med apex i regio tand 14
18
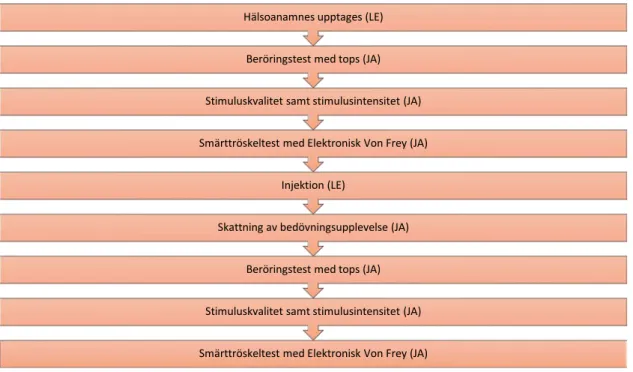
Arbetsgång: se Figur 4
Figur 4. Arbetsgång.
Hälsoanamnes: togs upp enligt protokoll (bilaga 1). Hälsoanamnes innehöll frågor gällande: intag
av analgetika inom de senaste 24 timmarna, förekomst av kronisk eller akut kroppslig smärta, användande av antidepressivt medel, två validerade TMD-screeningfrågor (Gör det ont i tinningen, ansiktet, käklederna eller käkarna en gång i veckan eller oftare? Gör det ont när Du gapar eller tuggar en gång i veckan eller oftare? (32) samt i förekommande fall TMD-smärtans duration (månader).
Injektionsprocedur: JA lämnade rummet. Studiedeltagaren fick instruktion enligt manus (bilaga
2), och därefter gavs injektion. Man väntade 5 minuter (mätt med timer) för att bedövningen skulle ges tid att verka/ha effekt.
Utfallsmått:
• Beröringsuppfattning: En bomullstops fördes över fast gingiva. Kontrollområde och testområde jämfördes genom att deltagaren fick värdera om det kändes likadant på bägge sidorna (JA/NEJ)
• Stimuluskvalitet samt stimulusintensitet: Pin Prick (Pin-Prick TM, tillverkad av Johannes Gutenberg University of Mainz, Mainz, Tyskland) instrument med kraften 512mN trycktes mot testområde i 2 s. Deltagare fick bedöma stimulis kvalitet som vass eller trubbig samt gradera smärtintensiteten enligt en numerisk skattningsskala (NRS) med ankarvärdena 0– 10 (där 0 innebär ingen smärta alls och 10 innebär värsta tänkbara smärta) (20).
• Smärttröskel för stick: Ett mekaniskt stimulus anlades på testområde med Electronic von Frey-instrument. Kraften ökades med 25 g/s tills deltagaren upplevde det som smärtsamt och avbröt stimuleringen genom att trycka på en knapp. Smärttröskeln definierades som
Smärttröskeltest med Elektronisk Von Frey (JA) Stimuluskvalitet samt stimulusintensitet (JA)
Beröringstest med tops (JA) Skattning av bedövningsupplevelse (JA)
Injektion (LE)
Smärttröskeltest med Elektronisk Von Frey (JA) Stimuluskvalitet samt stimulusintensitet (JA)
Beröringstest med tops (JA) Hälsoanamnes upptages (LE)
19 medelvärdet av tre konsekutiva mätningar, mätt i gram (g). 300 g valdes som högsta stimuluskraft för att undvika vävnadsskada.
• Bedövningskänsla: Deltagare skattade sin upplevda bedövningskänsla på en numerisk skattnings skala med värden 0-10. 0 innebär inte bedövad alls och 10 innebär så bedövad som man möjligen kan vara.
Statistiska metoder
Beskrivande statistiska metoder användes för att beskriva materialets egenskaper.
Kvantitativa variabler analyserades med parat T-test och ANOVA och kvalitativa variabler med Fischers exakta test. ANOVA test kontrolleras med post-hoc test med Bonferroni-korrektion. Bonferronikorrektion skapar en mycket låg p-värdes gräns och då genereras högre ställda krav för signifikans.
20
Resultat
Deltagare
31 personer genomförde studien: 19 kvinnor och 12 män.
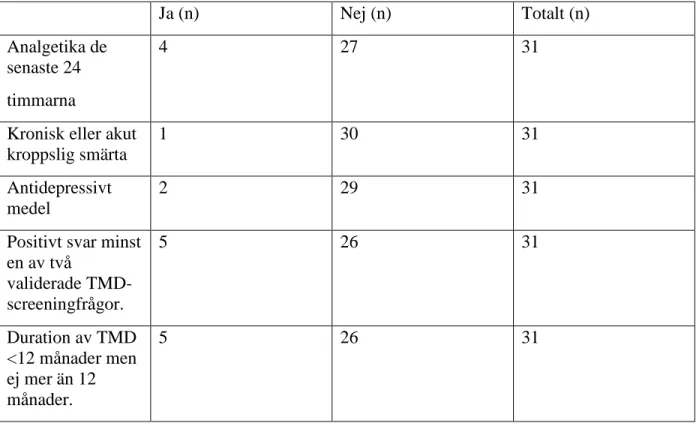
I tabell 1 beskrivs deltagarna i de tre grupperna med avseende på: intag av analgetika inom de senaste 24 timmarna, förekomst av kronisk eller akut kroppslig smärta, användande av
antidepressivt medel, två validerade TMD-screeningfrågor (Gör det ont i tinningen, ansiktet, käklederna eller käkarna en gång i veckan eller oftare? Gör det ont när Du gapar eller tuggar en gång i veckan eller oftare) samt i förekommande fall TMD-smärtans duration (månader). Tabell 1. Deltagarnas egenskaper.
Ja (n) Nej (n) Totalt (n)
Analgetika de senaste 24 timmarna
4 27 31
Kronisk eller akut kroppslig smärta
1 30 31
Antidepressivt medel
2 29 31
Positivt svar minst en av två validerade TMD-screeningfrågor. 5 26 31 Duration av TMD <12 månader men ej mer än 12 månader. 5 26 31 Beröringsuppfattning
Tabell 2 beskriver hur deltagarna uppfattade beröring i injektionsområdet jämfört med
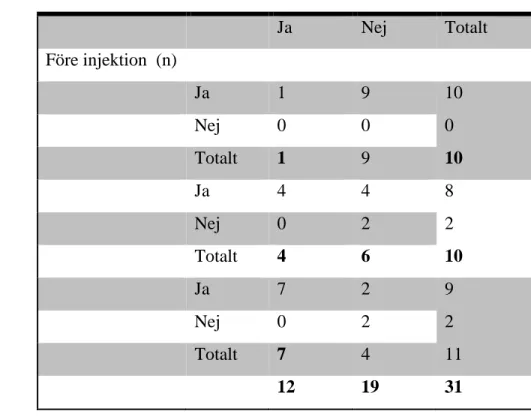
motsvarande kontralateralt område före respektive efter injektion (beröring uppfattas som lika ja/nej). Ingen statistiskt säkerställd skillnad ses mellan grupperna i uppfattningen om att båda sidor uppfattas lika (p = 0,511 enligt Fishers exakta test). Fyra av deltagarna upplevde en tydlig skillnad mellan sidorna före injektion.
Tabell 2. Värden för gruppernas uppfattning av upplevd skillnad mellan försöks- och
kontrollplats före och efter injektion vid beröring. JA innebär tydlig skillnad mellan sidorna. NEJ innebär ingen tydlig skillnad mellan sidorna. Ingen statistisk säkerställd skillnad sågs i
21 kunde genomföras på grund av konstant variabel, Icke-aktiv placebo: p=0,467 (Fishers exakta test), aktiv placebo: p=0,109 (Fishers exakta test)).
Försöksgrupper Efter injektion (n)
Ja Nej Totalt Före injektion (n) Aktiv injektion Ja 1 9 10 0 10 Nej 0 0 Totalt 1 9 Icke-aktiv placebo Ja 4 4 8 2 10 Nej 0 2 Totalt 4 6 Aktiv placebo Ja 7 2 9 2 11 Nej 0 2 Totalt 7 4 totalt 12 19 31 Bedövningskänslan
I tabell 3 presenteras respektive grupps bedövningsupplevelse efter injektion. Statisk säkerställd skillnad i bedövningsupplevelse ses mellan aktiv injektion och icke-aktiv placebo (p<0,001) samt mellan aktiv injektion och aktiv-placebo (p<0,001) enligt ANOVA samt post-hoc test med Bonferroni-korrektion. Ingen skillnad i bedövningsupplevelsen ses mellan grupperna med aktiv placebo och icke-aktiv placebo (p=0,98 post-hoc t-test).
Tabell 3. Gruppernas skattning av sin bedövningsupplevelse enligt en NRS-skala 0-10 efter injektion av bedövningsmedel. SD = standardavvikelse.
Medelvärde bedövningskänsla (NRS)
Hela gruppen 3,4
Aktiv placebo 3,4 (SD 1,7) Icke aktiv placebo 2,6 (SD 2,3) Aktiv injektion 8,8 (SD 0,9)
22
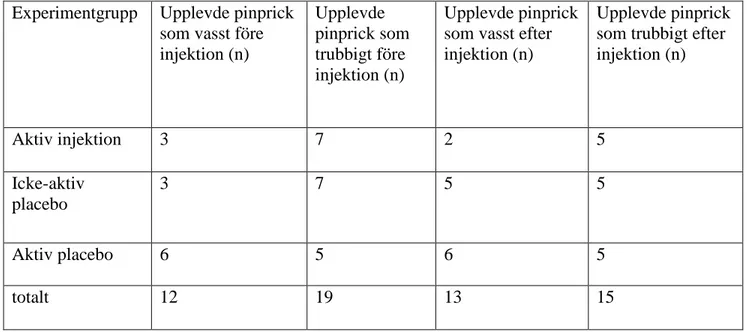
Stimuluskvalitet (vasst/trubbigt)
Fördelning av deltagarna som upplevde stimuli som vasst ses i tabell 4. Efter injektion fanns ingen statiskt säkerställd skillnad mellan grupperna i andelen deltagare som uppfattade stimulus som vasst (p = 0,148; Fishers exakta test) Ingen statiskt säkerställd skillnad fanns inom grupperna (före jämfört med efter injektion) i uppfattning av stimulus som vasst (p=0,081-1,000)
Efter injektion var det tre av tio deltagare som fick aktiv injektion som inte kunde avgöra om stimulus var vasst eller trubbigt.
Tabell 4. Deltagarnas upplevelse av stimuli före och efter injektion. Experimentgrupp Upplevde pinprick
som vasst före injektion (n) Upplevde pinprick som trubbigt före injektion (n) Upplevde pinprick som vasst efter injektion (n)
Upplevde pinprick som trubbigt efter injektion (n) Aktiv injektion 3 7 2 5 Icke-aktiv placebo 3 7 5 5 Aktiv placebo 6 5 6 5 totalt 12 19 13 15
Smärtintensitet stickstimulus med Pin-Prick
Medelvärdet för hela gruppen före injektion var NRS 1,7 (SD 1,8) och efter injektion NRS 1,1 (SD 1,5). Medelvärdet för smärtintensitet för respektive grupp före och efter injektion presenteras i tabell 5. Ingen statistisk säkerställd skillnad i upplevelsen av smärtintensitet finns före och efter injektion inom grupperna aktiv-placebo (p = 0,690 parat T-test) och icke-aktiv placebo (p = 0,726 parat T-test). En statistisk säkerställd skillnad i upplevd smärtintensitet fanns inom gruppen aktiv injektion före och efter injektion (p = 0,035 parat T-test).
Tabell 5. Medelvärdet av upplevd smärtintensitet med Pin-Prick inom grupperna före och efter injektion. Ingen statistiskt säkerställd skillnad mellan grupperna kunde ses före injektion (p=0,784 One-way ANOVA). Efter injektion sågs en statistiskt säkerställd skillnad mellan grupperna via One-way ANOVA test (p=0,026) men vid Post hoc visade att det enbart fanns skillnad mellan aktiv injektion och aktiv placebo (p=0,036).
Aktiv injektion Icke-aktiv placebo Aktiv placebo Smärtintensitet av
stimuli - Före
injektion (NRS 0-10)
23 Smärtintensitet av stimuli - Efter injektion (NRS 0-10) 0,1 (SD 0,3) 1.5 (SD 1.3) 1,7 (SD 2,0) Sticksmärttröskel
I tabell 6 presenteras sticksmärttröskel före och efter injektion inom grupperna. Ingen statistisk säkerställd skillnad ses inom gruppen aktiv placebo samt icke-aktiv placebo, men däremot inom gruppen aktiv före och efter injektion. Det fanns ingen statistisk säkerställd skillnad mellan aktiv placebo och icke-aktiv placebo efter injektion för sticksmärttröskeln (p=0,052 post-hoc t-test). En statistisk säkerställd skillnad sågs efter injektion mellan grupperna aktiv injektion och icke-aktiv injektion (p= 0,001 post-hoc t-test) samt mellan grupperna aktiv injektion och aktiv placebo för sticksmärttröskeln (p<0,001 post-hoc t-test).
Tabell 6. Medelvärde för sticksmärttröskel i gram inom grupperna före och efter injektion. Sticksmärttröskel (g) före injektion Sticksmärttröskel (g) efter injektion p-värde (t-test) Aktiv injektion 87,0 (SD 70,7) 211,0 (SD 91,3) 0,003 Icke-aktiv placebo 80,2 (SD 66,9) 87,2 (SD 69,5) 0,379 Aktiv placebo 65,6 (SD 30,2) 60,0 (SD 19,3) 0,505 p-värde (ANOVA) 0,691 0,001
24
Diskussion
Det viktigaste fyndet i denna studie var att man inte kunde se någon skillnad mellan icke-aktiv placebo och aktiv placebo i förmågan att förändra friska deltagares smärttröskel samt
smärtkänslighet för stickstimuli och ge samtidig upplevelse hos deltagaren om att vara bedövad. 0,1% Xylocain visade sig därmed inte uppfylla kraven som ställs på en bra aktiv placebo i förmåga att skapa en bedövningsupplevelse utan att samtidigt förändra smärttröskel samt smärtkänslighet för stickstimuli hos individen.
Material och metod
Det förväntade resultatet var att deltagare som fått aktiv placebo skulle känna sig bedövade utan att samtidigt påverka smärttrösklar och smärtkänslighet för stick, men denna studie fann ingen skillnad i bedövningsupplevelse mellan aktiv placebo och icke aktiv placebo. Det innebär att 0,1 % Xylocain utan vasokonstriktor inte kan användas som aktiv placebo i detta syfte. Tidigare studier har använt sig av QST (15, 17, 21) och metoden är validerad för intraoral användning och nedan diskussion kommenterar de valda instrumenten närmare. Dock finns det ej studier på koncentrationen för aktiv placebo vid diagnostik i experimentellt syfte. Detta innebär att metoden eventuellt kan svara på frågeställningen men vald koncentration kan ej användas. Ny
koncentration kan förslagsvis bestämmas genom en utvidgad dosintervall studie. Dock är det inte säkert att det går att hitta en koncentration som uppfyller alla krav.
Studien inkluderade friska deltagare utan närmre specifikation. En del deltagare upplevde Pin-Prick stimuli som trubbigt innan injektion och/eller en tydlig skillnad mellan sidorna vid beröringsstimuli innan injektion, vilket sannolikt beror på en normal variation mellan och inom individer. Antalet deltagare beräknades inte utifrån en poweranalys eftersom studien är
experimentell. Metoden som användes i studien måste testas i ett relevant kliniskt material för att man ska veta något gällande dess generaliserbarhet. . Även om resultaten ej är generaliserbara kan de ändå användas för jämförelser med resultat av framtida studier med liknande
frågeställning.
För en experimentell studie med samma frågeställning är denna design välfungerande då vi kunde besvara frågeställningen. Det var bra att studien var randomiserad för att minska risk för bias bland deltagarnas egenskaper exempelvis personlig smärtkänslighet vilket eventuellt kan påverka resultatet. Randomiseringen gör att deltagare med olika egenskaper placeras oberoende i de olika grupperna. Studiens deltagare var friska och lika varandra vilket skulle kunna innebära att en icke randomiserad design hade kunnat användas. Dubbelblindning är positivt då risk för subjektiv bias minskar både hos deltagare och försöksledare. Till exempel kan en av försöksledarna omedvetet förmedla vilken behandling som givits till deltagaren om denna har kunskap gällande behandling (31).
Ett alternativ som skulle kunna övervägas är att lägga till en cross-over design. Då skulle alla deltagare få samtliga injektionstyper vid tre olika tillfällen och då kan man jämföra om det finns skillnader inom individerna. Detta bidrar till att normalskillnader mellan individer elimineras och därmed blir den statistiska analysen mer säker. Denna design var ej möjlig på grund av
omfattning sett till tidstillgång. Därför var aktuell design den enda valbara.
25 Använda statistiska metoder är adekvata för att granska den data som samlades in. Dock är det inte optimalt att göra statistiska beräkningar på värden från en ordinalskala då skillnaden mellan värden i skalan inte alltid har samma betydelse. NRS är en ordinalskala men statistiska
beräkningar används ofta för analyser av dessa skalor även om de inte alltid är statistiskt korrekta (33).
Resultat
Ett oväntat utfall sett till beröringsuppfattning var att flera av deltagarna upplevde tydlig skillnad mellan sidorna före injektion vid test för dynamisk mekanisk allodyni, beröringstestet. Vid misstänkt neuropatisk smärta kan patienten uppleva känselförändringar i orofaciala området, medan en frisk individ oftast inte uppvisar några somatosensoriska förändringar. Detta innebär att resultaten från denna testmetod uppvisade en låg specificitet, vilket innebär att metoden har svårt att identifiera friska individer. Därför kan testets användbarhet i forskning/kliniskt ifrågasättas. Liknande resultat har setts i tidigare studier (17). Om fler studier visar att friska individer kan uppleva somatosensoriska förändringar utan att ha ett neuropatiskt tillstånd så kan detta indikera att detta är normalfynd för en del individer. Det bör diskuteras kring huruvida metoden i
framtiden kan användas som utfallsmått i studier med liknande frågeställning.
Studien fann ingen skillnad i upplevelsen av bedövningskänsla efter injektion mellan aktiv
placebo- och icke-aktiv placeboinjektion. Detta betyder att 0,1% Xylokain inte kan användas som aktiv placebo i detta avseende och därför bör man göra en mer omfattande dosintervallstudie där man säkerställer att effekten hos den aktiva placebon blir den önskade.
Xylocainets fysiologiska effekter förväntades medföra att gensvaret på stimuli övergår från vasst till trubbigt efter injektion om deltagaren är frisk. Resultatet uppvisade oväntade gensvar hos deltagarna i upplevelsen då flera deltagare upplevde stimuli som trubbigt före injektion vilket ej är önskat. Förväntade effekter sågs inte hos majoriteten av deltagarna vilket kan påverka
resultaten. Det finns aspekter som kan diskuteras vidare för att göra metoden mer valid. Skulle en eventuellt högre tryckkraft hos stimuli (>512mN) leda till att fler deltagare upplever en tydlig skillnad mellan vasst eller trubbigt. Många av deltagarna tyckte att det var svårt att avgöra om stimuli var vasst eller trubbig efter injektion med aktiv injektion. Om en tydlig uppfattning av vasst eller trubbigt inte kan uppfattas av deltagaren är detta en svaghet hos testet.
Deltagarna i studien graderade smärtintensiteten vid stickstimuli lågt innan injektion (NRS 1,7) vilket gör att den låga gradering efter injektion (NRS 1,1) enbart uppvisar en liten förändring. Om den ursprungliga smärtgraderingen är låg kan en så kallad golveffekt uppstå. Detta innebär att det låga ursprungsvärdet inte kan sänkas så mycket innan det når noll och blir därmed inte ett bra mått på effekten av en åtgärd, i detta fall injektionen då spridningen (SD) blir stor. I tidigare studier har smärtfria deltagare graderat smärtintensitet generellt sett högre jämfört med denna studie (15, 17). Dock var metoderna för uppmätning av smärtintensitet vid stickstimulus inte likadana. Därför är det svårt att jämföra resultaten. Detta kan indikera på att man eventuellt bör modifiera metoden för att minska risken för golveffekt.
Syftet med att använda aktiv placebo är att man vill ha ett kontrollmedel till aktiv injektion som
ger upplevd bedövningseffekt utan att påverka smärttröskeln. Smärttröskeln är därför ett viktigt utfallsmått för att bedöma injektionens effekt. Metoden med EvF-instrumentet ger ett säkert mått på smärttröskeln (21), och metoden var därför bra vald för studien. Dock finns det en risk att en del av deltagarna inte följde eller förstod instruktionerna. Deltagaren var tillsagd att avbryta testet
26 i samma stund trycket gick över till smärta. Risk finns att en del av deltagarna ej avbröt testet i denna övergång vilket kan påverka resultaten. Orsak till risk är att deltagare missförstår
instruktioner eller står ut med smärtan istället för att avbryta precis när den uppstår, exempelvis för att inte upplevas ha låg tolerans av smärta. För att minska denna risk gavs instruktionen åter vid misstanke om denna feltolkning.
Kliniska aspekter
Kliniskt relevant är att studien fann skillnader i bedövningskänslan mellan aktiv injektion och icke aktiv placebo. Detta bekräftar resultatet från en tidigare studie med liknande studiedesign. (29). Deltagarna i den studien kunde korrekt avgöra vilken av injektionerna, aktiv eller placebo, de givits. Förmodligen beror detta på en tydlig skillnad mellan injektionsmedlens förmåga att skapa en känsla av bedövning hos deltagaren.
Denna studie fann skillnader i uppfattning av bedövningskänsla trots att alla deltagare trodde att de skulle få bedövningsmedel. Detta är ett nytt fynd som bekräftar att en ny optimal aktiv placebo bör eftersökas i vidare studier.
Resultatet av den här studien kan inte generaliseras för en annan grupp än en liknande experimentell grupp med friska deltagare. Det krävs studier som är kliniska och utförs på patienter med akut/kronisk smärta med perifera och centrala för att skapa generella kliniska råd om smärtutredning med lokalanestesi. Även mer kunskap om hur man överför resultat gällande placeboeffekter hos friska deltagare på faktiska patienter behövs (31).
Diagnostik och placebo, dess etiska aspekt?
Det finns mycket få studier som undersökt placeboanvändning vid diagnostik. Placebo har visat sig ge positiva effekter vid behandling och är därmed intressant att forska mer om även gällande diagnostik. I detta fall skulle det vara för att underlätta tolkningen av diagnostiska test, genom att minimera placeboeffekten. Denna studie är en del i ledet av detta arbete. Dock kan användandet av placebo problematiseras. Som nämndes i introduktionen är placebo något som skapar en effekt hos en individ utan att farmakologiskt kunna påverka individen. Randomiserade studier med placebomedikament har ifrågasatts gällande de etiska aspekterna eftersom enbart en del av patienterna i de kliniska studierna får den farmakologiskt verksamma terapin och detta står i direkt konflikt till Helsingforsdeklarationen. Men sett till den kliniska aspekten av behandling, är det då viktigast att använda den behandling som ger bäst effekt för den individuella patienten även om denna behandling skulle vara ett placebo. Eller skall alla patienter informeras innan om att de får placebo även om detta i sin tur kan påverka de eventuella positiva placeboeffekterna? Problemet med placebobehandling är att man är oärlig mot patienten (34). Det har gjorts studier där resultaten tyder på att patienten får positiva effekter även om de vet om att de faktiskt fått en placebobehandling (29, 35). I en av dessa studier delades patienter med Irritable bowel syndrome (IBS) in i två grupper, en placebogrupp och en läkemedelsgrupp. Placebogruppen visste att de fick placebo, men de fick också info om att dessa piller har visat sig producera självläkande processer i kroppen, och de upplevde en signifikant förbättring. Förmodligen beror detta på att de fått informationen att pillret skulle ge effekter trots att det var rena ”sockerpiller”, vilket återigen visar på vikten av information och förväntan. Av detta kan man dra slutsatsen att det finns en styrka i placebobehandling eftersom icke viljestyrda mekanismer kan skapa äkta fysiska effekter, och detta skulle man kunna dra nytta av kliniskt för att uppnå en totalt sett bättre
27 effekt. Det är dock skillnad mellan att behandlas hos läkare och att frivilligt deltaga i en studie. Därför är det viktigt att använda placebo med försiktighet och då för den goda sakens skull där patientens behov placeras i centrum. Det är till exempel inte rätt att ersätta smärtlindrande
mediciner med placebo trots att även placebo visat sig ge en god effekt (31). Som vid användning av placebo vid behandling bör även hänsyn tas till den etiska aspekten även vid diagnostik. Men vid diagnostisk undanhålls dock inte effektiv behandling från patienten om placebo används. Placebo i diagnostiskt syfte kan eventuellt ha flera fördelar om den visas ge en positiv bidragseffekt till diagnostiken och därför bör metoden fortsatt utvärderas trots etiska frågeställningar.
Fortsatta studier
I framtida studier bör en lämplig koncentration tas fram som kan uppfylla kriterierna för en bra aktiv placebo. Detta kan göras genom att utföra en mer omfattande dosintervallstudie. I
förlängningen skall den aktiva placeboinjektionen kunna användas i diagnostiskt syfte då korrekt diagnos måste föregå behandling. I vidare studier bör man också undersöka hur den verbala instruktionen/informationen, upplevelsen av att vara bedövad samt patientens förväntan på effekt kan samspela och motverka varandra. Slutresultatet bör vara en diagnostisk metod eller procedur som utifrån experimentella studier på smärtfria individer har bästa möjliga förutsättningar att särskilja bedövningsmedlets farmakologiska effekt från placeboeffekt orsakad av alla dessa faktorer. Därefter krävs validering av metoden i kliniska material med patienter som har perifert respektive centralt underhållen smärta.
28
Konklusion
Studien fann ingen skillnad mellan icke-aktiv placebo och aktiv placebo i förmågan att förändra friska deltagares smärttröskel samt smärtkänslighet för stickstimuli och samtidigt ge en
upplevelse hos deltagaren om att vara bedövad. Detta innebär att deltagarna som fick aktiv placebo inte upplever sig vara mer bedövade än de deltagare som fick icke-aktiv placebo. Aktiv placebo gav i denna studie alltså ingen fördel framför icke aktiv placebo. 0,1% Xylocain
uppfyller inte de krav som kan ställas på en bra aktiv placebo.
29
Referenslista
1) https://www.iasp-pain.org/terminology?navItemNumber=576#Pain; 2019-02-11 2) Norrbrink C, Lundeberg T. Om smärta: ett fysiologiskt perspektiv. Andra upplagan.
Lund: Studentlitteratur AB, 2014.
3) Verner M, Leden I. Smärta och smärtbehandling. Andra upplagan. Stockholm: Liber AB, 2010.
4) Meyer A R, Ringkamp M, Campbell N J, Raja N S. Neural Mechanisms of Hyperalgesia after tissue injury. Johns Hopkins Apl Technical Digest 2005; 1. 5) Kehlet H, Jensen TS, Woolf CJ. Persistent postsurgical pain: risk factors and
prevention. Lancet 2006; 367: 1618-1625.
6) https://lakemedelsboken.se/kapitel/smarta/smarta_och_smartbehandling.html; 2019-02-11
7) https://www.iasp-pain.org/terminology?navItemNumber=576#Neuropathicpain; 2019-02-11
8) Treede RD, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW et al. Neuropathic pain: Redefinition and a grading system for clinical and research purposes. Neurology. 2008 Apr;70(18):1630-1635.
9) Haanpää M, Attal N, Backonja M, Baron R, Bennett M, Bouhassira D, et al. NeuPSIG guidelines on neuropathic pain assessment. Pain 2011; 152: 14-27.
10) Pigg M, Baad-Hansen L, Svensson P, Skjelbred P and Larheim A T, Neuropathic orofacial pain – diagnosis and management. Tandläkartidningen 2015; 107 : 56–62. 11) . Dagsdottir L, Skyt I, Vase L, Baad-Hansen L, Castrillon E, Roepstorff A, et al.
Persistant orofacial pain patients experience perceptual distortions of the face. J Dent Res 2014; 93: 437.
12) Olesen J, Gondsby P, Ramadan N, Tfelt-Hansen P, Welch K. The Headaches. 3rd ed. Philadelphia: Lippincott Williams & Williams; 2005.
13) Melis M, Lobo SL, Ceneviz C, Zawawi K, Al-Badawi E, Maloney G, et al. Atypical odontalgia: a review of the literature. Headache. 2003; 43: 1064-1074.
14) List T, Leijon G, Helkimo M, Öster A, Svensson P. Effect of local anesthesia on atypical odontalgia – A randomized controlled trial. Pain 2006; 122: 306-314. 15) Pigg M1, Baad-Hansen L, Svensson P, Drangsholt M, List T. Reliability of intraoral
quantitative sensory testing (QST). Pain 2010;148:220-226.
16) Campbell JN, Meyer RA. Mechanisms of neuropathic pain. Neuron 2006; 77-92. 17) Baad-Hansen L, Pigg M, Ivanovic SE, Faris H, List T, Drangsholt M, et al. Intraoral
somatosensory abnormalities in patients with atypical odontalgia, a controlled multicenter quantitative sensory testing study. Pain 2013 ;154:1287-1294.
18) Porporatti AL, Costa YM, Stuginski-Barbosa J, Bonjardim LR, Duarte MA, Conti PC. Diagnostic Accuracy of Quantitative Sensory Testing to Discriminate Inflammatory Toothache and Intraoral Neuropathic Pain. J Endod. 2015;41:1606-1613.
19) Htttps://mesh.kib.ki.se/term/D011601/psychophysics/;181124
20) Rolke R, Magerl W, Campbell KA, Schalber C, Caspari S, Birklein F, Treede RD. Quantitative sensory testing: a comprehensive protocol for clinical trials. Eur J Pain 2006;10:77-88.
30 21) List et al. New Protocol to evaluate the effect of topical anesteshia samt
Somatosensory profiling of intraoral capsaicin and menthol in healthy subjects. Anesthesia Progress 61: 135-144.
22) Lu S, Baad-Hansen L, List T, Zhang Z, Svensson P. Eur J Oral Sci; 2013: 29-35. 23) Ram S1, Teruel A, Kumar SK, Clark G. Clinical characteristics and diagnosis of
atypical odontalgia: Implications for dentists. J Am Dent Assoc 2009; 140: 223-228. 24) Porporatti AL, Costa YM, Stuginski-Barbosa J, Bonjardim LR, Conti PC. Effect of
topical anaesthesia in patients with persistent dentoalveolar pain disorders: A quantitative sensory testing evaluation. Arch Oral Biol 2015;60:973-981.
25) Malamed S. Handbook of local anesthesia. 6th ed. St Louis: Elsevier/Mosby 2013. 26) Bodelsson M. Anestesiologi, 2 upplagan. Lund : Studentlitteratur, 2005.
27) Robinsson D P. Local Anaesthesia in Dentistry. 7th Edition, Butterworth-Heinemann; 2000.
28) https://www.ne.se/uppslagsverk/encyklopedi/l%C3%A5ng/placeboeffekt; 2018-10-21 29) Nelson D. The mystery of pain. London ; Philadelphia : Singing Dragon, 2013.
30) Edvinsson O, Ekelund J. A pilot study: Double-blinded local injection of active/non-active agents: Normal response and importance of expectations. MUEP 2018. 31) L, Colloca. Placebo and pain : from bench to bedside. Amsterdam : Academic Press,
cop. 2013.
32) Nilsson I-M, List T, Drangsholt M. The reliability and validity of self-reported temporomandibular pain. J Orofac Pain 2006; 20: 138–44.
33) Bjørndal A, Hofoss D. Statistik för hälso- och sjukvårdspersonal. 1st ed. Stockholm: Universitetsforlaget; 1998.).
34) Kaptchuk TJ, Kelley JM, Conboy LA, Davis RB, Kerr CE, Jacobson EE, et al. Components of placebo effect: randomised controlled trial in patients with irritable bowel syndrome. Bmj. 2008 ;336: 999-1003. (via
http://www.lakartidningen.se/Functions/OldArticleView.aspx?articleId=10924;2018-10-21)
35) Kaptchuk TJ, Friedlander E, Kelley JM, Sanchez MN, Kokkotou E, Singer JP, et al. Placebos without Deception, A Randomized Controlled Trial in Irritable Bowel Syndrome. PLoS ONE 2010;5.