http://www.diva-portal.org
This is the published version of a paper published in Neurología.
Citation for the original published paper (version of record):
Garcia-Ptacek, S., Eriksdotter-Jönhagen, M., Jelic, V., Porta-Etessam, J., Kåreholt, I. et al.
(2013)
Quejas cognitivas subjetivas: hacia una identificación precoz de la enfermedad de Alzheimer.
Neurología, 8(31): 562-571
https://doi.org/10.1016/j.nrl.2013.02.007
Access to the published version may require subscription.
N.B. When citing this work, cite the original published paper.
Open Archive article
Permanent link to this version:
Neurología.2016;31(8):562—571
NEUROLOGÍA
www.elsevier.es/neurologia
REVISIÓN
Quejas
cognitivas
subjetivas:
hacia
una
identificación
precoz
de
la
enfermedad
de
Alzheimer
S.
Garcia-Ptacek
a,b,∗,
M.
Eriksdotter
b,c,
V.
Jelic
b,c,
J.
Porta-Etessam
a,
I.
Kåreholt
d,ey
S.
Manzano
Palomo
faServiciodeNeurología,HospitalClínicoSanCarlos,Madrid,Espa˜na
bDepartmentofNeurobiology,CareSciencesandSociety,KarolinskaInstitutet,Estocolmo,Suecia
cDepartmentofGeriatricMedicine,KarolinskaUniversityHospital,KarolinskaInstitutet/StockholmUniversity,Estocolomo,
Suecia
dAgingResearchCenter,KarolinskaInstitutetandStockholmUniversity,Estocolmo,Suecia eInstituteofGerontology,SchoolofHealthSciences,JönköpingUniversity,Jönköping,Suecia fServiciodeNeurología,HospitalInfantaCristina,Parla,Madrid,Espa˜na
Recibidoel15deoctubrede2012;aceptadoel17defebrerode2013 Accesibleenlíneael17deabrilde2013
PALABRASCLAVE Quejascognitivas subjetivas; Amiloide; Biomarcadores; Deteriorocognitivo subjetivo; Enfermedad deAlzheimer; Estadiopreclínicode enfermedad deAlzheimer Resumen
Introducción: LaneurodegeneraciónenenfermedaddeAlzheimer(EA)empiezadécadasantes quelademenciayalgunospacientescondeteriorocognitivolevepresentanunaimportante cargalesional.Laausenciadeinformaciónsobrelafisiopatologíatempranadelaenfermedad dificultalabúsquedadeestrategiasterapéuticas.
Laquejacognitivasubjetiva(QCS)agrupaasujetosconquejasmnésicassindéficits significa-tivosentestneuropsicológicos.Esunsíndromeheterogéneosobreelquenoexisteconsenso, peroalgunosdeestospacientespodríanrepresentarelestadiomásprecozdeEA.
Método: Realizamosunarevisiónbibliográficapararesumirelestadodelconocimientoactual sobrequejascognitivassubjetivas.
Resultados: Aunqueanivelindividualnopresentenenfermedadobjetivable,aniveldegrupo lospacientesconQCSrinden peorentest neuropsicológicosquela poblacióngeneraly tie-nenmayorincidenciadedeclivecognitivofuturo.Ladepresiónylacomorbilidadpsiquiátrica desempe˜nanunpapelperonosonlaúnicacausadequejascognitivas.Estudioscon resonan-ciamagnética muestran un patrón de atrofia hipocampal similar al deldeterioro cognitivo leveamnésicoyenresonanciafuncionalhayaumentodeactivaciónentareascognitivasque podríanrepresentarunacompensaciónantepérdidadefunción.LospacientesconQCS presen-tanunpatróntipoEAdemarcadoresbetaamiloide(A42)ytauconmayorfrecuenciaquela poblacióngeneral.
∗Autorparacorrespondencia.
Correoelectrónico:saragptacek@gmail.com(S.Garcia-Ptacek).
0213-4853/$–seefrontmatter©2012SociedadEspa˜noladeNeurolog´ıa.PublicadoporElsevierEspa˜na,S.L.U.Todoslosderechosreservados.
Quejascognitivassubjetivas:haciaunaidentificaciónprecozdelaenfermedaddeAlzheimer 563
Conclusiones: LasquejasmnésicassonunsíntomarelevanteypodríanpredecirEA.La hetero-geneidaddelospacientesydelosensayosclínicoshadificultadoladefinicióndelsíndrome.En elfuturo,unadefiniciónestandarizadayestudioslongitudinalesconunseguimientosuficiente, ycentradosenvariablescuantificables,podríanclarificaraspectostempranosdelaEA. ©2012SociedadEspa˜noladeNeurolog´ıa.PublicadoporElsevierEspa˜na,S.L.U.Todoslos dere-chosreservados. KEYWORDS Subjectivecognitive impairment; Amyloid; Biomarkers; Subjectivecognitive complaints; Alzheimerdisease; Preclinicalstageof Alzheimerdisease
Subjectivecognitiveimpairment:TowardsearlyidentificationofAlzheimerdisease Abstract
Introduction: Neurodegeneration inAlzheimer disease (AD)begins decades before demen-tiaandpatientswithmildcognitiveimpairment(MCI)already demonstratesignificantlesion loads.LackofinformationabouttheearlypathophysiologyinADcomplicatesthesearchfor therapeuticstrategies.
Subjectivecognitiveimpairmentisthedescriptiongiventosubjectswhohavememory-related complaints without pathologicalresults on neuropsychological tests. There isno consensus regarding thisheterogeneoussyndrome, butatleastsome ofthese patients may represent theearlieststageinAD.
Method: Wereviewedavailable literatureinordertosummarisecurrentknowledgeon sub-jectivecognitiveimpairment.
Results: Althoughtheymaynotpresentdetectablesignsofdisease,SCIpatientsasagroup scoreloweronneuropsychologicalteststhanthegeneralpopulationdoes,andtheyalsohave ahigherincidenceoffuturecognitivedecline.Depressionandpsychiatricco-morbidityplaya role butcannotaccountforall cognitivecomplaints.Magneticresonanceimagingstudiesin thesepatientsrevealapatternofhippocampalatrophysimilartothatofamnesticmildcognitive impairmentandfunctionalMRIshowsincreasedactivationduringcognitivetaskswhichmight indicatecompensationforlossoffunction.PrevalenceofanAD-likepatternofbeta-amyloid (A42)andtau proteins incerebrospinal fluid ishigher inSCI patients thaninthe general population.
Conclusions: Memory complaints arerelevant symptoms andmay predict AD. Interpatient variabilityandmethodologicaldifferencesbetweenclinicalstudiesmakeitdifficulttoassigna definitiontothissyndrome.Inthefuture,havingastandarddefinitionandlongitudinalstudies withsufficientfollow-uptimesandanemphasisonquantifiablevariablesmayclarifyaspects ofearlyAD.
©2012SociedadEspa˜noladeNeurolog´ıa.PublishedbyElsevierEspa˜na,S.L.U.Allrights reser-ved.
Introducción
Lasquejascognitivassubjetivas(QSC)agrupanaunconjunto heterogéneodepacientesquepresentanquejascognitivas sinevidencia deenfermedadneurodegenerativa.Los albo-resdel conceptoseencuentran enel estadio2dela GDS descritoporReisberg1 yha idoperfilándosecomoun posi-bleestadioinicialenenfermedadesneurodegenerativascon evoluciónhacia demencia, enespecial enenfermedad de Alzheimer(EA)2.Más allá de suutilidad epidemiológica o conceptual,tienesureflejoenlagranproporciónde pacien-tesquerecibenundiagnósticodeQSCenlaprácticaclínica habitual3,4. Sinembargo, la heterogeneidad metodológica entreestudios yla ausencia de unadefinición inequívoca yestandarizadadificultanlacaracterizacióndeestegrupo. ElempleodebiomarcadoresylasconsideracionesdelaNIA5 paraladefinicióndeunestadiopreclínicoenlaEAsonun buencomienzo,aunqueelpaso desdeunconcepto epide-miológicoodeinvestigaciónhastaunpacienteindividualen laclínicaaúnnosehayaconcretado.
La EA causa el 60-80% de todas las demencias. La prevalencia mundial era de 24,3 millones en 20056 y se
cuadruplicaráparael 20507.Labúsqueda detratamientos curativossehavistoentorpecidaporeldiagnósticotardío, las dificultades técnicas de los tratamientos y la fisiopa-tología de la enfermedad8-11. Los criterios de Dubois12,13, las recomendaciones de la NIA5 y el concepto de dete-rioro cognitivo leve (DCL) tienen, entre otros objetivos, adelantar el diagnóstico a estadios previos a la fase de demencia.Silaneurodegeneraciónempiezadécadasantes quelademencia14,15 yla fasedeDCLdura7-10 a˜nos,con unatasade conversión del16% anual16,es previsibleque existaungrupodepacientesconEAsindeteriorocognitivo objetivable13.Parecerazonablebuscarloscasosmás preco-cesentrelossujetosquepresentanquejascognitivaspero quenopresentansignosclínicosdeenfermedad.
La identificaciónde un grupo deindividuos enestadio preclínicotendríaunadobleutilidad. Primero,el desarro-llodenuevasestrategiasterapéuticas.Retrasartansoloun a˜noeliniciodelaenfermedadsupondríaunareducciónen laprevalenciamundial de9 millones decasosenlos pró-ximos 40 a˜nos7. Los tratamientos neuroprotectores llegan tardeenlademenciatipoAlzheimeryprobablemente tam-bién en el DCL16-20. El tratamiento sería más efectivo en
564 S.Garcia-Ptaceketal. pacientes con menor carga amiloide y podría atacar
mecanismosfisiopatológicos exclusivosde esta fasede la enfermedad12.
Anivelpoblacional,factorescomoladepresión,elbajo niveleducativo,lahipertensiónoladiabetesaumentanel riesgodeEA.Elriesgopoblacionalatribuibleesdel10-25%, deformaque1,1-3millonesdecasosseríanevitables21,22.La identificacióndeindividuosenriesgopermitiríaconcentrar elesfuerzopreventivo.
Enelpresenteartículorealizamosunarevisióndelabase bibliográficaPubMedempleandocomocriteriosdebúsqueda «subjective cognitive impairment», «subjective cognitive complaints» y«subjective memoryimpairment». La hete-rogeneidaddeestudios yla amplituddeltemaimpidieron realizarunarevisiónsistemática.
Pretendemosresumirelestadodelconocimientoactual sobreestesíndromeydescubriráreassusceptiblesde inves-tigaciónenelfuturo.
Desarrollo
Dificultadesenladefinicióndeunnuevosíndrome La EA sigue presentando retos diagnósticos y abarca un espectroheterogéneo,desdelospacientescon anatomopa-tologíacompatibleconEAsinsíntomasdela enfermedad, pasando por las formas atípicas e incluyendo a pacientes asintomáticos con biomarcadores de EA en líquido cefa-lorraquídeo(LCR).Enel DCLaumentalacomplejidad,con cohortes heterogéneas entre ensayos clínicos, tal como evidencianlasdistintastasasdeconversiónaEA16,17,19,20,23. Es esperable que la QCS suponga un reto aun mayor, al serunaentidadenlaque,pordefinición,nohayhallazgos clínicosrelevantes.
Heterogeneidadmetodológicaentreestudiosysus consecuenciassobrelosresultadosobtenidosenla prevalenciadequejascognitivassubjetivas
Lasquejascognitivassonunmotivodeconsultafrecuente yrepresentan un porcentaje importante de lospacientes atendidosen unidades de memoria a nivel mundial. Jon-ker etal. (2000)3 encontraron unaincidencia del25-56%. EnKarolinskaMemoryClinic(Huddinge,Suecia),el porcen-tajedeQSCfuedel38%en20054.EnlaUnidaddeEstudio delaCogniciónylaConductadelHospitalClínicoSan Car-los,elporcentajedesdeela˜no2008al2011fuedel7,52% (Manzano,observacionespersonalesnopublicadas). Proba-blemente,estacifraseatanbajaporquenosetratadeuna UnidaddeMemoriaenfocadaaldiagnósticoprecoz.Es nece-sarioprecisarquéseentiendeporQCSdadoelaltovolumen depacientesquerecibenestediagnóstico.
Sin embargo, no existe una definición establecida de QCS.Enocasiones,seemplea el término como síntoma o conjunto de síntomas; en otras, como entidad indepen-dientedistintade la EA o el DCL.En muchos estudios no serealizaunabateríaneuropsicológicaóptimayenalgunos sellegan a asimilarlos pacientescon quejas subjetivasa controlessanos24.
Nohay uncriterio homogéneode selecciónde pacien-tes.Algunosestudiostomansujetosdelapoblacióngeneral
y preguntan por quejas cognitivas25-34. Otros reclutan pacientes que acuden a unidades de memoria y en los que no se evidencian déficits relevantes en el estudio neuropsicológico35-39.Dadoquelospacientesqueacudena consulta lohacenmotuproprio,preocupados porsu dete-rioro,probablementeambosgruposnoseanequivalentes.
Enlos estudios en los que serealizó uncribado entre la población general, no hubo una pregunta o preguntas estandarizadasni validadas.Geerlings etal.28 emplearon: «¿Tieneustedquejassobresumemoria?»b,quesecodificó como «no», «a veces pero no es un problema», «sí y es un problema»,«sí yes unproblema serio».En el estudio Rotterdam emplearon la misma pregunta, pero con res-puestadicotómica40.EnelEasternBaltimoreMentalHealth Survey25yelPAQUID27sepreguntó«¿Encuentraustedquesu memoriale déproblemas?»que secodificócomo «sí/no». Enlosestudios,AMSTEL29,HughHallProject32yGospelOak Study34seusaronpreguntassimilaresalCAMDEX.Enel estu-dio EPESEse preguntó únicamente «¿Está empeorando su memoria?»ylaprevalenciadeQCSfuelógicamente supe-rior, situándose en un 56%26. Paradise et al.31 emplearon unaescalaLikertdefuncionamientomnésicoyJormetal. (2001)30 emplearon4 preguntas con unaescalade0-4. El subestudio del Nurse’s Health Study de Amariglio et al.41 empleó7 preguntas,algunas claramenterelacionadas con envejecimientonormalynoconenfermedad,porloquela incidenciadequejascognitivasfuemuyalta.Elúnico estu-diorealizadoennuestromediofueel deMontejoetal.33, quienes encuadraron sucribado dentro dela Encuestade SaluddelaCiudaddeMadrid(ESCM05)yusaron3preguntas delSCAN42 yCAMDEX43:«¿Tieneproblemas dememoria?», «¿Se leolvidadóndepone lascosas?» y«¿Sele olvidanlos nombresdefamiliaresyconocidos?»44.
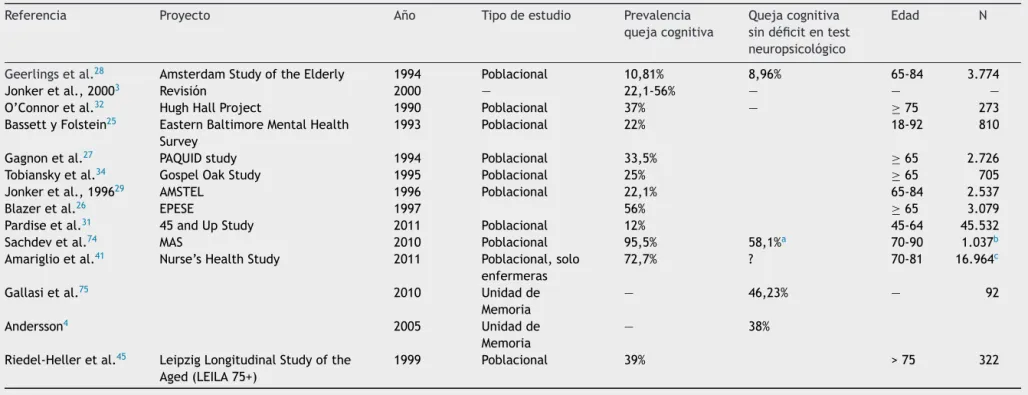
La heterogeneidad metodológica también explica las diferenciasentreincidenciasendistintos estudios, quese resumenenlatabla1.
Característicasdegrupodequejascognitivas subjetivasydiferenciasconlapoblacióngeneral Existe la duda de si las quejas cognitivas enadultos pre-dicen el deterioro cognitivoo son solo reflejo deestados depresivos y comorbilidad psiquiátrica. Sin embargo, y a pesar de que este síntoma es frecuente entre pacientes con depresión,la literaturase˜nala diferencias a nivel de grupo entreaquellos con QCS y la población general, no solo en comorbilidad psiquiátrica, sino también en resul-tados de test neuropsicológicos, declive cognitivofuturo, pruebas deneuroimagen yneuroimagenfuncional,y mar-cadores deLCR.Enlossiguientesapartados, analizaremos estospuntosendetalle.
Relaciónentrequejascognitivasyrendimientocognitivo
Losestudiossobrelarelaciónentrequejasyfuncionamiento cognitivo muestran resultados contradictorios2,27,29,32. La depresión es un factor de confusión3,29-32,41,45-47. El Mini-Mental State Exam de Folstein (MMSE) podría ser un
bLaspreguntashansidotraducidasdelosartículosoriginalesen
Quejas cognitivas subjetivas: hacia una identificación precoz de la enfermedad de Alzheimer 565
Tabla1 Trabajosqueevalúanlaprevalenciadequejascognitivassubjetivas
Referencia Proyecto A˜no Tipodeestudio Prevalencia
quejacognitiva
Quejacognitiva sindéficitentest neuropsicológico
Edad N
Geerlingsetal.28 AmsterdamStudyoftheElderly 1994 Poblacional 10,81% 8,96% 65-84 3.774
Jonkeretal.,20003 Revisión 2000 — 22,1-56% — — —
O’Connoretal.32 HughHallProject 1990 Poblacional 37% — ≥75 273
BassettyFolstein25 EasternBaltimoreMentalHealth
Survey
1993 Poblacional 22% 18-92 810
Gagnonetal.27 PAQUIDstudy 1994 Poblacional 33,5% ≥65 2.726
Tobianskyetal.34 GospelOakStudy 1995 Poblacional 25% ≥65 705
Jonkeretal.,199629 AMSTEL 1996 Poblacional 22,1% 65-84 2.537
Blazeretal.26 EPESE 1997 56% ≥65 3.079
Pardiseetal.31 45andUpStudy 2011 Poblacional 12% 45-64 45.532
Sachdevetal.74 MAS 2010 Poblacional 95,5% 58,1%a 70-90 1.037b
Amariglioetal.41 Nurse’sHealthStudy 2011 Poblacional,solo
enfermeras
72,7% ? 70-81 16.964c
Gallasietal.75 2010 Unidadde
Memoria
— 46,23% — 92
Andersson4 2005 Unidadde
Memoria
— 38%
Riedel-Helleretal.45 LeipzigLongitudinalStudyofthe
Aged(LEILA75+)
1999 Poblacional 39% >75 322
a Datoestimadoindirectamenteapartirdeporcentajesdisponiblesenpublicaciónoriginal. b Excluidospacientescondiagnósticopreviodedemenciaoenfermedadpsiquiátricamayor. c 100%mujeres.
566 S.Garcia-Ptaceketal. instrumentodemasiadosimpleparademostrardeterioroen
estospacientesque,sinembargo,sípresentanalteraciones en otros tests45. En la mayoría de las evaluaciones, las quejas cognitivas se relacionan con peor rendimiento cognitivo27,29,33,35,41,48 y mayor deterioro en los 4 a˜nos previos46. Sin embargo, existen resultados discordantes y otrosestudiosnorevelanestaasociación27,29-32,49.
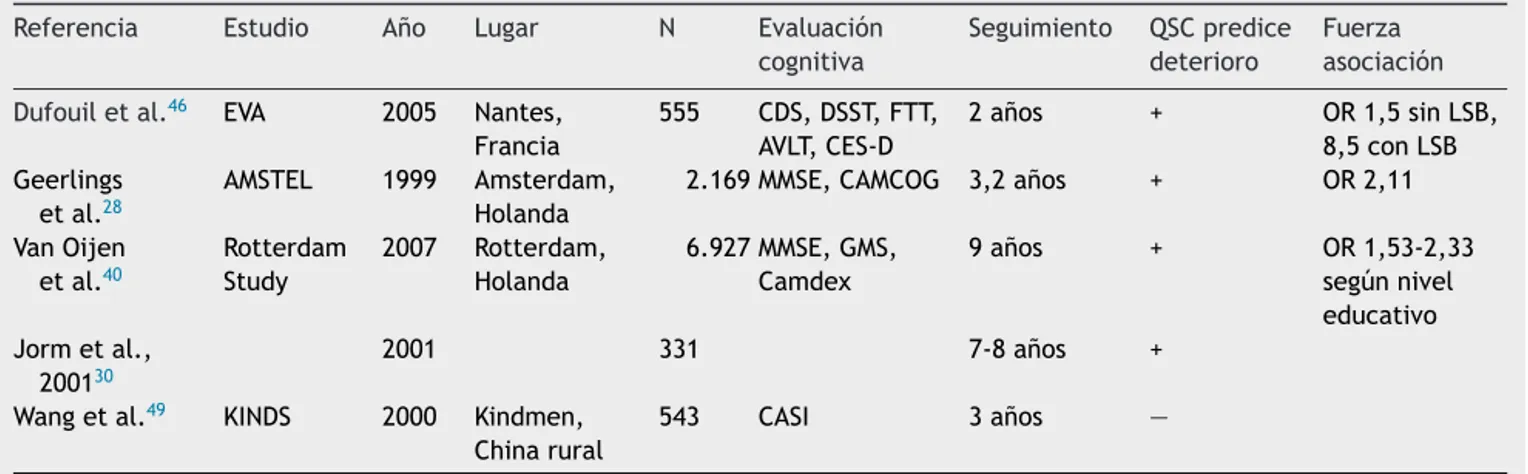
Los estudioslongitudinales arrojanalgodeluzsobrela cuestión, aunque persisten losresultados contradictorios, probablementedebidoadiferenciasmetodológicasya un tiempo de seguimiento insuficiente(tabla 2). Jorm etal. (2001)30 noencontraron relaciónentrequejascognitivasy rendimiento cognitivo basal, pero sí con deterioro en el seguimiento.Tobianski et al.34,Geerlins etal.28 y otros41 encontraronquelosindividuosconquejascognitivassin evi-denciadedeterioro presentaban unaincidencia mayorde EAenelseguimiento,despuésdecontrolarfactoresde con-fusióncomo ladepresión.Schmandetal.47,50 encontraron asociaciónentrequejascognitivaseincidencia de demen-cia, aunquenodistinguieron a lossujetos cognitivamente indemnesdelosyadeteriorados.
ElestudiodeGeerlingsetal.28incluyópoblaciónanciana seleccionada aleatoriamente de los listados de atención primariade la regiónde Ámsterdam.Examinaron a 3.774 sujetos.Analizarondatosdemográficos,quejascognitivasy untotalde4testdeestatuscognitivo,entreelloselMMSE. Excluyeronalossujetoscon demenciaydiferenciaron los quepresentabancogniciónnormal (MMSE26-30) y border-lineMMSE(21-25).El10,8%delospacientesrefirieronquejas cognitivasenlaprimeraevaluación.Eltiempomediode evo-luciónhastalasegundaevaluaciónfuede3,2a˜nos,alcabo deloscuales77pacienteshabíanprogresadoaEA.Quejas cognitivas,edadavanzada,sexofemenino,depresión,nivel educativoynivelcognitivodebasefueronsignificativosenel análisisunivariante,siendoelfactormásrelevantelaedad (oddsratio[OR]de6,17),lapresenciadedeterioro cogni-tivobasalconMMSE<26comparadocon26-30(OR3,77)y sexofemenino(OR2,22).Lasquejascognitivasseasociaron a evolución hacia EA, con una OR de 2,11. En el análi-sismultivariante, las quejascognitivas se asociaban a EA enpacientes conMMSE>26 enla evaluacióninicial, pero noen aquelloscon demencia o con cognición borderline, aunqueesteresultadopodríaestar influidoporlaalta fre-cuenciadepérdidasdeseguimientoentrelospacientescon demenciayborderline.Niladepresiónnielniveleducativo modificabanelresultado.Schofieldetal.51encontraron aso-ciaciónentreEAyquejascognitivassoloentrelossujetos queyaestabandeterioradosenlaprimeraevaluación,pero nosujetosconQCS.Sinembargo,laduracióndela observa-ciónfuetansolodeuna˜no,comparadoconlos3,2a˜nosdel estudiodeGeerlings28.
Dufouiletal.46tambiénencontraronrelaciónentre que-jascognitivasydeterioroenvariostests,conunaORmayor parapacientesqueademáspresentabanlesionesde sustan-ciablanca.
VanOijenetal.40realizaronunestudiolongitudinalcon 6.927sujetos,encuadradodentrodelRotterdam Study.La hipótesiseraque,debidoaunefectotechodelostest neu-ropsicológicos,lasquejascognitivastendríanmayorvalory seríanmás predictivasde deterioroen pacientescon alto niveleducativo.Elseguimientofuelargo,de10,8a˜nos.Se encontróque laeducación protegía de EA,sobre todo en
varones. Las quejascognitivas eran factor de riesgo para demencia,inclusodespuésdeajustar porniveleducativo, MMSEbasal,aleloApoEydepresión.Talcomo habían pre-visto,laasociaciónvariabaconlaeducación,siendomayor en pacientes con mayor nivel educativo. Tomaron como grupo de referencia a pacientescon bajo nivel educativo sinquejascognitivas:comparadosconellos,lossujetoscon bajo nivel educativo y quejas cognitivas tenían un riesgo 1,53vecesmayordedesarrollarEAyelgrupodealtonivel educativo,2,33.
Porel contrario,Wangetal.49 noencontraronrelación entre QCS y demencia. Estudiaron a 543 individuos pro-cedentes de una zona rural a los que se administraron 2evaluaciones,espaciadas3a˜nos.Enambasevaluaciones, las quejas cognitivas se correlacionaron con peor rendi-mientoenlostestsneuropsicológicos,peronoencontraron deterioro longitudinal. Poniendo estos resultados en con-texto del estudio Rotterdam, es posible que el tipo de población,ruralyconbajoniveleducativo,redujeraelvalor predictivodelasquejascognitivas.
Engeneral,lamayoríadelosestudioslongitudinales indi-canunaasociaciónpositiva,aunquemodesta,entrequejas cognitivasydeteriorofuturo(tabla2).
Elpapeldeladepresión
Se ha postulado que rasgos de personalidad o depresión podrían ser la causa de las quejascognitivas2. La depre-sión se asocia a quejas cognitivas29,32. La depresión en sí misma disminuye el rendimiento cognitivo yes factor de riesgodedeteriorofuturo52,actuandocomofactorderiesgo y como síntoma prodrómico de EA53. Es más, a partir de los 65 a˜nos, lospacientes deprimidos presentan un dete-rioro acelerado que deja de ser paralelo al de controles sanos54.
El perfil de deterioro en depresión, centrado en la capacidad atencional y la función ejecutiva, así como la atrofia,de predominiofrontal, nocorresponden alpatrón amnésicodeEA.Sinembargo,sehandescritoalteraciones delhipocampoenpacientesdeprimidos55 yladepresiónes factor de riesgo paraEA56. Krambergeret al.57 evaluaron marcadoresdeEAenelLCRenQCSyEA,ylos correlacio-naronconsusresultadosenlaescalaCornelldedepresión. Los sujetos con EA ydepresión presentaron unatau total (T-tau)significativamentemásbajaqueaquellossin depre-sión,aunquenohubodiferenciasentaufosforilada(P-tau) ni-amiloide.EnelgrupoQSC,T-tauyP-taueranmenores enelgrupocondepresión,mientrasquenosehallaron dife-renciasen-amiloide.Estoshallazgosiríanencontradela hipótesisqueasociapatologíaEAcondepresión.
En el estudio longitudinal de 7 a˜nos de Jorm et al. (2001)30,sedescribióunarelaciónentreafectividad nega-tiva y quejas cognitivas al inicio del estudio, pero las quejas cognitivas eran un factor independiente de dete-rioro cognitivo en el seguimiento, una vez controlada la depresión.Amariglioetal.41tambiénajustaronpara depre-siónyencontraronasociaciónentrequejascognitivasypeor rendimiento. Otros estudios corroboran que la depresión actúacomofactordeconfusiónenlaevaluacióndequejas cognitivas29,33,46.
Esimprescindible que losestudios sobrepacientes con QCSrealicenuncontrolestadísticodeestefactor.
Quejascognitivassubjetivas:haciaunaidentificaciónprecozdelaenfermedaddeAlzheimer 567
Tabla2 Estudioslongitudinales.Relaciónentrequejascognitivasydeterioroenelseguimiento Referencia Estudio A˜no Lugar N Evaluación
cognitiva
Seguimiento QSCpredice deterioro
Fuerza asociación Dufouiletal.46 EVA 2005 Nantes,
Francia
555 CDS,DSST,FTT, AVLT,CES-D
2a˜nos + OR1,5sinLSB,
8,5conLSB Geerlings
etal.28
AMSTEL 1999 Amsterdam, Holanda
2.169MMSE,CAMCOG 3,2a˜nos + OR2,11
VanOijen etal.40 Rotterdam Study 2007 Rotterdam, Holanda 6.927MMSE,GMS, Camdex 9a˜nos + OR1,53-2,33 segúnnivel educativo Jormetal., 200130 2001 331 7-8a˜nos +
Wangetal.49 KINDS 2000 Kindmen, Chinarural
543 CASI 3a˜nos —
AVLT:auditoryverballearningtest;Camcog:Cambridgecognitiveexam;Camdex:Cambridgeexaminationformentaldisordersofthe elderly;CASI:cognitiveabilitiesscreeninginstrument;CES-D:CenterforEpidemiologicStudiesDepressionScale;CSD:cognitive difficul-tiesscale;DSST:digitsymbolsubstitutiontest;FTT:fingertappingtest;GDS-S:geriatricdepressionscaleshortform;GMS:GeriatricMental Stateschedule;KINDS:KinmenNeurologicalDisordersSurvey;LSB:lesionesdesustanciablanca;MMSE:mini-mentalstateexamination.
Pruebasdeimagen
Elgrupo conQCSdifiere delapoblación generalen prue-bas de imagen58,59. Van der Flier et al.59 compararon a 20 pacientes con QCS con 28 controles, encontrando una reducciónsignificativaenvolumenhipocampalizquierdoen el primer grupo. Saykin et al.58 describen una reducción volumétrica temporal medial, frontotemporal y en otras áreasneocorticalessimilaraladelDCLamnésico,perode menorintensidad(n=40).Elgradodeatrofiaserelacionó conelgradodedeterioromnésicoylasquejascognitivas.
Laslesionesenlasustanciablancaincidenenlacurvade aprendizajedeQCS,peronodeDCLnicontrolessanos35,y potencianel riesgodedeteriorocognitivoenpresenciade QCS46.
Grambaiteetal.60 analizarona45sujetos,comparando volumen hipocampal y difusividad de la sustancia blanca entre sujetos con QCS yDCL con T-tau alta en el LCR, y sujetoscon QCSyDCL conT-taunormal.Encontraron una reduccióndelamemoriavisualyelvolumenhipocampalen elprimer grupoyunacorrelaciónentrerendimiento mné-sicoydifusióndesustanciablancaentrelossujetosconT-tau normal.
Neuroimagenfuncional
Varios estudios de RMN funcional (fMRI) han demostrado alteraciones en la codificación de memoria episódica en demencia por EA y DCL, tanto en la corteza temporal medialcomoenestructurasneocorticales.Ensujetos cog-nitivamentenormaleshomocigotosparaApoE4apareceun aumentodeactivacióndecórtexprefrontalizquierdo, hipo-campoizquierdo y biparietalcomparadocon homocigotos ApoE361,62.Además, lossujetoscon mayor activación pre-sentaron mayordeclive enlos2a˜nossiguientes61. EnDCL sehaobservadotantounaumentocomounadisminuciónde activaciónenregionesprefrontalesytemporalesmediales. Estas inconsistenciaspodríandebersea laheterogeneidad delgrupo,olainclusióndeindividuosendistintosestadios delaenfermedad.Enunprimermomento,seproduciríauna hiperactivacióncompensatoriaqueposteriormente fracasa-ríaydaríalugaraunahipoactivaciónenfasesmásavanzadas
de la enfermedad38,63. Esto se correlaciona con la teoría del engrosamiento cortical en fase DCL previo a la atrofiadelaEA,descritatambiénporautoresespa˜nolesdel grupodeMolinuevo36desdeunpuntodevistaestructural.
Rodda et al. (2009)38 compararon el perfil de fMRI en 10sujetosconquejascognitivasy10controlessanosdurante unatareadecodificaciónmnésica.Noencontraron diferen-ciasentrelosgruposenelestudiocognitivobasal.Elgrupo QCS no realizó una codificación menos eficaz ni cometió máserroresqueloscontroles,perosíaparecíaunamayor activacióndecorteza prefrontal dorsolateralypremotora izquierdas. Esto podría reflejar una hiperactivación com-pensatoria enel grupo QCS,similar a la que ocurriríaen elDCL.
Enotro estudiosimilarpero evaluando esta vez tareas deatencióndividida,Rodaetal.(2010)39,constataronun aumentodeactivaciónentálamo,cínguloposteriory cau-dadobilateral, y formaciónhipocampal yparahipocampal izquierdas. Como en su estudio anterior, no encontraron diferenciasenrendimientoentrelos2grupos.
Latomografíacomputarizadaporemisióndefotones sim-plesdeperfusióndistingueDCLamnésicosdenoamnésicos, peronodistingueQCSdecontroles64.
La tomografía de emisión de positrones con 18-F des-oxiglucosa aporta datos interesantes. Comparados con controles, en QCS aparece un metabolismo reducido en regiones parahipocampales, parieto-temporales, frontales inferiores,giro fusiformey tálamo. Estos hallazgos repli-canlosencontradosensujetossanosconriesgogenéticode EA(EAfamiliarautosómico-dominante,altacargafamiliaro homocigotosApoE4)yenDCL15.
Anatomopatología
Las quejas cognitivas presentes cerca del momento de la muerte se relacionan con la anatomopatología de EA, talcomo demuestrauntrabajo integradodentrodel Rush Memoryand AgingProject65.Examinaron 90cerebros yla asociaciónsemantuvotrasajustarporedad, sexo,estado desalud, depresióne intervaloentre evaluación y autop-sia. Enpacientes sin demencia, la anatomopatología tipo
568 S.Garcia-Ptaceketal. EA (evaluación histoquímica) y la carga amiloide y T-tau
(evaluacióninmunohistoquímicaporanticuerpos)se correla-cionabanconquejascognitivas.Enpacientescondemencia, sólo el T-tau se correlacionaba significativamente con el niveldequejas.Enambosgruposelniveldequejas cogniti-vassecorrelacionóconresultadodetestsneuropsicológicos. Estos resultados corroboran los hallazgos de un estudio previo66.
Biomarcadores
Lacombinaciónde-amiloide1-42(A42)bajaconT-tauy P-taualtasenelLCRayudaadistinguiralospacientesconEA deloscontroles.EnlaEA,elA42enelLCRdescendería pre-cozmente,mientrasqueelaumentodeT-tauyP-tausería mástardío37. Antonell et al.37 no encontraron diferencias enbiomarcadoresenelLCRentresujetosconQCSy contro-les,aunque lamuestraerapeque˜na.El estudioDESCRIPA, queincluyóamáspacientes,síencontrómayorfrecuencia debiomarcadorestipoEAenelgrupoQCScomparadoscon controles67.
Además,enelestudioDESCRIPA,losnivelesdeA42 pre-decíanelrendimientoentestsdememoriasemánticayde trabajoen controlesysujetos conQCS, mientrasque tau reflejabamejorelrendimientodelosindividuosconDCL68. Otroestudiocorroboróestoshallazgos69,indicando queel descenso precoz de A42 iría ligado a los primeros cam-bioscognitivos,peroqueotrosmecanismosrelacionadoscon tau explicarían mejor el declive en estadios intermedios de la enfermedad. Curiosamente, en estadio de demen-ciaelrendimientocognitivosehacíaindependientedelos biomarcadores69.
En población a˜nosa sana, un mayor depósito amiloide demostrado por PiB-PET en regiones prefrontal derecha, cortezacinguladaanterior,precuneusderechoycorteza cin-gulada posterior se correlacionó con menor confianza de lossujetosensuspropiascapacidadesmnésicas.Sonestas áreascerebraleslasquemuestrandepósitoamiloideprecoz enlaEA.Aunqueelrendimiento cognitivoenesteestudio nofue distintoentre sujetos con bajoy altodepósito de PiB, los autores concluyen que la percepción subjetiva delosparticipantesesválidaypuedepredecirEAincipiente, dadoquesecorrelacionaconunmarcadortempranodela enfermedad70.
Chételatetal.71encontraronunacorrelaciónentre depó-sitoPiByatrofiaensujetoscon QCSpero noencontroles sanos. En un estudio corolario vieron que sujetos sanos condepósito PiBaltoteníanmayores volúmenes tempora-lesmedialesque sujetosconQCSyPiB alto72. Lossujetos sanoscon PiB alto tenían volúmenes temporales mayores que los sujetos sanos con PiB bajo, así que no se trata deque lossujetos QCS tengan atrofia con respecto a los controles. Más bien estos temporales agrandados podrían correspondera unafase deedema oreacción al depósito amiloide.Obienreflejaríanreservacognitivayúnicamente los sujetos que constitucionalmente tuvieran temporales voluminosos serían capaces de mantenerse intactos con esenivel de cargaamiloide. El estudiode Fortea etal.36 encontró una relación en U invertida entre niveles A42 y volumen cortical. Pero serían necesarios estudios lon-gitudinales para dirimir si se trata de la evolución de la enfermedad o del comportamiento de grupos de sujetos distintos.
Conclusiones
Lamayoríadelosestudiosencuentranpeorfuncionamiento cognitivobasalenelgrupodepacientesconquejas cogni-tivas.ElHughesHallProject32eslaexcepción,aunquesolo aplicaronunestudioneuropsicológicocompletoapacientes con MMSE menor de 25, por lo que pudieron nodetectar déficitsenpacientesconMMSEpocoafectado.
Lamayoríadelosestudiospoblacionales longitudinales demuestranasociación entrequejascognitivasydeterioro cognitivo en el seguimiento, aunque con un incremento modestodelriesgo28,30,40,46.Esposiblequecohortesclínicas deindividuosquebuscanayudapreocupadosporsumemoria demuestrenunaasociaciónmásfuerteconEA,comparados con muestras aleatoriasde la población general. Es inte-resante que el altonivel educativo aumentela fuerza de la asociación, reflejando quizás un efecto techo en los tests neuropsicológicos. Los sujetos con altonivel educa-tivopodríanevaluarmejorsupropiorendimientocognitivo quelostests40.Casualmente, elúnico estudiorevisadode dise˜nolongitudinalquenoencontróasociaciónentreQCSy demenciafueeldeWangetal.49,realizadocon población ruraliletrada.
Quedapordesentra˜narelpapeldeladepresiónenel ren-dimientocognitivo,quejacognitivaydemencia.Pareceque actuaríamedianteunmecanismo multifactorial:causando directamenteunpeorrendimientopordéficitatencionaly motivacional,generandoquejascognitivas,participandoen lagénesisdeldeteriorocomofactorderiesgodedemencia yapareciendocomosíntomaacompa˜nanteenpacientescon demenciaestablecida.
Lospacientescon QCSdifieren delapoblación general enpruebasdeimagen,presentandoreduccióndevolumen hipocampalyunpatróndeatrofiasimilaraladelossujetos conDCLtipoamnésico58,59.Además,presentan anatomopa-tologíacompatibleconEA65,66.
Losestudiosconneuroimagenfuncionalsonmásdifíciles deinterpretarperoindicanqueelgrupoQCSdifieredelos controles sanos enlos patrones de activacióncerebral al realizartareascognitivas.Laheterogeneidadetiopatológica ylosdistintosestadiosevolutivosdelgrupopodríanexplicar las diferenciasentreestudios,pero esprobable queestos aumentos deactivación correspondana unmecanismo de compensaciónanteunapérdidadefunción.
A42, T-tau yP-tau son marcadoresinteresantes en la QCS,quepresentanconmayorfrecuenciaqueloscontroles un patrón típico de EA. A42 descendería de forma pre-coz y estaría ligado a los primeros trastornos cognitivos, mientras quetau intervendría enestadios intermediosde EA. Esposible que haganfalta seguimientos largos, supe-riores a los 2 a˜nos, para apreciar la evolución de estos parámetros37,67,68,73.
LaQCSpodría corresponder a unestadio preclínicode EA,másprecozqueelDCL.Esungrupointeresante,tanto por lo que tiene en común con EA establecida como en lo que difiere. Algunos deestos individuos representarían un equilibro inestable donde factores de compensación y reserva cognitiva comenzaríana claudicar ante el avance delaenfermedad.
Conestos hallazgos, se podría aventurar una hipótesis fisiopatológicaqueincluiríalaQCSenelespectrodelaEA.
Quejascognitivassubjetivas:haciaunaidentificaciónprecozdelaenfermedaddeAlzheimer 569 LacaídadeA42yeldepósitodeamiloideapareceríanen
primera instanciaacompa˜nadosdeaumentodeactivación cerebral en tareas mnésicas como compensación ante la pérdidaderendimiento.Quizásenestemomentoempiecen las primeras quejascognitivas, probablemente en sujetos conaltosrequerimientosfuncionales.Loslóbulos tempora-les pasaríanpor una fase deaumento de volumen previo alaatrofia.Elaumentodetauapareceríaala vezqueel deterioroobjetivable,marcandoelpasoalDCL.
El grupo QCS es heterogéneo. Las diferencias meto-dológicas entre ensayos dificultan la definición de las características y la evolución de estos pacientes. En el futuro,quizásdispongamosdefármacosquefrenenlaEAen susfasesprecoces,peroparaelloseríanecesariodeterminar quégrupodeindividuosseríancandidatosaunaintervención precoz.
Conflicto
de
intereses
Losautoresdeclaranquenoexisteningúnconflictode inte-reses.
Bibliografía
1.ReisbergB,FerrisSH,deLeonMJ,CrookT.Theglobal
deterio-rationscaleforassessmentofprimarydegenerativedementia.
AmJPsychiatry.1982;139:1136—9.
2.ReisbergB,GauthierS.Currentevidence forsubjective
cog-nitiveimpairment(SCI)asthepre-mildcognitiveimpairment
(MCI)stageofsubsequentlymanifestAlzheimer’sdisease.Int
Psychogeriatr.2008;20:1—16.
3.JonkerC,GeerlingsMI,SchmandB.Arememorycomplaints
pre-dictivefordementia?Areviewofclinicalandpopulation-based
studies.IntJGeriatrPsychiatry.2000;15:983—91.
4.AnderssonC.Predictorsofcognitivedeclineinmemoryclinic patients.[Doctoralthesis].Stockholm;2007.
5.Sperling RA, Aisen PS, Beckett LA, Bennett DA, Craft S,
Fagan AM, et al. Toward defining the preclinical stages
ofAlzheimer’s disease: Recommendations from the national
instituteonaging-alzheimer’sassociationworkgroupson
diag-nosticguidelinesforAlzheimer’sdisease.AlzheimersDement.
2011;7:280—92.
6.FerriCP,PrinceM,BrayneC,BrodatyH,FratiglioniL,GanguliM,
etal.Globalprevalenceofdementia:Adelphiconsensusstudy.
Lancet.2005;366:2112—7.
7.BrookmeyerR,JohnsonE,Ziegler-GrahamK,ArrighiHM.
Fore-castingtheglobal burdenofAlzheimer’sdisease. Alzheimers
Dement.2007;3:186—91.
8.Cummings JL. Alzheimer’s disease. N Engl J Med.
2004;351:56—67.
9.QuerfurthHW,LaFerlaFM.Alzheimer’sdisease.NEnglJMed.
2010;362:329—44.
10.McKhann G, Drachman D, Folstein M, Katzman R, Price D,
StadlanEM.Clinical diagnosisof Alzheimer’sdisease: Report
oftheNINCDS-ADRDAworkgroupundertheauspicesof
depart-mentofhealthandhumanservicestaskforceonAlzheimer’s
disease.Neurology.1984;34:939—44.
11.EriksdotterJonhagenM,NordbergA, AmberlaK,BackmanL,
EbendalT,MeyersonB,etal.Intracerebroventricularinfusionof
nervegrowthfactorinthreepatientswithAlzheimer’sdisease.
DementGeriatrCognDisord.1998;9:246—57.
12.Dubois B, Feldman HH, Jacova C, Dekosky ST,
Barberger-Gateau P, Cummings J, et al. Research criteria for the
diagnosis ofAlzheimer’s disease: RevisingtheNINCDS-ADRDA
criteria.LancetNeurol.2007;6:734—46.
13.Dubois B,FeldmanHH, JacovaC,Cummings JL, DekoskyST,
Barberger-GateauP,etal.RevisingthedefinitionofAlzheimer’s
disease:Anewlexicon.LancetNeurol.2010;9:1118—27.
14.BraakE,GriffingK,AraiK,BohlJ,BratzkeH,BraakH.
Neuro-pathologyofAlzheimer’sdisease:WhatisnewsinceAlzheimer?
EurArchPsychiatryClinNeurosci.1999;249(Suppl3):14—22.
15.Mistur R, Mosconi L, Santi SD, Guzman M, Li Y, Tsui W,
et al. Current challenges for the early detection of
Alzhei-mer’s disease: Brainimagingand csf studies.J ClinNeurol.
2009;5:153—66.
16.Petersen RC,ThomasRG, GrundmanM,BennettD,DoodyR,
FerrisS,etal.VitaminE anddonepezilforthetreatmentof
mildcognitiveimpairment.NEnglJMed.2005;352:2379—88.
17.Doody RS, Ferris SH, Salloway S, Sun Y, Goldman R,
WatkinsWE,etal.DonepeziltreatmentofpatientswithMCI:
A 48-week randomized, placebo-controlled trial. Neurology.
2009;72:1555—61.
18.Winblad B, Gauthier S, Scinto L, Feldman H, Wilcock GK,
TruyenL,etal.Safetyandefficacyofgalantamineinsubjects
withmildcognitiveimpairment.Neurology.2008;70:2024—35.
19.FeldmanHH,FerrisS,WinbladB,SfikasN,MancioneL,HeY,
etal.EffectofrivastigmineondelaytodiagnosisofAlzheimer’s
diseasefrommildcognitiveimpairment:TheINDDEXstudy.
Lan-cetNeurol.2007;6:501—12.
20.ThalLJ,FerrisSH,KirbyL,BlockGA,LinesCR,YuenE,etal.
A randomized, double-blind, study of rofecoxib in patients
with mild cognitive impairment. Neuropsychopharmacology.
2005;30:1204—15.
21.Barnes DE, Yaffe K. The projected effect of risk factor
reduction onAlzheimer’s diseaseprevalence. LancetNeurol.
2011;10:819—28.
22.Lautenschlager NT, Cox KL, Flicker L, Foster JK,
van Bockxmeer FM, Xiao J, et al. Effect of physical
acti-vityoncognitivefunctioninolderadultsatriskforAlzheimer
disease:Arandomizedtrial.JAMA.2008;300:1027—37.
23.Jelic V,KivipeltoM, WinbladB. Clinicaltrials inmild
cogni-tiveimpairment: Lessons for thefuture.J NeurolNeurosurg
Psychiatry.2006;77:429—38.
24.Mattsson N, Zetterberg H, Hansson O, Andreasen N,
Parnetti L, Jonsson M, et al. Csf biomarkers and incipient
Alzheimerdiseaseinpatientswithmildcognitiveimpairment.
JAMA.2009;302:385—93.
25.Bassett SS, Folstein MF. Memory complaint, memory
perfor-mance,andpsychiatricdiagnosis:Acommunitystudy.JGeriatr
PsychiatryNeurol.1993;6:105—11.
26.BlazerDG,HaysJC,FillenbaumGG,GoldDT.Memorycomplaint
as a predictorofcognitive decline: A comparisonof african
americanandwhiteelders.JAgingHealth.1997;9:171—84.
27.Gagnon M, Dartigues JF, Mazaux JM, Dequae L,
Letenneur L, Giroire JM, et al. Self-reported memory
complaints and memory performance inelderly french
com-munity residents: Results of the PAQUID research program.
Neuroepidemiology.1994;13:145—54.
28.GeerlingsMI,JonkerC,BouterLM,AderHJ,SchmandB.
Asso-ciationbetweenmemorycomplaintsandincidentAlzheimer’s
diseaseinelderlypeoplewithnormalbaselinecognition.AmJ
Psychiatry.1999;156:531—7.
29.JonkerC,LaunerLJ, HooijerC,LindeboomJ.Memory
com-plaints and memory impairment in older individuals. J Am
GeriatrSoc.1996;44:44—9.
30.JormAF,ChristensenH,KortenAE,JacombPA,HendersonAS.
Memorycomplaints asa precursorofmemory impairmentin
olderpeople:A longitudinalanalysisover 7-8years.Psychol
Med.2001;31:441—9.
31.Paradise MB, Glozier NS, Naismith SL, Davenport TA,
570 S.Garcia-Ptaceketal.
andpsychologicaldistressinthemiddle-aged:Across-sectional
study.BMCPsychiatry.2011;11:108.
32.O’ConnorDW,PollittPA,RothM,BrookPB,ReissBB.Memory
complaintsandimpairmentinnormal,depressed,and
demen-tedelderlypersonsidentifiedinacommunitysurvey.ArchGen
Psychiatry.1990;47:224—7.
33.MontejoP,MontenegroM,FernandezMA,MaestuF.Subjective
memory complaints inthe elderly:Prevalence and influence
of temporal orientation, depression and quality of life in a
population-based study in the city of madrid. Aging Ment
Health.2011;15:85—96.
34.TobianskyR,BlizardR,LivingstonG,MannA.TheGospelOak
Study stage iv:The clinical relevance of subjective memory
impairmentinolderpeople.PsycholMed.1995;25:779—86.
35.Lamar M, Dannhauser TM, Walker Z, Rodda JE, Cutinha DJ,
Shergill SS. Memory complaints with and without memory
impairment: The impact of leukoaraiosis oncognition. J Int
NeuropsycholSoc.2011;17:1104—12.
36.Fortea J, Sala-Llonch R, Bartres-Faz D, Llado A,
Sole-Padulles C, Bosch B, et al. Cognitively preserved
subjects with transitional cerebrospinalfluid -amyloid1-42
valueshave thickercortex inAlzheimer’s disease vulnerable
areas.BiolPsychiatry.2011;70:183—90.
37.Antonell A, Fortea J, Rami L, Bosch B, Balasa M,
Sanchez-Valle R, et al. Different profiles of Alzheimer’s
disease cerebrospinal fluid biomarkers in controls and
sub-jects withsubjective memory complaints. J Neural Transm.
2011;118:259—62.
38.Rodda JE,DannhauserTM,CutinhaDJ,ShergillSS,WalkerZ.
Subjective cognitiveimpairment:Increasedprefrontal cortex
activationcomparedtocontrolsduringanencodingtask.IntJ
GeriatrPsychiatry.2009;24:865—74.
39.RoddaJ,DannhauserT,CutinhaDJ,ShergillSS,WalkerZ.
Sub-jectivecognitiveimpairment:Functionalmriduringadivided
attentiontask.EurPsychiatry.2011;26:457—62.
40.VanOijenM,deJongFJ,HofmanA,KoudstaalPJ,BretelerMM.
Subjectivememorycomplaints,education,andriskof
Alzhei-mer’sdisease.AlzheimersDement.2007;3:92—7.
41.Amariglio RE, Townsend MK, Grodstein F, Sperling RA,
RentzDM.Specificsubjectivememorycomplaintsinolder
per-sonsmayindicatepoorcognitivefunction.JAmGeriatrSoc.
2011;59:1612—7.
42.VazquezBarqueroJL.Cuestionariosparalaevaluaciónclínica
enneuropsiquiatría(SCAN).Adaptaciónenespa˜nol.En:Unidad
deinvestigaciónenpsiquiatríasocialdeCantabria.Santander:
Meditor;1993.
43.Roth M, Tym E, Mountjoy CQ, Huppert FA, Hendrie H,
Verma S, et al. Camdex. A standardised instrument for the
diagnosisofmentaldisorderintheelderlywithspecial
refe-rence to the early detection of dementia. Br J Psychiatry.
1986;149:698—709.
44.AbdulrabK,HeunR.Subjectivememoryimpairment.Areview
of its definitions indicates the need for a comprehensive
set of standardised and validated criteria. Eur Psychiatry.
2008;23:321—30.
45.Riedel-HellerSG,MatschingerH,SchorkA,AngermeyerMC.Do
memorycomplaintsindicatethepresenceofcognitive
impair-ment?Resultsofafieldstudy.EurArchPsychiatryClinNeurosci.
1999;249:197—204.
46.DufouilC,FuhrerR,AlperovitchA.Subjectivecognitive
com-plaintsandcognitivedecline:Consequenceorpredictor?The
epidemiology of vascular aging study. J Am Geriatr Soc.
2005;53:616—21.
47.SchmandB,JonkerC,GeerlingsMI,LindeboomJ.Subjective
memory complaintsintheelderly:Depressivesymptoms and
futuredementia.BrJPsychiatry.1997;171:373—6.
48.JessenF,WieseB,CvetanovskaG,FuchsA,KaduszkiewiczH,
Kolsch H, et al. Patterns of subjective memory impairment
intheelderly:Associationwithmemoryperformance.Psychol
Med.2007;37:1753—62.
49.WangPN,WangSJ,FuhJL,TengEL,LiuCY,LinCH,etal.
Subjec-tivememorycomplaintinrelationtocognitiveperformanceand
depression:Alongitudinalstudyofaruralchinesepopulation.
JAmGeriatrSoc.2000;48:295—9.
50.Schmand B, Jonker C, Hooijer C, Lindeboom J.
Subjec-tivememory complaintsmayannouncedementia.Neurology.
1996;46:121—5.
51.Schofield PW, Marder K, Dooneief G, Jacobs DM, Sano M,
Stern Y. Association of subjective memory complaints with
subsequent cognitive decline in community-dwelling elderly
individualswithbaselinecognitiveimpairment.AmJPsychiatry.
1997;154:609—15.
52.ChodoshJ,KadoDM,SeemanTE,KarlamanglaAS.Depressive
symptomsasapredictorofcognitivedecline:Macarthurstudies
ofsuccessfulaging.AmJGeriatrPsychiatry.2007;15:406—15.
53.Enache DW, B. Aarsland D. Depression in dementia:
Epide-miology, mechanisms, and treatment. Curr Opin Psychiatry.
2011;24:461—72.
54.Gualtieri CT, Johnson LG. Age-related cognitive decline in
patientswithmooddisorders.ProgNeuropsychopharmacolBiol
Psychiatry.2008;32:962—7.
55.FrodlT,MeisenzahlEM,ZetzscheT,BornC,GrollC,JagerM,
et al. Hippocampal changes in patients with a first
epi-sode of major depression. Am J Psychiatry. 2002;159:
1112—8.
56.SaczynskiJS,BeiserA,SeshadriS,AuerbachS,WolfPA,AuR.
Depressivesymptoms and risk ofdementia:The framingham
heartstudy.Neurology.2010;75:35—41.
57.KrambergerMG,JelicV,KåreholtI,EnacheD,Erisdotter
Jönha-genM,WinbladB,etal.Cerebrospinalfluidalzheimermarkers
in depressed elderly subjects with and without Alzheimer’s
disease.DementGeriatrCognDisord.2012;2:48—56.
58.SaykinAJ, Wishart HA, Rabin LA, Santulli RB, Flashman LA,
WestJD, et al.Older adultswithcognitivecomplaints show
brain atrophy similar to that of amnestic mci. Neurology.
2006;67:834—42.
59.VanderFlierWM,vanBuchemMA,Weverling-RijnsburgerAW,
Mutsaers ER, Bollen EL, Admiraal-Behloul F, et al. Memory
complaints in patients with normal cognition are
associa-ted withsmaller hippocampal volumes. JNeurol. 2004;251:
671—5.
60.Grambaite R, Stenset V, Reinvang I, Walhovd KB, Fjell AM,
FladbyT.Whitematterdiffusivitypredictsmemoryinpatients
withsubjectiveandmildcognitiveimpairmentandnormalcsf
totaltaulevels.JIntNeuropsycholSoc.2010;16:58—69.
61.BookheimerSY,StrojwasMH,CohenMS,SaundersAM,
Pericak-Vance MA, Mazziotta JC, et al. Patterns of brainactivation
in people at risk for Alzheimer’s disease. N Engl J Med.
2000;343:450—6.
62.Wishart HA, Saykin AJ, Rabin LA, Santulli RB, Flashman LA,
Guerin SJ, et al. Increased brain activation during working
memory in cognitively intact adults withthe apoe epsilon4
allele.AmJPsychiatry.2006;163:1603—10.
63.Celone KA, Calhoun VD, Dickerson BC, Atri A, Chua EF,
MillerSL,etal.Alterationsinmemorynetworksinmild
cog-nitive impairment and Alzheimer’s disease: An independent
componentanalysis.JNeurosci.2006;26:10222—31.
64.Nobili F, Frisoni GB, Portet F, Verhey F, Rodriguez G,
CaroliA,etal.Brainspectinsubtypesofmildcognitive
impair-ment.FindingsfromtheDESCRIPAmulticenterstudy.JNeurol.
2008;255:1344—53.
65.BarnesLL, Schneider JA, Boyle PA, BieniasJL, Bennett DA.
MemorycomplaintsarerelatedtoAlzheimerdiseasepathology
inolderpersons.Neurology.2006;67:1581—5.
66.Jorm AF, Masaki KH, Davis DG, Hardman J, Nelson J,
Quejascognitivassubjetivas:haciaunaidentificaciónprecozdelaenfermedaddeAlzheimer 571
predictfuturepathologicdiagnosisofAlzheimerdisease.
Neu-rology.2004;63:1960—1.
67.Visser PJ, Verhey F, Knol DL, Scheltens P, Wahlund LO,
Freund-Levi Y,et al. Prevalence and prognostic valueofcsf
markersofAlzheimer’sdiseasepathologyinpatientswith
sub-jectivecognitiveimpairmentormildcognitiveimpairmentin
theDESCRIPAstudy:Aprospectivecohortstudy.LancetNeurol.
2009;8:619—27.
68.Rolstad S, Berg AI, Bjerke M, Blennow K, Johansson B,
ZetterbergH, et al. Amyloid-beta42 is associatedwith
cog-nitiveimpairmentinhealthyelderlyand subjectivecognitive
impairment.JAlzheimersDis.2011;26:135—42.
69.RamiL,ForteaJ,BoschB,Sole-PadullesC,LladoA,IranzoA,
etal.Cerebrospinalfluidbiomarkersandmemorypresent
dis-tinctassociationsalongthecontinuumfromhealthysubjectsto
ADpatients.JAlzheimersDis.2011;23:319—26.
70.Perrotin A, Mormino EC, Madison CM, Hayenga AO,
Jagust WJ. Subjective cognition and amyloid deposition
imaging: A Pittsburgh compound B positron emission
tomo-graphy study in normal elderly individuals. Arch Neurol.
2012;69:223—9.
71.Chételat G, Villemagne VL, Bourgeat P, Pike KE, Jones G,
Ames D, et al. Relationship between atrophy and
beta-amyloiddepositioninAlzheimerdisease.AnnNeurol.2010;67:
317—24.
72.Chételat G, Villemagne VL, Pike KE, Baron JC, Bourgeat P,
Jones G, et al. Larger temporal volume in elderly with
high versus low beta-amyloid deposition. Brain. 2010;133:
3349—58.
73.Bouwman FH, van der Flier WM, Schoonenboom NS, van
Elk EJ, Kok A, RijmenF, et al. Longitudinal changes of csf
biomarkers in memory clinic patients. Neurology. 2007;69:
1006—11.
74.Sachdev PS, Brodaty H, Reppermund S, Kochan NA,
TrollorJN,DraperB,etal.TheSydneyMemoryandAgeingStudy
(MAS):Methodologyandbaselinemedicalandneuropsychiatric
characteristics of an elderly epidemiological non-demented
cohort of australians aged 70-90 years. Int Psychogeriatr.
2010;22:1248—64.
75.GallassiR,OppiF,PodaR,ScortichiniS,StanzaniMaseratiM,
MaranoG,etal.Aresubjectivecognitivecomplaintsarisk