Examensarbete i Biomedicinsk Laboratorievetenskap Malmö Högskola 15 hp Hälsa Samhälle Biomedicinsk Analytikerprogrammet 205 06 Malmö Mars 2018
EN JÄMFÖRELSESTUDIE;
MOTILITET OCH VITALITET HOS
SPERMATOZOA I TVÅ OLIKA
KRYOKONSERVERINGS-
PROCESSER OCH
UPPTININGSMETODER.
EN JÄMFÖRELSESTUDIE;
MOTILITET OCH VITALITET HOS
SPERMATOZOA I TVÅ OLIKA
KRYOKONSERVERINGS-PROCESSER OCH
UPPTININGSMETODER.
CHRISTOPHER ODEBERGER
Odeberger, C. En jämförelsestudie; motilitet och vitalitet hos spermatozoa i två olika kryokonserveringsprocesser och upptiningsmetoder. Examensarbete i
Biomedicinsk laboratorievetenskap 15 högskolepoäng. Malmö universitet:
Fakulteten för hälsa och samhälle, institutionen för biomedicinsk vetenskap, 2018. Nedfrysning och upptining av spermatozoa används frekvent i
andrologi-laboratoriet för assisterad reproduktionsteknik och bedömning av spermatozoa. I dagsläget finns det ingen standard hur nedfrysning och upptining av spermatozoa ska ske. I denna studie jämförs två olika processer; ”slow freeze” följt av
upptining med G-IVFTM medium, vilken används på RMC Skånes
Universitetssjukhus. Kryokonservering med ”pellets” följt av upptining med HTF + 10% HSA medium enligt Martínez-Soto J C m.fl. Två olika upptiningsmetoder används för varje process; först tinas spermatozoa i rumstemperatur i 10 minuter, följt av 10 minuter uppvärmning i 37 °C och precis innan analys tillsätts 37 °C medium. I den andra upptiningensmetoden tillsätts 37 °C medium till det frysta provet och förvaras i värmeskåp, 37 °C i 20 minuter. I studien analyseras effekterna av spermatozoa motilitet och vitalitet. Resultaten visar att med ”slow freeze” och G-IVFTM finns det ingen signifikant skillnad mellan
upptiningsmetoderna för både motilitet, p-värde >0,05 och vitalitet, p-värde >0,05. I jämförelse med Martínez-Soto J C m.fl visades ingen skillnad mellan motilitet, p-värde >0,05. Studien visar en positiv effekt på vitalitet jämfört med Martínez-Soto J C m.fl studie, p-värde <0,01. Studien visar att användning av ”slow freeze” med G-IVFTM inte gör någon skillnad på motilitet men har en
positiv signifikant påverkan på spermatozoa vitaliteten. Mer studier är nödvändiga för att stärka dessa resultat och överlag behövs mer studier inom området för att utveckla bättre metoder.
A COMPARISON STUDY;
MOTILITY AND VITALITY OF
SPERMATOZOA IN TWO
DIFFERENT
CRYOPRESERVING-PROCESSES AND THAWING
METHODS
CHRISTOPHER ODEBERGER
Odeberger, C. A comparison study; motility and vitality of sperm in two different cryopreservingprocesses and thawing methods. Degree project in Biomedical
science 15 högskolepoäng. Malmö University: Faculty of Health and Society,
Department of Biomedical Science, 2018.
Freezing and thawing of spermatozoa are frequently used in the andrology
laboratory for assisted reproduction techniques and assessment of spermatozoa. At present, there is no standard on how freezing and thawing of spermatozoa should occur. In this study two different processes are compared; “slow freeze” followed by thawing with G-IVFTM medium, which is used at RMC University Hospital.
Cryopreservation with “pellets” followed by thawing with HTF + 10% HSA medium according to Martínez-Soto J C et al. Two different thawing methods are used for each process; first, the spermatozoa are thawed at room temperature for 10 minutes, followed by 10 minutes warming at 37 °C and just before analysis 37 °C medium is added. At the second thawing method, 37 °C medium is added to the sample and stored in a heating chamber, 37 °C for 20 minutes. The study analyzed the effects of spermatozoa motility and vitality. Results show that with “slow freeze” and G-IVFTM there is no significant difference between the two
thawing methods for both motility, p-value >0,05 and vitality, p-value >0,05. Comparing with Martínez-Soto J C et al. no difference between motility was shown, p-value >0,05. The study shows a positive effect on vitality compared to Martínez-Soto J C et al, p-value <0,01. The study shows that the use of “slow freeze” with G-IVFTM does not make any difference in motility but has a
significant positive effect on the spermatozoa vitality. More studies are necessary to strengthen these results. Overall more research is needed in the area to develop and find a common method.
INNEHÅLLSFÖRTECKNING
INLEDNING 1 Kryokonservering 1 Kryoskyddande ämne 2 Nedfrysning 3 Spermatozoa 3 Hantering av material 4 Förvätskning 4 Volym 4 Etik 5 SYFTE 5 MATERIAL 5 Nedfrysning 5 Upptining 5 METOD 5 Nedfrysning 6 Upptining 6 Mikroskopering 6 Motilitet 7 Vitalitet 7 Statistisk analys 7 RESULTAT 7 Motilitet 7 Vitalitet 8 DISKUSSION 8 Resultatdiskussion 8 Metoddiskussion 9 SLUTSATS 12 REFERENSER 13 BILAGA 1 15 BILAGA 2 161
INLEDNING
Kryokonservering används rutinmässigt i sjukvården vid till exempel reproduktion, strålbehandlingar, försäkring vid vasektomi, lagring av
spermadonation med mera [1]. Spelar en viktig roll som terapeutiska alternativ vid hantering av infertilitet, viktig roll i reproduktiv vetenskap, särskilt för bevarande av reproduktiva vävnader, gameter och embryon [2]. Kryokonservering av spermatozoa representerar ett användbart och terapeutiskt alternativ vid
behandling av infertilitet med flera möjliga tillämpningar Vid kryokonservering utsätts spermatozoa för kemisk och fysisk stress vilket orsakar ogynnsamma förändringar i spermatozoa motilitet (rörlighet) , vitalitet, membrankomposition samt acrosomen. Alla dessa ändringar påverkar spermatozoa negativt vilket resulterar i minskad befruktningsförmåga efter kryokonservering [3]. I dagsläget finns det ingen standard för hur nedfrysning och upptining av spermatozoa ska ske. För en lyckad nedfrysning av spermatozoa finns det många faktorer som spelar roll: kryostatprodukter, medium, tid, volym och upptiningstemperatur [3,4]. De tekniska aspekterna för nedfrysning, upptining och krykonserveringsmedium har förfinats under åren [3]. Kryokonservering är nödvändigt i
andrologi-laboratoriet för assisterad reproduktionsteknik och bedömningar. Traditionell preservering utan skyddande medel används generellt till molekylärbiologiska studier som DNA-, RNA och proteinanalyser, detta är dock skadligt för spermatozoas motilitet och vitalitet [1].
Martínez-Soto J C m.fl [3] evaluerar effekterna på spermatozoa efter nedfrysning (med pellets) och upptiningen med två olika upptiningsmetoder; Pellets får tina 10 minuter i rumstemperatur och därefter 10 minuter i 37 °C och vid analys tillsätts 37 °C varmt medium som består av human tubal fluid (HTF) + 10% human serum albumin (HSA) medium. I den andra metoden placeras pellets i samma medium men redan 20 minuter före analys. Tjugo prover analyserades efter motilitet och progressiv rörelse (framåtgående) med mikroskop. Med hjälp av CASA
(Computer assisten sperm analysis) analyserades också kurvig hastighet, rakt-linje hastighet samt genomsnittlig banhastighet m.fl. Spermatozoa analyserades även efter dess vitalitet, skador på lipidmembran och anterior membran på
spermatozoa, produktionen av reaktiv oxygen species (ROS) samt mängden kromatin kondensation [2].
På Reproduktionsmedicinskt centrum (RMC) Skånes Universitetssjukhus analyserades spermatozoas motilitet och vitalitet genom att ändra
nedfrysningsprocess till ”slow freeze” och medium till G-IVFTM. I denna
jämförelsestudie jämförs kryokonservering och upptining genom progressiv motilitet och vitalitet.
Kryokonservering
Kryokonservering har rapporterats orsaka skador på bland annat spermatozoas morfologi, inkluderat svansen och mitokondrier. Beror bland annat på bildandet av iskristaller som kan förekomma vilket förstör integriteten hos cellulärt membran, inducerar DNA-skador. Extracellulära trycket stiger som följd av de lösta ämnena uteslutna från isbildning, vilket pressar extracellulär lösning in i cellen och intercellulärt vatten ut ur cellen. Ökad koncentration av
intracellulärämnen och hyperosmotisk stress kan orsaka
DNA-dubbelsträngsbrytningar p.g.a. cellkrympning, bildandet av fria radikaler och förändringar i kromatinkompaktitet och tillgänglighet. Detta påverkar
2
spermatozoas förmåga att vidhålla intakta membraner vilket leder till att motiliteten påverkas [1]. Membranskador påverkar även viabiliteten [5]. Flera rapporter visar att vid nedfrysning och upptining minskar det metaboliska tillståndet hos spermatozoa vilket leder till att plasmamembranet skadas vilket i sin tur minskar antalet friska spermatozoa [6]. Spermatozoan består av fyra olika huvuddelar; huvudet består av acrosomen och membran som innesluter
cellkärnan. Huvudet är kopplat till nacken som innehåller en centriol. Efter nacken kommer ett mittstycke med en filamentös kärna med många mitokondrier kring den, dessa används för ATP-produktion för bland annat rörelse av svansen som driver spermatozoan framåt [7]. Dessa membraner måste förbli intakta för fungerande spermatozoa [1]. Nedfrysningshastigheten och val av komponenterna i lösningen, som cellerna fryses i, påverkar spermatozoans kvalitet efter
kryokonserveringen genom att påverka cytoskeletala element och minska det metaboliska tillståndet [6].
Även om det verkar som att spermatozoan är mindre känsliga mot kryoförvaring än andra celler, är kryokonservering fortfarande associerad med förändringar av spermatozoastrukturer [2].
Det är generellt accepterat att motiliteten minskar vid kryokonservering men orsakerna är inte helt kända. Hypotesen är att de kan ha mekaniska, fysiska eller kemiska orsaker [5]. Kryokonservering har också visat sig generera DNA
fragmentering men funktionen bakom har ännu inte blivit fullt förstådd. Det finns förslag på att DNA fragmenteringen kan beror på apoptos eller ROS men det saknas studier för att stärka detta. ROS dismuterar spontant eller enzymatiskt till väteperoxid. Tack vara sin förmåga att korsa membran och dess höga
oxidantaktivivet är det cytotoxiskt [8]. Men det finns flera faktorer som behöver beaktas vid optimering av överlevnaden av spermatozoa efter kryokonservering. Även nedfrysningsprocessen har en stor betydelse. Nedfrysningshastigheten kan påverka cellens uttorkning, att kunna hitta den optimala nedfrysningshastigheten är av stor betydelse [6]. Generellt används en kontrollerad långsam kylning, (”slow freeze”) när spermatozoa fryses ner [9].
Kryoskyddande ämne
Mellan individer skiljer sig spermatozoa motilitet och vitalitet vid kryokonservering enormt och det har postulerats att bearbetning- och
kylningsprotokoll ska skräddarsys och anpassas till varje individ. Bland annat för att försöka hitta den optimala sammansättningen av kryoskyddande ämnen [10]. Kryoskyddande ämnen tillsätts för att skydda spermatozoa från skador vid nedfrysning och upptining. De innehåller osmotisk aktiva ingredienser vars uppgift är att reducera intracellulära vätskan för att minimera skador orsakade av iskristallation [9]. Glycerol är det vanligaste kryoskyddande ämne för humana spermatozoa vid nedfrysning.
Glycerol främjar bland annat celldehydrering, minskar ackumulation av lösta ämnen och skadliga effekter från iskristallformation [10]. Glukos, humant
albumin serum och natriumklorid är andra kryoskyddande ämnen som hjälper till att skydda, underhålla och förhindra aggregering av spermatozoa [9]. Det finns studier som visar att tillförandet av olika komponenter, kallad extenders,
tillsammans med glycerol kan öka överlevnaden vid kryokonservering. Ensamma har extenders ingen beskyddande effekt men tillsammans med ett kryoskyddande ämne har de visat ökad återhämtning vid upptining [10].
Hur de skyddar är inte känt men man misstänker att de interagerar med fosfolipider, membranproteiner, buffert till pH och skyddar mot köld-chock.
3
Utan protokoll och starka bevis för modifierade frysmedium kommer dessa inte accepteras inom den moderna kliniska miljön. Med ökade regulatorer av bland annat EU:s vävnads- och celldirektiv, ska användningen av färdigberedda kryoskyddande medel som är konsistenta och har stränga kvalitetskontroller användas [10].
Nedfrysning
Spermatozoa är den första typen av cell som framgångsrikt både blivit nedfryst och upptinad [6]. Det finns många faktorer som påverkar ifall man lyckas göra en lyckad nedfrysning: vilka kryostatprodukter man använder, medium, tid, volym och upptiningstemperatur [3, 4].
Kryokonservering, ”slow freeze”, är i dagsläget den mest frekventa tekniken för preservering av humana spermatozoa [9, 11]. Tekniken är enkel och fungerar genom att provet späds med kryoskyddande ämnen, kyls och fryses i flytande kväve [9].
Nedfrysningenhastigheten påverkar de fysiska händelserna inom cellen och bestämmer resultatet av nedfrysningen. Om cellerna kyls ner för snabbt kommer de frysa intracellulärt. Detta beror på att vattnet inte hinner lämna cellerna
tillräckligt snabbt för att lyckas uppnå jämnvikt vilket leder till att underkylningen ökar och att jämnvikt uppnås genom intracellulär frysning. Genomgår cellerna intracellulär frysning, överlever de oftast inte [6].
Långsam nedfrysning får cellerna att förlora vatten snabbare vilket gör att de lösta ämnena koncentreras tillräckligt för att förhindra underkylning som i sin tur gör att cellerna dehydreras och undviker att frysas intracellulärt [6].
Skulle nedfrysningen ske allt för långsamt kommer cellernas volym att minska extremt och exponeras över en lång tid för höga koncentrationer lösta ämnen. Båda dessa faktorer kan orsaka celldöd [6].
Skadliga effekter på membran och molekylärnivå kan ske på humana spermatozoa vid kryokonservering, detta leder till att motilitet och vitalitet reduceras samt att fertiliseringspotentialen av spermatozoa försämras [9].
Skador på spermatozoa kan drastiskt minska hos många olika arter genom att man fryser ner långsamt och därför använder sig de flesta processer av en initialt långsam nedfrysningsprocess på ≤10 grader/h. När cellerna håller på att kylas ner till ungefär -5 °C förblir de och mediet ofrysta och underkylda [6].
Is börjar bildas i de externa delarna av mediet när temperaturen sjunker ner till mellan -5 och -10 °C medan cellerna fortfarande förblir underkylda och ofrysta. Celler som är underkylda har en högre kemisk potential än vattnet i mediet vilket orsakar att vatten lämnar cellen via osmos och fryses externt. Långsam kylning som ger 90% förlust av isotonisk intracellulärt vatten samt garanterar <2 grader intracellulär underkylning innan cellerna kylts ner till iskärnbildning bör därför förhindra intracellulär frysning [6].
Frysningen ner till -196 °C sker konventionellt på två olika sätt. Icke-kontrollerat (”pellets”) eller kontrollerat (”slow freeze”). Vid det
förstnämnda utsätter man provet direkt för flytande kväve. Vid det kontrollerade sättet fyller man på kväve i en kylkammare efter att provet först placerats i ett skyddande hölje. Studier har dock visat att flytande kväve inte är sterilt och kan vara en potentiell källa för kontaminering [9].
Spermatozoa
Normala spermatoza har ett homogent grått-opaliserande utseende vid
4
också variera beroende på olika faktorer: röd-brun om blodceller förekommer, gul om mannen har gulsot, tar vitaminer eller droger [7].
Typisk storlek på spermatozoa ligger kring 50 µm och består av ett huvud och svans. Huvudet är ovalt och platt i form, avsmalning apikalt och mäter 4,0 – 5,0 µm i läng och en bredd på 2,5 – 3,5 µm [12].
Huvudet kan delas upp i tre olika delar, kärnan, akrosomen och perinucleär kapsen. Kärnan med haploid uppsättning kromosomer, omfattar ungefär 65% av huvudet och består mestadels av packat kromosomalt material (mestadels DNA) och proteiner. Akrosomen, en vesikel som finns runt den proximala delen av huvudet och innehåller hydrolytiska enzymer som är essentiella för att kunna penetrera ägget [12, 13].
En styv kapsel, ”perinuclear theca”, som är ett cytoskeletalt element som innesluter spermatozoan. Delas upp i två regioner, subkromosomala och postkromosomala. Har en betydelse för addering, spridning och bindningen av akrosomen på spermatidernas kärna [13].
Svansen är ca 10x längre än själva huvudet. Anterior delen av svansen består av ett ark med tätt packade mitokondrier. Fibrerna som drivs av mitokondrierna i mittdelen kallas axial filament komplexet vilket är spermatozoas huvudorgan för motilitet [12].
Hantering av material
Vid insamling av spermatozoa är onanimetoden att rekommendera. Metoder som inkluderar samlag med utdrag (man drar ut penisen innan ejakulering), vaginal vätskekontaminering samt förlust av första spermatozoa fraktionen är inte att rekommendera. Av liknande orsaker är vaginal dränering samt oral
spermatozoauppsamling inget som rekommenderas [12].
Objektiv data får man bäst genom att analysera flera prover från samma patient. Optimalt ska analys av ejakulering ske var annan till tredje vecka tills fyra prover är ihopsamlade. Visar något av proven abnormitet tas flera prover för att bättre bedöma den kliniska diagnosen. Hormoner, kemikalier, värme m.m. påverkar kvaliteten av spermatozoa över tid [12].
Förvätskning
Efter ejakulation är sädesvätskan ofta en semi-koagulerad massa. Efter ett par minuter i rumstemperatur börjar sädesvätskan att förvätskas. I börjar är det lite aggregat i vätskan och med tiden blir lösningen mer homogen med endast ett fåtal koagulerade områden kvar. Sädesvätskan förvätskas oftast inom 15 minuter i rumstemperatur. Immobila spermatozoa får tillbaka rörligheten om sädesvätskan får förvätskas [7].
Volym
Ejakulatets innehåll utsöndras från prostatakörteln, sädesblåsorna samt en mindre mängd från bulbourethralkörteln och bitestiklarna [7]. Ejakulatets volym bestäms genom att pipetteras upp och volym läses av, standard på RMC Skånes
5
Etik
Lag (2003:460) om etikprövning av forskning som avser människor syftar till att skydda den enskilda individen och respektera människovärdet vid forskning. 4 § punkt 3 under tillämpningsområde: Forskning som omfattas av lagen lyder: ”avser studier på biologiskt material som har tagits från en levande människa och kan härledas till denna människa” [14].
Denna studie använder sig av biologiskt material; spermatozoa från levande individer. Genom att proven har blivit avidentifierade och fått ett id-nummer kan dessa inte spåras tillbaka till den enskilda individen.
SYFTE
Syftet med studien är att göra en jämförelse mellan två kryokonserverings-processer och upptiningsmetoder för att se om det föreligger signifikanta skillnader av vitalitet och motilitet på humana spermatozoa.
MATERIAL
Material kommer att delas upp i två olika moment: Nedfrysning och upptining, för att definiera vad varje moment kräver.
Nedfrysning
Oidentifierade mänskliga spermatozoa (enligt World Health Organisation (WHO) standard), Uppsamlingsburk (Starstedt, Nümbrecht, Tyskland), Vagga (Mixer 440, Swelabs, Spånga, Sverige), Pipett (3 ml, LP Italiana, Milano, Italien), Etikettskrivare, Spruta (BD EmeraldTM, BD, New Jersey, USA),
Strå (Paillettes CBSTM High Security sperm straw 0,3 ml, steril, Cryo Bio System,
Leeuwarden, Nederländerna), Sprutanslutning (Cryo Bio System, Leeuwarden, Nederländerna), 72% etanol, Miniräknare, Sperm Freeze (FertiPro 20 ml, Beernem, Belgien), Nål (BD MicrolanceTM 12x50 mm, BD, New Jersey, USA),
Svetsapparat (Cryo Bio System, Leeuwarden, Nederländerna),
Kryokammare (PLANER, Kryo 360 – 1,7, Shepperton, Storbritannien)
Upptining
Provrör (2 ml) med gummilock (Starstedt, Nümbrecht, Tyskland), Sax, G-IVFTM medium (Vitrolife, Göteborg Sweden), Värmeskåp (LABEX, Helsingborg, Sverige), Mikroskop (Eclipse 600 med Nikon Phase Contrast 0,90 DRY Japan, Nikon, Minato, Japan), Räknedosa (Compudiff 2000-16, MOLEK, Årsta, Sverige), Makler-kammare (Sefi-Medical instruments, Haifa, Israel), Immersionsolja, Eosin-nigrosin lösning.
METOD
I denna jämförelsestudie behandlas spermatozoa, på RMC Skånes
Universitetssjukhus, enligt riktlinjerna i Martínez-Soto J C m.fl [3] med viss modifikation. Martínez-Soto J C m.fl [3] använder sig av kryokonservering med
6
”pellets” och upptining med HTF + 10% HSA medium. RMC använder sig av ”slow freeze” konservering följt av upptining med G-IVFTM medium.
Upptiningen delas upp i två olika metoder. Vid första tinas spermatozoa i
rumstemperatur i 10 minuter följt av 10 minuter uppvärmning i 37 °C och precis innan analys tillsätts 37 °C varmt G-IVFTM. Vid andra upptiningsmetoden tillsätts 37 °C varmt G-IVFTM direkt och man låter provet stå 20 minuter i 37 °C.
Oidentifierade spermatozoa tillhandhölls från andrologilaboratoriet, RMC Skånes Universitetssjukhus i sterila uppsamlings burkar. Proverna är i bästa grad enligt WHO riktlinjer [7]: 1,5 – 6 ml spermatozoa, över 15 miljoner spermatozoa/ml, total progressivitet över 32%.
Männen onanerade och ejakulerade hela satsen i en ren uppsamlingsburk med bred öppning. Proven har insamlats efter minimum 2 dagar till maximum 7 dagar av sexuell avhållsamhet.
Vid infärgningen av spermatozoa blandades 10 µl ejakulat med lika delar eosin-nigrosinfärg. En droppe av blandningen applicerades därefter på ett objektglas som ströks ut och lufttorkades. Därefter applicerades en droppe immersionsolja på den mörka änden av objektglaset, där koncentrationen är högre, för att lättare urskilja levande från döda spermatozoa. Spermatozoa räknades i ett zic-zac mönster; uppifrån ner, nerifrån upp osv.
Nedfrysning
Spermatozoa placerades på en vagga i 10 minuter för att undvika agglutination [7]. En 3 ml pipett användes för att kontrollera kvantiteten på spermatozoa. Volymen spermatozoa avgör hur mycket SpermFreeze som tillsätts. Proverna späddes 0,7 gånger med SpermFreeze. Höljet till SpermFreeze-flaskan penetrerades med steril nål, lösningen sögs upp och applicerades droppvis till ejakulatet under omrörning. Ejakulatet placerades ytterligare 10 minuter på vaggan. Strå (”sugrör”) med sprutanslutning fästes på sprutan och ejakulatet sögs upp. Samma sprutanslutning användes till alla patientens strå. I ena änden av strået användes ett filter för att undvika kontaminering vid uppsugning. Strået frigjordes från sprutan och sprutanslutningen. Strået förseglades i bägge ändarna med hjälp av svetsapparaten. Ändarna torkades av med 72% etanol. Stråna placerades i kryokammaren med förbestämt frysprogram, ”slow freeze” (bilaga 1).
Upptining
Stråna klipps av i båda ändarna för att det frysta ejakulatet ska rinna ut i ett
uppsamlingsrör. Två olika upptiningsmetoder användes: I metod 1 överfördes 150 µl ejakulat överfördes till ett nytt provrör och lämnades i rumstemperatur i 10 minuter. Efter 10 minuter placerades provröret i ett värmeskåp, 37 °C i ytterligare 10 minuter. Innan analys tillsattes 37 °C, 300 µl G-IVFTM medium. I metod 2 överförde 150 µl ejakulat till ett provrör med uppvärmd, 37 °C, 300 µl G-IVFTM
medium och placerades i värmeskåp i 20 minuter.
Mikroskopering
På makler-kammare applicerades 0,7 µl ejakulat som analyserades i fas-kontrastmikroskop. Makler-kammaren har ett 10x10 rutnät för att kunna räkna antalet spermatozoa. Koncentrationen (antal miljoner spermatozoa/ml) räknades
7
ut genom att räkna de 10 första rutorna till vänster, uppifrån och ner, enligt RMC rutin.
Motilitet
I rutnätet räknades 200 spermatozoa med 200x förstoring. Spermatozoa ska vara hela, det vill säga huvud och svans ska vara synliga. Motiliteten delas upp i progressiv rörelse och immobila. Till progressiva räknas spermatozoa som tar sig framåt. Till immobila räknas döda, stillastående och spermatozoa som simmar i små cirklar.
Vitalitet
Tvåhundra spermatozoa räknades med 1000x förstoring. Spermatozoa ska vara hela, det vill säga huvud och svans ska vara synligt samt helt vita eller delvis infärgade. Om nacken av spermatozoan är infärgad räknas den som levande.
Statistisk analys
Data uttrycks som medelvärde ± SEM (standard error of the mean) och räknades ut i IBM SPSS Statistics Data Editor. Jämförelser görs mellan alla metoder och utgår från 95% konfidensintervall. Data som mätts är motilitet och vitalitet.
RESULTAT
Spermatozoa har ett medelvärde koncentration på 82,94 ± 7,91 x 106 miljoner/ml och en progressive motilitet på 81,85 ± 2,25% efter 20 olika patientprover (bilaga 2). Metoderna från RMC Skånes Universitetssjukhus kommer uttryckas som Metod 1 och 2 (M1 och M2). M1 och M2 representerar vilken metod det gäller för upptining. Metod 1 är upptining i rumstemperatur, 10 min följt av 10 min, 37 °C och metod 2 är 20 min upptining i 37 °C.
Motilitet
Ingen signifikant skillnad i motiliteten mellan metoderna M1&2, p-värde 0,52 erhölls, se Figur 1.
Figur 1. Medelvärdet (%) ± SEM från 20 olika patientprover. Metoderna visar andelen rörliga
spermatozoa (motilitet) efter upptining, p-värde >0,05.
0 2 4 6 8 10 12 14 16 18 20 Mo tilitet, % Rörliga Spermier Metod 1 Metod 2
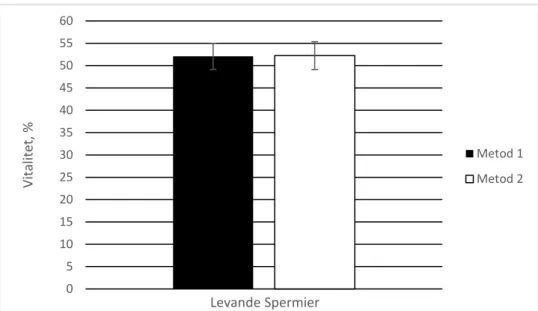
8 0 5 10 15 20 25 30 35 40 45 50 55 60 Vita lite t, % Levande Spermier Metod 1 Metod 2 Vitalitet
Jämförelse mellan M1 och M2 påvisar ingen signifikant skillnad, p-värde >0,05. Båda metoder visar en viabilitet på lite mer än 50%, se Figur 2.
Figur 2. Medelvärdet (%) ± SEM från 20 olika patientprover. Metoderna visar andelen
överlevande spermatozoa (vitalitet) efter upptining, p-värde >0,05
DISKUSSION
Studien utförs och analyseras på RMC Skånes Universitetssjukhus, på ett sätt som försöker efterlikna Martínez-Soto J C m.fl [2] studie. Som nämnts tidigare är kryokonservering viktigt för reproduktiv vetenskap. En internationell standard behövs för att minimera skador vid nerfrysning och upptining av spermatozoa. I dagsläget finns ingen väletablerad standard. Mer forskning kring ämnet behövs [3].
Resultatdiskussion
Ingen signifikant skillnad kunde påvisas mellan de två metoderna. Martínez-Soto J C m.fl [3] mikroskopiska resultat av motilitet på M1 blev 16,87 ± 0,97% och M2 16,06 ± 0,99. Jämför vi resultaten på motilitet från denna studie och Martínez-Soto J C m.fl [3] fås ett p-värde >0,05 och ingen signifikant skillnad kan ses. CASA resultaten från Martínez-Soto J C m.fl [3] på M1&2 är respektive 17,49 ± 0,37 och 16,53 ± 0,39 och även här syns ingen signifikant skillnad, p-värde >0,05 när de jämförs med denna studie.
Jämförs resultaten från M1&2 mellan vitalitet ses ingen skillnad mellan metoderna inom studien (M1&2, p-värde >0,05), se figur 2. Martínez-Soto J C
m.fl [3] resultat på vitalitet är med M1 30,85 ± 1,91 och M2 30,03 ± 1,97. Här
synes en signifikant skillnad mellan studierna när resultaten jämförs. Jämförs metoderna mot varandra fås ett p-värde <0,01 för både M1&2.
Resultaten tyder på att kryokonservering med ”slow freeze” och G-IVFTM ger en
9
Martínez-Soto J C m.fl [3] använder sig av ett flertal olika parametrar; olika hastigheter för motilitet, vitalitet, kromatin oxidation, acrosome status och ROS vid undersökningen [3]. Genom att använda fler parametrar kunde signifikanta skillnader hittas. Genom att mäta motilitet fanns ingen skillnad. Genom att titta närmare på hastigheterna hos spermatozoa sågs en signifikant skillnad p<0,01 för rörelserna hos M2 än hos M1 i Martínez-Soto J C m.fl studie [3]. Endast
jämförelse av motilitet visade ingen signifikant skillnad. Genom att granska mer specifika egenskaper hos motilitet, som till exempel kurvig hastighet, rakt-linje hastighet samt genomsnittlig banhastighet, kan signifikanta skillnader eventuellt påvisas. Detta i sin tur kan öka chansen att hitta skillnader som möjligen skulle stödja utvecklingen av bättre processer.
Metoddiskussion
Denna studie använder sig av en frysprocess, ”slow freeze”, som är ett mer teknologiskt förhållningssätt jämfört med kryokonservering med pellets som användes av Martínez-Soto J C m.fl [3]. Konservering med pellets ger ett större förhållande mellan yta och volymförhållande med viktiga följder för
kylningshastigheten, nedfrysning och upptining av spermatozoa. Det är lättare att lagra och hantera pellets men risken för krosskontamination och variation ökar jämfört med ”slow freeze” [3]. I flera studier har det påvisats att ”slow freeze” orsakar kraftiga förändringar, både i struktur och funktion hos spermatozoa [15-17]. Nya alternativa metoder har utvecklats och en av de mest nytänkande metoderna är vitrification; vilket är en metod som använder sig av ultrasnabb ökning och minskning av temperatur med eller utan kryoskyddande medel. Denna metod är snabbare och inte lika avancerad [11]. Vitrification är fortfarande inte helt förstådd och studier kring metoden utvecklas ständigt. Metoden har under många år utvecklats och protokollen har ändrats flera gånger. Lovande resultat har visats men metoden har än så länge bara implementerats på ett fåtal
IVF-laboratorier. Resultaten från Aizpurua J m.fl [11] visar signifikant bättre resultat hos spermatozoa angående funktion och struktur jämfört med ”slow freeze”. För motilitet och vitalitet verkar vitrification vara en värdig motståndare [11]. Att motilitetsresultat skiljer sig kan möjligen förklaras med skillnader i
spermatozoas glycolipid-, fosfolipid- och sterolhalt. Dessa skillnader kan förklaras av variationen av olika frysfrekvenser och frysningsmetoder [18].
Avgörande faktorer för spermatozoakvaliteten inkluderar ett flertal olika faktorer; vilken nedfrysnings- och upptiningsmetod, kryokonserverings-medium, volym samt kvaliteten av spermatozoa innan nedfrysning [19]. Låg spermatozoa kvalitet med döda spermatozoa och leukocyter i förfrysande ejakulat påverkar
överlevnadsgraden och fertilitetspotentialen efter upptining genom produktion av ROS. Flertal försök har gjorts för att förbättra kryokonservering vilket har lett till förbättringar inom fältet [19].
Enligt Esteves S C m.fl [20] uppnås den högsta överlevnaden för humana
spermatozoa genom att från rumstemperatur har en kylningshastighet på 0,5–1,0 °C/min till 5 °C och en nedfrysningshastighet till -80 på omkring 10 °C/min [20]. Enligt Tomlinson M [10] ska dock nedfrysning och upptining vara skräddarsydd utifrån varje enskild patient [10].
För upptining av humana spermatozoa finns det inget gemensamt protokoll. Det finns ett flertal olika metoder där proverna antingen tinas i rumstemperatur eller vattenbad (37 °C) eller en kombination av båda tekniker [21]. I många
10
Enligt Hammadeh, M E m.fl [6] tinades spermatozoa upp i ett 75 °C vattenbad följt av ett 37 °C vattenbad. Resultaten skiljde sig inte mot upptining i
rumstemperatur. Genom att använda så höga temperaturer finns dock risken att DNA fragmentering sker vilket påverkar hela spermatozoan [6, 21]. Skulle det visa sig att höga temperaturer kan användas utan risk för skador på spermatozoa kan mycket tid sparas. Upptiningen enligt Hammadeh, M E m.fl [6] tar mindre än 5 minuter [6] vilket är kortare än vid traditionella upptiningsmetoder som kräver i genomsnitt 20 min.
Vid räkning av spermatozoa ska området i räknekammaren som används för beräkning scannas visuellt och cellerna ska räknas snabbt för att inte överskatta antalet motila spermatozoa. Därmed undviks att spermatozoa som simmar in i rutnätet skulle påverka det sanna resultatet som då skulle leda till ett överskattat motilitetsvärde [7]. CASA är ett program som analyserar olika parametrar hos spermatozoan, bland annat motilitet. Genom att använda ett program specifikt för spermatozoa minskar de slumpmässiga felen. I denna studie räknades motiliteten med mikroskop vilket medför att de slumpmässiga felen blir betydligt fler än vad CASA orsakar. Dock kan det bli systematiska fel hos CASA som förskjuter värdena. Systematiska fel kan lätt korrigeras med CASA och genom att använda CASA sparas mycket tid och fler prover kan analyseras.
Vitalitet räknades med mikroskop i både denna studie och enligt Martínez-Soto J C m.fl [3]. Båda studier använder sig av en eosin-nigrosin färgning och följer WHO rekommendationen för spermatozoa vitalitet vilket lyder att spermatozoa med röd eller mörkrosa huvuden (membranskador) konstateras döda medan ljusrosa är levande. Skulle skadorna vara begränsade till nacken räknas dessa också till levande [7].
Skillnaden, mellan denna studie och Martínez-Soto J C m.fl [3] ligger i att
Martínez-Soto J C m.fl [3] använder sig av erfaren personal. Denna studie utfördes av en oerfaren student. Detta kan medföra att de slumpmässiga felen ökar på grund av oerfarenhet. Brist på erfarenhet kan också leda till antingen
överskattning av antalet levande eller döda spermatozoa. Studien har brister som kan förbättras. Användning av mer erfaren personal och mer avancerad teknologi behövs för att få resultat som är mer nära det sanna värdet och minska felkällor. Studien kunde även förbättras om parametrarna inte begränsas till motilitet, utan även olika hastigheter hos motilitet skulle analyseras.
Ämnen med kryoskyddande egenskaper bör adderas långsamt för att minimera osmotisk stress och balanseras noggrant med behovet av att minimera
glyceroltoxicitet. Dock finns det metoder som favoriserar snabb tillsättning. Området är fortfarande nytt och mer arbete behövs för att bestämma den hårfina balansen av kryoskyddande ämnens temperatur, borttagning och addering för att öka kvaliteten [10].
I denna studie användes enkelprover för varje prov som samlades in. Genom att analysera enkelprov kan svaren vara förskjutna till att vara överskattade eller underskattade [7]. Anledningen till att inte dubbel- eller trippelprov användes var att arbetet sköttes av en person och tid inte fanns. Dubbel- eller trippelprover hade kunnat utföras, men då hade antalet prov minskat. Trippelprover är att föredra för att få ett mer trovärdigt värde som bättre representerade varje insamlat prov. Detta för att kunna se till att skillnaden mellan proverna är procentuellt accepterande. Ifall skillnaderna skulle vara för stora kunde provmaterialet blandas om för att på
11
så sätt få en mer homogen blandning [7]. Ett medelvärde på trippelproverna skulle kunna tas vilket hade lett till ett resultat närmare det sanna värdet.
Rutiner av spermatozoa-analyser är viktiga för att minska omfattningen av
systematiska och slumpmässiga fel. För att resultaten ska vara trovärdiga behöver dessa fel vara minimala. För att minska provtagningsfel behövdes minst 200 spermatozoa räknas vid varje prov [7].
Antalet prover som analyserades dagligen varierade från 1 – 3 beroende på om det fanns prover som uppnådde WHO rekommendationer. Vanligtvis var det två prover som kunde analyseras dagligen. Det optimala skulle ha varit att göra ett prov om dagen för att minimera väntetiden mellan de olika analyserna, då det är känt att spermatozoakvalitet försämras över tid [12].
Proceduren att onanera och ejakulera i behållare i anslutning till
andrologilaboratoriet kan minska kvaliteten av spermatozoa jämfört med de män som får ha samlag hemma med icke-spermicidal kondom. Dessa skillnader kan förklaras med att olika former av sexuell upphetsning påverkar omfattningen av seminalutsläpp före ejakulation vilket också påverkar kvaliteten på ejakulatet [7]. Rekommendationen är dock att ejakulera i en behållare, som ska vara godkänd och fri från toxiska ämnen som potentiellt kan skada spermatozoa [12], i anslutning till andrologilaboratoriet. Om ejakulation sker hemma måste provet transporteras till laboratoriet och detta kan medföra stora temperaturskillnader vilket skadar spermatozoan. Rekommendationen är att försöka hålla spermatozoa nära kroppen vid transport om onani sker hemma. Proverna förvaras i
rumstemperatur för att undvika stora temperaturändringar vilket kan påverka spermatozoa [7].
Före spermatozoa analys rekommenderar WHO att man varit sexuell avhållsam i 2 – 7 dagar [12]. Aktivt sexliv dagarna före analys kan orsaka reducerad
spermatozoakoncentration, volym samt total motilitet. Vid sexuell avhållsamhet ökar koncentrationen samt volymen. Motilitet, viabilitet, morfologi eller pH påverkas inte av längden på avhållsamhet. Skulle den avhållsamma perioden vara kortare än 24 h ökar mängden omogen spermatozoa DNA och vid för lång tid ökar DNA fragmentering [12]. Det är viktigt vid ejakulation att första fraktionen hamnar i behållaren. Detta beror på att första fraktionen är spermatozoarik och rik på prostatiska vätskor medan senare fraktioner domineras av vesikulär vätska [7]. Att förlora första delen av ejakulatet har ett större påverkan på
spermatozoaeresultatet än att förlora den sista delen. Det är därför viktigt att man noterar detta vid analys [7].
Denna studie använde sig av pipetter för att mäta volymen av ejakulatet för att på så sätt kunna bestämma volymen SpermFreeze som behövdes vid nedfrysning. Att använda pipett för att bestämma ejakulatets volym är inte att rekommendera för att allt prov inte blir hämtat och kan därmed bli underskattat. Volymen som kan försvinna är 0,3–0,9 ml vilket i sin tur kan vara en ansenlig mängd spermatozoa [7]. Det bästa sättet att mäta volymen av ejakulatet är enligt WHO att behållaren vägs innan och efter den fylls med ejakulat. Genom att väga behållarna försvinner risken att förlora 0,3 – 0,9 ml av ejakulatet vid pipettering [7].
Preparation av spermatozoa med gradient eller swimp-up metoden används vanligtvis vid infertilitets behandlingar. Detta är för att selektera ut normala spermatozoa och öka kvaliteten av ejakulationen [19].
12
Studier visar också att preparation av spermatozoa efter kryokonservering kan leda till ökad mängd av både normala spermatozoa och spermatozoa med bra motilitet [22]. Spermatozoakvaliteten beror på faktorer som oftast inte kan modifieras, exempelvis testiklarnas faktiska spermatozoaproduktion,
extraordinära organsekretioner, sjukdomar, abstinenstiden (sexuell inaktivitet). Alla dessa faktorer bör alltid beaktas när resultaten analyseras [7].
Studien hade eventuellt kunnat göras bättre genom att använda gradient eller swim-up metod för att sålla bort onormala spermatozoa och bara använda normala. Genom att bara använda normala spermatozoa kan man lättare se hur spermatozoan påverkats av nedfrysning och upptiningen vid mikroskopering. Även om studien visar på normala värden kan onormala spermatozoa och leukocyter påträffas och dessa kan regenerera ROS vilket kan penetrera
plasmamembranet hos spermatozoa vilket i sin tur kan orsaka DNA fragmentering [23-25].
SLUTSATS
Denna jämförelsestudie visar att det inte finns någon signifikant skillnad mellan de olika upptiningsmetoderna när det gäller motilitet och vitalitet. Med dessa resultat kan vi utesluta att metoderna skiljer sig åt i kvalitet. Jämfört med Martínez-Soto J C m.fl [2] studie som detta projekt baseras på ses en signifikant skillnad på vitalitet vilket kan tyda på att det finns något med ”slow freeze” och G-IVFTM som är avgörande. Mer studier kring metoderna måste göras för att
13
REFERENSER
1. Liu T, Gao J, Zhou N, Mo M, Wang X, Zhang X, et al, (2016) The effect
of two cryopreservation methods on human sperm DNA damage.
Cryobiology 2016;72:210-215.
2. Yari N, Etebary S, Khalili M A, Talebi A R, (2017) Cryopreservation
enhances vacuolization in human spermatozoa. Asian Pacific Journal of
Reproduction 2017 November 01;6(6):247-251.
3. Martínez-Soto J C, García-Vazquez FA, Gumbao D, Landeras J, Gadea J, (2011) Assessment of two thawing processes of cryopreserved human
sperm in pellets. Cryobiology 2011;63:131-136
4. Nallella K P, Sharma R K, Allamaneni S S, Aziz N, Agarwal A, (2004)
Cryopreservation of human spermatozoa: comparison of two
cryopreservation methods and three cryoprotectants. Fertil Steril 2004
October 01;82(4):913-918.
5. Mohamed M S A, (2015) Slow cryopreservation is not superior to
vitrification in human spermatozoa; An experimental controlled study.
Iranian Journal of Reproductive Medicine 2015 October 01;13(10):631-642.
6. Hammadeh, M E, Szarvasy, D, Zeginiadou, T, Rosenbaum, P, Georg, T, Schmidt, W, (2001) Evaluation of cryoinjury of spermatozoa after slow
(programmed biological freezer) or rapid (liquid nitrogen vapour) freeze-thawing techniques. J Assist Reprod Genet 2001 January
01;18(7):364-370.
7. Organization WHO, (2010) WHO Laboratory Manual for the Examination
and Processing of Human Semen. Geneva; Geneva: World Health
Organization; World Health Organization; 2010.
8. Thomson, L K, Zieschang, J -A, Clark, A M, Fleming, S D, Aitken, R J, De Iuliis, G N, (2009) Cryopreservation-induced human sperm DNA
damage is predominantly mediated by oxidative stress rather than apoptosis. Human Reproduction 2009 September 01;24(9):2061-2070.
9. Creemers E, Nijs M, Vanheusden E, Ombelet W, (2011) Cryopreservation
of human sperm: Efficacy and use of a new nitrogen-free controlled rate freezer versus liquid nitrogen vapour freezing. Andrologia 2011 December
01;43(6):392-397.
10. Tomlinson M, Therapeutic sperm cryopreservation. I: Björndahl L, Giwercman A, Tournaye H, Weidner W, (2010) Clinical Andrology -
EAU/ESAU Course Guidelines. New York: Informa Healthcare, 2010.
11. Aizpurua J, Medrano L, Enciso M, Sarasa J, Romero A, Fernández M et al, (2017) New permeable cryoprotectant-free vitrification method for
native human sperm. Human Reproduction. 2017;32(10):2007-2015.
12. Jeyendran R, (2000) Interpretation of semen analysis results. Cambridge: Cambridge University Press; 2000.
13. Coppola G, Di Caprio G, Wilding M, Ferraro P, Esposito G, Di Matteo L, et al, (20014) Digital holographic microscopy for the evaluation of human
sperm structure. Zygote 2014 November 01;22(4):446-454.
14. Lag (2003:460) om etikprövning av forskning som avser människor. 15. O'Connell M, McClure N, Lewis S, (2002) The effects of cryopreservation
on sperm morphology, motility and mitochondrial function. Human
14
16. Isachenko E, (2004) DNA integrity and motility of human spermatozoa
after standard slow freezing versus cryoprotectant-free vitrification.
Human Reproduction. 2004;19(4):932-939.
17. Desrosiers P, Legare C, Leclerc P, Sullivan R, (2006) Membranous and
structural damage that occur during cryopreservation of human sperm may be time-related events. Fertility and Sterility. 2006;85(6):1744-1752.
18. Donnelly E, McClure N, Lewis S, (2001) Cryopreservation of human
semen and prepared sperm: effects on motility parameters and DNA integrity. Fertility and Sterility. 2001;76(5):892-900.
19. Petyim S, Neungton C, Thanaboonyawat I, Laokirkkiat P, Choavaratana R, (2014) Sperm preparation before freezing improves sperm motility and
reduces apoptosis in freezing-thawing sperm compared with post-thawing sperm preparation. Journal of Assisted Reproduction and
Genetics. 2014;31(12):1673-1680.
20. Esteves S C, Spaine D M, Cedenho A P, Miguel S, (2003) Effects of the
technique of cryopreservation and dilution/centrifugation after thawing on the motility and vitality of spermatozoa of oligoasthenozoospermic men.
International Brazilian Journal of Urology, Vol 29, Iss 2, Pp 133-140 (2003) 2003(2):133.
21. Rougier N, Uriondo H, Papier S, Checa M, Sueldo C, Alvarez Sedó C, (2013) Changes in DNA fragmentation during sperm preparation for
intracytoplasmic sperm injection over time. Fertility and Sterility.
2013;100(1):69-74.
22. Ricci G, Perticarari S, Boscolo R, Simeone R, Martinelli M, Fischer-Tamaro L et al, (2009) Leukocytospermia and sperm preparation - a flow
cytometric study. Reproductive Biology and Endocrinology.
2009;7(1):128.
23. Brugnon F, Ouchchane L, Pons-Rejraji H, Artonne C, Farigoule M, Janny L, (2013) Density gradient centrifugation prior to cryopreservation and
hypotaurine supplementation improve post-thaw quality of sperm from infertile men with oligoasthenoteratozoospermia. Human Reproduction.
2013;28(8):2045-2057.
24. Valcarce D, Cartón-García F, Riesco M, Herráez M, Robles V, (2013)
Analysis of DNA damage after human sperm cryopreservation in genes crucial for fertilization and early embryo development. Andrology.
2013;1(5):723-730.
25. Sharma R, Kattoor A, Ghulmiyyah J, Agarwal A, (2014) Effect of sperm
storage and selection techniques on sperm parameters. Systems Biology
15
BILAGA 1
Frysprogram Starttemperatur: 20°C 1. -5°C /min till -8°C 2. Håll 1 min 3. -10°C /min till -25°C 4. -25°C /min till 150°C16
BILAGA 2
Rådata över insamlat material
Prov Concentration, milj/ml Motilitet % Metod 1 motilitet % Metod 1 vitalitet % Metod 2 motilitet % Metod 2 Vitalitet % 409 130,5 85 19,5 45,5 22,5 41 412 96,5 87 19 40 19,5 36,5 440 48 89 15,5 48 18 51 441 116 63 0,5 33,5 5,5 40,5 444 119 80 21 63,5 19,5 62,5 446 102,5 71 45 60 40,5 64 469 71,8 63 1,5 48 2 39 491 102 81 9,5 59,5 16 67 494 98 88 7 69 6 75,5 503 50 63 2 41 3,5 39 530 87,5 89 27,5 68,5 31,5 65,5 550 148 89 3 40 9 44 558 67,5 92 9 40,5 10 36,5 580 27,7 91 17,5 65,5 15,5 69,5 592 54,25 77 17 66 13 56,5 599 114 93 13,5 67,5 12,5 67,5 607 93,2 74 8,5 33,5 8 39,5 621 70,7 85 8 40 4 35 752 10,6 90 15 43 30 46 758 51 87 14 69 29 69