Fenotypning av trombocytantigen HPA1a
med flödescytometri: screening för att finna
blodgivare som saknar HPA1a
HUVUDOMRÅDE: Biomedicinsk laboratorievetenskap
FÖRFATTARE: Krina Gohil och Johanna Keinvall
HANDLEDARE:
Marie Allvin, Annette Nilsson Bowers, Birgitta Olsen, Maja Vorkapic
JÖNKÖPING 2018 Juni
Sammanfattning
HPA1a är ett antigen på trombocytytan som kan orsaka alloimmunisering, såsom neonatal alloimmun trombocytopeni och post-transfusion purpura, vilket kan ge svåra blödningssymptom. I fall med antikroppar mot HPA1a måste kompatibla trombocyter finnas tillgängliga. Syftet med studien var att etablera en flödescytometrisk screeningmetod för fenotypning av HPA1a antigen på trombocyter samt att finna HPA1a negativa blodgivare. Före flödescytometrisk analys poolades två till fem blodprover samman till ett prov och vid förekomst av HPA1a negativa trombocyter i poolen analyserades proverna individuellt. Fluorokrommärkta anti-humana antikroppar mot CD42a och CD61 användes för att särskilja HPA1a negativa trombocyter från HPA1a positiva. Totalt fenotypades 177 blodprover varav sju (4%) typades som HPA1a negativa. Av de sju fynden genotypades fyra vid ett externt laboratorium vilket bekräftade att de var HPA1a negativa. Flödescytometrisk screening av HPA1a är snabb, pålitlig och lämplig för storskalig screening. För att fastställa prevalensen av HPA1a negativa individer behöver mer omfattande studier utföras där en större population ingår. Att ha flera HPA1a negativa blodgivare registrerade ger möjligheten att hjälpa patienter i andra regioner.
Summary
Phenotyping of platelet antigen HPA1a with flow cytometry: screening to find blood donors in absence of HPA1a antigen
HPA1a is an antigen on the platelet surface that can cause alloimmunization, such as neonatal alloimmune thrombocytopenia and post transfusion purpura, which can cause severe bleeding symptoms. In case of antibodies against HPA1a, compatible platelets must be available. The purpose of the study was to establish a flow cytometric screening method for phenotyping HPA1a antigen on platelets and to find HPA1a negative donors. Before the flow cytometric analysis, two to five blood samples were pooled into one sample and in the presence of HPA1a negative platelets in the pool, the samples were analyzed individually. Fluorochrome –labeled anti-human antibodies to CD42a and CD61 were used to distinguish HPA1a negative platelets from HPA1a positive. A total of 177 blood samples were phenotyped, of which 7 (4%) were HPA1a negative. Of the seven findings, four samples were genotyped at an external laboratory confirming that they were HPA1a negative. Flow cytometric screening of HPA1a is fast, reliable and suitable for large scale screening. In order to determine the prevalence of HPA1a negative individuals, more extensive studies need to be performed involving a larger population. By having many registered HPA1a negative donors, it can provide opportunities to help patients in other regions.
Innehållsförteckning
Bakgrund ... 1
Trombocytens funktion ... 1
Trombocytopeni ... 1
Humant trombocytantigen ... 2
Alloimmunisering orsakad av HPA1a ... 2
Post-transfusion purpura ... 2
Neonatal alloimmun trombocytopeni ... 3
Flödescytometri ... 3
Inmärkning av antigen ... 4
Syfte ... 6
Material och metod ... 7
Studiedesign ... 7
Provupparbetning inför flödescytometrisk analys ... 7
Flödescytometrisk analys ... 8
Databearbetning ... 8
Genotypning av fynd vid flödescytometrisk screening ... 8
Etiska överväganden ... 9
Resultat ... 10
Diskussion ... 11
Resultatdiskussion ... 11
Metoddiskussion ... 13
Slutsatser ... 15
Omnämnanden ... 16
Referenser ... 17
1
Bakgrund
Trombocytens funktion
Trombocyterna är blodets minsta celler och saknar cellkärna. Bildningen sker i benmärgen genom fragmentation av megakaryocyternas cytoplasma. Överlevnadstid hos trombocyterna är mellan 9 till 10 dygn och därefter elimineras de i mjälte och lever av fagocyterande celler. Trombocyter har en grundläggande roll vid den primära hemostasen samt vid aktivering av de humorala koagulationsfaktorerna. Vid kärlskada frigörs kollagen vilket tillsammans med Von Willebrands faktor (VWF) ger en adhesion av trombocyten. Adhesionen leder till aktivering av trombocyten med frisättning av granulainnehåll. Det aktiverar andra trombocyter i omgivningen och resulterar i konformationsförändring av ytreceptorn GPIIb-IIIa som gör att det kan binda proteinerna fibrinogen, VWF, fibronektin och trombospondin. Samtidigt binder proteinerna till andra trombocyter och fungerar således som bryggor mellan trombocyter. Detta är mekanismen som leder till en aggregation av trombocyterna och är en förutsättning för bildandet av en trombocytplugg. Aktiverade trombocyter frisätter också fosfatidylserin som behövs för snabb aktivering av protrombin och andra K-vitaminberoende koagulationsfaktorer i den humorala koagulationen (1).
Trombocytopeni
Referensintervall för trombocyter hos vuxna och barn över ett år är 125-400x109/L, hos nyfödda och barn upp till ett år är referensintervallet 80-550x109/L (1). Vid värden <50x109/L är blödningstiden förlängd och värden <10-20x109/L ger betydligt ökad blödningsrisk. Trombocytopeni kan uppkomma på grund av minskad trombocytproduktion eller ökad destruktion. Minskad produktion kan bero på sjukdomar som påverkar benmärgen såsom myelofibros eller maligna sjukdomar. Sekundär trombocytopeni kan orsakas av cytostatika- eller strålbehandling som stör benmärgens produktion av blodceller. Ökad destruktion kan orsakas av förstorad mjälte, som ofta ses sekundärt till levercirros, eller cirkulerande autoantikroppar mot trombocytantigen. Akut idiopatisk trombocytopeni drabbar oftast barn och kan uppkomma som immunologisk reaktion vid virusinfektion men kan även uppkomma utan orsak. Kronisk idiopatisk trombocytopeni förekommer i vuxen ålder och är ofta sekundär till andra autoimmuna sjukdomar såsom exempelvis Systemisk Lupus Erythematosus (SLE). Trombocytopeni ger ökad blödningsbenägenhet och ger symptom som
2
spontana petekier, slemhinneblödningar och hematom vid obetydliga hudtrauman. Trombocytopeni ger en betydligt ökad risk för blödningar i mag-tarmkanalen och i hjärnan (2).
Humant trombocytantigen
Humana trombocytantigener (Human Platelet Antigen, HPA) är genetiska polymorfismer som uttrycks på vissa integriner (glykoproteiner, GP) på trombocyters membran (3). År 1990 infördes ett numeriskt system där HPA numrerades i stigande ordning efter när de upptäcktes. De delades ytterligare in i a eller b efter allel-variationer där allel-a är vanligast förekommande (4). Den fenotypiska frekvensen för HPA1 i kaukasisk befolkning är 72% a/a, 26% a/b och 2% b/b (5).
Integrinerna är heterodimeriska membranglykoproteiner som består av icke-kovalent bundna α och β subenheter (6). GPIIb-IIIa (αIIb och β3) är ett integrin på trombocyternas yta och
består av två polypeptidkedjor, GPIIb med en molekylmassa på 140 kDa och GPIIIa med en molekylmassa på 105 kDa. Det är det mest förekommande membranproteinet på trombocytytan med ca 80 000 molekyler per cell. GPIIb-IIIa har en avgörande roll vid aggregation av trombocyterna när det vid aktivering binder fibrinogen som gör att det bildas bryggor mellan trombocyter. Proteinet binder fibrinogen endast om det har blivit aktiverat (1). HPA1a är lokaliserat till GPIIIa-subenheten. Hos HPA1b individer är cytosin i position 196 utbytt till tymin hos genen som kodar för GPIIIa. Det resulterar i ett utbyte av aminosyra nummer 33, från leucin till prolin, på GP IIIa (7, 8, 9).
Alloimmunisering orsakad av HPA1a
Post-transfusion purpura
Post-transfusion purpura (PTP) är en immunologisk komplikation som kan uppkomma 1–24 dagar efter blodtransfusion. Det kan orsaka kraftig trombocytopeni med blödningssymptom. PTP kan uppkomma hos patienter som sensibiliserats för ett trombocytantigen genom graviditet eller transfusion. När patienten åter utsätts för samma antigen via transfusion orsakar det ett immunsvar som leder till att de transfunderade och de autologa trombocyterna förstörs. Mekanismen bakom destruktionen av de autologa trombocyterna och dess samband med alloantikroppen är inte helt klarlagd. Antikroppar mot HPA1a orsakar 60% av fallen med PTP i kaukasisk befolkning. Mindre vanliga orsaker är antikroppar mot HPA1b, HPA2b,
3
HPA3a, HPA5a och HPA5b. Diagnosen ställs genom att påvisa antikroppar mot trombocytantigen i patientens plasma och avsaknad av antigen på trombocyterna. PTP är självbegränsande och trombocytnivån brukar återgå till det normala inom två veckor. Syndromet kan dock ge blödningar i hjärnan och rapporter har visat att dödligheten i PTP är upp till 13% (10).
Neonatal alloimmun trombocytopeni
Neonatal alloimmun trombocytopeni (NAIT) kan utvecklas när en gravid kvinna saknar trombocytantigen som finns hos fostret. Det kan leda till immunisering hos kvinnan och bildande av alloantikroppar. Antikropparna som är av IgG-klass kan passera placentan och förstöra barnets trombocyter (11, 12). Det leder till trombocytopeni hos fostret vilket i värsta fall kan orsaka blödningar i hjärnan som kan vara dödligt eller ge neurologiska följdsjukdomar (13). Incidensen av NAIT är 1–1,5 på 1000 levande födslar i kaukasisk befolkning och är den vanligaste anledningen till allvarlig trombocytopeni hos nyfödda. NAIT kan uppkomma redan vid första graviditeten och upptäcks vanligtvis inte förrän vid förlossning av ett symptomatiskt barn (5). Trombocytopeni hos en nyfödd kan effektivt behandlas genom transfusion av trombocyter som saknar antigenet som modern har bildat antikroppar mot. Blödningsrisken för foster vid efterföljande graviditeter är liknande den första, därför kan behovet av en trombocyttransfusion för spädbarn förutses. Intrauterin transfusion utförs endast i hög-risk fall (14). Andra alternativ vid känd risk för NAIT inkluderar behandling av modern med kortikosteroider och intravenöst immunoglobulin, fetal blodprovstagning och för tidig förlossning (5). Studier har visat att 75 % respektive 79 % av fallen med NAIT hos den kaukasiska befolkningen orsakas av antikroppar mot HPA1a (8, 15).
Flödescytometri
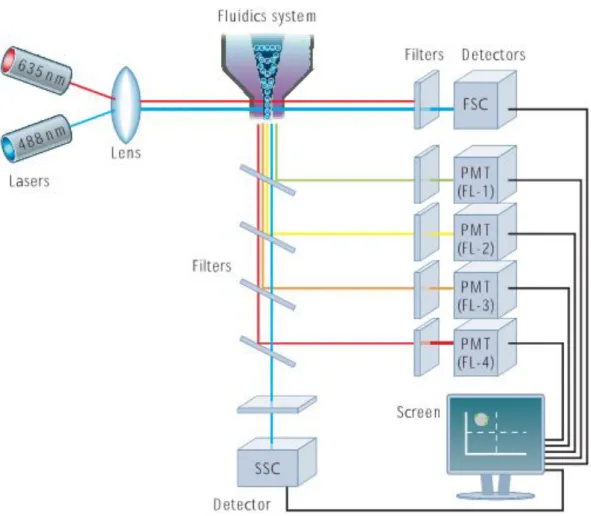
En av grundprinciperna med flödescytometri är förmågan att mäta egenskaper hos enskilda celler genom användning av molekylers förmåga att absorbera samt emittera ljus. Klassificering av cellers subpopulationer görs genom att cellerna markeras med fluorokrommärkta antikroppar riktade mot antigen av intresse och på så sätt mäts cellernas biologiska och biokemiska egenskaper (16, 17). Ett stort antal celler passerar genom en eller flera laserstrålar. Ljusbrytningen samt fluorescerande ljus detekteras (figur 1).
4
Flödessystemet där provet injiceras, består av en centralkanal vilken är omsluten av en yttre mantelvätska som har en högre flödeshastighet. Skillnader i hastigheten som uppstår mellan provlösning och yttre mantelvätskan ger upphov till hydrodynamisk fokusering där cellerna passerar mätpunkten individuellt för att möjliggöra analys av enskilda celler. Cellerna belyses av en eller flera lasrar av olika våglängder och ljusspridning sker i olika riktningar. Ljuset som sprids framåt upptill 20° från laserstrålens axel registreras i Forward Scatter (FSC) kanalen och påvisar cellens storlek. Sidospridda ljuset som sprids vinkelrätt mot laserstrålens längsriktning (90°) kallas för Side Scatter (SSC) och påvisar cellens granularitet och inre struktur. Genom att kombinera FSC och SSC som är unik för varje celltyp kan differentieringen av populationer samt olika celler i ett heterogent prov göras i ett spridningsdiagram (16).
Förutom information om cellernas storlek och granularitet kan även kvalitativ och kvantitativ information om cellerna fås. När fluorokrommärkta antikroppar bundna till celler belyses av laserljuset, absorberas ljuset av fluorokromen vilket i sin tur leder till att fluorokromen exciteras och sänder ut ljuset av en högre våglängd. Ljuset som sänds ut absorberas med hjälp av ett eller flera optiska filter som sorterar ut ljuset av en viss våglängd. Ljussignalen detekteras sedan i olika fluoroscenskanaler (FL) och fluoroscensintensiteten är proportionell mot mängden fluorokrommärkta antikroppar som bundit in till cellen (16, 18).
De registrerade signalerna av enskilda celler från varje detektor, dvs. från FSC, SSC och fluoroscens, lagras in i datorns programvara och presenteras som ett spridningsdiagram (16, 18). Avgränsning, så kallad gating, innebär klassificiering av subpopulationer av celler för analys (19).
Inmärkning av antigen
Antigen på cellers yta benämns Cluster of differentiation (CD) där varje unikt antigen fått ett CD-nummer. GPIX (CD42a) uttrycks på trombocyter och megakaryocyter (20, 21, 22). GPIIIa (CD61) uttrycks på trombocyter (23). I studien användes antikroppar konjugerade med Peridinin-Chlorophyll Protein complex (PerCP) riktade mot CD42a samt antikroppar konjugerade med Fluorescein IsoThioCyanat (FITC) riktade mot CD61. Vid flödescytometri har antikroppen mot CD61 markant minskad affinitet till HPA1a negativa trombocyter och är därför användbar för att urskilja HPA1a positiva och negativa trombocyter (24, 25).
5
Figur 1. Schematisk bild av flödescytometri. Celler passerar laserstrålen individuellt och ljuset sprids i olika riktningar som sedan sorteras av olika filter. Signalen detekteras och registreras i datorns programvara (Bio-Rad AbD Serotec Ltd, Introduction to Flow Cytometry: principles, data analysis, protocols, troubleshooting, med tillåtelse).
Laboratoriemedicin på Länssjukhuset Ryhov, Jönköping typar inte blodgivare för trombocytantigen HPA1a och har heller ingen metod uppsatt för ändamålet. Transfusionsmedicin i Jönköping är i behov av registrerade givare för att kunna använda i fall där individer med antikroppar mot HPA1a behöver transfunderas med kompatibla trombocyter. Det finns ännu inga kända givare av HPA1a negativa trombocyter och att köpa in HPA1a negativa trombocyter utifrån är resurskrävande. Därför är det av betydelse att etablera en metod samt att finna blodgivare som saknar HPA1a.
6
Syfte
Syftet med studien var att etablera en flödescytometrisk screeningmetod för fenotypning av HPA1a antigen på trombocyter samt att finna HPA1a negativa blodgivare.
7
Material och metod
Studiedesign
Studien inkluderade 177 manliga blodgivare mellan 18–60 år som lämnade blod vid Blodcentralen på Länssjukhuset Ryhov i Jönköping under veckorna 14–18 år 2018. I samband med blodtappning togs ett extra 3 ml BD Vacutainer® rör med tillsats av etylendiamintetraättiksyra (EDTA). Blodproverna kodades genom att de märktes med tappningsnummer och blodgrupp. Transfusionsmedicin vid Länssjukhuset Ryhov i Jönköping hade nyckeln till kodningen där tappningsnumret kunde kopplas till ett personnummer. Beroende på hur många prover som fanns tillgängliga poolades blod från två-fem blodgivare med samma blodgrupp samman till ett prov. Ett protokoll upprättades som angav vilka prover som ingick i varje pool. Proverna analyserades samma dag inom 8 timmar från blodtappning, vid Laboratoriemedicin, Länssjukhuset Ryhov. Som positiv kontroll användes blod från en känd HPA1a negativ trombocytgivare som erhölls från Universitetssjukhuset i Linköping.
Provupparbetning inför flödescytometrisk analys
Blodproverna späddes individuellt 1:25 med fosfatbuffrad natriumklorid 0,9% (w/v) (PBS) pH 7,4 innehållande 0,3% EDTA (w/v) (Acros Organics, Belgien). Trombocytkoncentrationen i varje spädning beräknades till 10 000/µl. Tillgång till trombocytantalet i varje blodprov fanns inte tillgängligt, därför antogs ett medelvärde i referensintervallet, till 250 x 109/ L för alla blodprover. Vid poolning överfördes 20 µl från två till fem individuella spädningar med samma blodgrupp till ett 5 ml falcon-rör (Corning science, Reynosa, Mexiko) så att den totala volymen blev 40–100 µl. Beräknat antal trombocyter från varje prov i poolen uppgick till 200 000. I poolen tillsattes monoklonala mus anti-humana fluorokrommärkta antikroppar; 4 µl/prov CD42a PerCP, klon Beb1 (BD Biosciences, Franklin Lakes, New Jersey) och 5 µl/prov CD61 FITC, klon SZ21 (Beckman Coulter, Brea, Kalifornien). Poolerna inkuberades i ljusskyddad miljö i rumstemperatur under 20 minuter. Slutligen tillsattes 400–460 µl PBS innehållande 0,3% EDTA i varje pool till en slutvolym på 500 µl (exkl. antikroppar).
Pooler som visade förekomst av HPA1a negativa trombocyter analyserades om individuellt. Upparbetning var densamma som vid poolning med skillnaden att endast en individuell spädning på 20 µl överfördes till respektive falcon-rör. De fluorokrommärkta antikropparna
8
CD42a och CD61 tillsattes i samma förhållande som vid poolning. Den slutliga tillsättningen av PBS innehållande 0,3% EDTA ökades till 480 µl.
Flödescytometrisk analys
Proverna analyserades med flödescytometrisk metod på instrumentet BD FACSCanto (BD Biosciences, Franklin Lakes, New Jersey) med mjukvaran BD FACSDiva software v8.0 (BD Biosciences, Franklin Lakes, New Jersey). Instrumentet används i klinisk diagnostik och kalibreras dagligen.
Databearbetning
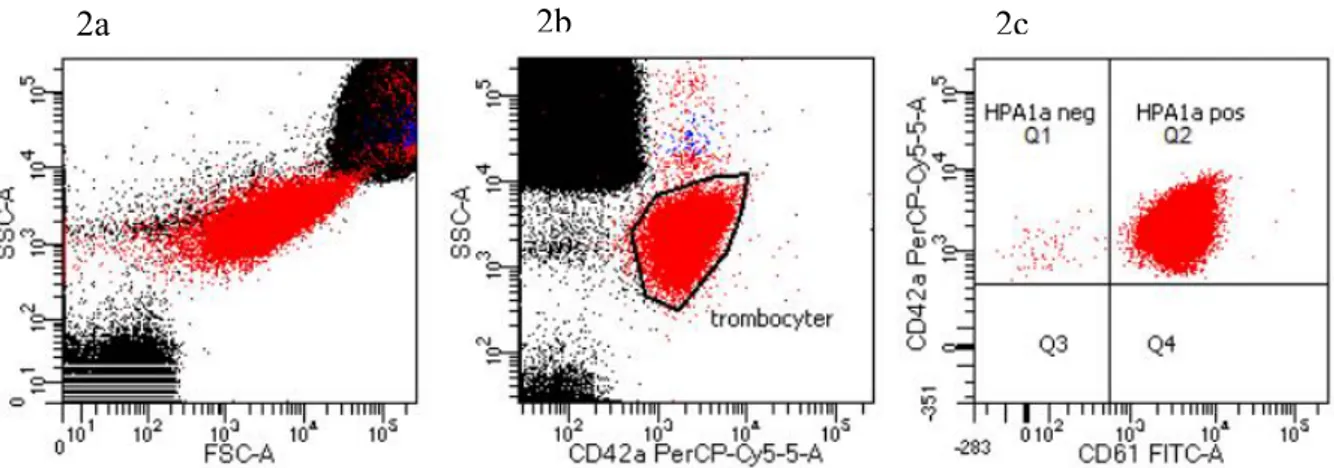
Gating har utförts efter BD Biosciences rekommendationer (26). Antal räknade celler uppgick till 20 000. Efter flödescytometrisk analys ställdes SSC (y-axel) mot FSC (x-axel) i ett spridningsdiagram och trombocyterna valdes ut (figur 2a). Utifrån trombocytpopulationen avgränsades celler som uttryckte CD42a (figur 2b). Därefter avgränsades CD42a trombocytgaten efter uttryck av CD42a (y-axel) och CD61 (x-axel) (figur 2c). Celler som hamnade i övre högra kvadranten (Q2) uttrycker både CD42a och CD61 (HPA1a positiv). Celler i den övre vänstra kvadranten (Q1) uttrycker CD42a men inte CD61 (HPA1a negativ).
Figur 2. 2a: avgränsning av trombocyter med hjälp av SSC och FSC. 2b: avgränsning av CD42a celler utifrån trombocytgaten. 2c: avgränsning efter uttryck av CD42a och CD61.
Genotypning av fynd vid flödescytometrisk screening
En del av de blodprover som fenotypades HPA1a negativa vid den flödescytometriska screeningen genomgick bekräftande genotypning. Analysen utfördes vid Klinisk immunologi,
9
Universitetssjukhuset i Linköping med metoden single specific primer- polymerase chain reaction (SSP-PCR).
HPA1b är det antitetikala antigenet till HPA1a, vilket innebär att en HPA1a negativ person skulle kunna betraktas som HPA1b homozygot. I studien används begreppet HPA1a negativ istället för HPA1b positiv med anledning av att antikroppen som användes var riktad mot HPA1a. Ingen antikropp mot HPA1b fanns tillgänglig. Efter erhållna resultat från genotypning kunde proverna betraktas som HPA1b homozygota.
Etiska överväganden
Blodgivarna fick skriftlig information om att ett examensarbete pågick där en ovanlig blodgrupp eftersöktes och att de kunde bli kontaktade efteråt (bilaga 1). Deltagande var frivilligt. Provtagning gjordes i samband med blodtappning vilket gjorde att provinsamling inte medförde ytterligare obehag för blodgivaren. Blodproverna kodades genom att de märktes med ett tappningsnummer och blodgrupp. Blodcentralen kunde identifiera proverna med hjälp av tappningsnumret som var kopplat till ett personnummer. Metodutveckling lyder under biobankslagen (27), vilken blodgivare samtycker till innan de lämnar blod (28), därför behöver ingen etisk prövning göras. Etisk egengranskning enligt Hälsohögskolan i Jönköping har utförts.
10
Resultat
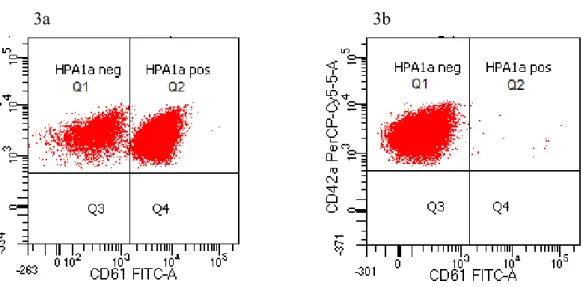
Pooler med förekomst av både HPA1a negativa och HPA1a positiva trombocyter visade två populationer i spridningsdiagrammet CD42a mot CD61 (figur 3a). Dubbla trombocytpopopulationer syntes i sju av de undersökta poolerna. Ett prov från varje pool med dubbel population identifierades som HPA1a negativ vid individuell analys (figur 3b). Sammanlagt var sju av 177 (4%) undersökta prover HPA1a negativa. Till dags dato har genotypning utförts i fyra av de sju fynden vid Klinisk immunologi, Universitetssjukhuset i Linköping vilket bekräftade att blodgivarna var HPA1b homozygota.
3a 3b
Figur 3. 3a: Dubbla populationer i en pool: trombocyter endast positiva för CD42a (25%) i Q1 och trombocyter positiva för både CD42a och CD61 (75%) i Q2. 3b: Individuell analys: hela trombocytpopulationen endast positiv för CD42a (99,9%) i Q1.
11
Diskussion
Syftet med studien var att etablera en flödescytometrisk screeningmetod för fenotypning av HPA1a antigen på trombocyter samt att finna HPA1a negativa blodgivare. Ett register över HPA1a negativa blodgivare är värdefullt för att kunna tillgodose patienter som har behov av kompatibla trombocyter. Det finns också andra anledningar att etablera en screeningmetod för fenotypning av HPA1a. Att känna till prevalensen av HPA1a negativa individer i en population är viktig för diagnos av NAIT men också för att avgöra om en eventuell screening av gravida kvinnor som löper risk för NAIT är nödvändig. Trombocytopeni kan uppkomma hos patienter med benmärgssjukdomar till följd av minskad produktion av trombocyter. De kan vara i behov av upprepade trombocyttransfusioner. En screening av dessa patienter för HPA1a skulle innebära att risken för alloimmunisering på grund av icke kompatibla trombocyter minskar.
Resultatdiskussion
Resultatet i studien visade att 4 % i den undersökta populationen var HPA1a negativa. Det överensstämmer med andra studier som har visat en prevalens mellan 2% - 4% i kaukasisk befolkning (3, 5, 11, 14, 29, 30, 31, 32). En av studierna (32) gjordes i Sverige 1995 där 236 blodgivare screenades och visade en prevalens på 4,2% HPA1a negativa individer, vilket är liknande resultat som den här studien visat. Det kan tyda på att prevalensen ligger runt 4% i Sverige men det kan också vara en ren tillfällighet då båda studierna hade en begränsad population. Det kan också bero på att det finns släkter i vissa områden som har anlag för den mer ovanliga HPA1b allelen. För att fastställa prevalensen i Sverige och Region Jönköpings Län behöver fler och större nationella studier utföras där större populationer inkluderas för att få ett representativt urval.
Denna studie inkluderade endast män och om förhållandet för kvinnor antas vara detsamma, så skulle det innebära att även 4 % av kvinnorna är HPA1a negativa. Dessa löper risk att vid graviditet bilda antikroppar mot fostrets HPA1a positiva trombocyter. NAIT upptäcks inte förrän vid första förlossningen men vid kända fall finns det flera åtgärder för att minska risken för allvarliga hjärnskador vid NAIT, såsom behandling av modern med kortikosteroider och intravenöst immunoglobulin, fetal blodprovstagning och för tidig förlossning (5). Eftersom förebyggande behandling finns, skulle det kunna motivera en screening av gravida. I Norge utfördes en stor studie från december 1995 till mars 2004 (31) där 100 448 gravida kvinnor
12
screenades genom typning av HPA1a. De kvinnor som typades HPA1a negativa följdes upp under hela graviditeten med ett interventionsprogram. Jämförelser i studien visade att screening och intervention minskade risken för livshotande komplikationer till följd av allvarlig NAIT ner till en fjärdedel, från 10 av 51 i en population utan screening till 3 av 57 i den screenade populationen. Prevalensen HPA1a negativa individer i den norska studien var 2,1% och antalet allvarliga fall av NAIT uppgick till 57 vilket trots allt är en väldigt låg siffra i jämförelse med antalet kvinnor som screenats. Även om prevalensen HPA1a negativa individer i Sverige skulle vara det dubbla skulle runt 110 allvarliga fall av NAIT inträffa av 100 448 gravida kvinnor. Det är fortfarande är en väldigt låg siffra och en screening av alla gravida kvinnor skulle vara resurskrävande.
Patienter med maligna benmärgssjukdomar kan ha en minskad trombocytproduktion vilket leder till trombocytopeni, som kan bli allvarligt (2). Det medför att det är en grupp patienter som kan behöva upprepade trombocyttransfusioner. För att minska risken för immunisering hos dessa patienter skulle en typning av HPA1a vara värdefull. En studie av onkohematologiska patienter (29) visade att 4% var HPA1a negativa och därmed riskerade immunisering orsakat av HPA1a. Enbart genotypning av HPA1 alleler är inte tillräckligt när risk för immunisering av HPA1a ska undersökas. Andra studier (33, 34) har visat att det finns flera fall där genotypning gett resultatet HPA1a/1b men att trombocyterna inte uttrycker HPA1a vid fenotypning. En genetisk defekt av HPA1a allelen skulle kunna innebära att HPA1a inte uttrycks trots genetiska anlag. En person som genotypas för HPA1a/1b men inte uttrycker HPA1a bör ha samma risk för immunisering som en HPA1b/1b. I de fallen är inte genotypning tillräcklig och fenotypning spelar en avgörande roll.
Trombocytkoncentrat framställs på två olika sätt: genom trombocytaferes från en givare eller poolning av lättcellsskikt (buffycoat) från fyra till fem givare (35). I denna studie hittades sju HPA1a negativa givare vilket kan vara till stor fördel när behovet finns för kompatibla trombocyter. Dels ger det ett större urval till aferesgivning och dels ger det möjligheter att kunna poola ihop trombocytkoncentrat. Trombocytkoncentrat är endast hållbara i 5 dygn (35) så vid behov av HPA1a negativa trombocyter finns de inte lagrade utan givarna kallas in vid behov. Därför är det värdefullt att ha flera givare att välja på. Fördelen med aferesgivning är att endast en givare behöver kontaktas. Vid poolning av trombocytkoncentrat ska fyra till fem personer kallas in och dessa måste ha samma ABO-grupp för att poolning ska kunna ske (36). Att ha flera HPA1a negativa givare i Jönköping ger också möjligheter att hjälpa patienter i
13
övriga Sverige. Det ger möjligheter att byta med andra sjukhus som är i behov av kompatibla trombocyter men som själva saknar registrerade givare.
Metoddiskussion
Studiepopulationen bestod uteslutande av män eftersom Transfusionsmedicin i Region Jönköpings Län använder främst män som trombocytgivare. Eftersom inga kvinnor screenades har drygt hälften av blodgivarna därmed uteslutits i studien vilket inte ger ett representativt urval och därför är det inte möjligt att generalisera resultaten på en hel population. Antalet screenade individer uppgick till 177 och är en relativt stor studiepopulation vilket stärker resultatet. Frekvensen av hur många som är HPA1a negativa varierar med etniskt ursprung (6). Information om etnicitet hos deltagarna i studien fanns ej att tillgå.
Fördelar med att poola ihop fem blodprover istället för individuella analyser bestod främst i arbets- och tidsbesparing. Dessutom minskade risken för felkällor orsakad av den mänskliga faktorn vid tillsättning av antikroppar. Pipetteringssteg med antikroppar reducerades och instrumentet analyserade fem blodprover på samma tid som en analys. Pooler med förekomst av HPA1a negativa trombocyter analyserades om individuellt med tillsats av nya antikroppar och tillhörande inkuberingstid på 20 minuter. Anledningen till att poolning valdes som metod var att chansen att finna HPA1a negativa blodgivare ansågs som låg eftersom tidigare statistik visat låg prevalens. I jämförelse med individuella analyser ger poolning möjlighet att screena många på kortare tid och med mindre arbetsbelastning vilket ses som en stor fördel.
För att få en jämn fördelning av trombocyter vid poolning antogs ett medelvärde i referensintervallet på 250 x 109/ L för alla blodprover. I samtliga pooler med förekomst av
HPA1a negativa trombocyter i spridningsdiagrammet CD42a mot CD61 (figur 3a) erhölls resultat i procent som var rimliga för att ett prov i poolen var HPA1a negativ. Innehöll poolen t.ex. fyra prover så motsvarade HPA1a negativa trombocyter omkring en fjärdedel av det totala antalet trombocyter. Resultatet från analyserna med poolning stämde med de individuella analyserna där ett av proverna i varje pool var HPA1a negativ. Inga pooler visade så låg förekomst av HPA1a negativa trombocyter att det rådde någon tveksamhet. Det stärker att ingen HPA1a negativ individ missades i screeningen och att metoden med poolning fungerar.
14
Flödescytometri är en metod som kräver mycket små provvolymer, provupparbetning går snabbt och analystiden är kort. Metoden används i klinisk diagnostik vid Laboratoriemedicin, Länssjukhuset Ryhov i Jönköping. Instrumentet är inte ackrediterat med externa kontroller men kalibreras dagligen med in vitro-diagnostik (IVD) märkta kalibratorer. IVD direktivet ställer grundläggande krav på produkten såsom sensitivitet, specificitet, noggrannhet, reproducerbarhet, precision samt även spårbarhet, livslängd och stabilitet (37). Fenotypning av HPA1a med flödescytometri har i andra studier visat sig vara snabb och pålitlig (14, 33) vilket även denna studie visat. Av de tidigare redovisade fynden genotypades fyra av sju funna HPA1a negativa blodgivare vid Universitetssjukhuset i Linköping och bekräftades vara HPA1b/1b. Blodprov från en känd HPA1a negativ trombocytgivare som kontroll har även säkerställt resultatet. Det stärker metodens reliabilitet. Det rådde heller inga tveksamheter i tolkning av spridningsdiagrammen, det syntes tydligt var trombocytpopulationerna befann sig. De enstaka punkterna som hamnade utanför populationen, tex Q1 i figur 2c, ansågs som debris bestående av fragmenterade celler. Flödescytometri är lämpligt som en snabb första screeningmetod för fenotypning av HPA1a för att sedan bekräftas med genotypning.
15
Slutsatser
Slutsatser som kan dras från studien är att flödescytometrisk screeningmetod av HPA1a fungerar och kan införas direkt vid Laboratoriemedicin på Ryhov. Fenotypning av HPA1a med flödescytometri är snabb, pålitlig och lämplig för storskalig screening. Prevalensen av HPA1a negativa individer i denna studie motsvarade tidigare studiers resultat men för att bekräfta prevalensen i Jönköping behöver fler och större studier utföras med mer representativt urval där även kvinnor inkluderas. Det kan också vara aktuellt med nationella studier för att fastställa prevalens i Sverige. Att Transfusionsmedicin i Jönköping kan ha sju HPA1a negativa trombocytgivare registrerade är värdefullt för patienter i behov av kompatibla trombocyter i Region Jönköpings Län men kan också hjälpa patienter i andra Regioner där registrerade givare saknas.
16
Omnämnanden
Tack till alla blodgivare som deltog i studien, all personal på Blodcentralen i Jönköping som var med och hjälpte till vid provinsamlingen samt våra metodhandledare Marie Allvin och Maja Vorkapic. Ett stort tack till Annette Nilsson Bowers som hjälpt oss hela vägen med instrumentet och det laborativa arbetet. Tack till Bio-Rad AbD Serotec Ltd för tillåtelse att använda bilden i figur 1 och Ronny Keinvall för att ha hjälpt oss med den tekniska delen
.
Dessutom ska vetenskaplig handledare Birgitta Olsen ha ett stort tack som hjälpt och handlett oss från studiens start.17
Referenser
1. Nilsson-Ehle P, Söderlund M, Theodorsson E. Laurells klinisk kemi i praktisk medicin. Lund: Studentlitteratur; 2016. s. 181–195.
2. Ericson E, Ericson T. Medicinska sjukdomar. 4e uppl. Lund: Studentlitteratur; 2012. s. 200.
3. Mangerona C, Garcia F, Moraes-Souza H. Frequency of human platelet antigens (HPA)-1, -2, -5 and -15 in Brazilian blood donors and establishment of a panel of HPA-typed donors. British blood transfusion society. 2015;25(3):189–194.
4. von dem Borne AE, Decary F. Nomenclature of platelet-specific antigens. Transfusion. 1990;30(5):477.
5. McQuilten ZK, Wood EM, Savoia H, Cole S. A review of pathophysiology and current treatment for neonatal alloimmune thrombocytopenia (NAIT) and introducing the Australian NAIT registry. The Australian and New Zealand journal of obstetrics and gynaecology. 2011;51:191–198.
6. Hillyer CD, Silberstein LE, Ness PM, Anderson KC. Blood banking and transfusion medicine: Basic principles & practice. 1st ed. Philadelphia: Churchill Livingstone; 2003. p. 63–67.
7. Newman PJ, Derbes RS, Asther RH. The Human platelet alloantigens, p1Al and pIA2 are associated with a Leucine33/Proline33 amino acid polymorphism in membrane glycoprotein IlIa, and are distinguishable by DNA Typing. The journal of clinical investigation. 1989;83(5):1778–1781.
8. Ghevaert C, Campbell K, Walton J, Smith GA, Allen D, Williamson LM, et al. Management and outcome of 200 cases of fetomaternal alloimmune thrombocytopenia. Transfusion. 2007;47(5):901–910.
9. Steffensen R, Kaczan E, Varming K, Jersild C. Frequency of platelet-specific alloantigens in a Danish population. Tissue antigens. 1996;48:93–96.
10. Harmening D. Modern blood banking & transfusion practices. 6th ed. Philadelphia: F.A. Davis Company; 2012. p. 350–355.
11. Howard P. Basic & applied concepts of blood banking and transfusion practices. 4th ed. St. Louis: Elsevier; 2017. p. 175.
12. McCullough J. Transfusion medicine. 2nd ed. Philadelphia: Churchill Livingstone; 2005. p. 460.
18
13. Tiblad E, Olsson I, Petersson K, Shanwell A, Winiarski J, Westgren M, et al. Experiences with fetomaternal alloimmune thrombocytopenia at a Swedish hospital over a 10-year period. Acta obstetricia et gynecologica scandinavica. 2003;82(9):803–806.
14. Hoffmann JJ, Janssen WC, von Hegedus HY. Flow cytometric phenotyping of platelet HPA-1a antigen: donor screening for a case of neonatal alloimmune thrombocytopenia due to anti-HPA1a antibodies. Immunohematology. 1995;11:125–128.
15. Davoren A, Curtis BR, Aster RH, McFarland JG. Human platelet antigen-specific alloantibodies implicated in 1162 cases of neonatal alloimmune thrombocytopenia. Transfusion. 2004;44(8):1220–1225.
16. Flow cytometry basic guide. Bio-Rad Laboratories, Inc. [läst 2018-03-14]. Tillgänglig:
https://www.bio-rad-antibodies.com/static/2017/flow/flow-cytometry-basics-guide.pdf
17. Olofsson T. Blodsjukdomar. In: Gahrton G, Lundh B, editors. Flödescytometri i hematologisk diagnostik. Stockholm: Natur och kultur; 1997. s. 319–328.
18. Rahman M. Introduction to Flow Cytometry: principles, data analysis, protocols, troubleshooting. Oxford: Serotec Ltd; 2006.
19. Jahan-tigh R, Ryan C, Obermoser G, Schwarzenberger K. Flow Cytometry. Journal of investigative dermatology. 2012;132(10):1–6.
20. Michelson AD. CD42 cluster workshop report. In: Schlossman SF, Boumsell L, Gilks W, et al, editors. Leucocyte typing V: white cell differentiation antigens. Oxford: Oxford University Press; 1995;2:1309.
21. Ruggeri ZM. The platelet glycoprotein Ib-IX complex. Progress in hemostasis and thrombosis. 1991;10:35–68.
22. Hickey MJ, Williams SA, Roth GJ. Human platelet glycoprotein IX: an adhesive prototype of leucine-rich glycoproteins with flank-center-flank structures. Proceedings of the national academy of sciences of the United States of America. 1989;86:6773–6777.
23. Garner SF, Smethurst PA, Merieux Y, Aeby C, Smith G, Armour KL, et al. A rapid one-stage whole-blood HPA-1a phenotyping assay using a recombinant monoclonal IgG1 anti-HPA-1a. British journal of haematology. 2000;108(2):440–447.
24. Weiss EJ, Goldschmidt-Clermont PJ, Grigoryew D, Jin Y, Kickler TS, Bray PF. A monoclonal antibody (SZ21) specific för platelet GPIIIa distinguishes PIA1 från PIA2. Tissue antigens. 1995;46:374–381.
25. Schwippert-Houtermans B, Strapatsakis S, Roesen P, Tschoepe D. Evaluation of an antibody-based genotype classification of the platelet fibrinogen receptor (GPIIb/IIIa). Communications in clinical cytometry. 2001;46:238–242.
19
26. Support protocols: platelet activation, staining, and analysis. Franklin Lakes: BD
Biosciences; 2018 [läst 2018-05-25]. Tillgänglig:
http://www.bdbiosciences.com/eu/resources/s/plateletactivation
27. SFS 2002:297 (Ändrad t.o.m. SFS 2018:441). Lag (2002:297) om biobanker i hälso- och sjukvården m. m. [webbdokument]. Stockholm: Socialdepartementet. [läst 2018-05-21]. Tillgänglig:
http://www.riksdagen.se/sv/dokument-lagar/dokument/svensk-forfattningssamling/lag-2002297-om-biobanker-i-halso--och_sfs-2002-297
28. Handbok för blodcentraler: Blodgivning och tappningsrutiner. 5th ed. Svensk förening för transfusionsmedicin; 2017 [läst 2018-05-21]. Tillgänglig: http://www.kitm.se/sv/wp-content/uploads/2017/10/HB-kap3-v5r0-2017pdf.pdf
29. Bianchi JV, de Azevado MR, Jens E, Nukui Y, Chamone DA. Frequency of human platelet antigens in oncohematological patients with thrombocytopenia and the probability of incompatibility to platelet transfusions. Revista Brasileira de hematologia e hemoterapia. 2012;34(3):202–205.
30. Williamson LM, Hacket G, Rennie J, Palmer CR, Maciver C, Hadfield R, et al. The natural history of fetomaternal alloimmunization to the platelet-specific antigen HPA-1a (PlA1, Zwa) as determined by antenatal screening. Blood. 1998;92(7):2280–2287.
31. Kjeldsen-Kragh J, Kjaer Killie M, Tomter G, Golebiowska E, Randen I, Hauge R, et al. A screening and intervention program aimed to reduce mortality and serious morbidity associated with severe neonatal alloimmune thrombocytopenia. Blood. 2007;110(3):833– 839.
32. Forsberg B, Jacobsson S, Stockelberg D, Kutti J, Rydberg L, Wadenvik H. The platelet-specific alloantigen PlA1 (HPA-1a): a comparison of flow cytometric immunophenotyping and genotyping using polymerase chain reaction and restriction fragment length polymorphism in a Swedish blood donor population. Transfusion. 1995;35(3):241–246. 33. Killie MK, Kjeldsen-Kragh J, Randen I, Skogen B, Husebekk A. Evaluation of a new flow
cytometric HPA 1a screening method: a rapid and reliable tool for HPA 1a screening of blood donors and pregnant women. Transfusion and apheresis science. 2004;30(2):89–92. 34. Watkins NA, Schaffner-Reckinger E, Allen DL, Howkins GJ, Brons NH, Smith GA, et al.
HPA-1a phenotype–genotype discrepancy reveals a naturally occurring Arg93Gln substitution in the platelet β3 integrin that disrupts the HPA-1a epitope. Blood. 2002;99(5):1833–1839.
20
35. Handbok för blodcentraler. Blodkomponenter: framställning och användning. 4 ed. Svensk förening för transfusionsmedicin; 2015 [läst 2018-05-21]. Tillgänglig:
http://www.kitm.se/sv/wp-content/uploads/2015/03/kap4-v4r0-2015-03-12.pdf
36. European directorate for the quality of medicines and healthcare. Guide to the preparation, use and quality assurance of blood components: Recommendation No. R (95) 15. 19th ed. France: European directorate for the quality of medicines and healthcare; 2017. p. 330. 37. IVD- direktivet och CE- märkning. Föreningen för klinisk mikrobiologi; 2010 [läst
2018-05-25]. Tillgänglig: http://referensmetodik.folkhalsomyndigheten.se/w/IVD-direktivet_och_CE-märkning