Uppföljning av patienter med Idiopatisk lungfibros i Sverige
– En registerbaserad studie av vårdkvalitet
Av: Nathalie Adilipour Handledare: Prof. Sköld Magnus
Innehållsförteckning
Populärvetenskaplig sammanfattning ... 3
Abstract ... 4
Ordlista ... 5
Inledning ... 6
IPF: Bakgrund ... 6 Lungfibrosregistret ... 10 Livskvalitet ... 10 Vårdkvalitet ... 11 Förbättringsmöjligheter i IPF-vården ... 12Syfte ... 14
Frågeställningar ... 14Metod ... 14
Studiedesign ... 14 Datainsamling ... 14Variabler och dataanalys ... 15
Etiska aspekter ... 15
Resultat del 1 ... 15
Variabler för uppföljning av IPF-vården ... 17
Resultat del 2 ... 19
1. Ålder vid diagnostik ... 19
2. Tid från symtom till diagnos ... 20
3. Tid från diagnos till behandling ... 21
4. Lungfunktion vid behandlingsstart ... 22
5. Andel transplanterade samt avlidna per sjukhus ... 23
6. Tid mellan spirometrier ... 24
7. Tid mellan HRCT ... 25 8. Tid mellan 6MWT ... 26 9. Livskvalitet ... 27
Diskussion ... 29
Metoddiskussion ... 29 Resultatdiskussion ... 31 Slutsatser ... 38Författarens tack ... 39
Referenser ... 40
Bilaga I: Namnförteckning över sjukhus ... 45
Populärvetenskaplig sammanfattning
I den här rapporten beskrivs för första gången vårdkvaliteten per sjukhus för patienter med Idiopatisk lungfibros (IPF) i Sverige. Idiopatisk betyder att orsaken till sjukdomen är okänd. IPF är en allvarlig sjukdom och innebär tilltagande ärrbildning i lungorna som leder till nedsatt lungfunktion, syrgasbehov och död inom några år. Det finns inga läkemedel idag som botar sjukdomen. Det är inte känt hur många som drabbas av sjukdomen men antalet
drabbade uppskattas till minst 1500 personer i Sverige.
Lungfibrosregistret är ett svenskt kvalitetsregister som startades år 2014 för att ta reda på hur många patienter det finns samt öka kunskapen och utvärdera vården. Varje år publicerar Svensk Lungmedicinsk Förenings (SLMF) en årsrapport som beskriver patientgruppen som helhet med värden som används inom lungmedicin för den här patientgruppen. Ingen kvalitetsuppföljning har gjorts per sjukhus.
I den här studien har data från lungfibrosregistret bearbetats för att beskriva vårdkvaliteten per sjukhus samt nationellt för patienter med IPF i Sverige. Data avgränsades till patienter
inkluderade mellan oktober 2014–september 2019. En litteratursökning gjordes för att bestämma vilken information i lungfibrosregistret som var lämplig att använda för att beskriva och följa upp vårdkvaliteten för patienter med IPF. Nio variabler identifierades och användes för att beskriva vårdkvaliteten per sjukhus samt nationellt. Det visade olika resultat på olika sjukhus.
Resultatet i denna studie kan hjälpa vårdgivare att bedöma vad som fungerar bra respektive mindre bra på det aktuella sjukhuset. Det kan vara intressant att i framtiden undersöka om det finns skillnader mellan sjukhus och vad de beror på när ännu mer data insamlats i
Abstract
Background: The Swedish Idiopathic pulmonary fibrosis (IPF) registry was set up in 2014 in
order to obtain accurate data on IPF in Sweden. Aim: To describe the quality of care and follow-up on hospital level of patients in the Swedish IPF registry. Methods: A literature search was done along with The Patient Care Plan for IPF patients in Sweden as basis, to identify variables that could reflect the quality of care of IPF patients. Data from the Swedish IPF registry were reviewed and analyzed cross sectionally to assess the demographics, lung function variables, time intervals between investigations and quality of life based on the identified variables. Results: Nine variables were identified for follow-up of the quality of care of IPF patients in the Swedish IPF registry: Age at diagnosis, Diagnostic Delay, Time from diagnosis to initiation of pharmacological treatment, Lung function, Proportion of lung transplanted patients, Time interval of spirometry, High-resolution computed tomography (HRCT) and 6 Minute Walking Test (6MWT) and K-BILD which reflects health related quality of life. Conclusion: Data from 2014-2019 in Swedish IPF registry indicated
differences between hospitals in Sweden in terms of variables that could reflect the quality of care of patients with IPF. Compatibility of clinical praxis on hospital level with the
recommendations in Patient Care Plan for IPF patients in Sweden could in some extent reflect the quality of care. Further investigations could contribute to improvement of quality of care for IPF patients.
Ordlista
6MWT 6 Minute Walk Test
T Differensen i tid mellan spirometrier ATAQ-IPF A Tool to Assess Quality of Life in IPF
CAT COPD Assessment Test
DLCO% Diffusionskapacitet i procent av förväntat FVC% Forcerad vitalkapacitet i procent av förväntat GAP Index Gender Age Predicted FVC and DLCO Index HRCT High-resolution computed tomography HRQL Hälsorelaterad livskvalitet
IIP Idiopathic Interstitial Pneumonia ILD Interstitiell lungsjukdom
IPF Idiopatisk lungfibros
IPF-PREM Patient Reported Experience Measures for Idiopathic Pulmonary Fibrosis IPF-PROM Patient Reported Outcome Measures for Idiopathic Pulmonary Fibrosis
IQR Kvartilavstånd
K-BILD King’s Brief Interstitial Lung Disease L-IPF Living with Idiopathic Pulmonary Fibrosis
M Medelvärde
MCID Minimal clinically important difference MDK Multidisciplinär konferens
Max Maximum, högsta värdet
Min Minimum, lägsta värdet
PESaM Patient Experiences and Satisfaction with Medications PREM Patient Reported Experience Measures
PRO Patient Reported Outcome
PROM Patient Reported Outcome Measures
SD Standardavvikelse
SGRQ St. George’s Respiratory Questionnaire
SGRQ-I IPF-specific version of St. George's Respiratory Questionnaire UIP Usual Interstitial Pneumonia
Inledning
IPF: Bakgrund
Idiopatisk lungfibros (IPF) tillhör de idiopatiska interstitiella pneumonier (IIP), som är en undergrupp till interstitiella lungsjukdomar (ILD) (1). Idiopatisk innebär att orsaken till sjukdomen är okänd (1). IPF är den vanligaste interstitiella pneumonin och karaktäriseras av fibrosbildning i lungparenkymet och en progressiv ärrbildning i lungorna som leder till lungsvikt, syrgasbehov och död inom loppet av bara några år (2, 3). De initiala symtomen är torrhosta och tilltagande andfåddhet som leder till att patienterna söker vård (4). I status noteras slutinspiratoriska rassel i mer än 80% av fallen vid lungauskultation och
trumpinnefingrar ses hos minst en fjärdedel (5). Prevalensen är okänd men uppskattas till minst 1500 i Sverige och är vanligare hos män än hos kvinnor (6). Det finns inga läkemedel idag som botar eller reverserar sjukdomen (5). En av de starkaste riskfaktorerna är ålder och tidigare rökning (5, 7). Andra beskrivna riskfaktorer är virusinfektioner och exponering för damm, rök och avgaser (5). Kunskapen om sjukdomen är begränsad och mer forskning om lungfibros är således angeläget (5).
Histopatologiskt ses progressiv ärrbildning av lunginterstitiet på grund av spridning av fibroblaster/myofibroblaster som producerar kollagen samt förekomst av regenererad alveolärt epitel (5). Mikroskopiska fynd är bland annat fibros i det alveolära interstitiet, fibroblastiska foci (cellfattiga områden med ansamling av fibroblaster med aktiv
bindvävsproduktion) och subpleural mikroskopiskt bikakemönster (8). På molekylär nivå ses onormalt många bindvävsmolekyler (t.ex. kollagen, glykoproteiner, proteoglykaner och glykosaminoglykaner) (8-10). På högupplösande datortomografi (HRCT) karakteriseras sjukdomen av retikulära förändringar, traktionsbronkiektasier och bikakemönster (“honey combing”) i lungans perifera och basala delar (11). De morfologiska kännetecknen för IPF benämns Usual Interstitial Pneumonia (UIP) (4). Sammantaget bidrar fibrotiseringen i lunginterstitiet till att vävnaden blir styv, mindre elastisk och tung, vilket leder till försämrad lungfunktion (5). På senare år pekar forskning på att alveolära epitelceller spelar en viktig roll vid IPF samt att individer med mutationer eller genvarianter som påverkar epitelcellers funktion och livslängd är predisponerade att utveckla sjukdomen (5, 12). Forskning om cellulära processer är central för att öka förståelsen för sjukdomens orsak och utveckling (5).
Diagnostik: År 2019 kom en uppdaterad och utökad version av det vårdprogram för IPF som
utgavs 2012 (5). Målet är att ge bland annat kliniskt verksam personal och forskare relevanta och aktuella kunskaper om sjukdomen samt praktiska stöd vid utredning, diagnostik och behandling (5). Diagnosen IPF baseras på två kriterier:
1. Uteslutande av andra orsaker till interstitiell lungsjukdom
2. UIP-mönster på högupplösande datortomografi (HRCT) och/eller lungbiopsi (11)
I vårdprogrammet 2019 rekommenderas att varje patientfall tas upp på en multidisciplinär konferens (MDK) där olika professioner såsom lungläkare, radiolog, patolog, klinisk fysiolog och reumatolog, med erfarenhet av IPF diskuterar och väger samman kliniska och
morfologiska fynd. Det leder till en ökad diagnostisk säkerhet, och är särskilt angeläget i de fall där HRCT-mönstret är sannolik UIP, obestämbar UIP eller talar för alternativ diagnos. Komorbiditeter är vanliga och flera av dem kan utgöra riskfaktor för sjukdomsutvecklingen. Behandling av exempelvis KOL och Gastroesofagal reflux rekommenderas i
vårdprogrammet. Vissa komorbiditeter är mer komplexa och behöver följas noggrant och patienten bör informeras. Ett exempel är lungcancer, där behandling av lungcancer ökar risken för exacerbation och överlevnad efter lungcancerkirurgi är sämre vid samtidigt IPF (5).
Behandling: Idag finns två godkända läkemedel för behandling av IPF. Pirfenidon och
Nintedanib som godkändes i EU 2012 respektive 2014 (5). Inget av läkemedlen botar
sjukdomen, men de har en bromsande effekt på sjukdomsprogressen (5). Båda behandlingarna är förenade med biverkningar, främst gastrointestinala, men även hudutslag förekommer (Pirfenidon), vilket kan ligga till grund för dosreducering eller avbrytande av behandling (5). Behandling bör pågå i minst 6 månader om eventuella biverkningar tolereras. I en nyligen genomförd studie har det visat sig att Nintedanib inte bara har en bromsande effekt mot IPF, utan även hos patienter med progressiv interstitiell lungsjukdom. Det är därför troligt att behandlingsindikationen kommer breddas inom nära framtid (13).
Syrgasbehandling erbjuds i symtomlindrande syfte och vid svårighet att saturera sig adekvat på luft (5). Effekten av syrgasbehandling är ännu inte helt klarlagd. Lungtransplantation är den enda botande behandlingen och bör övervägas redan i samband med diagnostik (14). Av alla lungtransplantationer som utförs i Sverige är det 10 % som avlider under första året efter transplantation. Ingreppet är svårt och komplext och patientens övriga hälsostatus samt ålder är av stor betydelse för utfallet. Särskilt problematisk är patienter över 65 år. I välbevarade
patienter med högre ålder kan i första hand ensidig lungtransplantation vara ett alternativ. I nuläget sker lungtransplantation enbart i Lund och Göteborg, som också är de inrättningar som fattar det slutgiltiga beslutet (5).
Vårdteamet är av stor betydelse för patienten. Förutom läkare och sjuksköterska, är andra professioner viktiga för rehabilitering och patientstöd under sjukdomen. Fysioterapeuten gör en bedömning av fysisk förmåga och ger övningar som är en del av lungrehabilitering.
Kurator finns till hands för stödsamtal och krishantering. Dietist tillhandahåller kostråd vid till exempel viktförändring eller gastrointestinala biverkningar. Arbetsterapeut bidrar till att underlätta vardagliga aktiviteter, förskriva hjälpmedel och hjälpa till med bostadsanpassning (5).
Undersökningar: Spirometri är en undersökning för att bedöma lungfunktionen inklusive
lungvolymer. Spirometri kan klassificeras i statisk, där hänsyn endast tas till volymen utandad luft och dynamisk, där tiden för utandning av volymen luft beräknas. Forcerad vitalkapacitet (FVC) är ett viktigt mått inom spirometri och mäter lungvolym i liter vid forcerad utandning efter maximal inandning (15). Gasutbytesstörning kan bedömas med hjälp av
diffusionskapacitet i procent av förväntat (DLCO%) som innebär att man i vila inandas en gasblandning som innehåller en liten mängd kolmonoxid. Genom att mäta tryckskillnader mellan inandad luft kan man beräkna gasutbytet som sker i lungornas alveoler och når blodet. DLCO% är sänkt hos nästan alla patienter med IPF (16). Patientens funktionella kapacitet samt grad av eventuell desaturering (lägre andel syremolekyler bundna till hemoglobinet än normalt, där normal syremättnad är ca 95%–100% ) (17) kan bedömas genom 6 Minute Walk Test (6MWT), ett gångtest där patienten uppmanas att gå så långt som möjligt på 6 minuter. Testet utförs enligt standardiserad metod med fysioterapeut. Puls, blodtryck och
syrgassaturation mäts före och efter testet, andfåddhet och bentrötthet skattas. 6MWT <250 m eller förkortad gångsträcka vid uppföljning, är en stark oberoende prediktor för mortalitet hos IPF-patienter (18).
Uppföljning: Uppföljning efter erhållen IPF-diagnos sker genom kliniska återbesök,
självskattning av livskvalitet via en enkät (se 2.3 Livskvalitet), HRCT samt lungfunktionsundersökningar. Dynamisk spirometri, statiska lungvolymer samt
diffusionskapacitet rekommenderas undersökas initialt, samt eventuellt var tredje månad det första halvåret, därefter var sjätte månad. Uppföljning efter 3 månader syftar främst till att
följa upp biverkningar och kontrollera följsamhet av nyinsatt behandling. 6MWT
rekommenderas genomföras initialt därefter var sjätte månad enligt vårdprogrammet (5). Se Tabell 1.
Tabell 1: Rekommenderade tidsintervall för uppföljning av lungfunktion vid Idiopatisk lungfibros
Undersökning Initialt 3 månader* 6 månader 12 månader
Dynamisk spirometri X X X X
Statiska lungvolymer X X X X
DLCO, kco X X X X
Ergospirometri eller 6MWT X X X
DLCO, kco= Diffusionckapacitet med kolmonoxidteknik korrigerat för Hb och alveolär volym, 6MWT= 6 Minute Walk Test (gångtest)
*Främst i syfte att monitorera svar på påbörjad behandling.
Prognos: Redan vid diagnostik kan faktorer kopplade till sämre prognos identifieras såsom
manligt kön, hög ålder, diagnosfördröjning, komorbiditeter, DLCO ≤40%, gåsträcka <250 m och/eller saturation <88% under 6MWT, grad av fibros på HRCT samt pulmonell
hypertension (3). Sjukdomens progressionshastighet varierar dock i hög grad mellan patienter och går inte att förutspå vid diagnostillfället. Uppföljning över tid är således ännu mera betydelsefullt för prognosen. Följande faktorer är associerade med mortalitet eller lungtransplantation hos IPF patienter: Sänkning >10% av FVC i procent av förväntat (FVC%), syrgasbehov i vila, sänkning >10%(19) -15% av DLCO%, akuta exacerbationer, förkortad gåsträcka >50 meter i 6MWT och ökad fibrotisering på HRCT över en period om 6–12 månader (3). I flera studier har sänkning av FVC% ansetts vara en bra variabel för progress och mortalitet av IPF (3, 20, 21). I en ny studie var syrgasbehov i vila den enskilt starkaste prediktorn för mortalitet eller lungtransplantation. Sambandet visade sig vara
oberoende av många faktorer som tidigare förknippats med sjukdomsprogress, såsom FVC%, DLCO%, GAP-stadium (screeningmetod för att bedöma prognos hos IPF-patienter baserat på kön, ålder och lungfysiologi) samt sjukhusvistelse. En svaghet i studien är att hänsyn inte tagits till 6MWT (22). Dock visade en ännu opublicerad registerbaserad kohortstudie baserad på data från det svenska lungfibrosregistret att gångavstånd (6MWT) vid inklusion i registret var en oberoende prediktor för död eller lungtransplantation (23).
Lungfibrosregistret
Lungfibrosregistret startade 2014 som ett kvalitetsregister med övergripande syfte att öka kunskapen om sjukdomen i Sverige och bidra till bättre vård och omhändertagande av de som drabbas av sjukdomen. Registret samlar patientdata på nationell nivå och har även en biobank för insamling av blodprov kopplad till sig. Karolinska Universitetssjukhuset är registerhållare och registrets personuppgiftsansvarige myndighet. Registret och biobankens aktiviteter regleras av en styrelse som träffas två gånger varje år. Finansiering av lungfibrosregistret har hittills skett med stöd av projektanslag från Hjärt- Lungfonden, samt med stöd av
läkemedelsindustrin (Roche och Boehringer-Ingelheim) och Stockholms Läns Landsting som anställt en registerkoordinator sedan 2014. Avtal med industrin sker enligt SKLs regler och med tekniskt stöd av Kvalitetsregistercentrum Stockholm (QRC-STHLM) (6). Registret nås via Svensk Lungmedicinsk Förenings (SLMF:s) hemsida (24). Med ett kvalitetsregister möjliggörs uppföljning av den vård som ges. I lungfibrosregistret kan kvalitetsuppföljningen ske utifrån symtomdebut, diagnosticering, uppföljning, behandling, biverkningar och
livskvalitet. Kunskapen om sjukdomen kan öka genom att bland annat ta reda på hur många patienter som drabbas i Sverige, vilka symtom patienterna har och hur sjukdomen utvecklas över tid. Lungfibrosregistret publicerar årligen en rapport där patientgruppen beskrivs utifrån värden som traditionellt används inom lungmedicin för att karaktärisera patientgruppen. Demografi och baslinjedata presenteras på nationell nivå, men ingen kvalitetsuppföljning är gjord på sjukhusnivå (6).
Livskvalitet
Hälsostatus är en individs relativa nivå av hälsa och sjukdom, med hänsyn till förekomsten av biologisk eller fysiologisk dysfunktion, symtom och funktionsnedsättning. Upplevd
hälsostatus är den egna bedömningen av sin hälsostatus som patienten gör. Den kan variera kraftigt mellan individer och behöver inte korrelera med objektiva fynd. Hälsorelaterad livskvalitet (HRQL) är en individs tillfredsställelse eller lycka i olika aspekter av livet i den mån de påverkar eller påverkas av hälsostatus. HRQL är skiljt från livskvalitet, då det i första hand berör de faktorer som faller under vårdgivare och sjukvårdssystem (25). Patient
Reported Outcome (PRO) syftar på patientens rapporterade självupplevda hälsa utan att resultatet tolkats av annan part. Resultatmått eller instrument som mäter PRO kallas för Patient Reported Outcome Measure (PROM). Med hjälp av PROM kan HRQL och hur sjukdomen påverkar patientens dagliga liv mätas och följas upp. Instrument för att mäta
livskvaliteten hos patienter med interstitiell lungsjukdom finns fortfarande i begränsad omfattning. Exempel på PROMs som har använts i klinik och studier är SGRQ, SGRQ-I, CAT, K-BILD, ATAQ-IPF och några är fortfarande under utveckling (L-IPF, IPF-PROM, PESaM, IPF-PREM) (26, 27). King’s Brief Interstitial Lung Disease (K-BILD) är det enda PROM som utvecklades specifikt för ILD-patienter, till skillnad från de övriga där
målgruppen var patienter med astma och kroniskt obstruktiv lungsjukdom (KOL). K-BILD togs fram 2012 och är ett lättanvänt självskattningsformulär som är validerat för patienter med interstitiell lungsjukdom samt översatt och validerat på svenska (28). Instrumentet bygger på tre domäner: Andnöd och aktiviteter, bröstsymtom samt psykologiska aspekter och består av totalt 15 frågor. Varje fråga graderas på en sjugradig skala och totalpoängen beräknas med en formel som ger mellan 0–100 poäng där högre värden indikerar en bättre HRQL och vice versa (29). Minimal Clinically Important Difference (MCID) är den minsta ändring i poäng som är en signifikant förändring och bestäms utifrån att en förändring i PRO korrelerar med flera accepterade verktyg för mätning av HRQL livskvalitet (30). I Sverige används K-BILD för att mäta och följa upp hälsorelaterad livskvalitet hos alla patienter som är anslutna till Lungfibrosregistret. Instrumentet ger också möjlighet att fånga upp outtalade behov hos patienter (5).
Vårdkvalitet
Vårdkvalitet kan definieras som graden av måluppfyllelse i vårdarbetet (31). Vårdkvalitet är ett vitt begrepp som innefattar flera faktorer såsom ekonomisk-, teknisk- och medicinska förutsättningar och utveckling. På senare år har även patientens tillfredställelse av vården och därmed patientperspektivet kommit in som en faktor för gradering av vårdkvaliteten. Genom kvalitetsregister kan man få data och mäta utfallen av vården. Sverige är unikt och ledande internationellt sett med fler än 100 nationella kvalitetsregister. Nationella kvalitetsregister samlar individbaserade data om diagnoser, åtgärder och resultat inom hälso- och sjukvård och omsorg. Registerdata kan användas i forskning, uppföljning och utvecklingsarbete. Syftet är att följa upp och förbättra vården. Alla nationella kvalitetsregister kvalitetsgranskas och finansiering sker av sjukvårdshuvudmän och med statliga medel. Det finns även många lokala och regionala kvalitetsregister som till skillnad från de nationella kvalitetsregistren inte finansieras med statliga medel (32). Kvalitetsregister kan bestå av strukturmått, processmått och resultatmått. Ibland kan samma variabel vara både processmått och resultatmått.
vilka insatser som görs medan resultatmått kan syfta på vårdens effekter och resultat. På senare år har även patientrapporterade mått inkluderats (33). I lungfibrosregistret är K-BILD ett exempel på detta. Genom att jämföra resultatmått och patientrapporterade mått kan få en helhetsbild av sjukdomen samt ett värdefullt diskussions- och beslutsunderlag för vården av patienter. Om exempelvis resultatmåttet för en patient visar en signifikant förbättring av lungfunktion i procent av förväntat, samtidigt som patienten inte upplever förbättring av symtom eller i sitt mående, kan man fråga sig vilket värde enbart resultatmåttet har för patienten? Det finns många möjligheter med PROMs. En central anledning till bristen på validerade PROMs idag är bristen på longitudinella data för att kunna validera och bestämma MCID för PROMs. Mer longitudinella data genom patientregister och för internationell jämförelse är således angeläget. Det kan leda till att utveckla nya och bättre PROMS (27). Förutom resultatmått, kan patientens erfarenhetupplevelse av vården bidra med ytterligare en aspekt i vårdkvaliteten. Patient Reported Experience Measure (PREM) är mätverktyg som kan delas in i relationella eller funktionella. Relationella PREM fokuserar på patienters upplevelse och erfarenhet av kontakten med vårdpersonalen, medan funktionella mått handlar om
erfarenheter såsom väntetider, renlighet, bekvämlighet osv (34). Idag saknas validerade och sjukdomsspecifika PREMs för patienter med IPF (27). Både PROM och PREM är viktiga verktyg som bör användas av multidisciplinära vårdteam eftersom det bidrar tillförståelse för patientens komplexa situation och möjliggör skräddarsydd palliativ vård (35).
Förbättringsmöjligheter i IPF-vården
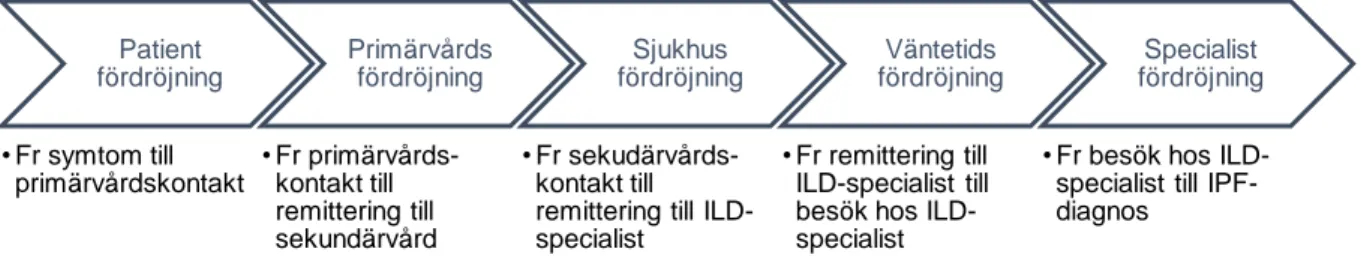
Snabb diagnostik, snabb tillgång till specialister på lungsjukdomar och tidig farmakologisk behandling har identifierats som viktiga i vården av IPF-patienter (36). Även större fokus på symtomcentrerad handläggning, adekvat information, information om kliniska prövningar och ökad medvetenhet om lungfibros/ IPF krävs (37). Fördröjning inom vården påverkas av flera faktorer däribland när patienten tar en första vårdkontakt efter symtomdebut, väntetid till vården, vårdgivarens bedömningstid och remittering till specialist, utredningstid hos specialist och tills diagnos ställs (36). I Figur 1 illustreras hur fördröjningen kan se ut.
Figur 1: Flödesdiagram för fördröjning inom vården
Flertalet studier har påvisat att det finns en fördröjning i diagnostiken av IPF (36, 38, 39). Orsaken till fördröjning är multifaktoriell och hittills inte helt klarlagd (36). Det finns antydan på att andningssymtom, vilka är de första symtomen på IPF ofta tillskrivs ålderdom, rökning och vanligare hjärt- eller luftvägssjukdomar av både patienter och vårdpersonal (40, 41). Riskfaktorer för fördröjning är manligt kön, hög ålder och behandlingsförsök av alternativ diagnos.En stor andel patienter får en felaktig diagnos innan IPF-diagnosen, 37%, 41% respektive 55% enligt Hoyer et al. (36), Moor et al. (37) och Cosgrove et al. (38).
Feldiagnostik leder inte sällan till initiering av behandling och bidrar på så vis ytterligare till fördröjning (38). En fördröjning leder till att diagnos ställs vid högre ålder. Hög ålder är kopplat till sämre prognos samt en avgörande faktor för att få genomgå lungtransplantation (14, 42).
Många patienter upplever att de saknar eller får bristande information om IPF vid
diagnostillfället. Tillgänglig information upplevs som begränsad och det saknas strategier för hur patienten ska hantera sjukdomen (43, 44). För patienter med komorbiditeter upplevs vården inte väl koordinerat mellan olika vårdgivare och är således också ett område som kan förbättras (44). Monitorering och regelbunden uppföljning är inte bara viktig för bedömning av sjukdomsprogressen, utan även något som uppskattas och gör att patienter känner sig omhändertagna (44).
Studier visar att IPF-patienter har sämre tillgång till palliativ vård jämfört med andra dödliga sjukdomar samt att mer än hälften avlider i sjukhusmiljö och endast en minoritet hänvisas formellt till palliativ vård innan bortgång (45). IPF är en progressiv sjukdom vars
utvecklingstakt inte går att förutspå. Sjukdomen kan progrediera väldigt snabbt och palliativ
Patient fördröjning • Fr symtom till primärvårdskontakt Primärvårds fördröjning • Fr primärvårds-kontakt till remittering till sekundärvård Sjukhus fördröjning • Fr sekudärvårds-kontakt till remittering till ILD-specialist
Väntetids fördröjning
• Fr remittering till ILD-specialist till besök hos ILD-specialist
Specialist fördröjning
• Fr besök hos ILD-specialist till IPF-diagnos
vård är således något som bör diskuteras med patienten i tidigt skede (46, 47). Framtagning av validerade och sjukdomsspecifika PREMs kan bli ett viktigt verktyg för att skräddarsy
palliativ vård och bidra till förbättrad vårdkvalitet (se 2.4 Vårdkvalitet) (35). Behovet av psykologiskt stöd är också en viktig del som identifierats (37).
Syfte
Att beskriva vårdkvaliteten på sjukhusnivå och hur den följs upp för patienter med Idiopatisk lungfibros (IPF) som inkluderats i lungfibrosregistret.
Frågeställningar
1. Vilka variabler i lungfibrosregistret är mest lämpade att använda för uppföljning av vårdkvaliteten med avseende på processmått och resultatmått?
2. Hur avspeglar variablerna vårdkvaliteten på sjukhusnivå?
Metod
Studiedesign
Studien är en registerbaserad studie. Studien är uppdelad i två delar; del 1 där kvalitativ metod använts för att besvara frågeställning 1 respektive del 2 där kvantitativ metod använts för att besvara frågeställning 2. Del 1 innefattade en litteratursökning för att bestämma vilka variabler i lungfibrosregistret som är lämpade för kvalitetsuppföljning av vården. I del 2 användes deskriptiv statistik för att sammanställa och beskriva data.
Datainsamling
Datainsamling för del 1 av studien: Information om idiopatisk lungfibros hämtades dels
från vårdprogrammet för IPF dels via en litteratursökning på Pubmed med sökordet Idiopathic Pulmonary Fibrosis tillsammans med relevanta begrepp för det ämne som berördes;
Demography (n=808), management (954), pathogenesis (3790), delay (85), guidelines (280), health quality (233) och filtrerat på tillgängligt Abstract (5). Med utgångspunkt i
rekommendationerna enligt vårdprogrammet för IPF kunde processmått och resultatmått urskiljas och kompletteras med resultat från litteratursökningen. Sökningarna gav sammanlagt 6150 träffar, varav vissa artiklar gav sökträff fler än en gång. Ungefär 10% av rubrikerna filtrerat efter ”bästa matchning” lästes och av de som bedömdes relevanta lästes Abstracts. Slutligen valdes 50 artiklar ut som låg till grund för hela studien, varav 23 artiklar (3, 11,14,
15, 18, 19, 20, 21, 26, 27, 35, 36, 37, 38, 39, 42, 43, 44, 49, 50, 53, 54, 58) bidrog till att identifiera variabler för uppföljning av vårdkvaliteten.
Datainsamling för del 2: Data insamlades från lungfibrosregistret och innefattade patienter
inkluderade mellan oktober 2014 till och med september 2019. Data i lungfibrosregistret har införts av behandlade läkare och annan vårdpersonal. Initialt bestod det extraherade materialet av totalt cirka 80 variabler, däribland 589 patienter från 26 sjukhus i Sverige. Extraherade data från lungfibrosregistret var samlad i en Excel-fil vars innehåll bearbetades så att endast variabler som var lämpade för kvalitetsuppföljning enligt resultatet från frågeställning 1 fanns med. Data sammanställdes på nationell nivå samt sorterades efter sjukhus för att resultatet skulle kunna presenteras på sjukhusnivå, samt nationellt för jämförelse. Data bearbetades i Excel.
Variabler och dataanalys
Resultatet i del 1 genererade variabler som utgjorde grunden för den andra delen av studien. Dataanalysen i del 2 utfördes med deskriptiv statistik och presenterades med centralmåtten median och medelvärde, samt spridningsmåtten standardavvikelse, absoluta värden samt kvartiler. Beräkningar genomfördes i Excel.
Etiska aspekter
Etikgodkännande för kvalitetsregistret erhölls i augusti 2014 av den regionala
etikprövningsnämnden i Stockholm (diarienummer 2014/1202-31/4). Ingen ytterligare etikprövning var nödvändig för den aktuella studien då det är ett examensarbete inom
läkarprogrammet på avancerad nivå (48). Patienternas förnamn och efternamn var utbytta mot koder i extraherad data från lungfibrosregistret. Data för sjukhus med färre än 10 patienter har inte redovisats separat på sjukhusnivå. Denna gräns har valts av etiska- och sekretesskäl för att patienternas identiteter inte ska avslöjas och därmed önskas aggregerad data.
Resultat del 1
Totalt har nio variabler tillgängliga i lungfibrosregistret identifierats för uppföljning av vårdkvaliteten för patienter med Idiopatisk lungfibros. Resultatet baseras på
rekommendationer i vårdprogrammet för IPF samt studie av litteratur och tillgängliga data i lungfibrosregistret. Ålder vid diagnostik kan vara en indikator för vårdkvalitet (resultatmått)
och är en variabel som är tillgängligt i registret. Hög ålder vid diagnos är kopplat till sämre prognos samt en avgörande faktor för att få genomgå lungtransplantation (14, 42). Det
påverkar således vilken behandling som kan erbjudas till patienten. Flertalet studier har också påvisat att det finns en fördröjning i diagnostiken av IPF vilket är förenat med sämre prognos och kan påverka behandlingsmöjligheter (36, 38, 39, 49). Baserat på data i registret kan tid från symtom till diagnos beräknas och följas upp (processmått). Vidare är variabeln tid från diagnos till initiering av farmakologisk behandling lämplig för uppföljning och kan tas fram ur data i registret (processmått). Tidig behandlingsstart rekommenderas generellt och
övervägs av majoriteten av lungläkare i samband med diagnostillfälle (44).
Lungtransplantation är den enda botande behandlingen och den generella indikationen är terapiresistent, progredierande lungsjukdom med förväntad dödlighet inom två år (5). Andel lungtransplanterade är således en viktig variabel att följa upp inte minst ur ett regionalt perspektiv eftersom ingreppet bara görs på två sjukhus i landet (resultatmått). Lungfunktion mätt i FVC% är ett utfallsmått (resultatmått) i kliniska prövningar och man rekommenderar mätning med tre till sex månaders intervall. Även med denna frekvens, kan sjukdomen progrediera och leda till dödsfall inom tidsintervallet (50). Nationella rekommendationer för tidsintervall anges i vårdprogrammet för IPF (5). Hur ofta som lungfunktionsundersökningar genomförs på sjukhusen i praktiken är således betydelsefulla variabler för att bedöma graden av måluppfyllelse av vårdprogrammets rekommendationer, samt en indikator för
vårdkvaliteten. I kliniken används HRCT främst för diagnostik. Uppföljande HRCT görs för att bekräfta eller utesluta betydande sjukdomsprogression, särskilt hos patienter med oklar sjukdomsbild. Det är vanligt att HRCT görs med 1–2 års intervall för att hitta eventuella förändringar i morfologi eller för att upptäcka en ny komorbiditet/malignitet (3). Nödvändiga data för att beräkna tid mellan spirometrier, 6MWT samt HRCT finns tillgängligt i
lungfibrosregistret (processmått). Även lungfunktion vid behandlingsstart kan vara en lämplig indikator för vårdkvalitet då det återspeglar sjukdomsprogress (3, 20, 21). Flera studier lyfter behovet av uppföljning av hälsorelaterad livskvalitet och patientens vårdupplevelse genom PROM och PREM för att förbättra vårdkvaliteten (26, 27, 35, 44). K-BILD återspeglar patientens hälsorelaterade livskvalitet. Resultaten av K-BILD finns rapporterade i
lungfibrosregistret och möjliggör uppföljning (resultatmått). Otillräcklig information om sjukdomen och sjukdomsprogress vid diagnostillfälle har lyfts i flera studier (37, 43, 44). Denna data finns dock inte i registret och kan således inte följas upp i denna studie. Likaså bristande koordination med andra vårdgivare vid komorbiditeter. Ytterligare en aspekt är den psykologiska som inte följs upp specifikt i lungfibrosregistret (37).
Variabler för uppföljning av vårdkvaliteten för IPF-patienter
Nedan presenteras de nio variabler för kvalitetsuppföljning som identifierats i denna studie, vilka utgör metod och ligger till grund för resultaten i del 2.
Ålder vid diagnostik: Differensen (år) mellan födelsedatum och diagnosdatum beräknades
för samtliga patienter i registret.
Tid från symtom till diagnos: Differensen (i dagar) mellan datum för symtomdebut och
diagnosdatum beräknades och dividerades med 365 för att få enheten år. Symtomdebut mer än 10 år tidigare än diagnosdatum bedömdes som avvikande värden och exkluderades. Eftersom kvalitetsregistret startade 2014 har patienter som fått sin diagnos tidigare än 2014 exkluderats.
Tid från diagnos till behandling: Differensen (i dagar) mellan diagnosdatum och det första
behandlingsdatum beräknades. Ingen hänsyn har tagits till om och/eller när den första
behandlingen avbröts, samt om nya behandlingsförsök gjordes. Patienter som fått sin diagnos tidigare än 2014 har exkluderats.
Lungfunktion vid behandlingsstart: Datum för registrerade resultat av
lungfunktionsundersökningar med avseende på FVC i procent av förväntat (FVC%) samt diffusionskapacitet i procent av förväntat (DLCO%) ±90 dagar från behandlingsstart.
Andel transplanterade samt avlidna: Andel transplanterade samt avlidna i procent av totalt
antal patienter per sjukhus. Genomgången transplantation baserades på att det fanns ett registrerat datum för transplantation i lungfibrosregistret.
Tid mellan spirometrier: Differensen (i dagar) mellan datum för första och andra
spirometrin. På samma sätt beräknades tid mellan andra och tredje respektive tredje och fjärde spirometrin. Första spirometrier som föll utanför intervallet ±6 månader från samtyckesdatum exkluderades.
Tid mellan HRCT: Differensen (i dagar) mellan datum för första HRCT och datum för andra
HRCT dividerades med 30 för att få enheten månader. På samma sätt beräknades tid mellan andra och tredje HRCT. Patienter som endast hunnit genomföra en HRCT-undersökning har således fallit bort.
Tid mellan 6MWT: Differensen (i dagar) mellan datum för första och andra gångtestet
(6MWT) respektive andra och tredje 6MWT beräknades. Endast 6MWT som hade genomförts utan tillförsel av syrgas inkluderades.
K-BILD: Totalpoäng av K-BILD vid tidpunkten för inklusion i registret, definierat som inom
Resultat del 2
Tjugosex sjukhus i landet var i september 2019 anslutna till registret. Totalt 589 patienter varav 162 hade avlidit vid tidpunkten för den aktuella studien. Resultatet presenteras per sjukhus med minst 10 patienter. Sjukhusen är namngivna efter stad/kommun och en förteckning över namnen på sjukhusen finns i bilaga I.
1. Ålder vid diagnostik
I Tabell 2 redovisas ålder vid diagnostik.
Tabell 2: Ålder vid diagnostik per sjukhus med minst 10 IPF-patienter
Min=lägsta ålder, Max=högsta ålder, SD=standardavvikelse, n=antal patienter. Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
Sjukhus Median (år) Min-Max M (år) SD n Sunderby 67,0 57–81 68,5 7,4 15 Östersund 69,0 59–82 69,7 6,6 29 Ängelholm 69,0 59–80 67,4 7,3 11 Kristianstad 71,0 60–76 70,6 4,6 10 Lund 71,5 54–83 70,6 7,0 38 Linköping 71,5 57–84 71,0 7,2 36 Göteborg 72,0 49–85 71,5 7,6 49 Örebro 72,0 50–83 70,8 7,6 13 Danderyd 73,0 59–84 71,4 9,6 10 KS Solna 73,0 46–87 71,9 7,9 151 Trollhättan 73,0 58–91 72,7 6,9 28 Norrköping 73,0 62–81 72,7 5,3 27 Gävle 73,0 56–86 71,9 7,3 21 Uppsala 74,0 56–86 72,4 7,2 36 Helsingborg 74,0 56–84 72,9 6,8 13 KS Huddinge 74,0 58–88 73,6 7,8 13 Falun 74,0 48–85 72,7 8,6 45 Riket 72,0 46–91 71,5 7,5 589
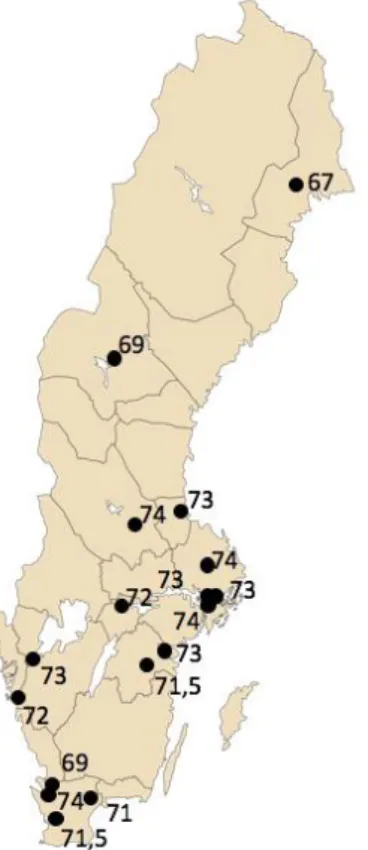
Medianåldern vid diagnostik var 72 år för hela riket och medelåldern var 71,5 ±7,5 år. Den yngsta patienten fick sin diagnos i 46 års ålder och den äldsta i 91 års ålder. Medianåldern varierade mellan 67–74 år för sjukhus med minst 10 patienter.
I Figur 2 illustreras medianåldern utifrån geografisk spridning. Lägst medianålder förekom i Norrbotten och högst i Falun, Uppsala, Stockholm och Helsingborg.
Figur 2: Geografisk spridning av medianålder vid diagnostik för sjukhus med minst 10 IPF-patienter
2. Tid från symtom till diagnos
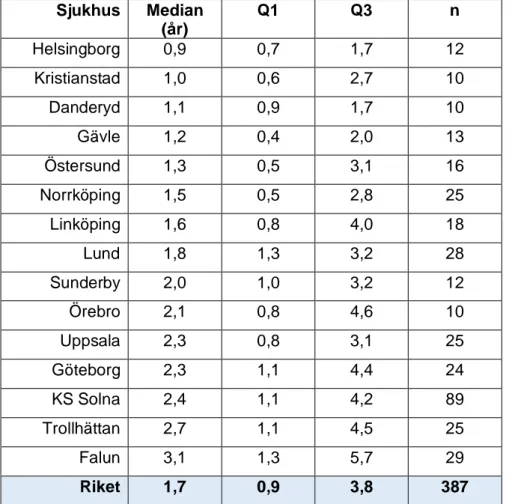
I Tabell 3 redovisas mediantid från symtomdebut till diagnos i enheten år per sjukhus med lägsta värdet högst upp i tabellen. Symtomdebut över 10 år från diagnosdatum exkluderades, totalt 22 patienter. Mediantiden för tid från symtom till diagnos var 1,7 år (IQR 0,9–3,8) för hela riket (387 patienter). Tidsintervallet från första symtom till datum för IPF-diagnos varierade kraftigt inom och mellan olika sjukhus.
Tabell 3: Tid från symtom till diagnos per sjukhus med minst 10 IPF-patienter Sjukhus Median (år) Q1 Q3 n Helsingborg 0,9 0,7 1,7 12 Kristianstad 1,0 0,6 2,7 10 Danderyd 1,1 0,9 1,7 10 Gävle 1,2 0,4 2,0 13 Östersund 1,3 0,5 3,1 16 Norrköping 1,5 0,5 2,8 25 Linköping 1,6 0,8 4,0 18 Lund 1,8 1,3 3,2 28 Sunderby 2,0 1,0 3,2 12 Örebro 2,1 0,8 4,6 10 Uppsala 2,3 0,8 3,1 25 Göteborg 2,3 1,1 4,4 24 KS Solna 2,4 1,1 4,2 89 Trollhättan 2,7 1,1 4,5 25 Falun 3,1 1,3 5,7 29 Riket 1,7 0,9 3,8 387
Q1= första kvartilen, Q3= tredje kvartilen, n= antal patienter. Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
3. Tid från diagnos till behandling
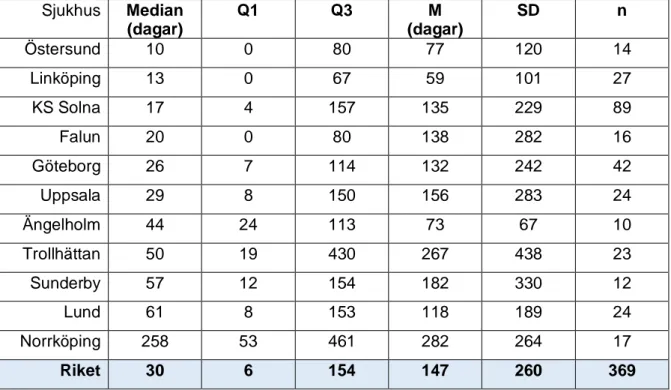
I Tabell 4 redovisas tid (i dagar) från diagnos till första farmakologiska behandlingsförsök. Totalt 369 patienter hade påbörjat behandling med Pirfenidon eller Nintedanib. Mediantiden från diagnos till första behandlingsstart var 30 dagar (IQR 6–154) på nationell nivå.
Tabell 4: Tid från diagnos till behandling per sjukhus med minst 10 IPF-patienter Sjukhus Median (dagar) Q1 Q3 M (dagar) SD n Östersund 10 0 80 77 120 14 Linköping 13 0 67 59 101 27 KS Solna 17 4 157 135 229 89 Falun 20 0 80 138 282 16 Göteborg 26 7 114 132 242 42 Uppsala 29 8 150 156 283 24 Ängelholm 44 24 113 73 67 10 Trollhättan 50 19 430 267 438 23 Sunderby 57 12 154 182 330 12 Lund 61 8 153 118 189 24 Norrköping 258 53 461 282 264 17 Riket 30 6 154 147 260 369
Q1= första kvartilen, Q3= tredje kvartilen, M= medelvärde, SD= standardavvikelse, n= antal patienter. Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
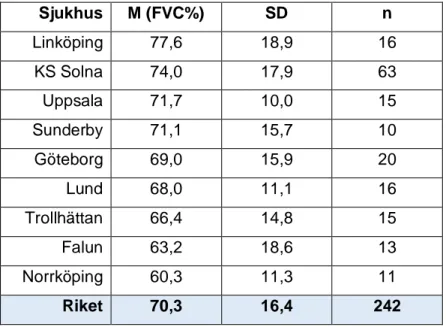
4. Lungfunktion vid behandlingsstart
I Tabell 5 och Tabell 6 redovisas resultat från olika lungfunktionsmätningar. Tabell 5 redovisar diffusionskapacitet i procent av förväntad (DLCO%) och i Tabell 6 redogörs forcerad vitalkapacitet i procent av förväntad (FVC%). Medelvärdet för DLCO% vid behandlingsstart var 46,8 % ±13,9 % för hela riket.
Tabell 5: Diffusionskapacitet i procent av förväntat (DLCO%) vid behandlingsstart per sjukhus med minst 10 IPF-patienter
Sjukhus M (DLCO%) SD n Lund 49,9 14,3 16 KS Solna 49,2 14,1 61 Göteborg 45,0 11,3 18 Falun 39,7 14,0 10 Riket 46,8 13,9 193
M= medelvärde, DLCO% = Diffusionskapacitet i procent av förväntad SD= standardavvikelse, n= antal patienter. Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
Tabell 6: Forcerad vitalkapacitet i procent av förväntad (FVC%) vid behandlingsstart per sjukhus med minst 10 IPF-patienter
M= Medelvärde, FVC%= Forcerad vitalkapacitet i procent av förväntad, SD= Standardavvikelse, n= antal patienter, Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
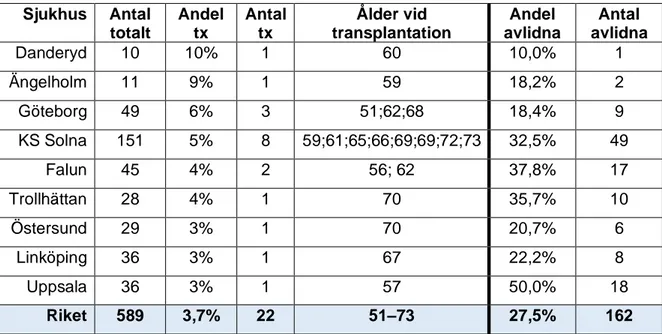
5. Andel transplanterade samt avlidna per sjukhus
I Tabell 7 redogörs andel transplanterade (tx) samt avlidna per sjukhus med minst 10 patienter. Totalt tjugotvå patienter med diagnosen IPF hade genomgått lungtransplantation fram till och med september 2019. Yngsta patienten var 51 år och äldsta var 73 år vid transplantationen. Medianåldern var 65,5 år. Av de transplanterade var 73 % män och 27 % kvinnor. På nationell nivå har 3,7% dvs. ungefär en på tjugosju patienter transplanterats.
Sjukhus M (FVC%) SD n Linköping 77,6 18,9 16 KS Solna 74,0 17,9 63 Uppsala 71,7 10,0 15 Sunderby 71,1 15,7 10 Göteborg 69,0 15,9 20 Lund 68,0 11,1 16 Trollhättan 66,4 14,8 15 Falun 63,2 18,6 13 Norrköping 60,3 11,3 11 Riket 70,3 16,4 242
Tabell 7: Transplanterade samt avlidna per sjukhus med minst 10 IPF-patienter Sjukhus Antal totalt Andel tx Antal tx Ålder vid transplantation Andel avlidna Antal avlidna Danderyd 10 10% 1 60 10,0% 1 Ängelholm 11 9% 1 59 18,2% 2 Göteborg 49 6% 3 51;62;68 18,4% 9 KS Solna 151 5% 8 59;61;65;66;69;69;72;73 32,5% 49 Falun 45 4% 2 56; 62 37,8% 17 Trollhättan 28 4% 1 70 35,7% 10 Östersund 29 3% 1 70 20,7% 6 Linköping 36 3% 1 67 22,2% 8 Uppsala 36 3% 1 57 50,0% 18 Riket 589 3,7% 22 51–73 27,5% 162
Tx= transplanterad. Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
6. Tid mellan spirometrier
I Tabell 8 redovisas sjukhus som har minst 10 patienter eller fler vid andra spirometrin. Delta
T (T) är tid i månader mellan spirometrier där T1 står för tidpunkten för första spirometrin, T2 står för andra spirometrin etc. I de flesta fall sammanfaller första spirometrin och datum för diagnostik samma dag. Resultatet har sorterats efter medelvärdet för tidsdifferensen i månader mellan första och andra spirometrin (T2–1) i fallande ordning.
Tabell 8: Tid mellan spirometrier hos IPF-patienter per sjukhus Sjukhus T2–1 M (månad) SD N=348 n T3–2 M (månad) SD N=265 n T4–3 M (månad) SD N=197 n Sunderby 8,4 4,2 13 8,9 8,5 11 7,3 3,2 8 Falun 7,8 4,1 29 10,1 6,0 17 8,6 3,1 10 KS Solna 7,6 4,1 113 8,0 4,1 85 8,3 4,2 57 Uppsala 6,1 2,3 32 6,7 2,6 25 6,1 2,8 20 Lund 6,0 2,9 28 5,6 1,8 22 6,6 2,2 19 Norrköping 5,9 4,5 18 4,2 1,9 15 4,5 2,4 12 Gävle 5,7 3,3 10 5,9 2,7 5 4,7 1,3 2 Trollhättan 5,5 3,5 19 3,9 2,6 17 5,1 3,6 13 KS Huddinge 5,2 2,1 10 5,4 3,4 8 4,6 2,9 7 Eksjö 5,0 2,3 11 3,2 2,7 5 3,7 1,2 3 Linköping 4,7 2,6 27 3,4 1,4 21 3,0 1,2 17 Ängelholm 4,5 1,1 10 3,3 0,7 10 3,4 1,1 7 Göteborg 4,0 1,2 28 4,1 1,3 24 4,3 1,3 22 Riket 6,3 3,7 392 6,2 4,1 295 6,0 3,4 213
T2–1; T3–2; T4–3= Tid mellan första–andra- ; andra–tredje- ; tredje–fjärde spirometrin, SD=
Standardavvikelse, N= Totalt antal patienter med minst 10 IPF-patienter, n= antal patienter, Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
Rikets medelvärde för T2–1 var 6,3 ±3,7 månader. Medelvärdet varierade mellan 4,0–8,4 månader på sjukhus med minst 10 patienter. I vissa fall var medeltiden dubbelt så lång sjukhus emellan.
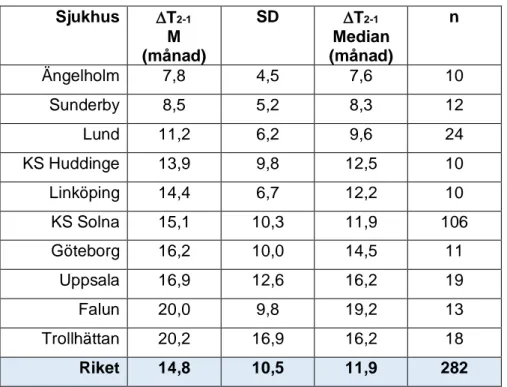
7. Tid mellan HRCT
I Tabell 9 redovisas tiden mellan den första och andra samt den andra och tredje HRCT– undersökningen. Således är det uppföljande HRCT som inkluderats och patienter som endast genomgått en HRCT-undersökning har utelämnats. Delta T (T) är tidsintervall i månader. Det första undersökningsdatumet T1 syftar på det första datumet räknat från inklusion i registret, och T2 motsvarar andra HRCT från inklusionsdatum. Ingen hänsyn har tagits till var i sjukdomsförloppet patienten befinner sig. Äldre datum än 2014 för HRCT har exkluderats.
Tabell 9: Tid mellan högupplösande datortomografi (HRCT) per sjukhus med minst 10 IPF-patienter Sjukhus T2-1 M (månad) SD T2-1 Median (månad) n Ängelholm 7,8 4,5 7,6 10 Sunderby 8,5 5,2 8,3 12 Lund 11,2 6,2 9,6 24 KS Huddinge 13,9 9,8 12,5 10 Linköping 14,4 6,7 12,2 10 KS Solna 15,1 10,3 11,9 106 Göteborg 16,2 10,0 14,5 11 Uppsala 16,9 12,6 16,2 19 Falun 20,0 9,8 19,2 13 Trollhättan 20,2 16,9 16,2 18 Riket 14,8 10,5 11,9 282
T2–1= Tid mellan första och andra högupplösande datortomografi, M= medelvärde, SD= Standardavvikelse, n=
antal patienter, Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
Medelvärdet för tid mellan första och andra HRCT var 14,8 ±10,5 månader och mediantiden var 11,9 månader för hela riket.
8. Tid mellan 6MWT
I Tabell 10 redogörs tid från föregående gångtest (6MWT) för andra, tredje respektive fjärde gångtestet per sjukhus med minst 10 patienter. Rikets medelvärde för tid mellan första och andra gångtestet var 7,8 ±5,6 månader, mellan andra och tredje var det 6,9 ± 4,6 månader och mellan tredje och fjärde var det 7 ±4,4 månader. Mediantiden mellan första och andra gångtestet var 6 månader för hela riket.
Tabell 10: Tid mellan gångtest (6MWT) per sjukhus med minst 10 IPF-patienter Sjukhus − M (mån) SD − Mdn (mån) n − M (mån) SD n − M (mån) SD n Linköping 3,5 1,9 3 20 2,7 1,5 17 3,1 2,2 15 Norrköping 4,8 2,9 4 19 6,6 3,5 14 4 1,0 3 Ängelholm 5,0 0,9 5 10 5,0 1,1 6 4 - 1 Gävle 6,8 4,5 5,5 12 5,6 3,1 5 6 3,0 3 Sunderby 8,4 4,0 8 13 8,6 8,8 11 7,7 2,2 6 Lund 9,2 6,2 8 24 7,4 3,6 19 7,3 3,0 12 KS Solna 9,2 6,1 8 90 8,0 4,3 65 9,1 4,8 38 Falun 9,3 5,7 9,5 12 9,4 5,8 5 - - 0 Riket 7,8 5,6 6 250 6,9 4,6 162 7,0 4,4 87
T2–1; T3–2; T4–3= Tid mellan första–andra- ; andra–tredje- ; tredje–fjärde gångtest, M= medelvärde, SD=
Standardavvikelse, Mdn= Median, n= antal patienter, Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
9. Livskvalitet
I Tabell 11 och Tabell 12 redovisas patienternas hälsorelaterade livskvalitet baserat på K-BILD i totalpoäng (av maximalt 100 poäng) för sjukhus med minst 10 patienter. Medelvärdet för K-BILD för samtliga sjukhus vid inklusion i registret var 54,4 ±10,5 (n=489).
Medelvärdet för de sjukhus som rapporterat data för K-BILD 12 månader efter inklusion i registret var 55,0 ±12,7 (n=191).
Tabell 11: Hälsorelaterad livskvalitet (K-BILD) vid inklusion per sjukhus med minst 10 IPF-patienter Sjukhus M (poäng) SD n Norrköping 57,5 14,1 26 Lund 57,3 12,1 37 Falun 56,1 13,3 36 KS Solna 55,5 10,1 128 Linköping 55,4 8,6 34 Gävle 54,9 9,2 12 Helsingborg 54,3 12,4 12 Uppsala 54,1 10,5 21 Östersund 53,1 10,1 25 KS Huddinge 52,3 6,4 13 Göteborg 52,0 9,5 34 Örebro 51,2 8,5 13 Ängelholm 50,3 11,3 11 Trollhättan 48,5 7,4 26 Riket 54,4 10,5 489
Maxpoäng 100. Högre poäng indikerar bättre hälsorelaterad livskvalitet och <60 poäng är förenat med försämrad livskvalitet. M= medelvärde, SD= Standardavvikelse, n= antal patienter, Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
Tabell 12: Hälsorelaterad livskvalitet (K-BILD) 12 månader efter inklusion för sjukhus med minst 10 IPF-patienter
Sjukhus M SD n Lund 59,2 15,9 19 Norrköping 56,3 8,3 13 Linköping 56,3 12,0 21 KS Solna 55,8 11,4 73 Göteborg 48,0 10,0 18 Riket 55,0 12,7 191
M= medelvärde, SD= Standardavvikelse, n= antal patienter, Riket omfattar samtliga sjukhus inklusive sjukhus med mindre än 10 patienter.
Bland sjukhus med minst 10 patienter var den hälsorelaterade livskvaliteten i Lund i det övre spannet (57,3 vid inklusion och 59,2 efter 12 månader). Snittet för Göteborg var indikerade lägre poäng både vid inklusion (52,0) och efter 12 månader (48,0). Bland dessa var Göteborg också den som hade lägre medelpoäng efter 12 månader (-4 poäng).
Diskussion
Metoddiskussion
Även om litteratursökningen delvis följde en algoritm, så genomfördes inte en fullkomligt systematisk litteratursökning. Anledningen till detta var begränsad tid samt att studiens syfte var uppföljning av vården i Sverige och lutade sig därför på det aktuella vårdprogrammet för IPF. Statistiska analyser för att ta reda på signifikanta skillnader gjordes inte och inga
slutsatser kring skillnader mellan sjukhus kunde därför dras. Datamängden i registret på sjukhusnivå är dock fortfarande så begränsat att det skulle påverka sådana slutsatser. Dessutom var inte syftet med studien att jämföra sjukhus. Att endast redovisa resultat för sjukhus med minst 10 patienter kan ifrågasättas och en lägre gränsdragning (såsom 5 patienter) hade varit tillräckligt för att inte avslöja patienternas identiteter och samtidigt inkluderat fler sjukhus i resultatet. I detta fall valdes dock gränsen 10 eftersom aggregerad data var önskvärt.
Tid från symtom till diagnos översteg 10 år i 5,8 % av fallen (24 av 411 patienter) och var mer än 15 år i 2,2 % av fallen (9 av 411) enligt tillgängliga data i lungfibrosregistret. Det var svårt att bedöma vart gränsen för avvikande värden skulle dras. I en ny studie var tid från symtom till diagnos mer än 5 år för en fjärdedel av patienter med idiopatisk lungfibros samtidigt som symtom som sträckte sig 20 år tillbaka i tiden från diagnosdatum bedömdes som osannolikt (36). En gränsdragning på 10 år gjordes mot bakgrund av detta. Det blev dock en skillnad i resultatet om gränsdragningen gjordes vid 10 eller 15 år, men för gränserna 15 eller 20 år blev det ingen skillnad (mediantiden för riket blev då detsamma). I denna studie har endast tid från symtom till diagnosdatum redovisats och tidsintervallet har inte
specificerats i delar (se Figur 1, s. 13) och det är därmed är det inte möjligt att ta reda på i vilka led som diagnosfördröjning uppstår.
Lungfunktion vid behandlingsstart avgränsades till ±90 dagar från behandlingsstart. Eftersom de flesta lungfunktionsundersökningar rekommenderas göras med längre tidsintervall än 90
dagar enligt vårdprogrammet kunde förväntas att mycket data som hamnade utanför avgränsningen föll bort. Samtidigt skulle en mer liberal avgränsning öka risken att lungfunktionen skulle vara påverkad av behandling och inte reflektera lungfunktion vid behandlingsstart.
Den första spirometrin för den aktuelle patienten definierades av inklusionskriteriet, även om patienten i verkligheten hade genomfört flera spirometrier innan. Anledningen till att
beräkningen inte gjordes från diagnosdatum till första registrerade spirometrin är att vissa patienter fick sin diagnos långt innan registret startade och spirometrier för den perioden fanns således inte rapporterade i registret. Konsekvensen skulle bli att tidsintervallet mellan diagnos och första spirometrin skulle bli osannolikt lång. Dessutom har en del patienter fått sin diagnos efter spirometrin.
Tidsintervall mellan undersökningar redovisades i första hand med medelvärde och
standardavvikelse, men för HRCT och 6MWT var spridningen så pass stor att medianvärdet bedömdes ge en mer ”rättvis” bild och lades därför till i resultaten. Det ter sig att
dubbelregistrering har skett i flera fall eftersom det senaste HRCT-datumet upprepades i fler än en uppföljningsanteckning samt att samma datum rapporterades i diagnosgrundande registrering och i nästkommande uppföljningsanteckning. Detta är något som skulle kunna förtydligas för uppgiftslämnarna. I ett antal fall var samma datum för HRCT registrerat två gånger och i ytterligare ett antal fall var det bara en dag mellan HRCT-undersökningar. Eftersom detta förefaller osannolikt, granskades fallen närmare i lungfibrosregistret och korrigerades när stöd för dubbelregistrering fanns. I ett fall kunde man utifrån informationen i registret inte dra slutsatsen att dubbelregistrering skett och värdet lämnades oförändrat.
För variabeln K-BILD vid inklusion användes kriteriet ±6 månader eftersom detta används vid uppföljning av lungfibrosregistret i årsrapporterna. För att inte få ett för stort bortfall av data definierades också tidsperioder såsom ”efter 12 månader” med ett inklusionskriterie om ±2 månader. Beroende på hur restriktiv eller liberal man är påverkas utfallets kvalitet. Ökad restriktivitet bidrar till mer korrekta tidsintervall men begränsar mängden data, samtidigt som ökad liberalitet ger mer data men minskar relevansen. Det blir således en avvägning som måste göras i studien.
Vissa sjukhus hade flera extremvärden som bidrog till en snedfördelning som påverkade medelvärdet. Därför valdes resultatet av exempelvis tid från symtom till diagnos att sorteras efter mediantid istället för medelvärde.
Resultatdiskussion
Resultatet av litteratursökningen visade att lämpliga variabler för uppföljning av patienter med idiopatisk lungfibros var i överensstämmelse med rekommendationerna i
vårdprogrammet för IPF. Medelöverlevnaden för patienter med IPF uppskattas till 3–5 år, men det finns en påtaglig individuell variation. Hög ålder (>70 år) är en av flera ogynnsamma faktorer för överlevnaden (5). En genomgång av de 21 pågående IPF-register världen över visar att medelåldern för patienterna varierade mellan 67–71 år för 9 register (51).
Insjuknande sker mellan 55–75 års ålder. Den europeiska medelåldern vid diagnos var 65.2 ±11.6 år enligt en registerstudie som omfattade 525 patienter inkluderade mellan 2009–2016 (52). I denna studie framkommer att medianåldern vid diagnostik var 72 år i Sverige, vilket är högre än det internationella snittet. Det är också långt över den internationellt
rekommenderade åldersgränsen (65 år) för lungtransplantation, som är den enda botande behandlingen. Ålder över 65 vid transplantation är förenat med ökad risk för komplikationer och ökad risk för mortalitet. Det finns dock en internationell enighet om att ”fysiologisk ålder” bör väga tyngre och gränsen för transplantation kan på sikt närma sig 70 år (53). I Sverige transplanteras visserligen patienter upp till cirka 70 år, och några ännu äldre. Men eftersom resultatet och överlevnaden är påtagligt sämre hos denna grupp patienter är det eftersträvansvärt ställa diagnos så tidigt som möjligt (54).
Kunskapen om sjukdomen är begränsad och sjukdomens debutsymtom (torrhosta och andfåddhet) är ospecifika symtom vilka skulle kunna vara möjliga förklaringar till en hög medianålder vid diagnos (4). Det nya vårdprogrammet publicerades också 2019 samtidigt som data i registret är flera år äldre. Ökad tillgång till information skulle således kunna påverka medianåldern för patienter som inkluderas i IPF-registret i framtiden.
Resultatet indikerar att medianåldern vid diagnos varierade mellan sjukhus. De fyra sjukhus som hade högst medianålder vid diagnos har också de äldsta patienterna. En skillnad i geografisk spridning kunde till viss del anas. En högre medianålder föreföll i region
(Sahlgrenska Universitetssjukhuset och NÄL i Trollhättan) och lägst medianålder i region Norrbotten (Sunderby sjukhus) samt region Jämtland Härjedalen (Östersunds sjukhus), se figur 2. Det går inte att dra några slutsatser om huruvida vårdkvaliteten skiljer sig mellan sjukhus eller regioner baserat på denna observation, eftersom orsakerna bakom eventuella skillnader i medianålder vid diagnostik inte studerats. Däremot ger resultatet en bild av nuläget vilket kan väcka nya frågor och ge grund till nya frågeställningar till exempel finns det regionala skillnader i kompetens och väntetider? Är sjukdomens utbredning kopplat till geografiskt läge?
Flera studier har visat att det finns en fördröjning i diagnostiken av IPF (36, 38, 39). Det finns flera faktorer som bidrar till fördröjningen och inte minst svårigheten att ställa diagnosen (36). I en prospektiv kohortstudie med 129 patienter var en längre tid från symtom (andfåddhet) till specialistbedömning associerat med högre mortalitet oberoende av lungfunktion (FVC%), ålder, kön och sjukdomsgrad och mediantiden var 2,2 år (39). Tid från symtom till diagnos är således en viktig variabel för patienter med IPF. Mediantiden för tid från symtom till diagnos var 1,7 år (IQR 0,9–3,8) för hela riket (387 patienter), vilket är kortare jämfört med resultatet i en dansk studie där tid från symtom till diagnos var 2,1 år (IQR 0,9–5,0) (36). I den danska studien hade dock gränsen för avvikande värden bestämts till 20 år. Om samma gränsdragning hade gjorts för denna studie hade medianåldern för riket blivit 2,0 år (IQR 0,9–4,3) och
därmed stämt bättre överens med den danska studien, se bilaga II. Det finns samtidigt en del svårigheter med att tolka resultatet. Tidpunkt för symtomdebut i registret är baserat på anamnesen, dvs. läkaren har frågat patienten när symtomen debuterade och patienten har svarat. Det blir en subjektiv bedömning som dels hänger på patientens minne och tolkning av frågan, dels på hur läkaren ställt frågan och hur läkaren bedömt huruvida svaret är relevant för sjukdomen eller inte. En del sjukhus har så få som en eller två läkare som handlägger samtliga IPF-patienter. Läkarens approach och subjektiva bedömning kommer således att ha betydelse för rapporteringens utfall. En del patienter har uppgett att första symtom uppträdde för 45 och 36 år sedan. Det finns således avvikande värden som sannolikt är orimliga för att bedöma fördröjning i IPF-diagnostiken. Det går heller inte att utesluta att de första symtomen kan ha haft andra orsaker än lungfibros, då symtomen förekommer i samband med flertalet vanligare sjukdomar. Den längsta mediantiden var mer än tre gånger längre än den kortaste. Orsaken till variationen går inte att säga baserat på denna data, men variationen är så pass påtaglig att det är värt att studera vidare.
Vårdgarantin är lagstadgad och syftar till att ge vård i tid. Vårdgarantin anger inom vilka tidsgränser vårdinsatser ska erbjudas och från den 1 januari 2019 är den förstärkt gällande primärvården; En patient som söker vård ska erbjudas träffa läkare inom 3 dagar (tidigare 7 dagar). Patienten ska få träffa en specialistläkare inom 90 dagar och eventuell operation ska erbjudas inom 90 dagar. Myndigheten för vårdanalys (Vårdanalys) har på uppdrag av regeringen följt upp vårdgarantin och resultatet visar att måluppfyllelsen var 92%, 90 % respektive 89 % för primärvård, specialist och operation. Dock finns det en stor variation mellan landsting, 80–97%, 81–98% respektive 75–98% (55). I en perfekt värld skulle misstanke om IPF väckas redan vid första patientbesöket i primärvården. Förutsatt att
vårdgarantin uppfylls skulle detta betyda att patienten får träffa en specialist inom 7 +90 dagar från första kontakt med vården. Väl hos specialisten dröjer det sällan 90 dagar att få IPF-diagnos, enligt Hoyer et al. (36) var denna tid 0,1 ett år vilket motsvarar 37 dagar. En rimlig tid från symtom till diagnos vore således 134–187 dagar. I resultatet ses också en spridning där tid från symtom till diagnos understiger 1 år i flertalet fall vilket understödjer att tidigare diagnos är möjligt. Sammantaget finns det utrymme och god anledning att sträva efter att förkorta diagnosfördröjningen. Tidig diagnostik skulle innebära tidigare handläggning och behandling, tidigare inbromsning av sjukdomsprogressen och längre överlevnad.
Det finns en tendens hos vissa vårdgivare att avvakta med behandling vid stabil lungfunktion (57). Även en heterogenitet finns bland lungläkare om när och på vilken basis man initierar behandling. Enligt en enkätstudie som omfattade 169 amerikanska lungläkare framkom att det finns betydande variationer i hur man initierar IPF-behandling och lungläkarens egenskaper kunde ha en påverkan. Majoriteten av läkarna (4 av 5) övervägde starta behandling
omedelbart efter IPF diagnosen ställts, men 20% valde en ”vänta och se” -strategi (57). Samtidigt understryker senare studier vikten av tidig insättande behandling och bättre behandlingsresultat (56). Eftersom sjukdomsprogressen inte går att förutspå vid
diagnostillfället är det viktigt att komma ihåg att IPF onekligen är en progressiv sjukdom som kommer resultera i förlust av lungfunktion, vilket patienten bör informeras om.
I en jämförande studie mellan Finlands och Sveriges IPF-register visade det sig att nästan 70% av de svenska patienterna hade fått börja farmakologisk behandling under en 3 års uppföljning av patienter inkluderade mellan 2014-2016 jämfört med bara 30 % av de finska patienterna (49). Resultatet i denna studie visar att mediantiden från diagnos till behandling för samtliga sjukhus var 30 dagar (IQR 6–154) och 86,5 % av alla patienter hade påbörjat
farmakologisk behandling. Patienter som fått sin diagnos tidigare än 2014 har exkluderats. Detta innebär också att tillgång till båda farmakologiska behandlingsalternativen fanns för de rapporterade tidpunkterna. Det är väl känt att de båda farmakologiska läkemedlen som är indicerade för behandling mot IPF har en del biverkningar som i vissa fall leder till dosreducering, ändring eller avbrytande av behandling. Hänsyn till detta har inte tagits i denna studie och andelen patienter som ändrat/avbrutit sin behandling har inte studerats. Således kan resultatet ge en övertolkning av andel som behandlas. Två sjukhus stack ut men en mediantid som översteg 8 månader. Ett av sjukhusen hade en mediantid på 258 dagar (IQR 53–461) och samtidigt ett lägre FVC% vid behandlingsstart (60,3%) vilket är betydligt lägre än snittet (70,3%). Man kan fråga sig om man väntar för länge innan man sätter in
behandling? Viktigt att notera är att spridningen var stor, i vissa fall väldigt stor och både median och medelvärde skiljde sig mycket från de individuella extremvärdena, men om man resonerar att 75% av alla patienter på samtliga sjukhus fick påbörja farmakologisk behandling inom 154 dagar samtidigt som 50% av patienterna på ett sjukhus påbörjade behandling
tidigast efter 258 dagar eller senare från diagnostillfället, så indikerade det en stor skillnad trots individuella variationer. En tänkbar hypotes skulle kunna vara att en ”vänta och se”-strategi tillämpades i de två sjukhusen med utstickande värden. Dock kunde detta inte motiveras baserat på till exempel sänkt lungfunktion mätt i FVC% vid diagnostillfället för ett av sjukhusen. Å andra sidan skulle korta tider från diagnos till behandling kunna bero på att IPF varit en arbetsdiagnos en tid före behandlingsstart och att diagnosen IPF sattes i samband med beslut om behandling. En konsekvent strategi för behandlingsbeslut samt
patienthantering skulle kunna minska variationen (57). Något som skulle kunna utforskas vidare är lungläkarnas behandlingsapproach. Avsaknad av data eller bristande rapportering skulle kunna vara en annan förklaring till indicerade skillnader.
Andelen lungtransplanterade indikerade en kraftig variation mellan sjukhus. Ålder och hälsostatus är avgörande i fråga om transplantation. De sjukhus med hög andel
transplanterade, hade också minst antal patienter totalt, vilket automatiskt ledde till ett större utslag för varje nytt transplantationsfall. På nationell nivå hade 3,7% (22 patienter)
transplanterats mellan 2014/10–2019/9 dvs. ungefär 1 av 27 patienter. Samtliga sjukhus med fler än 27 patienter hade minst en patient som transplanterats, förutom ett sjukhus där ingen av de 38 patienterna transplanterats. Andelen transplanterade i Göteborg och KS Solna var dubbelt så många som Uppsala och Linköping trots att samtliga fyra sjukhus har relativt många patienter med IPF. Vad dessa eventuella skillnader beror på går inte att besvara men
det finns risk att man missat registrera datum för transplantation i lungfibrosregistret. Andelen män (73%) respektive kvinnor (27%) som hade genomgått transplantation reflekterade samma fördelning mellan män och kvinnor med IPF totalt enligt senaste siffror från årsrapporten (6).
Vad gäller lungfunktionsmätning och diffusionskapacitet vid behandlingsstart samt uppföljning, minskar antalet patienter påtagligt i uppföljningsdata. Några tänkbara
förklaringar till detta är att patienter som fått sin diagnos på senare tid inte hunnit genomgå uppföljningar samt att många mätvärden som hamnar utanför tidsintervallet faller bort. Det kan också bero på att man helt enkelt inte registrerat undersökningarna i lungfibrosregistret. I de fall som patienter försämras snabbt över tid, måste vårdgivaren väga in nyttan av
ytterligare undersökningar och i en del fall mår patienten så pass dåligt att hen inte klarar av att genomföra undersökningen.
Syftet med uppföljning och återkommande undersökningar hos den enskilde patienten är att bedöma sjukdomsprogress, upptäcka eventuella komorbiditeter och behandla dessa, ta ställning till att ändra eller avsluta behandling, ta ställning till syrgasbehandling, besluta om palliativ vård eller remittera för lungtransplantation. För de flesta undersökningar är den generella rekommendationen tätare uppföljning initialt var tredje månad och senare
regelbundet var sjätte månad. I praktiken måste bedömning göras från fall till fall. En patient med stabil sjukdomsaktivitet kräver inte lika tät uppföljning under den stabila perioden, medan en snabbare sjukdomsaktivitet kräver tätare uppföljning. Samtidigt kan upprepade undersökningar vara omotiverat hos en patient som är väldigt sjuk och terminalt skede i sin sjukdom eftersom undersökningen skapar lidande och tillför mindre eller ingen nytta. Den individuella situationen är således central och gör det svårt att på basis av skillnader i
tidsintervall dra slutsatser om vårdkvaliteten mellan sjukhusen. Resultatet ger dock en bild om hur det ser ut på olika sjukhus i praktiken och hur väl utfallen stämmer överens med
rekommendationerna i vårdprogrammet.
Enligt vårdprogrammet för IPF rekommenderas spirometriintervallen T2–1=3–6,T3–2=6 samt T4–3=6 i månader (5). Resultatet visar att medelvärdet för T2–1 per sjukhus överskred
rekommendationerna med 1–5 månader avseende den lägre gränsen för T2–1, men vad gäller den övre gränsen var det endast 3 sjukhus med minst 10 patienter som hade ett medelvärde över 6 månader. Majoriteten av patienterna i lungfibrosregistret har påbörjat farmakologisk