Examensarbete i Biomedicinsk Malmö högskola
laboratorievetenskap Hälsa och samhälle
15 HP 205 06 Malmö
Hälsa och samhälle
IDENTIFIERING AV 13
NYA
MJÖLKSYRA-BAKTERIER MED DHPLC
EXAMENSARBETE I BIOMEDICINSK
LABORATORIEVETENSKAP 15 HP
RUZICA LIVAJA
Handledare:
Alejandra Vàsquez, Tobias C. Olofsson
1
INDENTIFICATION OF 13
NEW LACTIC ACID
BACTERIA BY DHPLC
DEGREE PROJECT IN BIOMEDICAL
LABORATORY SCIENCE
RUZICA LIVAJA
Livaja, R. Identification of 13 new lactic acid bacteria by DHPLC. Degree
project, 15 Credit Points. Biomedical Laboratory Science, Malmö University:
Health and Society, Department of Biomedical Laboratory Science, 2011 Lactic acid bacteria belonging to genera Lactobacillus and Bifidobacterium has been recently discovered in bees and the honey they produce, and includes 13 new species [1]. Researchers are working to develop new rapid and more reliable detection methods to characterize these bacteria.
In this project we investigate the possibility of identifying these bacteria with a new method called denaturing high performance liquid chromatography, DHPLC. The method involves the separation of the PCR (polymerase chain reaction) amplified 16S rDNA fragments in the DHPLC [8].
For the identification of bacteria various variable regions of 16S rRNA gene was amplified, sequencing proved great genetic variability between these bacteria [1]. Separation is effected by means of ion-pair reverse-phase high pressure liquid chromatography (IP RP HPLC) with partial denaturation of the DNA molecule. Previous studies of the identification of marine bacteria by DHPLC resulted in optimal separation [9]. Identification of the following lactic acid bacteria was verified to some limited degree. Analysis of the DHPLC demonstrated profiles with distinguishable peaks that represented the separation at the species level, that only between two bacteria of the genus Lactobacillus.
Despite numerous adjustments of operating conditions such as existing column temperature and eluent buffer, did not result in separation of all 13 species. The analysis may have been influenced by a variety of malfunctions in the HPLC system and improper sample preparation. The method could possibly be improved if time was not a limitation.
Keywords: Bifidobacterium, DHPLC, Lactobacillus, lactic acid bacteria, PCR,
IDENTIFIERING AV 13 NYA
MJÖLKSYRABAKTERIER
MED DHPLC
EXAMENSARBETE I BIOMEDICINSK
LABORATORIEVETENSKAP 15 HP
RUZICA LIVAJA
Livaja, R. Identifiering av 13 nya mjölksyrabakterier med DHPLC.
Examensarbete i biomedicinsk laboratorievetenskap 15 högskolepoäng. Malmö
Högskola: hälsa och samhälle, Utbildningsområde Biomedicinsk laboratorievetenskap, 2011
Mjölksyrabakterier tillhörande släkten Lactobacillus och Bifidobacterium har nyligen upptäckts hos bin och i honungen de producerar och innefattar 13 nya arter[1]. Forskarna arbetar med att ta fram nya snabba och mer pålitliga identifierings metoder för att karakterisera dessa bakterier.
I detta projekt undersöktes möjligheten att identifiera dessa bakterier med en ny metod som heter denaturing high performance liquid chromatography (DHPLC). Metoden bygger på separation av PCR (polymerase chain reaction) amplifierade 16S rDNA fragment i DHPLC [8].
Vid identifiering av bakterier amplifierades olika variabla regioner från 16S rRNA genen, som påvisade efter sekvensering störst genetisk variation mellan dessa bakterier [1]. Separationen utfördes med ion-pair reverse-phase high presure liquid chromatoghaphy (IP RP HPLC) med delvis denaturering av DNA molekylen.
Tidigare studier av identifiering av marina bakterier med DHPLC resulterade i optimal separation [9]. Identifiering av följande mjölksyrabakterier kunde
verifieras till en viss grad. Analys i DHPLC visade profiler med urskiljbara toppar som utgjorde separation på artnivå, detta enbart mellan två bakterier tillhörande släktet Lactobacillus.
Trots olika justeringar av analys parametrar gällande kolonntemperatur och elueringsbuffert, erhölls inte separation mellan alla 13 arter. Analysen kan ha påverkats av en rad olika funktionsfel i HPLC systemet och felaktig beredning av prov. Metoden kunde eventuellt förbättrats om tiden inte varit en begränsning.
Nyckelord: Bifidobacterium, DHPLC, Lactobacillus, mjölksyrabakterier, PCR,
3
INNEHÅLLSFÖRTECKNING
ABSTRACT 1 SAMMANFATTNING 2 INNEHÅLLSFÖRTECKNING 3 INLEDNING 4 Syfte 5MATERIAL OCH METOD 6
Material 6
Metod 7
Odling av bakterier 7
Fysisk sönderdelning av celler 7
PCR 7
Amplifiering av 16S 7
Amplifiering av V1 och V2 regionen 7
Amplifiering av V3 regionen 8 DHPLC 8 RESULTAT 9 PCR 9 DHPLC 9 V3 regionen 9 V1 och V2 regionen 10 Blandning av bakteriearter, 16S 12
Blandning av bakteriearter, V1 och V2 region 13
DISSKUSSION 14
INLEDNING
Nyligen upptäckte en forskargrupp 131 nya bakteriearter hos bin och deras honung. Bakterierna ingår i den fenotypiska gruppen mjölksyrebakterier, Lactic acid bacteria (LAB) som är välkända inom livsmedelsektorn och härstammar från släktena Lactobacillus och Bifidobacterium[1]. Mjölksyrabakterier betraktas som nyttiga bakteriearter och används idag inom probiotika med bevisade positiva effekter för humanhälsan och hälsan hos honungsbin [2,3]. Dessa bakterier har även påvisats vara av stor betydelse för produktionen samt lagringen av bipollen och bibröd vid framställning av honung [4]. De nyupptäckta bakterier producerar antibakteriella komponenter som organiska syror, väteperoxid, diacetyl och benzoat och därmed påvisat antimikrobiella egenskaper mot olika humana patogener [1].
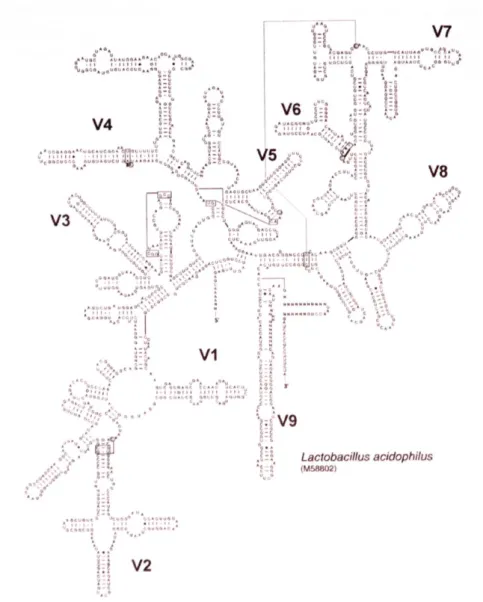
För identifiering av aktuella mjölksyrebakterier extraherades DNA från alla tretton bakterieprover innan PCR (polymerase chain reaction) amplifiering av 16S rRNA gener.16S rRNA genen som idag är det främsta redskapet för identifiering och utforskning av släktskapsförhållanden av bakterier [5,6]. Genen består både av variabla (V) och konserverade (U) regioner (fig.1) där variabla regioner utnyttjas för att lättare kunna separera närbesläktade bakteriearter. Efter
sekvensering av alla 13 bakterier kunde det konstateras att region 1, 2 och 3 i 16S rRNA innehåller signifikant baspar skillnad mellan dessa LAB vilket utnyttjades i PCR reaktionen med specifikt designade primers [1].
Detektering av PCR produkter sker med denaturing high-performance liquid chromatography (DHPLC). Dubbelsträngat DNA blir delvis denaturerat, där tillsatt GC svans till primers stabiliserar DNA molekylen till att inte bli enkelsträngat under ökad kolonntemperatur. Vilket gör det möjligt att urskilja genetiska skillnader i 16S rRNA mellan bakteriearter. DHPLC är en relativt ny analysteknik gällande bakterieanalys men som idag används i allt större
utsträckning för mutationsdetektering och för identifiering av 16S rRNA gener [7, 8].Seperationen av PCR fragment med DHPLC utförs med jonpar omvändfas vätskekromatografi (IP RP HPLC) Provet injiceras i flödessystemet till den mobila fasen bestående av trietylammoniumacetat (TEAA) och acetonitril (ACN). Positivt laddade ammoniumgrupper av TEAA joner bundna till den opolära stationära fasen binder den negativt laddade fosfat gruppen i den delvis denaturerade DNA molekylen. Ökning av ACN koncentrationen minskar interaktionen mellan TEAA/DNA och därmed sker en eluering av DNA
fragmenten [9]. DNA fragment med högre innehåll av A-T baspar denaturerar mer och därmed elueras snabbare än fragment med högre G-C innehåll [10].
DHPLC metoden är det känsligaste screening metod för detektion av
punktmutationer eller variationer i DNA [7, 11]. Analys med DHPLC har hög sensitivitet, en snabb analystid och har låg kostnad jämfört med andra detektions metoder. Utveckling av DHPLC metoden möjliggör en snabb och effektiv
identifiering av mjölksyrabakterier som sedan kan användas i vidare utveckling av probiotika.
1
5
I detta projekt undersöks möjligheten att identifiera dessa mjölksyrabakterier med DHPLC genom genetiska sekvens skillnader i 16S rRNA genen.
Figur 1. Sekundär struktur av 16S rRNA molekylen. Ur avhandling, Alejandra
V.M (2004) Systematics of Lactobacillus spp. of probiotic potential Lund: Media-Tryck.
Syfte
Syftet med detta projekt är att utveckla en DHPLC metod för att kunna identifiera dessa 13 mjölksyrabakterier.
MATERIAL OCH METOD
Material
Bakterieodling
I denna undersökning användes tretton rena bakteriekulturer bestående av Hon2, Hma2, Biut2, Bma5, Hma8, Fhon2, Hma11, Bin4, Fhon13, Hma3, Bin7, Bin2 och Bma6. Dessa bakterier härstammar från bin och deras honung [1]. Som buljong användes M.R.S. Broth från Oxoid (Hampshire, England). Till denna buljong tillsattes även 2 g fruktos och 0,1 g L-cysteine (patentansökan nr: 0701050-7, Sigma, USA) för optimal tillväxt av bakterier. Vid fysisk sönderdelning av bakterieceller användes glaskulor 106 µm (Sigma-Aldrich, St. Louise, USA), en vortex MS1 Minishaker (IKA Works, Wilmington, USA) och 0,2 ml Thermo-Strips (Abgene, Surrey, UK).
PCR
Reagenser som användes till PCR-mastermix var AmpliTaq Gold® 360 DNA Polymerase, AmpliTaq Gold ® 360 Buffer 10X, 25 mM Magnesium Chloride och 360 GC Enhancer samtliga (AB Applied Biosystems, Foster City, USA), 40 mM dNTP mix (Roche Mannheim, Germany ). 1 µl DNA från respektive
bakteriekultur användes som templat. PCR-analysen utfördes på PCR
Mastercykler (Hamburg, Germany). Primers som användes framgår av (Tabell 1.)
Annat material som användes var sterila 0,2 ml PCR Plates (ABgene® Thermo Fast, UK) med tillhörande lock (Ultra Clear Cap Strips) samt sterila pipettspetsar. Vid detektion av PCR produkter i agarosgelen användes SYBR Green I (Sigma-Aldrich, St Louise, USA). DNA molekylvikts markör VI (Boehringer mannheim, Germany).
Tabell 1. Primers med respektive nukleotidsekvens
Primer Sekvens FP6 5´-40 bp GC clamp -CCTACGGGAGGCAGCAG-3´ RP6 5´ -ATTACCGCGGCTGCTGG-3´ ENVI 5´-AGAGTTTGATIITGGCTCAG-3´* ENV2 5´-CGGITACCTTGTTACGACTT-3´* TGGE7 GC 5´- 40 bp GC clamp- CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG- 3´
* Förekomst av variabel nukleotid, I.
DHPLC
Analys av DNA fragment utfördes med YL9100 HPLC Systemet(L9101 Vacuum Degasser, YL9110 Quanternary Pump, YL9130 Column Compartment och
YL9160 PDA Detector från Young Lin Instrument, Korea). Typ av kolonn som användes var Helix DVB (Lake Forest, California, USA) som bygger på jon-par med omvänd fas vätskekromatografi (IP RP HPLC). Buffert sammansättningen bestod av (A) 0,1 M TEAA (triethylammoniumacetat), pH 7,0 och (B) 0,1 M TEAA, pH 7,0 med 25 % (v/v) acetonitrile. Injektionssprutan till HPLC systemet var en Microoliter™ Syringes, 702N, 25 µl (Hamilton, Bonaduz, Switzerland).
7
Metod
Odling av bakterier
Alla tretton bakteriekulturer odlades upp i M.R.S. buljong med 2 g fruktos, 0,1 g L-cysteine och 100 ml destillerat vatten i 37 ºC med 95 % luftfuktighet och 5 % CO2-halt. Odlingstiden 3-4 dygn. Innan bakterierna tillsattes i buljong för tillväxt,
autoklaverades buljongen för att undvika kontaminering av prover.
Fysisk söndeldelning av bakterieceller
Från odling tvättades bakterierna, där 500 µl per bakterikultur överfördes i eppendorfrör och tvättades två gånger med destillerat vatten, vid varje tvätt centrifugerades bakterierna i 13 000 x g i 10 minuter (Biofuge Pico Heraeus). För att utvinna bakterie-DNA utfördes fysisk sönderdelning av bakterieceller genom att tretton stycken 0,2 ml rör (8 rör/remsa) fylldes med 3-4 mm glaskulor (106 µm) och 100 µl destillerat vatten. Till varje rör tillsattes 50 µl av respektive bakterie kultur. Rören skakades i 45 minuter på en vortex med microtiter platta inställning (MS1 Minishaker). För att enbart erhålla DNA i supernatanten efter skakningen centrifugeras rören i 6 000 rpm i 2 minuter (VWR Galaxy Mini) och 1 µl av supernatanten användes i följande PCR-analyser.
PCR
Primers som användes för amplifiering av olika fragment av 16S rRNA
designades specifikt för önskade regioner utifrån DNA sekvens för varje enskild bakterie. Olika primerpar användes för att få en uppfattning om vilket fragment som gav störst baspar skillnad i den amplifierade regionen av 16S rRNA för att sedan åstadkomma separation artspecifikt i DHPLC. Primerkoncentrationen i stocklösningen var 100 µM/l och späddes till 10 µM/l med destillerat vatten.
Amplifiering av 16S
PCR-reaktionsmix blandades så att totalvolymen blev 49 µl per reaktion och prov. I ett autoklaverat rör tillsattes 5 µl 10x PCR reaktions buffert (100 mM Tris-HCl, 15 mM MgCl2, 500 mM KCL, pH 8,3), 1 µl av varje primer (ENV1 och ENV2), 1
µl dNTP Mix, 0,50 µl Taq DNA polymerase och 40,5 µl sterilt vatten. Allt blandades genom att vortexas. PCR-mixen tillbereddes på ett frysblock varefter även PCR-rören placerades på plattan, ett rör för varje prov. 49 µl av PCR-mixen pipetterades till varje rör därefter tillsattes 1 µl av tidigare erhållet DNA-templat till respektive rör. Som kontroll användes enbart PCR-mix, utan tillsatts av DNA. Amplifiering av 16S utfördes enligt följande PCR program, denaturering 96 ºC i 15 s, annealing 48 ºC i 30 s och elongering 72 ºC i 90 s. Detta upprepades i 30 cykler och avslutades med ett extra elongeringssteg på 72 ºC i 10 min.
Amplifiering av V1 och V2 regionen
PCR produkt av 16S användes vidare som templat för amplifiering av ett ca 340 baspar långt DNA fragment av V1 och V2 regionen utav 16S rRNA.
Tillvägagångsättet för framställning av PCR-mixen utfördes enligt samma beskrivning. Komponenterna i denna reaktionsmix bestod av 5 µl 10x PCR reaktions buffert, 3 µl 25 mM MgCl2, 5 µl GC Enhancer, 0,25 µl (1,25 U)
AmpliTaq® Gold polymerase, 1 µl dNTP Mix, 1 µl av varje primer (ENV1 och TGGE7 GC). PCR utfördes enligt följande program, ett prePCR steg med
denaturering 95 ºC i 10 min följt av denaturering 95 ºC i 1 min, annealing 56 ºC i 1 min och elongering 72 ºC i 3 min. Detta upprepades i 34 cykler och avslutades av ett extra elongeringssteg på 72 ºC i 10 min.
Amplifiering av V3 regionen
PCR amplifiering utfördes enligt tidigare beskrivning [9]. Med undantag av följande ändringar; annealing temperatur 56 ºC istället för 54 ºC, direkt
amplifiering av V3 regionen med rDNA som mall med primerpar (FP6 och RP6) utan tidigare amplifiering av 16S rRNA.
Gelelektofores
Agarosgel med 1,5 % agaros tillverkades genom att lösa upp agaros i 1x TB-buffert. Agaroslösningen värmdes i mikrovågsugn tills grumligheten försvann och kvar blev en klar vätska. Lösningen fick svalna till 55 ºC innan den hälldes på elektroforesvanna. Gelen fick stelna i 30 min innan den sattes ner i
elektroforeskaret . Proverna förberedes genom att 10 µl PCR produkt blandades med 5 µl SYBRgreen i ett 100 µl rör. Därefter ställdes rören mörkt i 15 min så SYBRgreen kunde binda in till DNA. Sedan tillsattes 3µl loading buffert och 15µl av varje prov laddades till brunnarna i gelen. Som negativ kontroll användes PCR produkt utan DNA tillsatts samt en molekylviktsstandard för detektion av
fragment storlek. Dessa prover förberedes på samma sätt.
Spänningen på aggregatet låg på 120 V, gelerna kördes i 30 min. Därefter fotograferades gelerna på ett UV-ljusbord.
DHPLC
Metoden baseras på PCR och HPLC tekniker [12,13] och bygger på bakteriernas fysiska egenskaper och hur deras amplifierade DNA beter sig i HPLC. Flera olika parametrar undersöktes för optimering av analysen, faktorer som kolonn
temperatur 63-72 ºC, buffert B gradienteluering 35-45 % samt olika PCR amplifierade fragment av 16S rRNA (V1, V2 och V3 regioner) testades för att åstadkomma idetifiering av tidigare nämnda bakterier. Proverna analyserades med IP RP HPLC med Helix DVB kolonn för DNA fragment analys. Buffert A
bestående av en vattenlösning med 0,1 M TEAA och buffert B en vattenlösning med 0,1 M TEAA och 25 % (v/v) ACN. Detektion på 260 nm. Analys resultat som erhållits var under rådande förhållanden; kolonn temperatur på 72 ºC,
eluerings buffert B gradient på 35 % i 2 min, 60 % i 6 min samt 60 % i ytterligare 7 min, flödeshastigheten 0,5 ml/min. Varje prov späddes 1:2 med sterilt vatten innan analys på DHPLC. Mellan varje prov sköljdes injektionsventilen med 1x 20 µl 100 % ACN följt av 3x 20 µl sterilt vatten.
I början på dettaprojekt utfördes analyser på alla tretton bakterier allteftersom en rad olika justeringar av analysparametrar utfördes. Detta resulterade i att tiden började rinna ut utan något erhållen resultat. På grund av tiden som en
begränsning utfördes resterande analyser endast av sex utvalda bakterier2, enbart dessa resultat presenteras i resultat delen.
2
9
RESULTAT
PCR och DHPLC optimering
V3 regionen
Inledande tester på DHPLC utav amplifierade V3 regionen med kolonn-
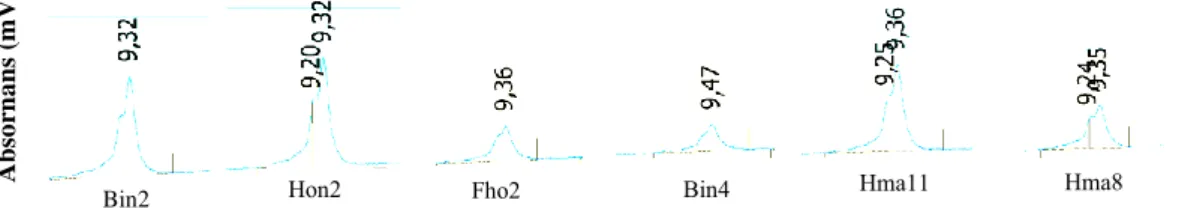
temeperatur på 63 ºC genererade tvetydiga toppar (opublicerade observationer). Därefter utrede vi kolonntemeperatur mellan 64- till 72 ºC. Den optimala temperaturen undersöktes genom att samma mängd (15 µl) av enskild PCR produkt analyserades enskilt samt i slumpmässig mix bestående av två bakterier i DHPLC. Sex mjölksyrabakterier analyserades, Hon2, Fhon2, Bin2, Hma11 och Hma8 alla tillhörande släktet Lactobacillus och bakterien Bin4 släktet
Bifidobacterium. Fig 2A visar 64 ºC kolonntemperatur med bristande förmåga att
karakteriesera dessa sex bakterie arter. Trots olika justeringar av elueringsbuffert kunde ingen ytterliggare förbättring av kromatogram selektivitet observeras.
Retentionstid (min)
Figur 2A. DHPLC analys av PCR amplifierade 16S rDNA fragment från V3
regionen. Kolonntemperatur 64 ºC. Provet bestod av 10 µL av PCR produkt spädd 1:2, där 15 µL analyserades på DHPLC.
Analyser med kolonntemperatur på 68 ºC uppvisad helt eller delvis avsaknad av kromatografiska toppar (fig. 2B). I DHPLC systemet spelar kolonntemperatur en avgörande roll för delvis denaturering av DNA molekyler. Detta möjliggör en identifiering samt separation av bakterier genom detektion av baspar skillnader i DNA.
Retentionstid (min)
Figur 2B. PCR amplifierade 16S rDNA fragment från V3 regionen för bakterien
Hma11. Kolonntemperatur 68 ºC. Provet bestod av 10 µL av PCR produkt spädd 1:2, där 15 µL analyserades på DHPLC.
Bin2 Hon2 Fho2 Bin4 Hma11 Hma8
Abso rn a n s (m V) Hma11 Abs orba ns ( m V)
Kolonntemperaturer som undersöktes, var kolonntemperatur med 72 ºC som uppvisade en klar förbättring över de andra genom högre upplösning av
kromatografiska toppar (fig. 2C). Denna temperatur användes i påföljande PCR och DHPLC analyser för region V1 och V2 av enskilda bakteriearter.
Retentionstid (min)
Figur 2C. DHPLC analys av PCR amplifierade 16S rDNA fragment från V3
regionen. Kolonntemperatur 72 ºC. Provet bestod av 10 µL av PCR produkt spädd 1:2, där 15 µL analyserades på DHPLC.
Kolonntemperatur på 72 ºC resulterade i en märkbar upplösning av
kromatografiska toppar för mjölksyrabakterier analyserade som ett enskilt prov i DHPLC. Däremot visar en jämförelse av fyra bakterier analyserade i en mix bestående av två bakterier tillhörande olika släkten (fig.3A) samt två bakterier från samma släkte (fig.3B) att ingen separation kunde åstadkommas.
Figur 3. DHPLC analys av PCR produkter från V3 regionen i en mix. (A)
bestående av Hma11 och Bin4 från släktet Lactobacillus och Bifidobacterium, (B) mjölksyrabakterier tillhörande enbart Lactobacillus släkte.
V1 och V2 regionen
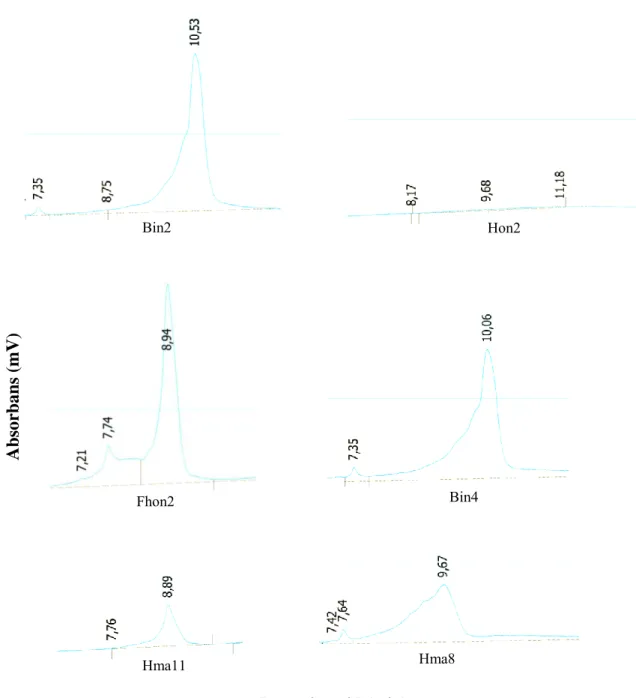
Amplifiering av V1 och V2 region uppvisar en högre grad av separation utav analyter. Avsaknad av kromatogram för Hon2 bakterien kan bero på att Dnaser brutit ned DNA i detta prov (fig. 4).
Bin2 Hon2 Fhon2 Bin4 Hma11
Hma8 Abso rb an s ( m V)
Hma11 & Bin4 Hma11 & Bin2
A B
) )
11
Retentionstid (min)
Figur 4. DHPLC analys av PCR amplifierade 16S rDNA fragment från V1 och
V2 regionen. Kromatogram topparna visar respektive sex mjölksyrabakterier analyserade på 72 ºC. Provet bestod av 10 µL av PCR produkt spädd 1:2, där 15 µL analyserades på DHPLC.
Tidigare analyser i DHPLC med en mix bestående av två bakteriearter med sitt ursprung från olika släkten likaså tillhörande samma släkte lede inte till seperation mellan de. Analysen utförd med bäst erhållna driftsförhållanden i DHPLC
systemet med kolonntemperatur på 72 ºC, elueringsbuffert B 35 % i 2 min, 60 % i 6 min samt 60 % i ytterligare 7 min, resulterade i en separation på artnivå mellan mjölksyrabakterie Fhon2 och Bin4 (fig. 5B).
Bin2 Hon2 Fhon2 Bin4 Hma11 Hma8 Abso rb an s (m V)
Retentionstid (min)
Figur 5. Kromatogramet representerar analys av PCR amplifierade 16S rDNA
fragment utav V1 och V2 regionen i en mix blandning bestående utav två
bakterier, (A) Bin2-Hon2, (B) Fhon2-Bin4. Analysen utförd på 64 ºC och 72 ºC. Provet bestod av 10 µL av PCR produkt för varje enskilt bakterie spädd 1:2, där 20 µL analyserades på DHPLC.
Det visar också tydliga skillnader i retentionstid av enskild analyserade arter (fig. 4), vilket bekräftar att det är samma bakterier och ger en relativ karakterisering av arterna. A 64ºC A B 72ºC B Abs orba ns ( m V) Bin2-Hon2 Fhon2-Bin4 Bin2-Hon2 Fhon2-Bin4
13
DISKUSSION
Försöket med att identifiera de 13 nyupptäckta mjölksyrabakterier med DHPLC genom sekvens skillnader i 16S rRNA kunde ej uppnås. Projektet fick avgränsas till 6 mjölksyrabakterier då analys utförandet stöte på motgång i HPLC systemet och tiden började rinna ut utan några erhållna resultat. Vidare i projektet kan vi ändå presentera en metod i DHPLC som uppvisar potential att identifiera dessa mjölksyrabakterier.
För att påvisa olika PCR amplifierade fragment av 16S rRNA utfördes olika ändringar i DHPLC metoden för att undersöka samt åstadkomma bästa resultat för identifiering av mjölksyrebakterier. De här bakterierna valdes ut för analys då sekvensering visat en betydande skilland i baspar i de utvalda regioner.
DHPLC analys av PCR produkter utav sex olika bakterier amplifierade från V3 regionen i 16S rRNA genen med kolonntemepretur på 64 ºC respektive 72 ºC lede till att analyser utförda på 72 ºC resulterade i bättre upplösning. Att uppnå en baslinje separation skall upplösningen vara 1,5 vilket är ett mål i alla HPLC metoder för alla slag av analyter [13]. I DHPLC har kolonntemperatur en avgörande betydelse för separation av bakterie arter. En anledning till
kromatografiska toppar inte uppvisade en högre upplösning kan vara att baspar skillnaden mellan bakterier i region V3 ändå inte var tillräckligt stor för att erhålla en separation i DHPLC.
Utifrån resultatet från respektive kromatogram förväntades inga dubbeltoppar då man efter gelelektrofores konstaterat att ingen kontaminering av prover skett. Även om gelelektrofores talar för att ingen kontaminerg av prover konstaterats kan man inte utesluta med säkerhet att det inte förekommit en kontaminering av de olika prover. Prover analyserade på 64 ºC uppvisade mer utmärkande
dubbeltoppar gentemot analysen utförd på 72 ºC som inte indikerade lika tydliga tecken på dubbeltopp. Vilket kan förklaras med att den delvis denaturerade DNA molekylen vid högre temperatur denaturerar mer och på så sätt erhålls detektion av större antal baspar skillnader i DHPLC och därmed bättre separation mellan bakterier, detta i enlighet med tidigare studier på andra bakterie kulturer [9]. Samma PCR fragment bestående av 2 bakterier i en blandning har trots olika justeringar i temperatur samt längre elueringstid inte bistått att åstadkomma en seperation mellan bakterierna. Detta bekräftar att den genetiska variations skillnaden i denna region är minimal för att erhålla separation i DHPLC. Ett återkommande problem var ostabiliteten hos baslinjen, vilken exponerades i form av en ojämn hackig linje tillsammans med högt motståndstryck över kolonn, som kan ha inverkat på resultatet. Detta kan ha orsakats av luftbubblor i den mobila fasen eller att kristaller utav salter bildads vid fel hantering av kolonnen alternativt förekomst av andra föroreningar på kolonnen. Som ett första åtgärd vid högt tryck skall förkolonnen bytas, vilket i detta fall saknades helt. Därmed innan vidare analys på DHPLC utfördes rengöring av kolonn (enligt Varian
föreskrifter). Trycket förblev ostabil likaså den ojämna baslinjen. Därmed
utfördes rengöring ofta för att på så sätt hålla trycket under kontroll. Oförklarliga händelser som hände under analysens gång där kromatogram plötsligt försvann och hela HPLC systemet stannade upp, kan jag tyvärr inte förklara.
För att få ett renare PCR produkt extraherades DNA:t på nytt från gående bakteriekultur. Amplifiering av hela 16S rRNA utfördes för att sedan användas som mall för vidare amplifiering av 340-bp DNA fragment av V1 och V2 regioner av 16S rRNA. DNA fragmentet från V1 och V2 regionen består av ca 340 bp jämfört med V3 regionen som var ca 240 bp långt. Därutav en större baspar skillnad i de regioner och bättre separation i DHPLC analysen.
Det har påvisats att den största genetiska skillnaden i 16S rRNA finns i region V1-V2 mellan dessa 6 bakteriearter [1]. DHPLC resultat visar en klar förbättring av separation mellan dessa bakterier amplifierade från V1 och V2 regionen.
Bakteriearten tillhörande Lactobacillus (Fhon2) och Bifidobakterium (Bin4) släktet analyserade med DHPLC, kolonntemperatur på 72 ºC genererade en separation på artnivå. Utifrån retentionstider för respektive bakterie analyserat enskilt och i mix bekräftar en separation på artnivå. Upplösningen är inte optimal. En betydelsefull åtgärd för det skulle vara ett problemfritt HPLC system. Vidare kan man konstatera också att denna region är användbar för identifiering av bakterier på släkt- och på artnivå.
Analytens färd genom kolonnen påverkas både av kemiska och fysikaliska interaktioner med stationärfasen. Beroende på analytens egenskaper, den stationära fasens sammansättning och vilken typ av mobilfas som används bestämmer i vilken grad analyten retarderas. Då detektion av PCR produkterna gav dubbeltoppar i DHPLC gjordes försök med att variera temperaturen i
kolonnen, detta utan förbättrad resultat. Även en ökad koncentration av eluerings buffert testades. Detta gav inte heller ett bättre resultat. Inför framtida analyser rekomenderas en komplett ekvilibrering av systemet.
För att åstadkomma en separation i DHPLC är det många faktorer som spelar en av avgörande roll och det krävs tid för att utveckla en metod som åstadkommer separationen mellan analyterna, vilken i detta projekt var begränsad.
15
REFERENSER
1. Olofsson T C, Vásquez, A (2008) Detection and Identification of a Novel Latic Acid Bacterial Flora Within the Honey Stomach of the Honeybee Apis mellifera, Curr Microbiology, 57, 356-363
2. Ouwehand AC, Salminen S, Isolauri E (2002) Probiotics: an overview of beneficial effects. Antonie van Leeuwenhoek 82, 279-289
3. Forsgren E, Olofsson T C, Vásquez A, Fries I (2009) Novel lactic acid bacteria inhibiting Paenibacillus larvea in honey bee larvae, Apidologie, 41, 99-108
4. Vásquz A, Olofsson T C (2009) The lactic acid bacteria involved in the production of bee pollen and bee bread, Journal of Apicultural Research
and Bee World, 48(3), 189-195
5. Vásquez Moreno, A (2004) Systematics of Lactobacillus spp. of probiotic
potential, Lund: Media-Tryck
6. Chakravorty S, Helb D,Burday M, Connell N, Alland D (2007) A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of
pathogenic bacteria. J Microbiol Methods, 69(2), 330-339 7. Xiao W, Oefner P J (2001) Denaturing High-Performance Liquid
Chromatography: A Review, Human Mutation 17,439.474
8. Yu B, Sawyer N A, Chiu C, Oefner P J, Underhill P A (2006) DNA mutation detection using denaturing high-performance liquid chromatography (DHPLC), Human Genetics, 7.10.1-7.10.14
9. Barlaan E A, Sugimori M, Furukawa S, Tekeuchi K (2005) Profiling and monitoring of microbial populations by denaturing high-performance liquid chromatography, Journal of Microbiological Methods, 61, 399-412
10. Belda E, Sentandreu V, Silva F J (2004) Identification and separation of PCR products based on their GC content by denaturing high-performance liquid chromatography, Journal of Chromatography B,263-268
11. Oefner P J, Huber C G (2002) A decade of high-resolution liquid
chromatography of nucleic acids on styrene-divinylbenzene copolymers,
Journal of Chromatography B, 782, 27-55
12. Wilson K, Walker J (2005) Principles and techniques of biochemistry and
13. Dong M W (2006) Modern HPLC for practicing scientists, USA: Wiley-Interscience.