Effekter av inkuberingstemperatur
på kroppsform hos juvenil atlantlax
(Salmo salar L.)
Effects of incubation temperature on body shape in juvenile Atlantic salmon
(Salmo salar L.)
Oscar Adolfsson
Fakulteten för hälsa, natur- och teknikvetenskap Biologi
Grundnivå 15 hp
Handledare: Larry Greenberg Examinator: Eva Bergman 2018-01-30
Abstract
Rising temperatures, because of climate change, will have major consequences for the world's fish
populations, including the Atlantic salmon Salmo salar L. The greatest temperature changes are expected to occur during winter, which will affect S. salar since the eggs are developing during this time of year. Several studies have shown that elevated temperatures during embryogenesis cause morphological changes, in S. Salar, that are shown in later life stages. Some of these studies indicate that eggs incubated at high temperatures should generate parr with deeper bodies. To investigate whether high temperatures during the egg stage cause changes in body shape, parr from normal and high temperature incubated eggs, referred to as as “cold” and “warm” fish, respectively, were examined. A box-truss of euclidean distances between 10 landmarks on the fish body and a discriminant function analysis (DFA) was used to determine which of the distances best discriminated between the two groups. The test showed a significant
discrimination between cold and warm parr regarding body shape where cold parr had greater heads and warm parr were deeper over the tail region and showed greater distances between the pelvic fin and the front attachment of the anal fin. 67,3 % of all parr where correctly classified by the test. These results support those notions that indicates that the incubation temperature is important for the morphological development of S. salar although it does not support the hypothesis.
Sammanfattning
Stigande temperaturer, till följd av klimatförändringar kommer att få stora konsekvenser för jordens fiskpopulationer, däribland atlantlaxen Salmo. Salar L. Störst temperaturförändringar väntas ske vintertid, vilket kommer att påverka S. Salar som övervintrar sin rom. Flera studier har visat att förhöjda temperaturer under embryogenesen ger upphov till morfologiska förändringar hos S. Salar under senare livsstadier. Några studier pekar mot att högtemperaturinkuberad rom torde ge upphov till parr med djupare kroppsform. För att undersöka om höga temperaturer under romstadiet ger upphov till förändringar beträffande kroppsform undersöktes parr (kalla resp. varma) från normal- respektive högtemperaturinkuberad rom. Med hjälp av ett rutnät / box-truss mättes avstånd mellan 10 landmärken på fiskkroppen och en discriminant function analysis DFA användes för att avgöra vilket av avstånden som bäst diskriminerade mellan de båda
grupperna. Testet visade en signifikant diskriminering mellan kalla och varma parr beträffande kroppsform där kalla parr hade större huvudmått och varma parr hade djupare mått över stjärtspolen och längre mått mellan analfenans främre infästning och bukfenan. 67,3 % av all parr förutspåddes tillhöra rätt grupp. Dessa resultat är i linje med den litteratur som anger att inkuberingstemperaturen har betydelse för den
Inledning
De temperaturförändringar som är att vänta under det pågående seklet (IPCC 2013) kommer att få stora konsekvenser för jordens fiskpopulationer (Hauer et al., 1997, Xenopoulos et al., 2005, Hari et al. 2006). En av anledningarna är att fiskar är poikiloterma organismer (Qualls & Andrews 1999, Andrews 2008, Finstad et al. 2012). Fiskar påverkas av vattentemperaturen redan från romstadiet (Björnevik et al. 2003, Finstad et al. 2012) och under hela livet. Till exempel påskyndar högre temperaturer, inom den gräns för vilken en art tål, embryots tillväxt och utveckling (Peterson et al. 1977, Stickland et al. 1988, Usher et al. 1994, Nathanailides et al. 1995). Därtill påverkar vattentemperaturen under embryogenesen andelen lyckade kläckningar, energiomsättningen i äggulan (Mueller et al. 2015), liksom fiskarnas morfologiska utveckling (Johnston et al. 1995, Galloway et al. 1998 Björnevik et al.2003, Fraser et al. 2015).
Atlantlaxen Salmo salar L. påträffas i de subarktiska delarna av Nordatlanten och är spridd över åtminstone 2600 vattendrag (Aaset al. 2011 Solem et al. 2011). Det stora utbredningsområdet och de varierande miljöerna till trots, följer fortplantningen i allt väsentligt samma mönster överallt. Salmo. salar leker under hösten i strömmande vattendrag (Jonsson et al. 2005), de samma som de där de en gång föddes (Riddel et al. 1981, Aas et al. 2011), varefter rommen utvecklas, nedgrävd i lekgruset och kläcks på våren alternativt tidigt under sommaren (Jonsson et al. 2005). De globala temperaturförändringar som är att vänta, kommer att vara som störst i de norra delarna av norra halvklotet (IPCC 2013), med en förväntad ökning omkring 6 °C vintertid och 4 °C sommartid (Sveriges metereologiska och hydrologiska institut, SMHI). Således lär det vara under S. salars romstadie som framtida vattentemperaturer kommer att skilja sig som mest från dagens nivåer (Jonsson et al. 2005, Elliot & Elliot 2010).
Fenotypisk plasticitet innebär att en organism med en särskild genotyp kan uppvisa olika fenotyper beroende på yttre förhållanden (Thompson 1991). Skillnader inom en art, som svar på en föränderlig miljö kan således ge upphov till en variation beträffande morfologiska egenskaper. Den variationen gör
organismen bättre anpassad till miljöförändringar (Kinnison & Hendry, 2004).
Laxfiskar (Salmonidae) visar
överlag upp en bred plasticitet beträffande kroppsform (Currens et al., 1989; Beacham, 1990, VonCrammon-Taubdel et al. 2005). Även om S. salars livscykelmönster ter sig likadant i stora drag världen över, uppvisar arten anpassningar till den lokala miljön. Däribland syns tämligen distinkta, bland annat
morfologiska, skillnader mellan populationer (Solem, et al. 2006). Dessa skillnader upprätthålls genom fiskarnas starka homingbeteende (Beacham & Murray, 1987; Quinn, 2005 Aas et al. 2011). När individer från populationer, som normalt växer upp geografiskt åtskilda från varandra, låtits växa upp i samma miljö har de dock tenderat att likna varandra i större utsträckning. (Von Cramon-Taubdel et al. 2005, Drinnan et al. 2012). Samtidigt har morfologisk konvergens kunnat påvisas när S. salar av olika ursprung har odlats i liknande miljöer (Fleming et al., 1994; Hedenskog et al. 1997). Sådana resultat understryker miljöns betydelse, för vilket utseende laxen ska komma att få (Von Cramon-Taubdel et al. 2005).
En mångårig studie i älven Imsa, Norge, visade att juvenila S. salar hade en snabbare tillväxttakt och var yngre när de migrerade ut i havet, efter år då vattentemperaturen varit relativt varm under vintern än de år
då vattnet varit kallare under motsvarande period. Skillnaden mellan ålderskullarna var oberoende av vattentemperaturen under efterföljande sommar (Jonsson et al. 2005). Det har dessutom visat sig att rom från S. salar som inkuberas vid högre temperaturer ger upphov till parr med högre konditionsfaktor (enligt Fulton´s condition factor) än den parr, som härrör från lågtemperatur-inkuberad rom (Bjørnevik et al. 2003). Förhöjd inkuberingstemperatur har också kunnat kopplas till missbildningar på ryggkotor (Ørnsrud et al. 2004, Ytterborg et al. 2010) och ett stort antal missbildningar på ryggkotor är i sin tur kopplat till högre konditionsfaktor (Hansen et al. 2010). I en studie från Institute of Marine research i Trondheim, Norge, konstaterades att en förhöjd inkuberingstemperatur ger upphov till parr med färre antal ryggkotor (Fraser et al. 2015). Detta resultat är i linje med ”Jordans rule”, vilken stipulerar att antalet ryggkotor i allmänhet är större bland arter och populationer inom en art, som lever på högre breddgrader som en följd av lägre vattentemperatur (Jordan, D.S. 1892). Ett större antal ryggkotor har också kunnat kopplas till en fiskkropp av mer avlång karaktär medan ett mindre antal ryggkotor är kopplat till en djupare kropp (McDowall 2008). Även om de exakta bakomliggande orsakerna till temperaturrelaterade deformationer på ryggkotor inte har klargjorts är det känt att osteoblaster är känsliga för ökade temperaturer (Ytterborg et al. 2010).
Dessa resultat i enlighet med andra nämnda studier väcker frågor kring hur temperaturförändringar kan komma att påverka morfologiska egenskaper hos S. salar och vilka konsekvenser det kan komma att få för artens ekologi. Med pågående klimatförändringar, som från nu och för en oviss tid framöver kommer att resultera i stora miljömässiga omställningar (IPCC 2013), aktualiseras frågorna kring vilka effekter
temperaturökningarna kan komma att få för organismers morfologiska utveckling och vilka effekter det kan få för respektive arts fortlevnad. Målet med denna studie är att utreda huruvida olika
inkuberingstemperaturer genererar skillnader beträffande kroppsform hos parr från S. salar. De studier som visat att muskeltillväxten hos flera olika fiskarter (Johnston et al., 1995, Galloway et al., 1998, Galloway et al., 1999), däribland S. salar (Usher et al., 1994; Johnston & McLay, 1997) påverkas av temperaturen innan kläckning samt de studier vilka på annat sätt visat miljöns betydelse för S. salars kroppsform (Jonsson et al. 2005, on Cramon-Taubdel et al. 2005, Drinnan et al. 2012), pekar mot att inkuberingstemperaturen har betydelse för S. salars form.
Den erhållna hypotesen är därför att rom som inkuberats vid olika temperaturer kommer att generera populationer som signifikant skiljer sig från varandra beträffande kroppsform. Med bakgrund av Jordans rule, resultaten från Bjørnevik et al. (2003), Hansen et al. (2010) och Fraser et al. (2015) torde
högtemperaturinkuberad rom ge upphov till parr med djupare kroppsform och högre konditionsfaktor än rom inkuberad vid normala (kalla) temperaturer.
Material och metoder
Till experimentet användes parr av Vänerlax från den stam som historiskt har nyttjat Gullspångsälven (58°59′0″ N, 14°7′0″ E), som lekområde. Fisken odlades på Gammelkroppa fiskkläckeri. Totalt 12 vuxna honor och 12 vuxna hanar delades in i 6 olika grupper med 2 honor och 2 hanar i varje grupp. Fiskarna klämdes på rom respektive mjölke, varpå rom från de båda honorna befruktades med mjölke från hanarna i samma grupp. Varje grupp utsattes för två temperaturbehandlingar under inkubering (6 grupper x 2
inkuberingstemperaturer). 6 grupper kom således att inkuberas med vatten från en intilliggande sjö och är nedan omnämnda som ”kalla” fiskar. Resterande 6 grupper, med samma föräldrar (2 hanar och 2 honor var), inkuberades i samma vatten, där temperaturen höjdes med ~4 °C från den naturliga vattentemperaturen under perioden 1 december 2015 till 15 april 2016 (Fig. 1). På hösten 2016 sattes PIT-tags i bukhålan på alla fiskar för att kunna skilja individerna åt. I tidigare studier har det visat sig att märkning med PIT-tag inte påverkar fisken (Newby et. al, 2007). Från och med 15 april 2016 levde alla fiskar under samma förhållanden med naturligt tempererat vatten på kläckeriet.
Fiskarna transporterades till Karlstads universitets akvarieanläggning i mars 2017. Där förvarades de i två 7m långa, 6 m³ stora strömakvarier i syfte att erbjuda en så naturlig miljö som möjligt. Akvarierna var uppdelade i tre sektioner. Akvarierna fylldes med filtrerat vatten varefter 25 salttabletter (14 gram) och 100 gram NaHCO3
tillsattes för att balansera pH-värdet. Detta gjordes 24 timmar före fiskarna sattes ut i vattnet.
Vattentemperaturen höjdes långsamt från 7 °C till 13 °C och hölls därefter konstant vid samma temperatur. Vattnet hölls cirkulerande med hjälp av två pumpar (6 L/sekund) per akvarium. Alla fiskar matades med pellets.Figur 1. Vattentemperaturen under inkuberingstiden 12-1-15 t.om. 4-5-15 för kontrollgrupp Kall och gruppen Varm (Leksell 2017)
0 00 , 00 1 , 00 , 2 , 3 00 , 00 4 5 , 00 , 00 6 00 7 , 8 , 00 , 00 9 varm kall
Datainsamling
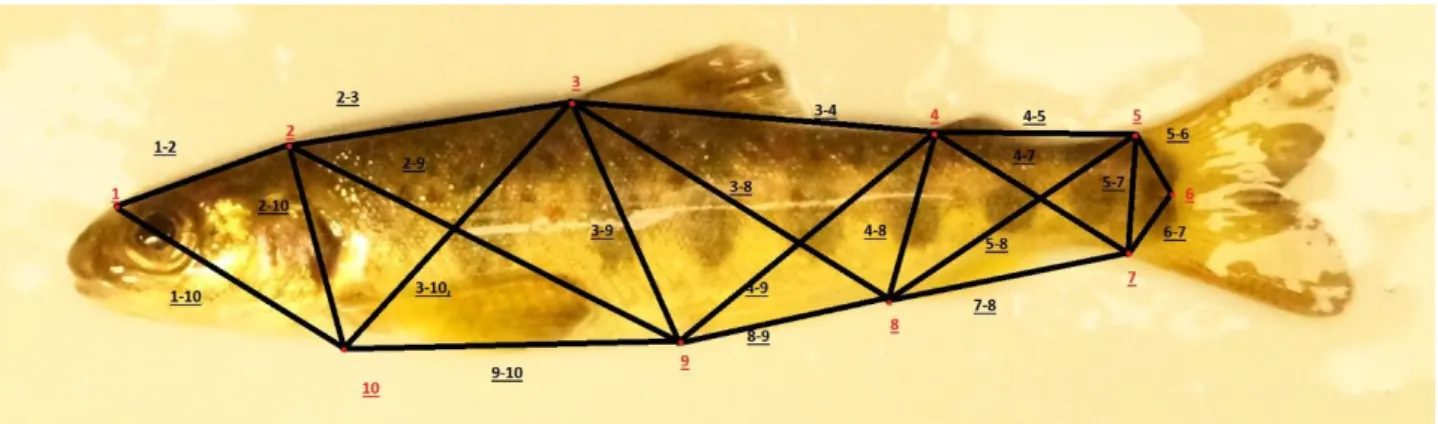
Parr sövdes med MS 222, lades på ett vitt fat och fotograferades en och en med en Canon XA10. Kameran var fäst på ett stativ och alla bilder togs med samma inställningar avseende inzoomning, för att säkerställa att alla bilder motsvarade samma skala. Detta gjordes i juni 2017. Med hjälp av mjukvaran tpsDig2w32 (version 2.30. Rohlf 2017) digitaliserades 10 landmärken (2D-koordinater) på varje parr-bild varpå avståndet mättes mellan intilliggande landmärken (Figur 2). Avstånden mellan landmärkena bildar ett rutnät / truss (Strauss & Bockstein 1982), vilket täcker stora delar av fisken i flera etapper. På så vis beräknas avstånd över stora delar av fisken, som beskriver dess form. Det är ett tillvägagångssätt som har använts vid flera
liknande studier (Von Cramon-Taubdel et al. 2005, Drinnan et al. 2012). Brukligt är att ett av landmärkena utgörs av fiskens nosspets (Strauss & Bockstein 1982, Von Cramon-Taubdel et al. 2005, Drinnan et al. 2012). Eftersom en stor andel av den parr som fotograferats hade munnen öppen i någon mån sattes motsvarande landmärke 1 strax ovanför ögat. För att säkerställa att landmärke 1 sattes på motsvarande position på all parr drogs en rät linje från landmärke 10 vilken tangerade ögats mittpunkt och vidare ut till skallens ovansida (Fig. 3). Landmärke 2 (bakre delen av neurokranium) och 10 (nedanför bröstfenans infästning) definierades genom att dra en rät linje, från dorsal till ventral sida, som tangerade bröstfenans infästning samt den övre lätt tillspetsade änden på gällocket (Figur 3). Även längden jämfördes mellan grupperna. Bilder på parr i en position där kroppen var böjd valdes bort eftersom måtten på en sådan individ skulle påverka resultatet i allt för stor utsträckning. Totalt användes 101 bilder med 48 kalla och 53 varma parr
Figur 2. 10 Landmärken mellan vilka 20 avstånd har mätts upp:2. Ovanför ögat - Dorsala bakre delen av neurokranium (vid nackens första fjäll), 1-10. Ovanför ögat – Nedanför bröstfenans infästning, 2-3.Bakre delen av neurokranium - Ryggfenans främre infästning 2-9. Bakre delen av neurokranium – Bukfenans infästning, 2-10 Bakre delen av neurokranium – Nedanför Bröstfenans infästning, 3-4 Ryggfenans främre infästning- Fettfenans främre infästning, 3-8 Ryggfenans främre infästning - Analfenans främre infästning, 3-9 Ryggfenans främre infästning – Bukfenans infästning, 3-10 Ryggfenans främre infästning – Nedanför bröstfenans infästning, 5 Fettfenans främre infästning - Stjärtfenans dorsala infästning,
4-7 Fettfenans främre infästning - Stjärtfenans ventrala infästning, 4-8 Fettfenans främre infästning - Analfenans främre infästning, 4-9 Fettfenans
främre infästning - Bukfenans infästning, 5-6 Stjärtfenans dorsala infästning - Stjärtfenans laterala infästning (synlig som övergång mellan sidolinjen och stjärtfenans mellersta fenstråle), 5-7 Stjärtfenans dorsala infästning - Stjärtfenans ventrala infästning, 5-8 Stjärtfenans dorsala infästning - Analfenans främre infästning, 6-7 Stjärtfenans laterala infästning - Stjärtfenans ventrala infästning, 7-8 Stjärtfenans ventrala infästning - Analfenans främre infästning, 8-9 Analfenans främre infästning - Bukfenans infästning, 9-10 Bukfenans infästning - Nedanför Bröstfenans infästning.
Figur 3. Linje 1-10 och 2-10 användes för att definiera landmärke 1., 2. och 10.
Statistisk analys
Eftersom varje avstånd mellan två intilliggande landmärken beskriver storleken för respektive parr likaväl som formen, var det tvunget att korrigeras. Det gjordes genom att dividera varje avståndsvariabel med det geometriska medelvärdet för alla avståndsvariabler på den specifika individen (Jungers et al. 1995). Därefter kontrollerades värdena för att se om de följde en normaldistribution med Kolmogorov-Smirnov test.
Eftersom inte alla värden uppvisade en normalfördelning (P>0,05) transformerades värdena med log10. För att analysera genom vilka avstånd de båda grupperna varma och kalla främst skiljer sig åt tillämpades discriminant function analysis (DFA) där avståndsvariablerna infördes stegvis. Även längden LF (mm), vikten (gram) och konditionsfaktorn K (K = 105W / L³, där W = massa och LF = Fork length / avstånd från nosspets till stjärtfenans mellersta fenstråle) jämfördes mellan grupperna. Det gjordes med MANOVA (p = 0,05). IBM SPSS Statistics användes för alla statistiska analyser.
Resultat
MANOVA visade inga signifikanta skillnader beträffande vare sig längd, vikt eller konditionsfaktor mellan parr från de båda behandlingarna. DFA på de 20 avståndsvariablerna visade en signifikant diskriminering mellan kalla och varma parr beträffande kroppsform (Wilk's Lambda, df = 3, P <0,001, Fig 4), främst beroende av tre variabler. Cirka 64,6 % av kalla parr och 69,8 % av varma parr antogs tillhöra den grupp de faktiskt tillhörde. Det ger en korrekt klassificering av totalt 67,3 % (Tabell 1). De tre avståndsvariablerna, som bäst separerade de båda grupperna åt var 1–10, 5–6 och 8–9. Kalla parr hade ett större huvudmått 1– 10 medan Varma parr hade ett djupare mått över stjärtspolen 5–6 och längre underkropp 8–9 (Figur 5).
Tabell 1. Diskriminering mellan respektive grupp kalla / varma utifrån de olika avståndsvariablerna. Testet jämför varje individs avståndsvariabler
med övriga individer inom grupperna. Därefter klassificerar testet individen som kall eller varm beroende på om den lenderar att likna kalla eller varma parr mest (förmodad behandling). Ex: av totalt 48 kalla parr klassificerade testet att 31 st. som kalla parr. Testet klassificerade 17 av dessa 48 som varma. Det ger ett korrekt antagande i 64.9% av kalla parr och totalt 67,9 % av alla parr.
Faktisk behandling Förmodad behandling Total Kalla Varma Kalla 31 17 48 Varma 16 37 53 Kalla 64,9 % 35,4 % 100 % Varma 30,2 % 69,8 % 100 % .
Figur 4. Medel discriminant scores för kalla resp. varma parr med 50 % av värdena inom kvartilavståndet och resterande 50 % inom whiskers. En
utliggare angiven under boxplott för varma parr. Varje enskild poäng/score är ett index för en individ och ett mått på hur väl den individen skiljer sig från övriga individer. Det totala värdet av alla discriminant scores (varma och kalla parr) är lika med noll. Ju längre från noll medianvärdet för en grupp ligger, desto mer skiljer sig gruppen från det genomsnittliga utseendet. En stor variation av discriminant scores inom gruppen indikerar en stor utseendevariation inom gruppen.
Figur 5. Två representativa individer för de båda behandlingarna Det röda strecket på den kalla fisken visar avståndsvariabel 1-10, vilken var längre
hos parr från kall behandling. De blå sträcken på den varma fisken visar avståndsvariabel 5-6 f resp. 8-9, som var längre bland parr med varm be-handling.
Diskussion
Flera studier som tidigare har visat att inkuberingstemperaturen har betydelse för den morfologiska ut-vecklingen hos S. salar (Usher et al., 1994; Johnston & McLay, 1997, Fraser et al. 2015) är i enlighet med det ovan redovisade resultatet. Kroppsformen hos S. salar påverkas av inkuberingstemperaturen. Det är svårt att beskriva formskillnader i så generella ordalag, som att den ena eller andra behandlingen ger upphov till parr med mer djup kroppsform. Hypotesen om att varma parr skulle ha en djupare kroppsform får inte stöd av mina resultat och måste därför falsifieras. Avståndet över stjärtspolen 5–6 är den variabel som, om nå-gon, som tyder på att varma parr skulle ha en djupare kropp men eftersom den linjen är dragen diagonalt över stjärtspolen är en mer rimlig slutasts att stjärtspolen är kraftigare bland varma parr. Avstånden mellan analfenans främre infästning och bukfenans främre infästning 8–9 tyder istället på att varma parr skulle vara mer långsmala. Avstånd 1–10, ovanför ögat till nedanför bröstfenans infästning, är liksom 5–6 svår att av-göra huruvida det indikerar en skillnad beträffande kroppsformens djup. Snarare tyder det på ett mindre huvudmått hos de kalla fiskarna. Därtill fanns inget stöd för att varma parr skulle uppvisa högre konditions-faktor.
Litteraturen anger ingen klar bild av att högtemperaturinkuberad rom skulle ge upphov till parr med en dju-pare kropp. Hypotesen är snarare en konklusion utifrån tidigare kända kopplingar mellan S. salars morfologi och temperatur. Bjørnevik et al. (2003) påvisade kopplingen mellan högtemperaturinkuberad rom och hög konditionsfaktor. Det sammantaget med resultaten som visar att vattentemperaturen påverkar ryggkotor-nas tillväxt likväl som antalet missbildningar bland dem (Ørnsrud et al. 2004, Ytterborg et al. 2010, Fraser et al. 2015) och betydelsen av missbildningar på ryggkotorna för S. salars konditionsfaktor (Hansen et al. 2010) pekar mot att högemperaturinkuberad rom torde ge upphov till parr med en högre kroppsform. Dessutom är det i linje med Jordan´s rule (McDowall 2008). Det är därför förvånande att hypotesen inte överensstämmer med resultatet.
I studien av Fraser et al. (2015) jämfördes parr från rom inkuberad i temperaturer mellan 6, 8 och 10 °C. Lägst antal ryggkotor och störst andel ryggkotor med missbildningar uppträdde bland fisk inkuberad vid 10 °C, en temperatur som romkornen i den här studien aldrig utsattes för. Där var det möjligt att påvisa att högtemperaturinkuberad rom gav upphov till fiskar med färre ryggkotor. Noterbart är att man i samma stu-die inte fann några skillnader i förhållandet mellan kroppshöjd och -längd (Fraser et al. 2015). Det står i motsättning till resultaten från studien av Jonsson et al. 2005. De skillnader i konditionsfaktor som påvisats mellan parr från milda respektive kalla vintrar kana tänkas bero på det försprång fiskarna får om de kläcks tidigt under säsongen under en mild vinter. Den tidigare mognad migration ut i havet som dessa ”mildvin-terindivider” uppvisar, styrker en sådan tes. Även om den höga inkuberingstemperaturen i den här studien skulle ha genererat missbildningar på ett antal ryggkotor är det möjligt att det inte resulterat i skillnader beträffande kroppsform. Enligt Hansen et al. (2010) kan nämligen S. salar uppträda tillsynes opåverkad med upp till tio missbildade ryggkotor. Än högre temperaturer under embryogenesen, än de extra
~
4 °C, somanvändes i den här studien, kan därför tänkas vara det, som leder till ytterligare förändringar beträffande kroppsform. Möjligen är det först då S. salar uppvisar andra konditionsfaktorvärden oberoende av om de fått ett försprång i deras vilda miljö. Noterbart är det temperaturdropp som infann sig mellan 12-15-15 till 12-29-15. Där låg inkuberingstemperaturen för varma parr betydligt närmre den kalla gruppen än + 4 °C. Det är därför relevant att fundera över om detta inträffande kan ha påverkat resultatet såtillvida att morfo-logiska skillnader mellan grupperna har stävjats, särskilt som det är just tidigt i embryogenesen som ut-vecklingen av ryggkotor sker (Jordan 1982). Det är heller inte otänkbart att även skillnader i muskelsam-mansättning skulle ha påverkats av dessa omständigheter.
Temperaturer under embryogenesen över den gräns för vad S. salar tål leder till tydliga deformeringar i skelett hos den juvenila fisken (Ytterborg et al. 2010, Fraser et al. 2015). Det är därför mycket möjligt att dessa deformeringar också påverkar S. salars form. De mindre huvudmåtten bland varma parr skulle kunna vara ett resultat inducerat av temperaturpåverkade osteoblaster. Usher et al. (1994) kunde påvisa
muskulära skillnader mellan parr från låg- respektive högtemperaturinkuberad rom. Det är rimligt att anta att sådana muskulära förändringar påverkar formen vare sig skelettet är deformerat eller ej. Dock är det omöjligt att utifrån denna studie utreda vad temperaturökningen påverkar för att inducera de påvisade skillnaderna. Oavsett vilka förändringar, muskulära eller skeletala eller bådadera, som inducerar
formförändringen vet vi ännu inte hur den påverkar S. salars rörelseförmåga eller övriga anatomi. Ej heller vet vi vad det kommer att innebära för S.Salars ekologi.
Om vidare studier genomförs på ämnet finns det skäl att jämföra formskillnader mellan individer vid senare livsstadier. Morfologiska skillnader som påvisats i den här studien kan tänkas visa sig än tydligare när fiskarna vuxit ytterligare och uppträder som adulta individer. Kanske syns då även helt andra
formskillnader. Intressant vore också att jämföra resultat av behandlingen mellan olika laxpopulationer med tanke på den morfologiska konvergens som är påvisad hos arten (Fleming et al., 1994; Hedenskog et al. 1997). Önskvärt vore att i fortsättningen använda avlivad fisk, förutsatt att fisken inte ändrar form efter avlivning. Detta för att kunna markera landmärken ventralt och dorsalt, så att de tydligt syns från den laterala sida fotot tas ifrån. Därtill skulle det gå att kontrollera att alla fiskar har munnen stängd, varpå risken för eventuella mätfel minimeras. Avlivade fiskar möjliggör dessutom räkning av antalet ryggkotor hos varje individ.
Frågan är om resultat, som i laboratoriemiljö tyder på att varma S. Salar får en djupare kroppsform i ett varmare klimat, skulle visa sig på samma sätt bland vilda populationer. Kan den stress, som ett varmare klimat i förlängningen torde innebära, leda till att S. Salar får en mer långsmal kropp oberoende av om arten skulle bära färre ryggkotor än vad de idag gör och ha en annan muskelsammansättning? Förändras exempelvis artens födoresurser och konkurrensen om de samma till det negativa är det möjligt att en djupare kroppsform, vilket inte kan uteslutas som ett resultat av höga inkuberingstemperaturer, inte blir uppenbar. En svulten fisk lär ändå vara smalare än en välgödd. Därför vore det inte bara intressant utan
också av stor vikt att göra fler och mer omfattande studier inom ämnet för att förstå vad ett varmare klimat kommer att innebära för S. salar och dess morfologi såväl som dess samspel med övriga organismer. Tack till
Larry Greenberg för handledning och stort tålamod under projektet och Annika Flytström för tips och idéer samt teknisk support.
Källor
Aas. Ø., S. Einum., A. Klemetsen., J. Surdal. (2011). Atlantic Salmon Ecology. 1 uppl. West Sussex Willey-Blackwell Publishers
Andrews RM (2008) Effects of incubation temperature on growth and performance of the veiled chameleon (Cha - maeleo calyptratus). Journal of experimental zoology. Part A, Ecological genetics and physiology 309A: 435−446
Beacham, T. D. (1990). A genetic analysis of meristic and morphometric variation in chum salmon (On-corhynchus keta) at three different temperatures. Canadian Journal of Zoology 68: 225–229
Bjørnevik, M., Beattie, C., Hansen, T. & Kiessling, A. (2003). Muscle growth in juvenile Atlantic salmon as influenced by temperature in the egg and yolk sac stages and diet protein level. Journal of Fish Biology, 62 (5): 1159 - 1175.
Drinnan T. J., Mcginnity P., Coughland J.P., Harrison S.C., (2012) Morphological variability of Atlantic salmon Salmo salar and brown trout Salmo trutta in different river environments. Ecology of Freshwater Fish 21 (3):
420–432.
Currens, K. P., Sharpe, C. S., Hjort, R., Schreck, C. B. & Li, H. W. (1989). Effects of different feeding regimes on the morphometrics of chinook salmon (Oncorhynchus tshawytscha) and rainbow trout (O. mykiss). Copeia 1989 (3): 689–695.
Elliott, J.M. & Elliott, J.A. (2010). Temperature requirements of Atlantic salmon Salmo salar, brown trout Salmo trutta and Arctic charr Salvelinus alpinus: predicting the effects of climate change. Journal of Fish Biology, 77 (8): 1793-1817
Finstad, A.G. & Jonsson, B. (2012). Effect of incubation temperature on growth performance in Atlantic salmon. Marine Ecology Progress Series, 454: 75-82.
Fleming, I. A., Jonsson, B. & Gross, M. R. (1994). Phenotypic divergence of sea-ranched, farmed and wild salmon. Canadian Journal of Fisheries and Aquatic Sciences (51): 2808–2824
Fraser, T. W. K., Hansen, T., Fleming, M. S., Fjelldal, P. G. (2015) The prevalence of vertebral deformities is increased with higher egg incubation temperatures and triploidy in Atlantic salmon Salmo Salar L. Journal of Fish Diseases 38: 75-89
Galloway, T. F., Kjorsvik, E. & Kryvi, H. (1998). Effect of temperature on viability and axial muscle
development in embryos and yolk sac larvae of the Northeast Arctic cod (Gadus morhua). Marine Biology (132): 559–567
Hari, R. E., Livingstone, D. M., Siber, R., Burkhardt-Holm, P. & Guttinger, H. (2006). Consequences of climatic change for water temperature and brown trout populations in Alpine rivers and streams. Global Change Bi-ology 12: 10–26
Hauer, F. R., Baron, J. S., Campbell, D. H., Fausch, K. D., Hostetler, S. W., Leavesley, G. H., Leavitt, P. R., McKnight, D. M. & Stanford, J. A. (1997). Assessment of climate change and freshwater ecosystems of the Rocky Mountains, USA and Canada. Hydrological Processes 11: 903–924.
Hedenskog, M., Petersson, E., Jarvi, T. & Khamis, M. (1997). Morphological comparison of natural produced Atlantic salmon (Salmo salar L), anadromous brown trout (Salmo trutta L), and their hybrids. Nordic Journal of Freshwater Research 73: 35–43.
Intergovernmental Panel on Climate Change (IPCC) Climate change: (2013). The physical science basis. The fifth assessment report of the intergovernmental panel on climate change.
Johnston, I. A. & McLay, H. A. (1997). Temperature and family effects on musclecellularity at hatch and first feeding in Atlantic salmon (Salmo salar). Canadian Journal of Zoology 75: 64–74
Johnston, I. A., Vieira, V. L. A. & Abercromby, M. (1995). Temperature and myogenesis in embryos of the Atlantic herring Clupea harengus. Journal of Experimental Biology 198: 1389–1403.
Jonsson, N., Jonsson, B. & Hansen, L.P. (2005). Does climate during embryonic development influence parr growth and age of seaward migration in Atlantic salmon (Salmo salar)? Canadian Journal of Fisheries & Aquatic Sciences, 62 (11): 2502-2508.
Jonsson & Jonsson (2011) Ecology of Atlantic salmon and brown trout. Springer
Jordan, D.S. (1892) Relations of temperature to vertebrae among fishes. Proceedings of the United States National Museum, 1891: 107–120.
Jungers, W. L., Falsetti, A. B. & Wall, C. E. (1995). Shape, relative size, and size adjustments in morphometrics. Yearbook of Physical Anthropology 38: 137–161.
Leksell, Lina. 2017. Early environmental effects on dominance in Juvenile Atlantic Salmon (Salmo salar L.) Department of Biology, Karlstad University.
McDowall, R. M. (2008). Jordan's and Other Ecogeographical Rules, and the Vertebral Number in Fishes. Journal Of Biogeography, 35 (3): 501 - 508.
Mueller, C., Eme, J., Manzon, R., Somers, C., Boreham, D. & Wilson, J. (2015). Embryonic critical windows: changes in incubation temperature alter survival, hatchling phenotype, and cost of development in lake whitefish (Coregonus clupeaformis). Journal of Comparative Physiology B: Biochemical, Systemic & Environmental Physiology, 185 (3): 315 -31.
Nathanailides, C., Lopez-Albors, O. & Stickland, N. C. (1995). Influence of pre-hatch temperature on the development of muscle cellularity in posthatch Atlantic salmon (Salmo salar). Canadian Journal of Fisheries and Aquatic Sciences 52: 675–680.
Nicieza, A. G. (1995). Morphological variation between geographically disjunct populations of Atlantic salmon: the effects of ontogeny and habitat shift. Functional Ecology 9: 448–456.
Peterson, R. H., Spinney, H. C. E. & Spreedharan, A. (1977). Development of Atlantic Salmon (Salmo salar) egs and alevins under varied temperature regimes. Journal of Fisheries Research Board of Canada 34: 31–43 Qualls CP, Andrews RM (1999) Cold climates and the evolution of viviparity in reptiles:cold incubation temperatures produce poor-quality offspring in the lizard, Sceloporus virgatus. Biological journal of the Linnean Society 67: 353−376
Quinn, T. P. ( 2005). The Behavior and Ecology of Pacific Salmon and Trout. 1 uppl. UBC Press
Riddel B.El, Legget W.C, Saunders R.L (1981). Evidence of adaptive variation between two populations of Atlantic salmon (Salmo salar) native to tributaries of the S.W. Miramichi River, N.B Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38 3: 321-333
Solem, Ø., Berg O.K., & Kjøsnes, A.J. (2006)
Inter- and intra-population morphological differences between
wild and farmed Atlantic salmon juveniles. Journal of Fish Biology, 69: 1466-1481Solem, Ø., Berg, O.K. (2011) Morphological differences in parr of Atlantic salmon Salmo salar from three regions in Norway. Journal of Fish Biology 78: 1451-1469.
Stickland, N. C., White, R. N., Mescall, P. E., Crook, A. R. & Thorpe, J. E. (1988). The effect of temperature and myogenesis in embryonic development of the Atlantic salmon (Salmo salar L.). Anatomy and Embryology 178: 253–257.
Sveriges meteorologiska och hydrologiska institut, SMHI. http://www.smhi.se/klimat/framtidens-klimat/klimatscenarier?area=eur&var=t&sc=rcp85&seas=vin&dnr=0&sp=sv&sx=0&sy=297
Thompson, J. D. (1991). Phenotypic plasticity as a component of evolutionary change. Trends in Ecology and Evolution 6: 246–249.
Usher, M. L., Stickland, N. C. & Thorpe, J. E. (1994). Muscle development in Atlantic salmon (Salmo salar) embryos and the effect of temperature on muscle cellularity. Journal of Fish Biology 44: 953–964.
Von Crammon-Taubdel, N., Ling, E., Cotter, D. C., & Wilkins, N.P. (2005) Determination of body shape variation in Irish hatchery-reared and wild Atlantic salmon. Journal of Fish Biology 66 (5): 1471-1482
Xenopoulos, M. A., Lodge, D. M., Alcamo, J., Marker, M., Schulze, K. & van Vuuren, D. P. (2005). Scenarios of freshwater fish extinctions from climate change and water with drawal. Global Change Biology 11: 1557– 1564.
Ytteborg, E., Baeverfjord, G., Torgersen, J., Hjelde, K. & Takle, H. (2010) Molecular pathology of vertebral deformities in hyperthermic Atlantic salmon (Salmo salar). Bio Med Central Physiology 2010 10: 12.
Ørnsrud, Gil L. & Waagbø, R. (2004) Teratogenicity of elevated egg incubation temperature and egg vitamin Astatus in Atlantic salmon, Salmo salar L. Journal of Fish Diseases 27: 213–22