1 Akademin för hållbar samhälls-
och teknikutveckling
Adhesion av mikroorganismer till lignocellulosa
Anders Karlsson
C-uppsats i Kemiteknik – Läkemedelsdesign, 20p Handledare: Sven Hamp & Anne Stockenberg Uppdragsgivare: STFI-Packforsk AB
Examinator: Magnus Neumüller Västerås: 2008-10-27
2
Abstract
The aim of the project was to develop a method to investigate differences in adhesion of microorganisms to materials that contains lignocellulose. The method was tested on a gram-positive (Micrococcus lutea) and one gram-negative (E-coliJM109) bacteria.
The study was begun by cultivation of the two microorganisms. The cultivation was done to calculate the generation times of the bacteria and to obtain growth curves. Cells from these cultivations were also frozen (-70ºC) and later used for inoculation.
At STFI-Packforsk AB the total charge on the mass was measured and later a conductivity titration on the mass was executed as well, all to find out more about the different properties of the mass. Properties that in a later part of this study could possibly be linked to the adhesion of cells to the pulp. The adhesion experiments that were executed gave poor results. The adhesion experiment with M. lutea was the only experiment that gave a reproducible result. In this experiment M. lutea was contacted with bleached leaf. A reduction of cells was observed in all of the dilutions where M. lutea had been in contact with the mass. The number of colony forming units of the culture was 1,2×107 before the adhesion and 2×106 subsequently.
3
Sammanfattning
Projektets syfte var att utveckla en metod för att undersöka skillnader i adhesion av mikroorganismer till material som består eller framställs av lignocellulosa. Metoden tillämpades på en gram-positiv (Mikrococcus lutea) samt en gram-negativ (E-coliJM109) bakterie.
Studien inleddes med uppodling av de båda bakterierna där tillväxtkurvor utformades, generationstider beräknades och cellbanker skapades. På STFI uppmättes massornas totala laddningsförmåga och därpå gjordes ytterligare en konduktivitetstitrering på massorna för att utröna mer om deras egenskaper, egenskaper som i en senare och fortsatt del av denna studie skall kunna länkas till mikroorganismernas interaktion med materialet. Adhesionsförsöken som sedan utfördes gav mycket ojämna resultat. Några fullständiga försök med konduktivitet kunde aldrig genomföras p.g.a. tidsbrist. Resultaten från adhesionsförsken med M. lutea visade bäst reproducerbarhet. I försöket där M. lutea adherades till blekt löv påvisades en reduktion av antalet kolonier i alla spädningar där mikrococcin kontaktats med blekt löv. CFU för den kultur som uppodlats vid det omtalade tillfället var 1,2*107 före adhesionen och 2*106 efter. Reduktionen var alltså en tiopotens.
4
INTRODUKTION 6
TEORETISK BAKGRUND 7
MATERIAL OCH METODER 8
MATERIAL 8
Mikroorganism 8
Utrustning för odlingsförsöken 8
Utrustning för mätning av pappersmassa 9
Utrustning kontaktförsök 9
Kemikalier 10
Odlingsmedia och lösningar 10
METODER 11
ODLING PÅ PLATTA 11
ODLING I FERMENTOR 12
JONBYTE AV MASSA TILL H+-FORM 12
MÄTNING AV DEN TOTALA LADDNINGEN HOS MASSORNA 12
ADHESIONSFÖRSÖK 12
KONDUKTIVITETSTITRERING PÅ MASSORNA 13
SEM (SCANNING ELECTRON MICROSCOPE) 14
FERMENTATIONSFÖRSÖK 14 M. LUTEA FÖRSÖK 1 14 E. COLI FÖRSÖK 1 16 M. LUTEA FÖRSÖK 2 18 E. COLI FÖRSÖK 2 20 E. COLI FÖRSÖK 3 22 RESULTAT 24
ADHESIONSFÖRSÖK MED M. LUTEA 24
ADHESIONSFÖRSÖK E. COLIJM109 25 TOTALLADDNING AV MASSOR 25 KONDUKTIVITETSTITRERING 26 ELEKTRONMIKROSKOPBILDER 31 DISKUSSION 32 REFERENSER 34 BILAGA 1 35 BERÄKNINGAR 35 BILAGA 2 37
TITRERINGSKURVA BLEKT LÖV-MASSA 1 37
BILAGA 3 38
TITRERINGSKURVA BLEKT LÖV-MASSA 2 38
BILAGA 4 39
TITRERINGSKURVA BLEKT BARR-MASSA 1 39
5
TITRERINGSKURVA BLEKT BARR-MASSA 2 40
BILAGA 6 41
TITRERINGSKURVA OBLEKT LÖV-MASSA 1 41
BILAGA 7 42
TITRERINGSKURVA OBLEKT LÖV-MASSA 2 42
BILAGA 8 43
TITRERINGSKURVA OBLEKT BARR-MASSA 1 43
BILAGA 9 44
6
Introduktion
Syftet med projektet var att framställa ett material som kan användas i hygieniska
sammanhang. Materialet skall besitta egenskaper som gör att det attraherar mikroorganismer. I studien som utfördes utarbetades en metod för att undersöka skillnader i adhesion av två olika mikroorganismer, en grampositiv och en gramnegativ, till lövvedsmassa och
barrvedsmassa i blekt och oblekt tillstånd.
Anledningen till studien är att det finns ett intresse att utforma material med egenskaper som gör att bakteriehalten i omgivningen kan reduceras. I sjukhusmiljöer skulle ett sådant här material kunna användas i örngott eller skurmoppar. I en framtid med nya hotbilder från multiresistenta bakterier p.g.a. alltför frekvent bruk av antibiotika efterfrågas andra metoder och infallsvinklar på problemet.
Studien utfödes genom att bakteriesuspension med känd halt bringas i kontakt med det adsorberande materialet. Cellkoncentrationen före och efter kontakt i suspensionen uppmättes och reduktionen visar effektiviteten.
Uppgiften inleddes med en primär litteraturstudie av grundläggande mekanismer för adhesion. Sedan utvecklades den metod som skulle standardiseras för odling och skörd av bakterierna. Ett standardiserat förfarande utarbetades även för kontakt mellan bakterierna och testmaterialet. Studien är komplex då bakteriernas egenskaper förändras mellan olika
7
Teoretisk bakgrund
Processen där bakterier fäster till ytor dikteras av en rad olika komponenter. En tumregel brukar vara att bakterier som fäster till abiotiska ytor gör det genom icke specifik adhesion exempelvis genom hydrofob interaktion. Bakterier som fäster till levande ytor gör det däremot genom mer specifik interaktion via lektiner, adhesiner eller ligander. Ett typiskt exempel för en sterospecifik interaktion är den mellan en lektin och kolhydrat. Att den är specifik innebär att endast den yta som bär den motsvarande kolhydratstrukturen som passar till lektinen vilken finns på bakterien, kommer att fästa1. Det är dock lite utav en förenkling att påstå att hydrofob interaktion är helt och hållet ospecifik. Olika faktorer så som essentiella
näringskomponenter och motstånd mot skadliga fysiska och kemiska påfrestningar är också viktiga för en lyckad kolonisation. Adhesionsprocessen brukar delas in i faktorer som
innefattar presentation, orientering och åtkomlighet. Först måste organismen närma sig ytan, framdriven antingen slumpmässigt av en vätska som strömmar över ytan eller så kan det ske på ett mer styrt vis genom så kallad kemotaxis där en cell förflyttar sig mot eller från en ökande koncentration av ett kemiskt ämne. När organismen når en så kallad kritisk närhet till ytan (≤1nm) så avgörs adhesionsförfarandet genom summan av de krafter som antingen verkar attraktivt eller repulsivt. Exempel på dessa krafter är elektrostatiska, hydrofobiska, van der Waals, sterisk effekt och temperaturpåverkan. Eftersom de flesta inerta ytor är negativt laddade och bakteriers ytor också är negativt laddade så verkar elektrostatiska krafter repulsivt då dessa två ytor interagerar.
När en bakterie fäst till en yta genom att förankra sig genom specifik interaktion så är adhesionen irreversibel. Endast med fysikalisk eller kemisk påverkan kan adhesionen brytas. Alltså sker troligen adhesionen i två steg där det första steget är reversibelt och det andra irreversibelt. Den irreversibla adhesionen orsakas av adhesiner2.
I försöken användes två stycken bakterier, Escherichiacoli JM109 och Mikrococcus.
Lutea. Den mest intressanta skillnaden mellan de två är att den ena är gram-positiv och den andra gram-negativ. Gram-positva bakterier har en hög koncentration av teichonsyra i det yttre skiktet. Detta ger de gram-positiva bakterierna ett lägre pH. En direkt effekt av detta är att dessa bakterier har en lägre zeta-potential än de gram-negativa. Zeta-potentialen är ett mått på en bakteries nettoladdning. En låg zeta-potential reflekterar alltså en hög surhet på ytan av en bakterie3. För övrigt skiljer sammansättningen på grampositiva och gramnegativa
cellväggar på ett tydligt vis. De grampositiva bakterierna har en tjockare och därmed mycket mer stabil cellvägg med peptidoglykan som den mest centrala beståndsdelen (20-40 nm). Gramnegativa bakterier har också peptidoglykan som en viktig beståndsdel. Skiktet av peptidoglykan täcks dock av ett yttre membran med fosfoyl-lipopolysaccharidprotein (LPS) utstickande ytterst. Adhesiner sitter fästa här. I det yttre membranet finns även hydrofoba proteiner med vidhäftande förmågor4. Man bör alltså kunna förvänta sig tydliga skillnader mellan grampositiva och gramnegativa bakteriers vidhäftningsegenskaper.
8
Material och metoder
MaterialMikroorganism
Micrococcus lutea (M.lutea) förvarad i frysmedium, erhållen fryst (-70°C) från instutionens stamförråd.
Escherichia coli JM109 (E.coli JM109) förvarad i LB med 10 % glycerol, erhållen fryst (-70˚C) från instutionens stamförråd.
Utrustning för odlingsförsöken
Autoklav:
Varioklav, steam steriliser H+P Labortechnik GmbH Type 400E
S/n 42200999 PH-meter:
Orion 520A
Orion Research Inc S/n 006872 Skakinkubator: Orbital shaker 4536 Forma Scientific S/n 16258/21 Mikrovågsugn: Elvita Model E18TF S/n 9611002393 Magnetomrörare: Kebolab MR 2000 S/n 05301
1L Fermentor med tillbehör:
SARA small Bioreactor controlserie 2000 Belach Biotechnik Styrprogram, Phantom 2000 v.2.01 Spektrofotometer: Ultraspec 3000 UV/visible spectrophotometer Model 80-2106-20 S/n 65513 Analysvåg: Mettler Toledo P11875 Snabbpipetter: 5-1000 µL, Labassco Aluminiumfolie
9 Autoklavtejp Bägare 500 ml Duralexflaskor 250 ml, 500 ml, 1000 ml E-kolv 50 ml, 250 ml, 500 ml Eppendorfrör Exikator Falconrör Filterpapper Hink Kanyler Kvartsküvett Magnetloppa Muffinsformar Mätcylinder 1000 ml Parafilm Petriplattor Plastküvett Pinsett Sax Skedar Slangklämmor Sprutor 1 ml, 10 ml, 20 ml, 50 ml
Utrustning för mätning av pappersmassa
Analysvåg: XT6200C-FR Precisa Dator: Specialprogram Tinet 2.4 Konduktivitetsmätare: CDM80 Radiometer Copenhagen Exsickator Termostadbad Vaccumflaska Buchnertratt
3 st. 1000 ml kolv (används för att bereda lösningar) Förvägda filterpapper Munktell nr 3 (7 cm)
Provbehållare
Utrustning kontaktförsök
Autoklav:
Varioklav, steam steriliser H+P Labortechnik GmbH Type 400E
S/n 42200999 Skakinkubator:
10 Forma Scientific S/n 16258/21 Aluminiumfolie Autoklavtejp E-kolv 500 ml, 50 ml Eppendorfrör Duralexflaskor 500 ml, 1000 ml Petriplattor Snabbpipetter: 5-1000 µL, Labassco Glaspärlor: 3 mm i diameter Kemikalier
Glucose SIGMA D-(+)-Glucose EC no. 200-075-1
Natriumklorid, NaCl, Fischer Scientific UK Limited, Batch 0737701
Casein Trypsic Peptone (Tryptone), Scharlau Microbiology, Batch 13986, 15994 Yeast Extract BactoTM, Lot 3296925
Peptone from soymeal papain digested, Lot 744112
Agar-Agar, granular powder, Fischer scientific, Batch 0737925 Sodium hydroxide pellets, Scharlau, Batch 7764
Hydrochloricacid 37% reagent grade Scharlau, Batch 82597 Natriumdihydrogenfosfat, Prolabo, Batch J020, NaH2PO42H20
DiNatriumhydrogenphosphat-dihydrat, Schalau Chemie SA, Batch 1.06580.1000 70 % Etanol, EtOH
Skumdämparolja, Structol Kalibreringslösningar:
1. pH 7,00, Scharlau Cheine SA, Batch 74079 2. pH 4,00, Scharlau Cheine SA, Batch 74250
Odlingsmedia och lösningar
LB-medium (dubbelt medium) 1 L
Trypton 20 g Natriumklorid 5 g Jästextrakt 10 g Fosfatbuffrad salin-lösning (PBS) 2L Lösning A: 100 ml 0,2 M NaH2PO4 NaH2PO4*2H2O = 3,12 g Lösning B: 250 ml 0,2 M Na2HPO4 Na2HPO4*2H2O = 8,9 g 19 ml av lösning A 81 ml av lösning B 19 g NaCl pH ställs till 7,4
11
40 % glukos-lösning
200 ml MilliQ-vatten 80 g D(+)-Glukos
1 L Agar för gjutning av petriplattor
10 g Tryptone 10 g NaCl 5 g jästextrakt 15 g agar agar
Metoder
Odling på plattaMikroorganismerna hämtades från instutionens stamförråd, en frysbox med temperatur -70ºC. Med ympögla racklades de ut på petriplatta med en s.k. tertiärstrykning. Detta moment
utfördes på laboratoriebänk som innan strykningen tvättats ren med 70 % etanol. Strykningen utfördes i närvaro av öppen låga för att minska kontaminationsrisken.
Agarblandning autoklaverades och ca 30 st. plattor placerades på en spritad laboratoriebänk. På laboratoriebänken placerades även en bunsenbrännare med öppen gaslåga. Den varma lösningen hälldes över till petriskålarna och därefter brändes eventuella luftbubblor bort med brännaren. Skålarna fick sedan stå i rumstemperatur i ca 24 timmar innan de placerades i kylskåp.
Förberedelse av odling
Fermentorn monterades och alla sensorer kontrollerades. Syreelektroden kalibrerades till 100 % efter att ha polariserat under ca 3 timmar. pH-elektroden kalibrerades med
kalibreringslösningar pH 4 resp. pH 7. Temperaturgivaren kalibrerades till rumstemperatur. Odling av förkulturer förbereddes genom blandning av dubbelt LB-medium. Mediet hälldes ned i E-kolvar som förslöts med folie och därefter autoklaverades i samma omgång med glukos som blandats i en separat duralexflaska vid 1,2 bar övertryck och 121ºC. Efter färdig sterilisering placerades utrustningen i LAF-bänk.
1000 ml dubbelt LB-medium blandades och överfördes till odlingskärlet. Slangar för bas samt syra kläddes med folie före den efterföljande autoklaveringen av utrustningen.
Ympningen utfördes sedan i LAF-bänk. Önskad koloni ympades från odlingsplatta med steril ympögla i det sterila mediumet. E-kolvarna placerades sedan i stillastående skakinkubator vid 37ºC. Ett tidur startade skakinkubatorn i lämplig tid för förkulturerna. Alla förkulturer odlades under betingelserna 37ºC och 250 rpm.
12
Odling i fermentor
Det steriliserade odlingskärlet ställdes på plats och anslöts till luft, kylvatten, omrörare och pH-reglering. 5 M H3PO4 och 5 M NaoH användes för reglering av pH i mediumet. Slangen
för utgående luft anslöts till en spritfälla för avdödning av bakterierna. Ingående luft skapade ett högre tryck inuti kärlet än utanpå. Temperaturen ställdes till 37ºC. Sedan togs prov från mediumet. Med erhållet prov kontrollerades pH samt absorbansen i spektrofotometer.
Absorbansen kontrollerades vid en våglängd på 600 nm och eventuella utspädningar utfördes med PBS.
Efter dessa moment ympades mikroorganismen. Ympens volym var 25-50 ml beroende på odlingstillfälle. Syreregleringen kalibrerades sedan till 100 %. Prover togs därefter med jämna mellanrum för att kontrollera tillväxten. Efter 1h av odling påbörjades manuell tillförsel av glukos. Syreregleringen ställdes in på ett högt börvärde för att undvika syrebrist i odlingen. Absorbansprover mättes sedan fram till stationärfasen.
Jonbyte av massa till H+-form
5 g av pappersmassan vägdes upp och blandades med 500 ml 0,01 M HCl i en rundbottnad 1000 ml kolv och därefter ställdes pH till 2. Lösningen fick sedan stå i 30 min och pH justerades med HCl vid behov. I nästa steg filtrerades massan av i en buchnertratt med filter och tvättades med destvatten tills konduktiviteten på filtratet var under 5 µs/cm. Den var nu i sin H+form. Filterkakan separerades efteråt från filtret och vägdes. Pappersmassans vikt angavs i våtform.
Mätning av den totala laddningen hos massorna
En 1000 ml rundbottnad kolv placerades på analysvågen och en äggformad magnetloppa lades i. En uppskattning av massans våtvikt omvandlad till torrvikt bestämdes till 1/10 av våtvikten. 1/10 av pappersmassan som genomgått jonbyte till H+-form placerades i kolven. 5 ml 0,01 M HCl tillsattes och därefter 10 ml 0,01 M NaCl. Provet späddes upp till en
totalvolym om 500 ml. Kärlet placerades i termostadbadet (25˚C) och konduktivitetscell, pH-givare samt kväveslang anslöts. Titreringen startades sedan genom datorprogram. Efter körningen filtrerades massan av i buchnertratt. Filtret som användes var förvägt så att den exakta vikten av massan efter titreringen erhölls. Efter titreringen utvärderades kurvan manuellt (se bilagor 1-9).
Adhesionsförsök
1 L CLED-agar blandades och autoklaverades (1,2 atm, 120ºC i 20 min). Agar göts i plattor som fick stå i rumstemperatur över natt för att eliminera kondens. Dagen därpå placerades de i kylskåp för förvaring före användning.
2 L PBS och 500 ml dubbelt LB-medium blandades . 200 ml av LB-mediumet hälldes sedan ned i en 500 ml E-kolv som täcktes med folie. Förfarandet ägde rum i LAF-bänk. E-kolven autoklaverades sedan under samma betingelser som vid tidigare tillfällen. Sedan ympades E-kolven och placerades därefter i skakinkubator vid 37ºC skakfrekvens 250 rpm.
500 ml PBS hälldes över i duralexflaska och autoklaverades tillsammans med 1 g blekt lövmassa som vägts upp i en 50 ml E-kolv och därefter täckts med två lager av folie. PBS:bufferten kyldes efter avslutad autoklavering i isbad.
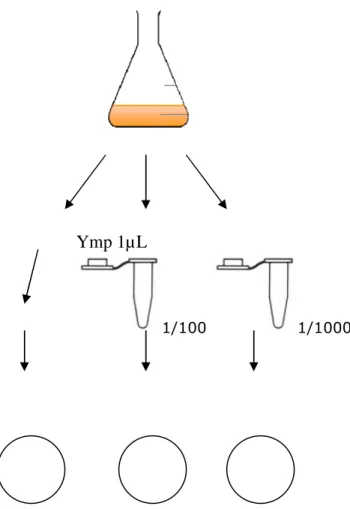
13 Adhesionsförsöket inleddes med att 1 µL från förkulturen odlad över natt ströks ut på platta med ympögla. Sedan togs ytterligare 1µL av övernattodlingen till ett eppendorfrör och späddes med 99 µL PBS vilket gav en spädning på 1:100. Även en spädning på 1:1000 gjordes till eppendorfrör till en totalvolym på 1ml. Från dessa båda spädningar pipetterades 25µL till petri-plattor (se Figur 1). Dubbelprov av plattor tillämpades. Spädningarna racklades ut på plattorna m.h.a. sterila glaspärlor(diameter 3 mm).
25ml av övernattodlingen hälldes sedan över till kolven med 1g blekt löv-vedsmassa. E-kolven vortexades i ca: 20 sekunder på 1800 varv. Därefter skakades den även för hand i c:a 30 sekunder. Därefter utfördes samma spädningar som ovan. 1µL övefördes med ympögla direkt från E-kolven till platta sedan spädningar på 1:100 samt 1:1000. 25µL av dessa racklades sedan ut på petri-plattor. Dubbelprov av plattor tillämpades.
Ymp 1µL
1/100 1/1000
Figur 1. Översikt av adhesionsförsök mikrococcus lutea och Ecoli JM109.
Konduktivitetstitrering på massorna
En bägare med volymen 1000 ml fylldes med 5 ml 0,01 M HCl, 10 ml 0,01 M NaCl och späddes upp till 500 ml med milliQ-vatten. Bägaren placerades på omrörningsplatta i
14 både på prover med och utan pappersmassa. 2 gram massa togs ut vid varje titrering.
Konduktivitetsmätningar utfördes efter varje tillsatt droppe NaOH.
SEM (Scanning electron microscope)
Representativt prov togs och torkades in. Provet guldpläterades under vakuum i 100 sek. vid 1,2 kw spänning och 30 mA ström.
Fermentationsförsök
M. lutea försök 1
500 ml dubbelt LB-medium blandades och tre st. 250 ml E-kolvar fylldes med vardera 100 ml medium. 150 ml 40 % glukos blandades. De tre E-kolvarna med medium, glukos-lösning (separat i duralexflaska) samt skumdämparolja autoklaverades och fick därefter vila i LAF-bänk.
Under pågående sterilisering av förkulturerna, glukos-lösning och skumdämparolja monterades det stora odlingskärlet ihop med alla dess givare och slangar. Efter monteringen skruvades en av muttrarna loss och 1L dubbelt LB-medium hälldes ned i kärlet. Syra- och bas- slangarnas öppningar kläddes med folie och kärlet med medium samt syra- och
basslangar autoklaverades. Förkulturerna ympades med varsin koloni av M .lutea. Kolonierna hade renstrukits dagen innan på CLED-plattor. Ympen utfördes i LAF-bänk.
De tre E-kolvarna placerades i skakinkubator över natt i 37˚C, 250 rpm. Glukos-lösningen och skumdämparoljan lämnades kvar i LAF-bänken som fick stå påslagen under natten.
Efter 5 h i skakinkubator hade tillväxt ägt rum i alla tre E-kolvar. Slangarna för in- och utluft anslöts till fermentorn och luften in ställdes till 8 cc/min. Sedan anslöts slangarna för
kylvatten, syra och basslangar samt alla sladdar till elektroderna.
5 M H3PO4 och 5 M NaoH användes för reglering av pH i mediumet. Temperaturen
skruvades upp till ett börvärde på 37˚C och rpm till 300. Två droppar skumdämparolja tillsattes till odlingen. 4 ml prov togs ut för pH-kontroll och absorbansmätning.
Regleringsintervallet för pH ställdes in mellan 6,89 och 7,14. Överföringen av förkultur från E-kolv till spruta på 50 ml gjordes i LAF-bänk. Efter 7h på skakinkubator ympades
fermentorn med innehållet i sprutan. Efter 11 h gjordes upptäckten att syreregleringen av misstag inte var påslagen och därmed hade ingen ökning av omrörningen ägt rum. När denna aktiverades ökade tillväxten och den seglivade lagfasen gick snabbt mot logfas.
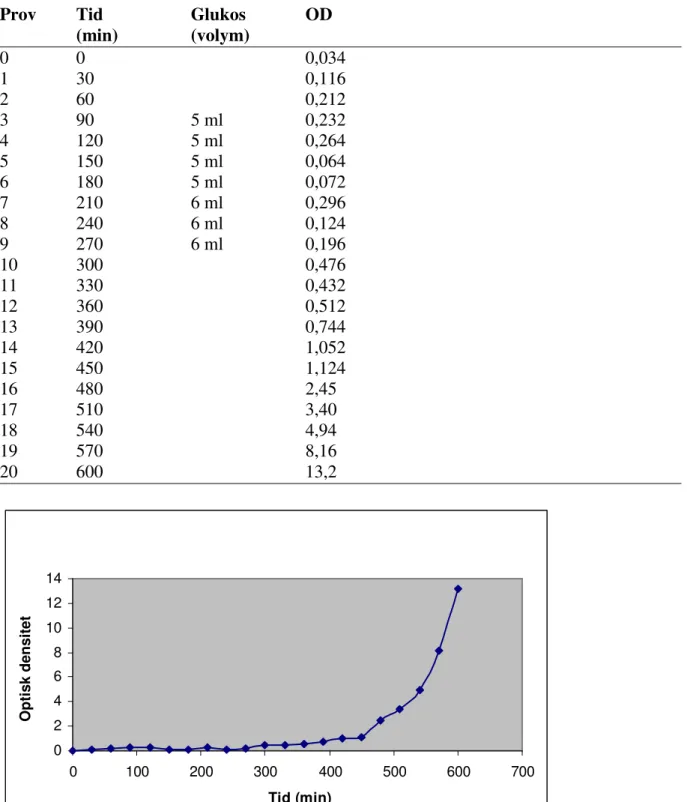
Glukos tillsattes med jämna mellanrum, (tabell 1). Första injektionen glukos gjordes 1,5 h efter ymp och därefter injicerades glukos varje halvtimme (se Fig. 2 och Fig. 3).
15
Tabell 1. OD-mätningar för monitorering av tillväxt under odling av M. lutea
Prov Tid Glukos OD
(min) (volym) 0 0 0,034 1 30 0,116 2 60 0,212 3 90 5 ml 0,232 4 120 5 ml 0,264 5 150 5 ml 0,064 6 180 5 ml 0,072 7 210 6 ml 0,296 8 240 6 ml 0,124 9 270 6 ml 0,196 10 300 0,476 11 330 0,432 12 360 0,512 13 390 0,744 14 420 1,052 15 450 1,124 16 480 2,45 17 510 3,40 18 540 4,94 19 570 8,16 20 600 13,2 0 2 4 6 8 10 12 14 0 100 200 300 400 500 600 700 Tid (min) O p ti s k d e n s it e t
16 0 0,5 1 1,5 2 2,5 3 0 100 200 300 400 500 600 700 Tid(min) o p ti s k d e n s it e t
Figur 3. Logaritmerad logfas av tillväxtkurva M.lutea försök 1
Bedömning av generationstiden m.h.a. den räta linjens ekvation: ∆y = ln13,2 – ln3,4 = 1,356 ∆x = 90 min µ = 0,01506 min-1 tg = 46,0 01506 , 0 2 ln = min
E. coli försök 1
Fermentorn monterades och givare kalibrerades på samma sätt som vid föregående odlingstillfälle. 500 ml dubbelt LB-medium blandades. 3st 250 ml E-kolvar fylldes med vardera 100 ml av mediet och täcktes med folie. Dessa tre E-kolvar autoklaverades
tillsammans med 150 ml 40 % glukos (separat i duralexflaska) samt skumdämparolja. I nästa omgång autoklaverades fermentorn med samma arrangemang som vid föregående odling med avseende på alla detaljer. E-kolvarna ympades med kolonier erhållna från petriplattor med LB-agar.
Fermentorn ställdes på plats för odling. Inluften skruvades på, elektroder samt slangar för syra och bas kopplades på. Därefter togs prov från LB-mediet för mätning av OD samt
pH-kontroll. Efter 9,5 h odling i skakinkubator av förkulturerna ympades fermentorn med 20 ml som påvisat tillväxt pH var då 6,85 och mediet 37°C. Syreregleringen kalibrerades till 100 % vid tillfället för ymp. Omrörningen sattes till 300 rpm och två droppar skumdämparolja tillsattes. Första satsen glukos tillsattes efter c:a 1 h odling och därefter gjordes ytterligare tillsatser med jämna mellanrum, (se Tabell 2). Absorbansmätningar gjordes utan avvikelser från föregående odling för att erhålla tillväxtkurva, (se tabell 2 och Figur 4).
17
Tabell 2. OD-mätningar för monitorering av E-coliJM109:s tillväxt under odling
Prov Tid Glukos OD
(min) (volym) 0 0 0,036 1 12 0,048 2 30 0,052 3 50 0,070 4 70 5 ml 0,098 5 95 5 ml 0,134 6 115 0,202 7 135 5 ml 0,332 8 155 5 ml 0,472 9 175 0,832 10 195 5 ml 0,896 11 215 1,55 12 235 10 ml 1,99 13 255 10 ml 2,53 14 285 10 ml 2,50 15 305 3,02 16 325 10 ml 4,12 17 345 10 ml 4,80 18 365 7,60 19 385 8,80 20 405 9,20 0 1 2 3 4 5 6 7 8 9 10 0 100 200 300 400 500 Tid(min) O p ti s k d e n s it e t
18 0 0,5 1 1,5 2 2,5 0 50 100 150 200 250 300 350 400 450 Tid(min) o p ti s k d e n s it e t
Figur 5. Logaritmerad logfas av tillväxtkurva E.coliJM109 försök 1
∆y = ln9,20 – ln3,02 = 1,114 ∆x = 100 min µ = 0,0114 tg = 62,2 0114 , 0 2 ln = min
M. lutea försök 2
För att underlätta det förberedande arbetet vid kommande odlingar utfördes denna odling med syftet att göra en s.k. cellbank. Celler togs ut från odlingen under logfas och placerades i eppendorfrör som sedan frystes in i -70°C. Dessa celler avsågs utgöra en stambank att användas som ymp för framtida odlingstillfällen.
Fermentorn gjordes i ordning och givare kalibrerades som vid tidigare odlingar. 500 ml dubbelt LB-medium blandades. 2 st. E-kolvar med volymen 500 ml fylldes med vardera 200 ml av mediet och täcktes med aluminiumfolie. Dessa autoklaverades med 200 ml 40 % glukos samt skumdämparolja som blandats separat från mediumet i indivduella durexflaskor.
Därefter blandades 1000 ml dubbelt LB-medium som omgående fördes över till fermentorn. Syra och basslangar täcktes med folie och alla öppningar in i kärlet stängdes. Slangar för in och utluft täpptes igen med klämmor. Allting förvarades sedan över natt i kylrum. Förkulturerna ympades och placerades därefter i skakinkubator och inkubatorn startades med hjälp av tiduret. Varvtal och temperatur ställdes in på samma sätt som vid tidigare odlingstillfällen.
Efter 6 h odling var mediumet fortfarande blankt varpå ett större inokulat togs och blandades med 10 ml sterilt LB-medium, detta medium överfördes sedan till de båda förkulturerna. 8 ml till den ena E-kolven och två till den andra. Glycerol autoklaverades för att undvika skador på mikroorgansimerna då de frystes ned. Efter 9 h på skak fördes ympen till fermentorn. pH var då 6,7 och temperaturen 37ºC. Syreregleringen kalibrerades till 100 % och ett börvärde på denna reglering ställdes in på 93%.
19 Odlingen pågick sedan under 8 h. Då hade OD stigit till ett värde av 10, 0. Enligt tidigare resultat befann sig då bakterien i logfas, (Tabell 1, Figur 2) och därmed avslutades odlingen. 20 ml glycerol tillsattes fermentorn och efter omblandning togs provet ut i 20 st. sterila eppendorfrör. De 20 rören som erhölls placerades sedan i frys (-70ºC).
Tabell 3. OD-mätningar för monitorering av tillväxt under odling av M.lutea försök 2
Prov Tid Glukos OD
(min) (volym) 0 0 0,030 1 20 0,056 2 40 0,066 3 70 5 ml 0,080 4 100 10 ml 0,088 5 130 10 ml 0,106 6 160 10 ml 0,138 7 190 10 ml 0,192 8 220 0,268 9 250 0,396 10 280 0,566 11 310 0,830 12 335 1,150 13 360 1,640 14 390 2,640 15 415 3,800 16 445 5,520 17 475 6,200 18 495 10,04 0 2 4 6 8 10 12 0 100 200 300 400 500 600 Tid(min) O p ti s k d e n s it e t
20 0 0,5 1 1,5 2 2,5 0 100 200 300 400 500 600 Tid(min) o p ti s k d e n s it e t
Figur 7. Logaritmerad logfas av tillväxtkurva Mikrococcus.lutea försök 2
Beräkning av µ m.h.a. den räta linjens ekvation: ∆y = 1,569
∆x = 110 min µ = 0,01426 tg = 48,6 min
Resultatet överensstämmer väl med resultatet från försök 1.
E. coli försök 2
Fermentorn monterades och givare kalibrerades på samma sätt som vid tidigare
odlingstillfällen. 200 ml dubbelt LB-medium blandades. Mediet fördes över till en 500 ml E-kolv och autoklaverades därpå tillsammans med 150 ml 40 % glukos (separat durexflaska) samt skumdämparolja. Efter steriliseringen flyttades materialet över till påslagen LAF-bänk. 1000 ml dubbelt LB-medium blandades med peptone baserat på soyabönor istället för tryptone. Förkulturen ympades med en koloni från en plattodling av E-coliJM109. Odling på skakinkubator gjordes lika tidigare.
Efter 8,75 h odling i skakinkubator utfördes ympen av fermentorn. Temperaturen var då 36,5ºC, rpm 130 och pH 6,93. Syreregleringen kallibrerades till 100% i samband med ympen. Inluften drogs ned till 0 cc/min då just denna stam av E-coli visat sig syrekänslig i början av odling. Omrörningen reglerades manuellt under odlingens gång. Glukosstickor användes för att registrera glukoshalten. 3 h in i odlingen var omrörningen inställd till 500 rpm och inluften uppskruvad till 6 cc/min. Celler för förvaring i stambank togs ut och frystes in vid ett OD på 6. På rekommendation av handledaren tillsattes 150 ml glycerol/l. OD-mätning efter 5 h visade 5,84, se (Tabell 4 och Figur 8). Glycerol tillsattes fermentorn m.h.a. sterilpipetter, volym 25 ml. Fermentorn förflyttades till LAF-bänk. De sterila eppendorfrören fylldes under iakttagande av aspetik. 78 eppendorfrör frystes in i -70º C. Ett av eppendorfrören användes för kontaminationstest samt mätning. Med ympögla ströks provet ut på LB-platta.
OD-21 mätningen gav en absorbans på 6,28 vid skörd av kulturen (se Figur 8). På LB-plattan kunde nästföljande dag inga främmande kolonier upptäckas.
Tabell 4. OD-mätningar för monitorering av tillväxt under odling av E.coliJM109 försök 2
Prov Tid Glukos OD
(min) (volym) 0 0 0,122 1 10 0,146 2 35 0,170 3 55 6 ml 0,212 4 75 0,248 5 105 0,446 6 135 0,710 7 155 1,680 8 175 2,420 9 200 2,500 10 220 3,060 11 245 4,260 12 265 4,960 13 280 5,840 0 1 2 3 4 5 6 7 0 50 100 150 200 250 300 Tid(min) O p ti s k d e n s it e t
22 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2 0 50 100 150 200 250 300 Tid(min) o p ti s k d e n s it e t
Figur 9. Logaritmerad logfas av tillväxtkurva E.coliJM109 försök 2
Bedömning av µ m.h.a. den räta linjens ekvation: ∆y = 0,848
∆x = 80 min µ = 0,0106 min-1
tg = 65 min
E. coli försök 3
Fermentorn monterades och givare kalibrerades lika tidigare. Tinade celler från cellbanken användes direkt för ymp av fermentorn. 1000 ml medium blandades lika tidigare och
överfördes till den monterade fermentorn. Även 300 ml 40 % glukos blandades lika tidigare i en separat duralexflaska. Slangar för bas och syra kläddes i folie och skumdämparolja
överfördes till duralexflaska. Varorna autoklaverades som vid tidigare odlingstillfällen. Fermentorn ympades med 5 ml EcoliJM109 från cellbanken. Temperaturen i
odlingskärlet var vid tillfället för ymp 28,9°C och pH 6,9. Omrörningen var nästan 0 rpm och luftflödet var frånslaget. Efter ca 2 h ökades inluften till 3 cc/min. Omrörningen justerades till 260 RPM. 10 minuter senare tillsattes första satsen glukos och den var 5 ml. Glukosstickor användes för att mäta nivån av glukos i odlingen. Omrörningen ökades successivt manuellt under odlingen och efter fyra timmars odling var RPM inställt på 675. 5,5h efter ymp tillsattes ytterligare 5 ml glukos. Strax innan denna andra tillsats av glukos ökades omrörningen till 985 rpm. En sänkning i pH efter tillsatsen av glukos indikerade att 5 ml möjligtvis var en aning för mycket, se (Tabell 5, Figur 10 och Figur 11).
23
Tabell 5. OD-mätningar för monitorering av tillväxt vid odling av E.coliJM109
Prov Tid Glukos OD
(min) (volym) 0 0 0,040 1 30 0,058 2 60 0,060 3 80 0,064 4 140 5 ml 0,088 5 180 0,182 6 210 0,262 7 240 0,424 8 270 0,820 9 295 1,360 10 325 5 ml 2,270 11 355 2,680 12 380 3,720 13 410 3 ml 4,660 14 430 3 ml 5,640 15 450 6,720 16 475 7,360 17 485 8,560 18 495 8,800 0 2 4 6 8 10 0 100 200 300 400 500 600 Tid(min) O p ti s k d e n s it e t
24 0 0,5 1 1,5 2 2,5 0 100 200 300 400 500 600 Tid(min) op ti sk d en si te t
Figur 11. Logaritmerad logfas av tillväxtkurva EcoliJM109 försök 3
Bedömning av generationstiden m.h.a. den räta linjens ekvation: ∆y = 1,01
∆x = 120 min µ = 0,0084 min-1 tg = 82,35 min
Lagfasen var längre i försök 3 i jämförelse med försök 2 för E.coliJM109. Den förändrade strategin för glukostillsats avspeglas i kurvornas utseende då logfasen kan identifieras vilket inte var möjligt i försök 1. Generationstiderna skiljer sig med ca 17 min och den längre lagfasen i försök 3 kan vara att härleda till bytet av tryptone till peptone. Ympförfarandet skiljde sig också, vilket också kan ha bidragit.
Resultat
Adhesionsförsök med M. lutea
CLED-plattor användes under försöket. Se metoddelen sid. 10-11 för information om hur mikroorganismen adherades till fibrerna.
Tabell 6. Resultat av adhesionsförsök med M. lutea adhering till blekt lövvedsmassa.
Spädning Icke adherade Adherade
Ospädd 1µL överväxt i primärstryket överväxt i primärstryket
1/100 överväxt överväxt men mindre till antalet
1/1000 ca 300 st = 1,2 × 107 CFU/l ca 50 st = 2 × 106 CFU/l
Kolonibildning före och efter adhesion:
25 Resultatet visar en reduktion på106 kolonibildande enheter per L vilket motsvarar en
reduktion om c:a 90 % efter att odlingen kommit i kontakt med den blekta lövvedsmassan. Detta resultat är en stark indikation på att bakterien fäst till den blekta lövmassan.
Adhesionsförsök E. coliJM109
Motsvarande adhesionförsök utfördes på E.coli JM109. Ympningen till förkulturen utfördes med colibakterier från cellbanken. CLED-plattor användes för utodling av
E-colibakterierna precis som i föregående adhesionsförsök.
Resultatet av kontaktförsöket påvisade inga skillnader i antalet kolonier mellan proverna före och efter kontakt. Samtliga CLED-plattor påvisade överväxt av antalet kolonier. E.coli tycks ha egenskaper som är svåra att förutsäga. Det krävs större precision i försöksvariablerna. Adhesionsmetoden tycks inte vara tillräckligt välpreciserad.
Totalladdning av massor
För att kunna se ett sammanhang mellan laddning och graden av bindning så mättes den totala laddningen av de fyra olika massorna. Noterbart är att båda massorna hade en högre laddning i sitt oblekta tillstånd och att lövvedsmassa uppvisade en högre laddning i jämförelse med barrmassa.
Tabell 7. Totalladdning massor.
Medelvärde blekt löv: 71,3 µekv/g Medelvärde blekt barr: 43,5 µekv/g Medelvärde oblekt löv: 146,5 µekv/g Medelvärde oblekt barr: 91,0 µekv/g
26
Konduktivitetstitrering
Konduktivitet är ett mått på hur väl ett material kan transportera elektrisk laddning. Denna faktor kan ha en avgörande inverkan på ett materials vidhäftningsförmåga.
Konduktivitetsmätningen utfördes först enbart på bufferten och sedan på de fyra olika massorna Konduktivitetstitrering Buffert 0 10 20 30 40 50 60 70 80 90 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Vol(m l) K o n d (µ S /c m )
Figur 12. Konduktivitetstitrering av Buffert. Konduktivitetens beroende av tillsatt volym 0,1M NaOH. Vol(ml) Kon(µS/cm) 0 66,9 0,2 54,5 0,4 40,1 0,55 48 0,85 55,9 1,1 64,9 1,5 83,7
27
Konduktivitetstitrering Blekt lövvedsmassa
0 10 20 30 40 50 60 70 80 90 100 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Vol(m l) K o n (µ S /c m )
Figur 13. Konduktivitetstitrering blekt lövvedsmassa. Konduktivitetens beroende av tillsatt volym 0,1M NaOH. Vol(ml) Kon(µS/cm) 0 53,9 0,2 43,9 0,4 41,5 0,5 44 0,9 60,3 1,2 78,5 1,5 90,4
28
Konduktivitetstitrering Blekt barrvedsmassa
0 10 20 30 40 50 60 70 80 90 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 Vol(ml) K o n d (µ S /c m )
Figur 14. Konduktivitetstitrering av blekt barrvedsmassa. Konduktivitetens beroende av tillsatt volym 0,1M NaOH.
Vol(ml) Kond(µS/cm) 0 59,6 0,1 54 0,2 47,2 0,4 40,3 0,6 40,6 0,8 51,3 1 62,8 1,2 72,6 1,4 79,3
29
Konduktivitetstitrering Oblekt lövvedsmassa
0 20 40 60 80 100 120 140 160 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 Vol(ml) K ond( µ S /c m )
Figur 15. Konduktivitetstitrering av oblekt lövvedsmassa. Konduktivitetens beroende av tillsatt volym 0,1M NaOH.
Vol(ml) Kond(µS/cm) 0 89,7 0,2 97,3 0,5 107,7 0,6 112,2 0,8 119,6 0,9 125,5 1,1 134,5 1,4 146,6 1,7 158,1
30
Konduktivitetstitrering Oblekt barr
0 20 40 60 80 100 120 140 160 180 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 Vol(m l) K o n d (µ S /c m )
Figur 16. Konduktivitetstitrering av oblekt barrvedsmassa. Konduktivitetens beroende av tillsatt volym 0,1M NaOH.
Vol(ml)Kond(µS/cm) 0 89,7 0,2 97,3 0,5 107,7 0,6 112,2 0,8 119,6 0,9 125,5 1,1 134,5 1,4 146,6 1,7 158,1
I massornas oblekta form är konduktiviteten mycket hög initialt (runt 90 µS/cm) till skillnad från i blekt tillstånd (runt 55-60 µS/cm). Konduktiviteten för de oblekta massorna påvisade en stigande konduktivitet genom hela titreringen. Titreringen på endast buffert gav en högre konduktivitet initialt (runt 70 µS/cm), i jämförelse med massornas blekta form. Noterbart är också att konduktiviteten aldrig sjunker lägre än 40 µS/cm, varken under titreringen på bufferten eller i massornas blekta form.
31
Elektronmikroskopbilder
Elektronmikroskop bilder av blekt lövvedsmassa med adherenta E. coli bakterier. Bilderna togs med syftet att se hur bakterierna fäste till materialet.
Bilderna visar samma preparat. Den första bilden är tagen med förstoringsgraden 1×3500 och den andra 1×10000. Bakterien syns tydligt på båda bilderna och tycks ligga adherent på ytan till materialet.
32
Diskussion
Studien inleddes med upprepade odlingar av de båda mikroorganismerna för att studera egenskaperna hos bakterierna. Tillväxtkurvor gjordes för de båda mikroorganismerna.
Tillväxtkurvorna baserades på optisk densitet som mättes under pågående odlingar. Syftet var att kontaktförsöken senare skulle utföras med mikroorganismerna i logfas.
Över hälften av odlingarna genomfördes utan möjlighet att mäta glukoshalten. Under dessa inledande odlingar tillsattes rikligt med glukos. När sedan användandet av glukosstickor påbörjades visade det sig att en mycket mindre mängd glukos troligen varit tillräcklig. För mycket glukos har en negativ effekt på tillväxten hos bakterier och proteiner då oönskade syror produceras. M.lutea verkade dock inte påverkas av den höga halten glukos. Däremot visade sig E.coli lite mer känslig i detta avseende då tillväxten saktade av vid ett par tillfällen.
E.coli visade sig också känslig i andra avseenden. Då den under ett flertal tillfällen visade sig trögstartad och vid något tillfälle inte alls ville växa så gjordes ett antagande om att stammen var syrekänslig (Sven Hamps kommentar). Metoden ändrades så att syrehalten i början hölls nära noll. Så fort tillväxt påvisats genom absorbansmätningarna skruvades syretillförseln upp succesivt. Mikrococcin som är strikt aerob trivdes med hög syretillförsel genom hela
odlingen.
På STFI mättes totalladdningen av pappersmassorna. Dessa mätningar indikerade att lövvedsmassa i dess båda tillstånd påvisade en högre totalladdning i jämförelse med barr. Den oblekta formen för lövmassa gav ett värde på 146,5 µekv/g medan den oblekta barrmassan gav ett värde på 91,0 µekv/g. Den blekta massan gav ett värde på 71,3 µekv/g för lövmassa och 43,5 µekv/g för barrmassa. Påföljande konduktivitetstitreringar utförda efter dessa mätningar visade ingen noterbar skillnad mellan massorna, däremot mellan de båda kvaliteterna. I massornas oblekta form var konduktiviteten mycket högre initialt (runt
90µS/cm) till skillnad från i blekt tillstånd (runt 55-60µS/cm). Konduktiviteten för de oblekta massorna påvisade en stigande konduktivitet genom hela titreringen där de blekta massorna uppträdde mer förutsägbart.
I studier av liknande karaktär har olika slutsatser kunnat dras. I en studie gjordes experiment med varierande jonstyrkor hos en- och tvåvärdar metalljoner för att karakterisera den hydrofila karaktären hos cellulosafibrer. Studien kom med slutsatsen att elektrostatiska krafter är involverade i adhesionsprocessen genom Lewissyra-basinteraktion vid låg
jonstyrka6.
I en annan studie gjordes antagandet att hydrofoba, icke specifika interaktioner är bestämmande för bakterieadhesionen, detta p.g.a. att både fiberyta och bakteriers cellyta är starkt elektrondonerande. I denna studie bestämdes ytenergin hos olika fibrer genom indränkning med vätska i kapillaritetsstudier på provark med olika vätskor7.
En tredje studie visade också ett intressant resultat. I denna studie användes laboratoriefilter av nylon, cellulosa och glasfibrer. Två Gram-negativa och en Gram-positiv bakterie användes i studien och den visade att bakterier passerar filter där porvidden är minst 5 gånger
bakteriediametern. Med en förminskad porstorlek kan bakterier lätt hållas kvar genom adhesion8. För att undersöka hur molekylära interaktioner såsom van der Waals och elektrostatiska bindningar på olika sätt påverkar bakteriernas pappersmassabindande egenskaper vore det intressant att använda atomic force mikroskopiteknik. Denna typ av studie har även föreslagits av Dufrene Y.F9.
Adhesionsförsöken visade sig komplicerade och lämnade stort utrymme för optimering vid fortsatta studier. Minimering av hantering samt sterilisering av massan inklusive
resterande ingående material och utspädningslösning är essentiellt. Adhesionsförsöket med
M.lutea som vidhäftande mikroorganism får anses som det mest lyckade då en tydlig reduktion av kolonier efter kontakt kunde påvisas. Det bör dock nämnas att reduktionens
33 uppkomst nödvändigtvis inte beror på att mikroorganismen fäst till materialet. Samma
förfarande med E.coli visade varierande resultat utan möjlighet att dra slutsater av.
För vidare studier i ämnet föreslås främst användning av M.lutea då denna ger jämnare resultat under både odling och adhesionsförfarande. Intressant här är den uppmätta skillnaden i totalladning mellan massorna och sambandet med kvaliteten. Även information från
konduktivitstitreringarna kan vara av intresse att jämföra. Försök bör också göras med konduktivitetsmätningar efter kontakt mellan massa och bakterier. Det är svårt att uttala sig om materialens användbarhet för dessa försök. Vidare studier måste genomföras. Dock finns en del information om materialen som kan vara av intresse för vidare experiment, så som laddning och konduktivitet. Elektrostatiska krafter bör verka repulsivt då fibrerna har en negativ yta, vilket även bakterierna har. De stora skillnaderna i laddning mellan massorna i oblekt respektive blekt tillstånd borde alltså kunna spela roll för adhesionen. Det vore intressant att undersöka. Andra variabler som kan vara intressanta att undersöka är om adhesionen varierar under inverkan av olika pH eller om det går att detektera skillnader i adhesion i samband med olika tillväxtfaser hos mikroorganismerna.
34
Referenser
1. Bacterial adhesion to Cells and Tissues. Ofek, I. And Doyle, R.J. Chapman & Hall 1994, ISBN 0-412-03011-X, s 5
2. http://cmr.asm.org/cgi/content/full/15/2/155#Docking:%20Primary%20Bacterial%20 Adhesion, 071215, American society for Microbiology.
3. Ofek, I. And Doyle, R.J. Chapman & Hall, s 84 4. Ofek, I. And Doyle, R.J. Chapman & Hall, s 54-59
5. Handout: Laboration i fermentationsteknik december -06- januari – 07
6. Adhesion of Pseudomonas putida KT2442 Is Mediated by Surface Polymers at the Nano and Microscale. Environmental Engineering Science (2205), 22(5), 629-641. Bell, C.H., Arora, B.S. et al.
7. Determination of Cellulose Surface Energy by Imbibition Experiments in Relation to Bacterial Adhesion. Journal of Dispersion Science and Technology (2004), 25(6), 781-787. Pezron, I, Rochex, A. et al
8. Removal of bacteria in laboratory filters: models and experiments. Water research (1993), 27(6), 955-62. Logan, B.E., Hilbert, T.A. et al.
9. Application of atomic force microscopy to microbial surfaces: from reconstituted cell surface layers to living cells. Micron (Oxford England: 1993) (2001), 32(2), 153-65. Dufrene Y.F.
35
Bilaga 1
Beräkningar Beräkning av totalladdning på massor 5/11
I botten av kurvan drogs en baslinje (se bilagor 2-9). Sedan ritades en linje längs kurvans högra linje som också går igenom den omslagspunkt som datorn registrerat. Där denna linje korsar baslinjen, där erhålls den nya omslagspunkten. Sedan räknades skalan om m.h.a. linjal. En punkt till höger om den nya omslagspunkten där milliliteranatalet är känt, t.ex. 1,000 ml användes för att dividera med antal cm ut till denna punkt. Denna siffra multiplicerades sedan med antal cm vid omslagspunkten. Detta gav ny Cond EP (ml). 500 ml drogs sedan ifrån vilket gav en ny egentlig EP. Detta tal multiplicerades med 100 vilket gav µekv. Den exakta invägda massan dividerades sedan med föregående siffra för att få µekv/g. Dubbelprov utfördes. Mer än tio % differans på proven indikerar någon slags felfaktor.
Blekt löv prov 1: ((1,0 / 11,65 * 9,75) - 0,500) * (100 / 0,4674) = 72,0812 µekv/g Blekt löv prov 2: ((1,0 / 10,2 * 8,7) – 0,500) * (100 / 0,5001) = 70,5741 µekv/g Medelvärde blekt löv: 2 5741 , 70 0812 , 72 + = 71,328 µekv/g Blekt barr 1: ((1,0 / 11,65 * 8,9) - 0,500) * (100 / 0,5935) = 44,4732 µekv/g Blekt barr 2: ((1,0 / 11,65 * 8,6) - 0,500) * (100 / 0,5607) = 42,4821 µekv/g
Medelvärde blekt barr: 43,4777 2 4821 , 42 4732 , 44 = + µekv/g Oblekt löv 1: ((1,4 / 11,4 * 9,5) - 0,500) * (100 / 0,4564) = 146,0706 µekv/g Oblekt löv 2: ((1,4 / 12,7 * 10,7) - 0,500) * (100 / 0,4626) = 146,89311 µekv/g Medelvärde Oblekt löv: 146,4818 2 89311 , 146 0706 , 146 = + µekv/g
36
Oblekt barr 1:
((1,2 / 12,2 * 9,5) - 0,500) * (100 / 0,4956) = 87,6566 µekv/g
Oblekt barr 2:
((1,2 / 10,9 * 8,8) – 0,500) * (100 / 0,4969) = 94,3464 µekv/g
Medelvärde Oblekt barr: 91,0015 2 3464 , 94 6566 , 87 = + µekv/g
Beräkningar lösning A och B för Fosfatbuffrad salin (PBS) 1L
Lösning A: 100ml 0,2M NaH2PO4
NaH2PO4*2H2O=156 g/mol
0,2mol/L*0.100L=0,02mol 0,02 mol*156g/mol=3,12g Lösning B: 250ml 0,2M Na2HPO4 Na2HPO4*2H2O=178g/mol 0,2 mol/L*0,250L=0,05mol 0,05mol*178g/mol=8,9g
37
Bilaga 2
38
Bilaga 3
39
Bilaga 4
40
Bilaga 5
41
Bilaga 6
42
Bilaga 7
43
Bilaga 8
44