Examensarbete i
PROTOKOLLUTVECKLING FÖR
CALDESMON SAMT EN
JÄMFÖRELSE MED SMMS-1 AV
DESS EFFEKTIVITET SOM EN
MYOEPITELIAL MARKÖR PÅ
FIBROADENOM
PROTOKOLLUTVECKLING FÖR
CALDESMON SAMT EN
JÄMFÖRELSE MED SMMS-1 AV
DESS EFFEKTIVITET SOM EN
MYOEPITELIAL MARKÖR PÅ
FIBROADENOM
SAHRA BRENTEL
Brentel S. Protokollutveckling för caldesmon samt en jämförelse med SMMS-1 av dess effektivitet som en myoepitelial markör på fibroadenom vävnad.
Examensarbete i biomedicinsk laboratorievetenskap 15 högskolepoäng. Malmö högskola: Fakulteten för hälsa och samhälle, institutionen för biomedicinsk vetenskap, 2017.
Immunohistokemi (IHK) är en metod som används för att undersöka närvaron av specifika biomarkörer i vävnad. Metoden utnyttjar antikroppars affinitet till antigen och dess närvaro visualiseras. Caldesmon är ett protein associerat med cytoskelettet som förekommer i glatta muskelceller och i icke-muskelceller. Det används inom IHK som en glatt muskelmarkör men även som en markör för myoepiteliet. Syftet med studien var att utveckla ett nytt protokoll för caldesmon och att jämföra den med SMMS-1, även den en markör för glatt muskulatur och myoepiteliet. Jämförelsen utfördes på fibroadenom vävnad, en bröstcancerform som utvecklats ur epitelialvävnad och stroma, då den innehåller mycket
myoepitelial celler. För att effektivisera processen användes tissue microarray tekniken, där vävnad från flera olika preparat (klotsar) stansades ut och
sammanfördes till en ny klots. Instrumentet Ventana Benchmark Ultra användes för att utveckla ett nytt protokoll för caldesmon. Det nya protokollet användes sedan vid jämförelsen med SMMS-1. Resultatet visade att SMMS-1 gav en tydligare infärgning av det myoepiteliala lagret då det enbart färgade in det, medan caldesmon även färgade in stroma. Då fibroadenom vävnad innehöll mycket stroma var det svårare att urskilja det myoepiteliala lagret från dess omgivning med caldesmon infärgningen.
Nyckelord: Caldesmon, fibroadenom, immunohistokemi, protokoll, SMMS-1, tissue microarray
PROTOCOLDEVELOPMENT FOR
CALDESMON AND A
COMPARISON OF ITS
EFFICIENCY AS A
MYOEPITHELIAL MARKER IN
FIBROADENOMA WITH SMMS-1
SAHRA BRENTEL
Brentel S. Protocoldevelopment for caldesmon and a comparison of its efficiency as a myoepithelial marker in fibroadenoma with SMMS-1. Degree project in Biomedical laboratory science, 15 högskolepoäng. Malmö University: Faculty of health and society, Department of biomedical science, 2017
Immunohistochemistry (IHC), is a method used for examining the presence of specific biomarkers in tissue. It uses antibodies affinity for antigens and their presence can then be visualized. Caldesmon is a protein that is associated with the cytoskeleton in smooth muscle and non-smooth muscle cells. It is used within IHC as a marker for smooth muscle but also as a marker for the myoepithelium. The intent of this study was to develop a new protocol for caldesmon and to compare it with SMMS-1, also a marker for smooth muscle and the
myoepithelium. The comparison was performed on tissue from fibroadenoma, a type of breast cancer that evolved from epithelial tissue and stroma, due to its high content of myoepithelial cells. For optimal effectiveness, the tissue microarray technique was used, where tissue from several blocks are extracted and brought together into a single new block. A Ventana Benchmark Ultra was used to develop a new protocol for the new antibody, caldesmon. The new protocol was used in the comparison with SMMS-1 on fibroadenoma tissue. The results were that SMMS-1 had a clearer and sharper staining of the myoepithelial layer, due to the fact that it only stained the layer. While caldesmon also stained the stroma in the tissue. Because fibroadenom tissue contained so much stroma the staining done with caldesmon made it harder to separate the myoepithelial layer from its surroundings.
Keywords: Caldesmon, fibroadenoma, immunohistochemistry, protocol, SMMS-1, tissue microarray
FÖRORD
Jag skulle först och främst vilja tacka mina handledare Annika Nilsson och Maria Stollenwerk för deras hjälp under det här examensarbetet. Jag vill även tacka personalen på klinisk patologi på CSK. Ett speciellt tack till Ernestas Petkovicius, patologen som hjälpte mig att utvärdera resultatet och Charlotte Haraldsson för hjälpen med tissue microarray. Jag vill även tacka enhetschefen, Leif Gillving, för möjligheten att utföra mitt examensarbete på klinisk patologi på CSK
INNEHÅLLSFÖRTECKNING
BAKGRUND 5 Immunohistokemi 5 Caldesmon 6 SMMS-1 6 Tissue microarray 6 Tidigare studier 7 Syfte 7MATERIAL OCH METOD 7
Material 8 Metod 8 Protokollutveckling för caldesmon 8 Etisk frågeställning 9 RESULTAT 10 DISKUSSION 13
Jämförelse mellan SMMS-1 och caldesmon 14
Förbättringar 15
KONKLUSION 16
REFERENSER 17
BAKGRUND
Fibroadenom är en benign tumör och det är den vanligaste bröst tumören hos unga kvinnor. Det utvecklas från epitelet och stroma, den mjuka bindväven, i
mjölkkörteln. Tumören är i de flesta fall en smärtfri fast massa som ej är större än tre centimeter och den behandlas normalt med kirurgisk excision. Fibroadenom har en spridning av körtelvävnad och stroma gemensamt. I körtelvävnad återfinns myoepiteliala celler som är kontraherande element och förekommer i saliv-, svett- och bröstkörtlar. Dessa celler påvisar både glatt muskulatur och epiteliala
fenotyper i kombination med varandra. I normal bröstvävnad förekommer ett intakt lager av myoepiteliala celler. Vid fibroadenom (men även andra
cancerformer) används förekomsten av det myoepiteliala lagret som en diagnos för in situ eller invasiv cancer. Med in situ cancer menas att cancern inte har spridit sig i vävnaden tillskillnad från invasiv cancer som har spridit sig. Inom bröstpatologi är det därför viktigt att kunna urskilja om det myoepiteliala lagret är intakt, något som kan vara svårt att göra med enbart rutin infärgningar som hematoxylin och eosin. Immunohistokemi används för att ge ett tydligare resultat. Då myoepiteliala celler påvisar både glatt muskulatur och epitel fenotyper
används normalt antikroppar som märker in glatt muskulatur, till exempel SMMS-1, h-caldesmon, S-100, calponin och SMA (smooth muscle actin) [1–3].
Immunohistokemi
Immunohistokemi (IHK) är en metod som används för att bestämma biomarkörer som uttrycks i vävnader och den utnyttjar antikroppar och antigens affinitet för varandra. IHK används som ett komplement vid diagnostik av främst cancer men även andra sjukdomar som till exempel infektioner. Med IHK kan man bestämma en tumörs ursprung, det används även för att sätta en korrekt diagnos och den optimala behandlingen för patienten i fråga [4–7].
Vävnad som ska immunofärgas måste först genomgå den histologiska processen med fixering, utskärning, dehydrering, inbäddning, snittning och
värmebehandling. Skillnaden från normal färgning är att snitten läggs på plusglas, dess positiva laddning attraherar negativa strukturer i vävnaden och snittet binds till glaset med jonbindningar. Det är essentiellt att använda en kontroll vid immunofärgning. Kontrollen kan vara positiv (vävnad som uttrycker antigenen) eller negativ (vävnad som inte uttrycker antigenen), detta för att försäkra sig om att metoden fungerar som den ska. [5,7].
Epitop återvinning
Antigen i vävnaden förändras av de histologiska processerna. Bland annat så förändras proteiners strukturer. Formalin (det vanligaste fixeringsmedlet) avstannar enzymatisk aktivitet och förhindrar förruttnelseprocesser. Vid fixeringen bildas metylenbryggor vilket kan blockera epitopen och hindra antikroppens inbindning. Förändringarna är dock reversibla och kan återställas med värmeinducerad epitop återvinning då vätebindningarna i metylenbryggorna bryts [5,8]. Vid värmeinducerad epitop återvinning värms objektglaset upp till höga temperaturer i en speciell återvinnings lösning. Till Ventana Benchmark Ultra används två olika färdiga lösningar från Ventana, CC1 (Ventana Medical systems inc, Tucson, USA) och CC2 (Ventana Medical systems inc, Tucson, USA). CC1 (”cell conditioning”) är en Trisbaserad buffert med ett lätt basiskt pH och CC2 är en Citratbuffert som har ett lätt surt pH. Båda lösningarna
temperatur [9,10]. Förutom värmeinducerad epitop återvinning förekommer även enzyminducerad epitop återvinning där proteolytiska enzym frilägger epitopen. Den metoden används dock inte lika ofta kliniskt som den värmeinducerade och användes därför inte i studien [5,8].
Visualisering av antigenen
För att visualisera närvaron av antigenen kan olika metoder användas som till exempel immunoflourescens där en antikropp märkt med en flourokrom omvandlar ljus som ej är synligt för det mänskliga ögat till synligt ljus vid en annan våglängd. En annan vanlig metod är avidin-biotin metoden, där en primär antikropp tillsätts som binder in till antigen. En sekundär antikropp som är konjugerad med biotin binder in till den primära antikroppen. Biotin har en stark affinitet för avidin och det tillsätts som ett komplex med HRP (horseradish peroxide). Vid tillsatts av ett färglöst ämne, en kromogen, bildas en färgad produkt när den reagerar med peroxidaset. För att förtydliga
antikroppsinfärgningen används kontrastfärgning, vilket främst består av hematoxylin och eventuell blåning [5,11,12].
Caldesmon
Caldesmon är ett protein associerat med cytoskelettet som förekommer i glatta muskelceller och i icke-muskelceller. En gen på kromosom sju kodar för caldesmon som splitsas till två isoformer, h-caldesmon och i-caldesmon. H-caldesmon har en hög molekylvikt (89–93 kDa) och tros vara begränsat till glatta muskelceller och myoepiteliala celler. Det binder till calmodulin och Ca2+ och
reglerar kontraktion i glatt muskulatur genom Ca2+-beroende inhibering.
I-caldesmon har lägre molekylvikt (59–63 kDa) och återfinns i icke-muskelceller. Det är en reglerande faktor i mikrofilament, där det stabiliserar och sätter ihop mikrofilament. Båda isoformerna har förmågan att binda in till aktin,
tropomyosin, myosin, Ca2+-kalmodulin och fosfolipder. De är även starka
inhibatorer av myosin MgATPas (magnesium ATPas) som aktiverats av aktin-tropomyosin. Antikroppar som binder till caldesmon används inom IHK som markörer för glatta muskelceller och myoepiteliala celler [13,14].
SMMS-1
SMMS-1 står för ”smooth muscle myosin, heavy chain 1” (kan även förkortas SMHC eller SM-MHC). Proteinet fungerar som fungerar som en strukturell komponent i myosin och det förekommer i glatt muskulatur. Det är strukturellt likt de tunga myosin kedjor som finns i skelett- och hjärtmuskulatur [14,15]. SMMS-1 består av två tunga kedjor, en på 17 kDa och en på 20 kDa. SMMS-1 förekommer enligt äldre studier i två isoformer [16,17]. Nyare vetenskapliga studier har visat att det finns ytterligare två isoformer, nämligen SM1A, SM1B, SM2A och SM2B [15,18]. SMMS-1 används som en markör för glatt muskulatur men även som en myoepitel markör [19].
Tissue microarray
Microarray är en teknik som går ut på att organisera små mängder av biologiska prover på en stabil bas. Vid tissue microarray stansas mindre delar från olika paraffin inbäddade vävnadsbitar och bäddas in i en ny paraffin klots, se figur 1. Det kan utföras manuellt eller maskinellt. Med tissue microarray instrument stansas ett hål i en tom paraffin klots som sedan fylls av en stans av samma storlek tagen från en klots med vävnad. Detta upprepas för de resterande klotsarna och den förut tomma klotsen fylls med små vävnadsbitar. Manuellt stansas
vävnadsbitar ut för hand och bäddas sedan ihop i en ny klots. Tissue microarray kan utföras med olika storlekar på stanserna och därav kan klotsar innehålla olika antal stanser. Om man stansar biopsier med storleken två mm så kan man rymma cirka 40 stycken vävnadsbitar per klots. Medan om man stansar med storleken 0,6 mm kan en klots rymma upp till 600 stycken. Då enbart en stans av en klots används kan den med hjälp av microarray räcka till fler undersökningar. Då färre färgningar behöver utföras sparas tid, material och personal [20,21].
Figur 1: Bilden visar klotsar framställd med hjälp av tissue microarray teknik som gjordes och användes i studien. På var klots finns 15 biopsier från olika givar klotsar.
Tidigare studier
I en tidigare studie som studerade ett fall av fibroadenom utfördes IHK på tumörmaterialet. Materialet kom från en ung kvinna, 27 år, som genomgått kirurgisk excision. Olika IHK färgningar utfördes bland annat caldesmon som färgades positivt [2]. Både SMMS-1 och caldesmon har använts vid studier av olika cancertyper i bröstvävnad. Studierna har undersökt fibroadenom,
bröstkarcinom, duktal karcinom och vid återkommande bröstcancer [2,3,22]. I tidigare studier har caldesmon och SMMS-1 använts som myoepiteliala markörer. Mänskligt bröstkörtelmaterial användes till IHK. Det myoepiteliala lagret
färgades in med både caldesmon och SMMS-1 [23]. SMMS-1 har även använts som myoepitelial markör för att skilja bröstkarcinom från duktal karcinom [3].
Syfte
Syftet med studien är att utveckla ett nytt protokoll för caldesmon. Caldesmons användbarhet som en myoepitelial markör på fibroadenom vävnad ska jämföras med SMMS-1 som är en av de antikroppar som rutinmässigt används som myoepitelial markör.
MATERIAL OCH METOD
Studien genomfördes på avdelningen klinisk patologi på Centralsjukhuset Kristianstad (CSK). Där IHK utfördes i en Ventana Benchmark Ultra (Ventana Medical systems inc, Tucson, USA). Tissue microarray utfördes manuellt under handledning av en biomedicinsk analytiker. Klotsarna snittades i en mikrotom (Leica, Biosystems, Wetzlar, Tyskland) och lades på plusglas (SuperFrost Plus, VWR, Radnor, USA).
Material
Caldesmon (E89) Rabbit Monoclonal Antibody (Ventana Medical systems inc, Tucson, USA). införskaffades. Denna specifika antikropp var redan utspädd i en färdig dispenser. Detta resulterade att protokollutvecklingen ej behövde innehålla olika spädningar av caldesmon utan studien fick fokusera på andra steg inom IHK.
Monoclonal Mouse Anti-human Smooth Muscle Myosin Heavy Chain, SMMS-1 (Dako, Glostrup, Danmark) användes.
Preparat till protokollutvecklingen
Till protokollutveklingen användes preparat som tidigare snittats och vars objektglas färgats med caldesmon på klinisk patologi i Malmö respektive Lund. Detta för att jämföra de nya protokollens effektivitet och färgnings resultat med redan infärgat material. Klotsarna från dessa sex preparat snittades och färgades med de nya protokollen för caldesmon.
Preparat till jämförelsen
Preparaten som användes till jämförelsen mellan caldesmon och SMMS-1 valdes utifrån fall diagnostiserade med fibroadenom under perioden 2015 och 2016 på klinisk patologi, CSK. Bland dessa glas valdes 20 olika fall och från dem valdes 30 objektglas ut. De utvalda glasens klotsar hämtades ut från arkivet och de sammanställdes till två klotsar med hjälp av tissue microarray teknik. Kontrollvävnad
Vid IHK krävs det att även en kontrollvävnad färgas med de antikroppar som skall användas. En positiv kontroll används för att försäkra att färgningen har fungerat [5]. I denna studie har en så kallad ”MB1” kontroll använts. ”MB1” innehåller tre olika vävnadsbitar, från tonsill, appendix och lever.
Metod
I denna studie användes främst IHK metoden med även tissue microarray användes.
Tissue microarray
Från de utvalda klotsarna stansade cylindriska bitar av vävnaden (biopsier). Dessa vävnadsbitar bäddades sedan in i en ny klots. Metoden utfördes manuellt med handledning av en biomedicinsk analytiker.
Visualisering av antigenen
I denna studie har avidin-biotin metoden använts för att visualisera antigenet. DAB har använts som kromogen, vilket omvandlas till en brun färg när det tillsätts till avidin-biotin komplexet [11].
Protokollutveckling för caldesmon
Utvecklingen av ett nytt protokoll till caldesmon utfördes i tre steg. Det första steget innehöll tre olika protokoll (protokoll 1–3), det andra steget innehöll två olika protokoll (protokoll 4-5) och det tredje innehöll endast protokoll 6, se tabell 1.
I det första steget undersöktes vilken lösning för värmeinducerad epitop
återvinning som gav bäst resultat. Som bas användes det allmänna protokollet för immunohistokemiska färgningar som används på klinisk patologi på CSK som kördes som protokoll 1. I det protokollet utfördes först ”bakning” på 65℃ under fyra minuter. Sedan utfördes avparaffinering i 72℃ med EZ prep (Ventana Medical systems inc, Tucson, USA). Värmeinducerad epitop återvinning utfördes vid 95℃ där objektglas inkuberas i 64 minuter i CC1 lösningen. Sedan genomförs ett tvättsteg med en reaktionsbuffert (Ventana Medical systems inc, Tucson, USA). En droppe av antikroppen mot caldesmon tillfördes och fick inkubera under 32 minuter som avslutas med ett tvättsteg med reaktionsbuffert. Efter det utförs kontrastfärgningen med hematoxylin (Ventana Medical systems inc, Tucson, USA) i 12 minuter sedan tvättsteg med reaktionsbuffert. Till slut appliceras en droppe av bluing reagent (Ventana Medical systems inc, Tucson, USA) som inkuberas i 4 minuter och sedan tvättas med reaktionsbuffert. Det allmänna protokollet modifierades och kördes i ytterligare två olika varianter där lösningen för den värmeinducerade epitop återvinningen ändrades. Caldesmon protokoll 2 använde CC1 mild (36 minuter) och caldesmon protokoll 3 kördes med CC2 standard (68 minuter).
Det andra steget utgick från caldesmon protokoll 2. I detta steg byttes det vanliga hematoxylinet som är en variant av Gill’s hematoxylin ut mot hematoxylin II som är en modifierad Mayer’s [12]. Caldesmon protokoll 4 utgick från protokoll 2 med undantaget att hematoxylin II (Ventana Medical systems inc, Tucson, USA) användes vid kontrastfärgningen (dock var infärgningstiden den samma, 12 minuter). Caldesmon protokoll 5 körde också med hematoxylin II men även en kortare tid för antikroppsinfärgningen (endast 16 minuter till skillnad från 32 minuter).
Det tredje steget utgick från caldesmon protokoll 4. Där ökades kontrastfärgnings tiden med hematoxylin II till det dubbla (24 minuter). Caldesmon protokoll 6 kördes därför med utgång från protokoll 4 med en ändrad tid för
kontrastfärgningen.
Tabell 1: Tabell över de olika protokollen som utfördes under
protokollutvecklingen. Samtliga protokoll börjar med ”bakning" i fyra minuter för att sedan avparaffineras i 72℃. Efter kontrastfärgning med hematoxylin (htx) utfördes blåning i fyra minuter på samtliga protokoll.
Protokoll nr Protokoll
1 Protokoll 2 Protokoll 3 Protokoll 4 Protokoll 5 Protokoll 6 Epitop återvinnings lösning (minuter) CC1 standard (64) CC1 mild (36) CC2 standard (68) CC1 mild (36) CC1 mild (36) CC1 mild (36) Antikropps färgtid 32 32 32 32 16 32 Kontrastfärg (minuter) Htx I (12) Htx I (12) Htx I (12) Htx II (12) Htx II (12) Htx II (24) Etisk frågeställning
Då studien använde färdig diagnosticerat material som redan avpersonifierats behövdes inte en etisk ansökan göras.
RESULTAT
Caldesmon protokollet utvecklades i tre steg och sex olika protokoll testades (se tabell 1). Färgningen verifierades med positivt infärgade kontroller och
färgresultatet kan ses nedan i figur 2 och 3. I figur 3 visas skillnaderna i färgintensitet mellan de 3 olika protokollen som testades i det första steget av utvecklingen och det som färgade på klinisk patologi i Lund. Caldesmon protokoll 1 gav ett tydligt mer intensivt resultat medan protokoll 2 var blekare. Protokoll 3 gav det blekaste resultatet även om det gav en kraftigare infärgning än det som färgades i Lund. Figur 3 visar att kontrastfärgningen på de färgningarna (protokoll 4–6) är svagare än de i figur 2. I caldesmon protokoll 6 är den dock lite kraftigare.
Figur 2: Snitt från samma klots alla färgade med caldesmon men med olika protokoll från det första steget. Klotsen innehöll hud preparat, ett utvidgat excision där det tidigare diagnostiserats malignt melanom. A) Färgades med caldesmon protokoll 1. B) Färgades med caldesmon protokoll 2. C) Färgades med caldesmon protokoll 3. D) Färgades i Lund 2016 innan vävnaden diagnostiserats. Alla bilderna är tagna med 20 x förstoring.
Figur 3: Snitt från samma klots som i figur 2 färgade med olika protokoll för caldesmon. A) Färgades med protokoll 4. B) Färgades med protokoll 5. C) Färgades med protokoll 6. Alla bilderna är tagna med 20 x förstoring.
Tissue microarray utfördes där 30 olika klotsar stansades och sammanfördes till två klotsar med 15 biopsier vardera. Dessa klotsar snittades och färgades med caldesmon respektive SMMS-1 och färgresultatet verifierades med positivt infärgade kontroller vilket kan ses i figur 4. Figur 5 visar objektglasen från
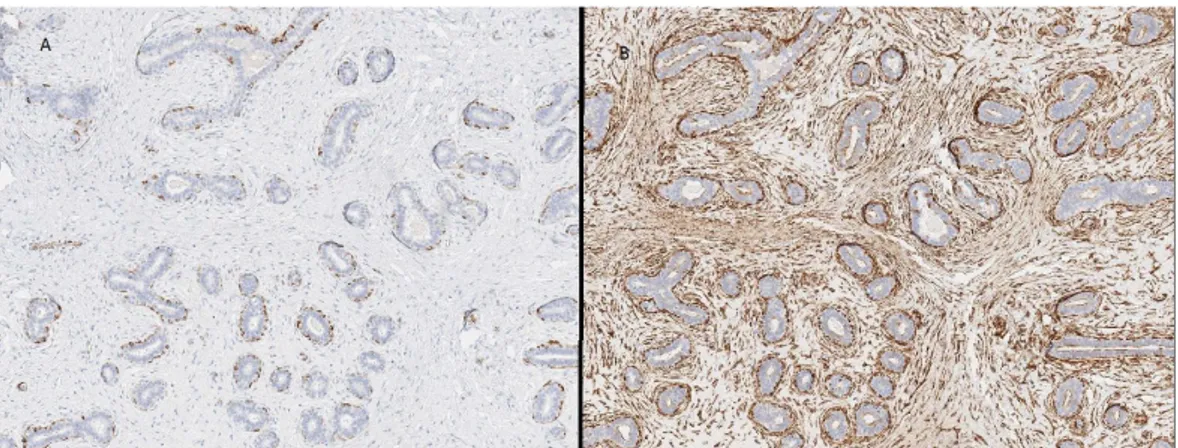
jämförelsen utan förstoring, hur caldesmon har färgat in mer än SMMS-1. Figur 6 och 7 visar i förstoringen hur mycket mer omkringliggande vävnad caldesmon har färgat medan SMMS-1 enbart färgat in det myoepitelial lagret.
Figur 4: Kontroller från färgning med SMMS-1 (A) och caldesmon (B). Bilderna föreställer vävnad från appendix och tillhör ”MB1” kontrollen. Bilderna har 20 x förstoring.
Figur 5: Klots 1 och 2 tillverkade med hjälp av tissue microarray teknik med positiva kontroller färgade med SMMS-1 respektive caldesmon. Alla stanser är extraherade från olika klotsar med fibroadenom vävnad medan kontrollvävnaden som använts är ”MB1”. A) Klots 1 färgad med SMMS-1. B) Klots 1 färgad med caldesmon. C) Klots 2 färgad med SMMS-1. D) Klots 2 färgad med caldesmon.
Figur 6: Fibroadenom vävnad färgad med SMMS-1 respektive caldesmon. A) Vävnad från klots 1 nummer 4 färgad med SMMS-1. B) Vävnad från samma klots som i A men färgad med caldesmon. C) Vävnad från klots färgad med SMMS-1. D) Vävnad från samma klots som i C färgad med caldesmon. Bilderna har 20 x förstoring.
Figur 7: Vävnad från klots 2 nummer 4 färgad med SMMS-1 (A) respektive caldesmon (B). Bilderna är tagna i 20 x förstoring.
DISKUSSION
Syftet med studien var att utveckla ett nytt protokoll för caldesmon. Men även att jämföra dess effektivitet som en myoepitelial markör med SMMS-1.
Protokollutvecklingen för caldesmon utgick inte från något färdigt protokoll för caldesmon. Caldesmon färgas i både Lund och Malmö men där är man inte helt nöjd med protokollen. Därför utgick utvecklingen från det allmänna antikropps protokoll som finns på CSK. Protokollutvecklingen för caldesmon utfördes i tre olika steg. Detta gjordes för att undersöka enskilda delar av färgningsprocessen och dess påverkan på det slutgiltiga färgningsresultatet.
I det första steget undersöktes vilken lösning som gav bäst resultat vid den
värmeinducerade epitop återvinningen. Ventana tillverkar två olika lösningar CC1 och CC2. De två lösningarna används i standard och mild variant där skillnaden är tiden för epitop återvinningen. Då Trisbaserade buffertar (CC1) vid ett högre basiskt pH ofta är passande för de flesta antigen användes det med mild och standardversionerna [8]. Caldesmon protokoll 1 använde CC1 standard och det gav ett alltför intensivt färgresultat. Den intensiva infärgningen gav ett smutsigt intryck och då den bruna färgen var för mörk ansågs resultatet otydligt.
Caldesmon protokoll 2 med den mildare CC1 bufferten gav det bästa
färgresultatet. Färgresultatet var ej lika intensivt som i protokoll 1 utan gav en mer passande färgintensitet. Då Citratbaserade buffertar (CC2) ger bäst resultat för antigen i cellkärnor och kan producera falsk positiv kärnfärgning, användes bara CC2 i dess standardform [8-10]. Det användes i caldesmon protokoll 3 där det gav ett resultat som var för blekt. Då alla objektglas färgade med protokollen i steg 1 undersöktes i ljusmikroskop konstaterades det att caldesmon protokoll 2 hade det bästa resultatet. Det hade däremot alltför intensiv kontrastfärgning vilket blev fokus i det andra steget.
Det andra steget fokuserade på färgintensiteten och utgick från caldesmon protokoll 2. Då kontrastfärgningen var alltför intensiv byttes hematoxylin sort. Hematoxylin II är en modifierad version av Mayer’s hematoxylin som gav ett mildare färgresultat än det vanliga hematoxylinet som används [12]. Caldesmon protokoll 4 kördes i likhet med protokoll 2 med undantag för att hematoxylin II användes vid infärgningen och även samma tid för infärgningen användes. Den nya kontrastfärgen (hematoxylin II) ansågs för svag men det föredrogs framför vanligt hematoxylin och användes i efterföljande steg. För att säkerhetsställa att
antikroppsfärgningen gav det bästa resultatet testades även en kortare
inkuberingstid för antikroppen i caldesmon protokoll 5 utöver hematoxylin II. Resultatet gav dock en alltför svag brun antikropps färg och det användes inte vidare.
Det tredje steget utgick från caldesmon protokoll 4. Då kontrastfärgningen i det andra steget ansågs för svag dubblades dess inkuberingstid med hematoxylin II (24 minuter). Caldesmon protokoll 6 kördes därför med utgång från protokoll 4 med en ändrad tid för kontrastfärgningen. Detta gav ett kraftigare färgresultat för kontrastfärgningen som ändå ej var lika intensivt som det vanliga hematoxylinet. Detta resultat ansågs tillfredställande.
Jämförelse mellan caldesmon och SMMS-1
Det färdiga protokollet för caldesmon jämfördes med SMMS-1 vilket rutinmässigt används på fibroadenom vävnad som innehåller myoepiteliala celler. SMMS-1 är en av antikropparna som rutinmässigt används för att fastställa ifall cancern är in situ eller invasiv. Vid in situ cancer förekommer ett intakt lager av myoepiteliala celler (något som finns i frisk bröstvävnad) medan det saknas vid invasiv cancer. Då tissue microarray teknik användes var vävnaden som valdes för studien tvungen att innehålla myoepitelial lager i så pass stor utsträckning att en stans på två mm innehöll myoepiteliala celler. Då fibroadenom är rikt på myoepiteliala cellager var den optimal för denna studie [1–3]
Urvalet av klotsar för jämförelsen mellan caldesmon och SMMS-1 valdes utifrån en de fall som diagnosticerats med fibroadenom på CSK under perioden 2015– 2016. Objektglas färgade med hematoxylin och eosin från dessa fall undersöktes av en patolog. De objektglas som innehöll vävnad med tydlig fibroadenom noterades och dessa specifika områden markerades. Bland dessa glas valdes 20 olika fall och från dem valdes 30 objektglas. Valet baserades på att få variation bland vävnaderna, glas valdes med olika utseenden både färg och formmässigt för att uppnå maximal variation.
De 30 utvalda klotsarna sammanställdes med hjälp av tissue microarray teknik till två nya klotsar. Var klots innehöll vävnad från 15 olika klotsar. Tissue microarray användes för att effektivisera processen och minska kostnaderna. Då studien utfördes utöver den IHK som utförs på klinisk patologi dagligen fick den inte hindra det kliniska arbetet. IHK kunde inte utföras om där inte fanns lediga platser i färgmaskinen vilket gjorde att 30 separata färgningar ej kunde utföras. Med tissue microarray kunde vävnader från 30 olika klotsar sammanföras till två klotsar. Kostnaden för antikroppar är hög och att utföra färre färgningar sparar stora kostnader. Att utföra färre färgningar sparar även på lösningar och material som används vid infärgningen vilket även det drar ner på kostnaderna. Det sparade även tid. Tissue microarray tekniken var ett värdefullt hjälpmedel i studien och effektiviserade jämförelsen avsevärt.
De objektglas som färgades med SMMS-1 och caldesmon hade snitt från en av tissue microarray klotsarna och en kontroll. Kontrollen, ”MB1”, valdes då det är den kontroll som används på klinisk patologi i Lund och Malmö där de färgat med caldesmon under en längre tid. Då ”MB1” fungerar som en positiv kontroll måste den ha färgats in för att resultatet ska kvalificeras som godkänt. Både SMMS-1 och caldesmon hade infärgade kontroller.
En del av syftet med den här studien är att jämföra caldesmons användbarhet som en myoepitelial markör på fibroadenom vävnad med SMMS-1. På fibroadenom vävnad ger SMMS-1 ett bättre färgresultat än caldesmon, då det tydligt färgar in det myoepiteliala lagret och väldigt lite annat. Det myoepiteliala lagret är därför lätt att urskilja i ljusmikroskop och ett kliniskt fall hade snabbt kunnat
diagnostiserats som in situ cancer vid dess närvaro. Caldesmon färgar det
myoepiteliala lagret men den färgar även mycket annan vävnad, som stroma. Då så mycket av omliggande vävnad är infärgad är det svårare att urskilja om där förekommer ett intakt lager. Då fibroadenom vävnad innehåller mycket stroma synliggörs det med caldesmon och det försvårar den kliniska diagnosen av in situ cancer. Det tar längre tid och kräver mer arbete för att verifiera ett intakt
myoepitelialt lager än med SMMS-1. Det fanns ett undantag där SMMS-1 färgningen inte var optimal. Vävnad från klots 2 nummer 4 har SMMS-1 färgat avsevärt blekare och det är därför svårare att urskilja det myoepiteliala lagret i vävnaden färgad med SMMS-1 än i den färgad med caldesmon. Men då det är fibroadenom vävnad hade den diagnostiserande patologen hellre efterfrågat en annan myoepitelial markör, till exempel S100 eller calponin.
Förbättringar
Vid protokollutvecklingen användes en färdig dispenser som redan var spädd, vilket innebar att olika spädningar på antikroppen inte kunde undersökas. En färdigspädd antikropp ger en ökad stabilitet hos antikroppslösningen vilket underlättar vid den normala kliniska körningen. Då antikroppar är väldigt beroende av lösningen den späds i kan olika lösningar påverka en antikropps stabilitet och dess bindningsförmågor. Vid spädning av antikroppar är även pH viktigt att tänka på då det kan påverka effektiviteten i färgnings processen. Då vissa lösningsmedel har temperatur känsligt pH (Trisbaserad buffert) är det även viktigt att minimera temperaturförändringar [24]. Att slippa dessa bekymmer förenklar arbetet efter protokollutvecklingen, vid klinisk användning. En färdig dispenser betyder att de biomedicinska analytikerna på klinisk patologi på CSK inte behöver späda caldesmon själva vilket avlägsnar eventuella problem som kan uppstå vid spädning och effektiviserar processen. Därför valdes en färdig
dispenser för studien och för framtida IHK färgningar med caldesmon. Om en ospädd antikropp hade valts kunde även spädningen av antikroppen ha anpassats till det nya protokollet och ett annat resultat hade kanske nåtts.
I studien användes 30 olika klotsar från 20 olika fall. Optimalt så hade 30 olika fall använts men på grund av fel i kommunikationen hade enbart 20 fall plockats fram. För att spara tid plockades inte 10 nya fram då det relevanta materialet inte fanns lättillgängligt. Istället plockade ytterligare klotsar från de redan framtagna 20 fallen.
Då caldesmon visades färga in stroma hade en annan vävnadstyp varit mer passande för den antikroppen. Studien visar att caldesmon fungerar som en myoepitelial markör. Resultatet visar starkt infärgade myoepiteliala celler. Problemet ligger i den omkringliggande vävnaden. Fibroadenom valdes då det är en cancerform som innehåller mycket myoepiteliala celler. Men mängden stroma som färgades in med caldesmon försämrade synligheten av dem. En annan sorts cancer innehållandes myoepiteliala celler hade varit att föredra, till exempel in situ ductal karcinom eller adenokarcinom [3].
KONKLUSION
Genom den här studien har ett fungerande protokoll för caldesmon utarbetats. Protokollet har använts till flera olika vävnader och tillfredställande resultat har uppnåtts. Den har även visat att caldesmon är en fungerande markör för
myoepiteliala celler men att SMMS-1 är en mer användbar myoepitelial markör på fibroadenom vävnad.
REFERENSER
1. Brogi E (2014) Fibroepithelial Neoplasms. I: Brogi E (Eds) Rosen’s Breast Pathology. (Fourth edition) Philadelphia, PA: Lippincott Williams & Wilkins, s 213-271.
2. Kajo K, Machàlekova K (2008) Fibroadenoma with Digital Fibroma-Like Inclusions in Neurilemmoma-Like Stromal Component. Breast journal. 14, 112-113.
3. Kalof A N, Tam D, Beatty B, Cooper K (2004) Immunostaining patterns of myoepithelial cells in breast lesions: a comparison of CD10 and smooth muscle myosin heavy chain. Journal of clinical pathology. 57, 625-629.
4. Taylor C R, Shi S (2014) Techniques of immunohistochemistry: Principles, Pitfalls and Standardization I: Dabbs D J (Eds) Diagnostic
immunohistochemistry: theroanostic and genomic applications (Fourth edition). Philadelphia, PA: Elsevier, s 1 -39.
5. Carsson F, Hladik C (2009) Histotecnology- a self-instructional text. USA: American Society for Clinical Pathology.
6. Duraiyan J, Govindarajan R, Kaliyappan K, Palanisamy M (2012) Application of Immunohistochemistry. Journal of Pharmacy and Bioallied sciences, 4, 307-309.
7. Taylor C R (2013) Introduction to immunohistochemistry I: Rudbeck L, Taylor C R (Eds) Immunohistochemical Staining Methods (Sixth edition). Danmark: Dako an agilent technologies company, s 10-19.
8. Taylor C R, Shi S (2013) Antigen retrieval I: Rudbeck L, Taylor C R (Eds) Immunohistochemical Staining Methods (Sixth edition). Danmark: Dako an agilent technologies company, s 30-44.
9. Ventana (2017) Cell conditioning solution CC1
>http://productlibrary.ventana.com/ventana_portal/OpenOverlayServlet?launchIn dex=1&objectId=950-12416307SV< (2017-03-09).
10. Ventana (2017) Cell conditioning solution CC2
>http://productlibrary.ventana.com/ventana_portal/OpenOverlayServlet?launchIn dex=1&objectId=950-12316308SV< (2017-03-09).
11. Pederssen H C, Petersen K (2013) Detection methods I: Rudbeck L, Taylor C R (Eds) Immunohistochemical Staining Methods (Sixth edition). Danmark: Dako an agilent technologies company, s 78-92.
12. Ventana (2017) Counterstains > http://www.ventana.com/product/list/6< (2017-03-24).
13. Huber P (1997) Caldesmon. The International Journal of Biochemistry & Cell Biology, 29, 1047-1051
14. Ceballos KM, Nielsen GP, Selig MK, O'Connell JX. (2000) Is Anti–h-Caldesmon Useful for Distinguishing Smooth Muscle and Myofibroblastic
Tumors? An immunohistochemical study. American journal of clinical pathology, 114, 746-753.
15. Loukianoy E, Loukianoya T, Periasamy M (1997) Myosin Heavy Chain Isoforms in Smooth Muscle. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 117, 13–18.
16. Borrione A, Zanellato A, Scannapieco G, Pauletto, P, Sartore S (1989) Myosin heavy-chain isoforms in adult and developing rabbit vascular smooth muscle. FEBS Journal 183, 413-417.
17. Aikawa M, Sivam PN, Kuro-o M, Kimura K, Nakahara K, Takewaki S, Ueda M, Yamaguchi H, Yazaki Y, Periasamy M, et al. (1993) Human smooth muscle myosin heavy chain isoforms as molecular markers for vascular development and atherosclerosis. Circulation Research 73, 1000-1012.
18. Babu G, Warshaw, Periasamy M (2000) Smooth Muscle Myosin Heavy Chain Isoforms and Their Role in Muscle Physiology. Microscopy research and
technique, 50, 532-540.
19. Dewar R, Fadare O, Gilmore H, Gown AM (2011) Best practices in diagnostic immunohistochemistry: myoepithelial markers in breast pathology. Archives of pathology and laboratory medicine journal. 135, 422-429.
20. Nazar J Tissue (2009) Microarray: A rapidly evolving diagnostic and research tool. Annals of Saudi medicine. 29, 123-127.
21. Kampf C, Olsson I, Ryberg U, Sjöstedt E, Pontén F (2012) Production of Tissue Microarrays, Immunohistochemistry Staining and Digitalization Within the Human Protein Atlas. Journal of visualized experiments. 63, 3620.
22. De Marchi T, Timmermans A, Smid M, Look M, Stingl C, Opdam M, Linn S, Sweep F, Span P, Kliffen M, van Deuzen C, Luider T, Foekens J, Martens J, Umar A(2016) Annexin-A1 and caldesmon are associated with resistance to tamoxifen in estrogen receptor positive recurrent breast cancer. Oncotarget. 3, 3098-3110.
23. Lazard D, Sastre X, Frid M, Glukhova M, Thiery J, Koteliansky V (1993) Expression of smooth muscle-specific proteins in myoepithelium and stromal myofibroblasts of normal and malignant human breast tissue. Proceedings of the National Academy of Sciences of the United States of America. 90, 999-1003. 24. Pace GE (2013) Optimization of immunohistochemical reactions I: Rudbeck L, Taylor C R (Eds) Immunohistochemical Staining Methods (Sixth edition). Danmark: Dako an agilent technologies company, s 102-109.