Borrelia burgdorferi; metodutveckling och tillämpning
avseende odling och resistensstudier mot komplement,
särskilt interaktion med faktor H
ABSTRACT
The bacterial genus Borrelia is widespread and cause different diseases, among others borreliosis, also named “Lyme disease”, associated with a lot of suffering. The disease is a zoonos and the infectious agent, the bacteria, is spread through a vector, the hard tick Ixodes
ricinus. Humans as well as animals can get infected through bites from the tick. The first sign
of the disease is in most cases a local skin reaction, a circular reddish rash named erythema migrans. The rash often show a pale central region surrounded by a blush, 4 – 5 cm in diameter. Treatment with antibiotics is often successful. Untreated, the infection may give rise to very serious disturbances with effects on joints, e.g. arthritis, heart as well as other organs and on the CNS (central nervous system). In what way the bacteria succeed in spreading to different parts of the body is not fully understood, but it has been shown that some Borrelia species have developed strategies for avoiding the immune defence by inactivating components of the host complement system.
The complement system is part of the body’s immune defence and consists of around 30 different soluble proteins in inactive forms. When activated by for example a bacterial invasion, the different proteins will interact and generate products which in turn will give rise to different effects like blood vessels dilatation, kemotaxic attraction of phagocytotic cells and opsonisation.
It is known that the relations and interactions towards the complement system differs between different Borrelia species and that species and strains belonging to the group of Borrelia
burgdorferi sensu lato interacts with host complement proteins to avoid complement attack.
An example of such a protein is factor H and many Borrelia strains can express receptors on the outer cell membrane that will attract and bind this factor. Without factor H there will be no complement activation and the bacteria will avoid lysis.
Another immune defence of the body is phagocytosis of the foreign elements and works together with the complement system.
The aim of the present study was to optimize the culturing of Borrelia followed by a mapping of different Borrelia burgdorferi sensu lato strains concerning sensitivity or resistivity towards the serum complement system and also the dependence of varying serum concentration and bacteria cell density. Further, the degree of complement activation for the different strains was to be evaluated as well as tagging with FITC followed by microscopic and/ or FACS analyses for studies of morphology and phagocytosis.
For the assessment of sensitivity or resistivity for different strains towards the complement system, the number of live spirochetes after incubation was estimated by counting under phase microscopy. The connection between the number of bacteria and complement activation was studied through ELISA – technique and the analysis of free C3a and free TCC (Terminal Complement Complex).
All Borrelia strains under study were found to be easy to culture except for Borrelia garninii Pbi, when working with high sterility demands and frequent subcultivation. A possible explanation for the problems with Borrelia garninii Pbi might be a prolonged lag phase, which was also observed.
The results from the counting of surviving bacteria exposed to differing serum concentrations showed that all Borrelia afzelii strains are resistant while most of the Borrelia garninii strains are sensitive towards the action of the complement system
.
The analyses of C3a and TCC after incubation with human blood serum show that the activation of the complement takes place at increasing and very high numbers of cells. Incubations with human whole blood gave the same type of response.
Tagging of B. afzelii K78 and B. garninii Lu59 with FITC resulted in good illustrations of the bacterial morphology. The follow up FACS analysis showed that monocytes as well as granulocytes may phagocytise living bacteria and further, the different stages of the phagocytosis are illustrated after nuclear staining.
INNEHÅLLSFÖRTECKNING
SAMMANFATTNING
6INTRODUKTION
7Allmänt om Borrelia; patogenicitet, vektorer och förekomst 7
Borrelia burgdorferi sensu lato 7
Beskrivning av bakteriens morfologi och egenskaper 8
Diagnostik 10
Behandling 11
Prevention 11
Bakteriens skydd mot värdens immunförsvar – 11 komplementsystemet
Reglering av komplementaktivering 13
Komplementsystemets faktor H och dess funktion vid 13 mikrobangrepp
Fagocytos 15
SYFTE
15MATERIAL OCH METODER
16In vitro odling 16
Odlingsmedium och Borreliastammar 16
Odling 17
Bedömning av de olika bakteriestammarnas känslighet 18 respektive resistens mot immunförsvarets komplementsystem
Pilotförsök 18
Exponering av startkultur från samtliga borreliastammar 18 mot spädningsserie av NHS/ INHS
Studium av komplementaktivering som funktion av 19 bakterietätheten
Pilotförsök för C3a/ TCC - analys (spädning 107 => 102) 20 Studium av Lu59 och K78 med modifierad metod 20 Studium av Lu59 och K78 med hög celltäthet och exponering 20 för NHS och färskt humant helblod
Inmärkning med fluorescerande isothiocyanat (FITC) (Pilotstudie) 21 Fagocytosförsök med FITC - inmärkta borreliabakterier (Pilotstudie) 21 C3a-analyser med ELISA - teknik (Enzyme Linked Immuno 22 Sorbent Assay)
TCC - analys med ELISA - teknik 22
RESULTAT OCH DISKUSSION
23TACK
33REFERENSER
34Appendix A
38Appendix B
44Appendix C
50Appendix D
51Appendix E
52Bilaga – resultat
53SAMMANFATTNING
Bakteriegruppen Borrelia burgdorferi har en stor utbredning och förorsakar sjukdomen borreliosis, även kallad Lyme disease, som orsakar mycket lidande. Sjukdomen är en zoonos och smittämnet, bakterien, sprids via en vektor, fästingen Ixodes ricinus. Både människor och djur kan smittas i samband med bett från fästingen. Sjukdomen borreliosis börjar oftast som en lokal hudinfektion med ett karakteristiskt utslag, erythema migrans. Utslaget uppvisar en blek mittregion som omges av en rodnad, 4 – 5 cm i diameter. Antibiotikabehandlig är ofta framgångsrik. Utan behandling kan sjukdomen få allvarliga konsekvenser med påverkan på leder, hjärta, andra organ och centrala nervsystemet (CNS). Hur bakterierna lyckas sprida sig i kroppen och orsaka kroniska tillstånd är ännu inte kartlagt. Det har dock visats att en del av borreliaarterna har en utvecklad strategi för att undgå en del av kroppens immunförsvar genom inaktivering av komponenter i komplementsystemet.
Komplementsystemet utgör en del av kroppens immunförsvar och består av ett 30-tal lösliga proteiner i inaktiv form. Vid aktivering till exempel vid invasion av mikrober interagerar proteinerna med varandra och generar produkter, som i sin tur resulterar i olika effektorfunktioner. I samband med proteolytisk aktivitet frisätts mindre produkter, som kan inducera kärlvidgning, agera som kemotaktiskt stimuli för fagocyterande celler och inducera opsonisering. Det är sedan tidigare känt att förhållandet till komplementsystemet skiljer sig åt hos olika borreliaarter. Arter och stammar inom gruppen Borrelia burgdorferi sensu lato interagerar med proteiner från värdens komplementsystem för att på så sätt undgå komplementattack. Faktor H är exempel på ett sådant protein. Borreliabakterien kan uttrycka receptorer i sitt yttermembran, som binder in denna faktor. Vid medverkan av faktor H dämpas komplementaktiveringen och bakterien kan undgå lys.
Målet med föreliggande studie var att optimera odlingsbetingelserna för Borrelia följt av kartläggning av olika stammar av Borrelia burgdorferi sensu lato avseende känslighet respektive resistens mot serumkomplement och dess beroende av serumkoncentration respektive bakterietäthet. Vidare skulle grad av komplementaktivering för olika stammar bedömas, liksom inmärkning med FITC följt av mikroskopisk och/ eller FACS - analys för studium av morfologi och fagocytos.
För bedömning av känslighet respektive resistens för olika stammar gentemot komplementsystemet, genomfördes räkning av levande bakterier genom faskontrastmikroskopi. Resultaten avseende bakteriehalter kontra komplementaktivering analyserades med hjälp av ELISA-teknik och analys av lösligt C3a respektive lösligt Terminal Complement Complex (TCC).
Samtliga i projektet ingående borreliastammar, med ett undantag Borrelia garninii Pbi, befanns vara lättodlade under förutsättning av sträng sterilteknik och upprepad subkultivering. En förklaring till problemet med B. garninii Pbi kan vara en observerad längre lagfas. Observation är subjektiv utan experimentell studie.
Resultaten av räkning av överlevande bakterier som mått på känslighet/resistens mot komplementsystemet i humant normalserum visade att samtliga Borrelia afzelii – stammar var resistenta medan flertalet Borrelia garninii - stammar var känsliga.
Resultaten från analyser av fritt C3a och TCC efter inkubering med NHS visar att komplementaktivering sker först vid ökande och mycket höga bakterietätheter.
Försök med inkubering med NHS respektive hirudinbehandlat helblod visade inte på någon nämnvärd skillnad i utfall.
FITC-inmärkning av B. afzelii K78 och B. garninii Lu59 resulterade i goda illustrationer av spiroketernas morfologi.
FACS -analys av fagocyterade inmärkta bakterier visade att både monocyter och granulocyter har förmåga att fagocytera borreliabakterier och att EDTA märkbart hämmade fagocytosen. Vidare tycks B. afzelii K78 fagocyteras i något större omfattning än B. garninii Lu59. De olika stadierna i fagocytosförloppet framgår av den mikroskopiska analysen av kärninfärgade preparat.
INTRODUKTION
Allmänt om Borrelia; patogenicitet, vektorer och förekomst
Genus Borrelia består av flera olika arter och stammar associerade till kända sjukdomar såsom återfallsfeber (relapsing fever) och borreliosis (Lyme disease).
Återfallsfeber kan orsakas av Borrelia recurrentis, en epidemisk lusburen (Pediculus
humanus) sjukdom (Volk et al. (1995), Smittskyddsinstitutet (2008), Tortora. et al. (2002)).
Lyme disease, i dagligt tal ”borrelia eller borreliosis”, beskrevs första gången 1975 av Allen Steere och hans kollegor i sökandet efter svar på orsaken till varför fallen av artrit hos unga människor i staden Old Lyme i Connecticut, USA ökade kraftigt (Volk et al. (1995), Tortora et al. (2002)). Sjukdomen gavs namnet Lyme disease och kopplades till en spiroket, Borrelia
burgdorferi. Bakterien sprids av fästingen Ixodes ricinus, vanlig bl.a. i södra och östra
Sverige. Fästingens överlevnads- och expansionsmöjligheter beror framförallt på vegetationstyp, klimat inklusive mikroklimatet i marken och tillgång till mellanvärdar (fåglar och olika däggdjur inklusive rådjur) (Dotevall et al. (2007)). Optimal miljö är fuktig vegetation med gräs, buskar, skogsmark och lummiga trädgårdar. Fästingarna blir aktiva då dygnstemperaturen överstiger + 4 – 5oC (Volk. et al. (1995), Dotevall. et al. (2007)).
För närmare beskrivning av fästingens biologi, interaktion mellan fästingar och borreliabakterier, mellanvärdar och smittöverföring – se appendix A, detta arbete.
Borrelia burgdorferi sensu lato
Borrelia burgdorferi sensu lato (B.b.s.l.) är ett samlingsbegrepp för ett antal underarter med
förmågan att orsaka den fästingöverförda sjukdomen Lyme borreliosis. I Sverige förekommande patogena underarter till B.b s.l. är B. afzelii, B. garninii och B. burgdorferi sensu stricto (B.b.s.s.) (Dotevall et al.(2007)).
Vidare tyder en del studier på tropism, dvs. att olika stammar av B.b.s.l. adapteras till antingen mammalier eller fåglar som värddjur (Kurtenbach et al. (2002)). Av dess är B.b.s.s. den minst specialiserade arten, med förmåga att infektera såväl fåglar som mammalier, allt ifrån gnagare till större djur (Kurtenbach et al. (2002)). Överföringen av B.b.s.l. från fästing till en vertebrat
är en komplex biologisk process med många molekylära interaktioner (Kurtenbach et al. (2002)).
Beskrivning av bakteriens morfologi och egenskaper
Bakteriesläktet Borrelia tillhör familjen Spirochetaceae, spiroketer. Bakterier tillhörande denna familj är mikroaerofila, helikala och oregelbundet formade samt utrustade med 7 – 20 periplasmatiska, axiala flageller, som ger hög rörlighet (Panelius (2002)). Vidare uppvisar cellmembranet egenskaper av såväl gramnegativ som grampositiv karaktär (Panelius (2002), Pinne (2006), Radolf et al.(1994)).
B. burgdorferi är en obligat parasit som kräver såväl sin mer eller mindre specifika
arthropodvektor som sin vertebratvärd för att överleva och reproduceras (Pinne (2006)). Spiroketerna är förhållandevis stora, ca 30 μm långa och 0,5 μm i diameter. De kan studeras i mikroskop efter infärgning enligt exempelvis Giemsa (Murray et al. (1990), Pinne (2006)). Genetiskt har 16S ribosomal RNAs -analyser visat att Borrelia är närbesläktad med
Treponema (Volk (1995), Pinne (2006)). Vidare innehåller bakteriens linjära kromosom 900
gener med 920 000 baspar kompletterat med flera plasmider, 12 linjära och 9 cirkulära om 430 gener med ca 533 000 baspar (Volk (1995), Pinne (2006), Aguero-Rosenfeld et al. (2005), Fraser et al. (1997)). De kromosomala generna kodar för proteiner nödvändiga för DNA-replikation, transkription, translation, transport av lösta ämnen och energimetabolism, men innehåller inga gener för cellulär biosyntes (Pinne (2006)). De gener som kodar för bakteriens ytstruktur är lokaliserade till plasmider och skiftar i uttryck under bakteriens infektiösa fas.
Vid in vitro – odling förloras dessa egenskaper lätt och därmed den infektiösa förmågan (Pinne (2006)). Även om de flesta plasmider är nödvändiga för virulens, men inte för överlevnad finns ett undantag, den cirkulära plasmiden cp26, som är nödvändig för tillväxt även in vitro (Pinne (2006), Barbour (1998)).
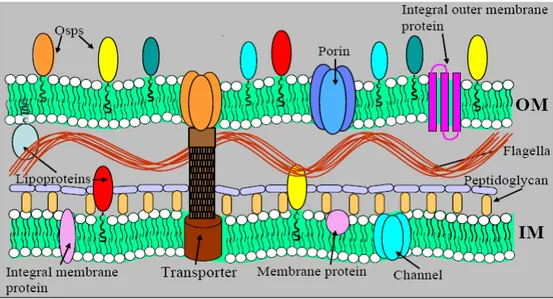
Bakteriens yttermembran utgör en selektiv barriär, som bland annat innehåller ett stort antal receptorer, kommunikationsmolekyler och antigena strukturer (figur 1) (Pinne, (2006)). De rikligast förekommande och mest studerade proteinerna i bakteriens yttermembran är lipoproteinerna (Osps) med OspA, OspB och OspC som exempel. Allra rikligast förekommande är OspA och är även det mest studerade; några karakteristika för lipoproteinernas interaktion är:
• immunisering med OspA har visats skydda mot infektion med B. burgdorferi (Pinne (2006), de Silva et al. (1996)). Dock har OspA p.g.a. bieffekter visat sig olämpligt som vaccin.
• exponering för värddjuret påverkar uttrycken av OspA/B och OspC. Dessa regleras ömsesidigt och växlar medan borreliabakterien överförs från fästingen till värddjuret. Hos fästingar, som inte har sugit blod uttrycks OspA och OspB rikligt medan OspC knappast uttrycks alls.
• i samband med att fästingen suger blod från värddjuret och under pågående infektion nedregleras syntesen av Osp A/B medan syntesen av Osp C uppregleras (Pinne (2006), Byram et al. (2004))
• OspC underlättar transporten av borreliabakterierna från fästingens tarm till spottkörtlarna. Detta initieras av att fästingen suger blod på sitt värddjur och nästa steg är att fästingen injicerar bakterierna från spottkörtlarna till värddjuret.
Vidare uttrycker bakterierna adhesiner, DpbA/B (decorin-binding protein A och B), vilka underlättar adhesionen till värdens olika vävnadstyper. Dessa adhesiner tycks vara inblandade i vävnadstropismen hos ”Lyme disease – spiroketerna” och uppregleras vid infektion, dvs. då temperaturen höjs från 23oC till 35oC (Pinne (2006), Radolf et al. (1994)). En ytterligare strategi för överlevnad i värddjuret är varierade antigena uttryck hos vissa lipoproteiner, exempelvis Bmp A – D, som består av fyra olika antigena lipoproteiner. Av dessa används Bmp A vid diagnos av Lyme disease och de tycks också vara nödvändiga för växt – såväl in
vivo som in vitro – liksom för virulens (Pinne (2006), Radolf et al. (1994, Rautemaa & Meri
(1999)).
Figur 1. Schematisk bild av borreliabakteriens cellmembran, bestående av yttermembran (OM), innermembran (IM) med det tätt förankrade lagret av peptidoglukan och däremellan det periplasmatiska utrymmet med flageller. Antalet flageller är artberoende. I membranen uttrycks lipoproteiner, OSPs (Outer Surface Protein), poriner, kanalproteiner m.m. Flagellernas ena ände i det periplasmatiska utrymmet är förankrade i innermembranet (Pinne (2006)).
Gramnegativa bakterier har flera strategier för att undvika komplementsystemet som exempelvis kapsel, lipopolysackarider (LPS) eller yttre membranproteiner (OMPs). Hos speciellt Borrelia finns flera lipoproteiner med egenskapen att förhindra
komplementaktivering genom inbindning av faktor H hos värddjuret och/eller bildande av membran - attack - komplexet (MAC) (Radolf et al. (1994)).). Exempel på detta är lipoproteinerna OspE och Osp F. Ytterligare exempel återfinns hos Borrelia afzelii, som genom en annan grupp av ytproteiner, ”complement regulator acquiring surface proteins (CRASPs) och speciellt CRASP I och CRASP II, kan binda in komplementsystemets faktor H och på så sätt utveckla komplementresistens (Kuby (1994), Kraiczy et al. (2001)).
Beroende av uppsättning av OSPs och CRASPs med flera membranfaktorer klassas olika Borreliaarter/ stammar som resistenta, intermediära eller känsliga gentemot komplementsystemet och faktor H (tabell I) (Kuby (1994), Kraiczy et al. (2001)). Påpekas
bör att uttrycket av OSPs och CRASPs kan variera även med bakteriens aktuella omgivningsmiljö, zoonotisk cykel och mellan in vivo- och in vitro – förhållanden med variationer i odlingsbetingelser.
Vidare kan variationer i odlingstemperatur för olika isolat av borreliabakterier resultera i varierande uttryck av OspA och OspC. Det finns inga belägg för att en komplementkänslig borreliastam in vitro är komplementresistent även in vivo (Kraiczy et al. (2001)).
Tabell I. Exempel på komplementresistens/känslighet hos olika arter av Borrelia (Kraiczy et al. (2001))
Genoart Resistens % Intermediär % Känslighet %
B. afzelii 75 25 0
B. burgdorferi s. s 10 90 0
B. garninii 0 47 53
Diagnostik
Då borreliabakterier från biopsier generellt är mycket svårodlade sker patientdiagnostik framförallt genom mikroskopering av blodutstryk; B. recurrentis (återfallsfeber/ relapsing fever) och serologi; B. burgdorferi (Lyme disease). Vid Lyme disease syns sällan spiroketer i kliniskt provmaterial och odling av B. burgdorferi från hudbiopsi hos positiv patient lyckas sällan.
De kliniska manifestationerna varierar och det kan vara svårt att utifrån dessa säkra diagnoserna. Förutom kliniska symtom som EM säkerställs diagnosen därför antingen direkt med PCR - teknik (bakteriefynd från hudbiopsi vid bettområdet) eller med serologisk metod för påvisande av bildade antikroppar.
Vid studium av antikroppar används företrädesvis ”Enzyme Linked Immuno Sorbent Assay (ELISA), då denna teknik är känslig för alla stadier av Lyme disease. Dock varierar känsligheten under sjukdomens förlopp och är som lägst under det första, akuta skedet, då endast 50 % av patienter med EM ger positiva utslag. Detta har sin förklaring i att en höjning i IgM – titern uppträder först 3 – 6 veckor efter fästingbettet, för att därefter gradvis sjunka och mötas upp av en successivt ökande halt av IgG, en höjning som sedan kvarstår under lång tid. Specifika IgM - och IgG - antikroppar kan detekteras i blod, cerebrospinalvätska och ledvätska, titern ökar med infektionens fortskridande, men det är inte möjligt att med serologiska test avgöra om sjukdomen befinner sig i akut, sen, aktiv eller behandlad/ utläkt fas. Alla patienter med s.k. sena komplikationer av sjukdomen uppvisar antikroppar mot B.
burgdorferi även om titern kan vara låg hos antibiotikabehandlade patienter (Murray et al.
(1990), Ruzic-Sabljic (2001)). Av detta följer att observation av den tidiga hudreaktionen är mycket viktig för diagnos då ELISA- tekniken inte har så hög känslighet i det tidiga sjukdomsstadiet.
För direkt påvisande av B. burgdorferi s.l. i patientprover som kroppsvätskor och vävnadsmaterial, har olika PCR – tekniker utvecklats. Sekvenser för amplifiering kan vara kromosomala eller av plasmidursprung. Tekniken är i och för sig snabb men kräver en viss mängd bakterier, minst 10 st., för säkert provsvar ( Ruzic-Sabljic (2001), Padula et al. (1994)).
Behandling
Tidiga manifestationer av Lyme disease behandlas med gott resultat med olika penicilliner, tetracyklin eller chloramphenicol. Vid multipla erythrem och/eller neuroborreliosis sker behandling genom injektioner av bensylpenicillin eller rocephalin (ceftriaxon). Dock är sen antibiotikabehandling ofta verkningslös, då bakterierna har invaderat epitelceller och tillväxer där. Sjukdomens senare förlopp behandlas med riktad terapi mot uppkomna sjukdomstillstånd och symtomatisk behandling. Vid graviditet utesluts behandling med Doxycyklin och andra tetracyklinpreparat (Dotevall et al. (2007)).
Prevention
Den viktigaste preventiva åtgärden är att undvika fästingbett. Vid nödvändig vistelse i fästingrika områden rekommenderas heltäckande klädsel och regelbunden kontroll med avseende på krypande fästingar, gärna med hjälp av annan person. Vissa i handeln förekommande insektsmedel påstås ha en viss skyddande effekt även mot fästingar och för husdjur finns olika preparat baserade på exempelvis permethrin.
Även vaccination har testats och 1999 fanns ett vaccin tillgängligt på den amerikanska marknaden. Detta drogs dock in redan 2001 . Dålig försäljning tillsammans med misstanke om att personer med genen HLA-DR4 kunde utveckla autoimmun artrit påstods vara orsaken (Volk et al. (1995)). Antigen var ett rekombinant OspA (rOspA), med avsikt att stimulera produktion av antikroppar för avdödning av bakterierna i den infekterade, blodsugande fästingen ( Wallich et al. (1996), Sviberg & Meri (2004)). Utvecklingsarbete pågår om att använda outer-surface-protein (OspC) och glycolipoprotein som agens för immunisering ( Lyme disease (2008)).
Bakteriens skydd mot värdens immunförsvar – komplementsystemet
Infektion med B. burgdorferi orsakar en kraftig reaktion från värdens immunförsvar med aktiverat komplementsystem och ökande nivåer av antikroppar. Detta till trots kan dock spiroketen överleva i kroppen under lång tid.
Efter invasion hotas bakterierna av såväl det medfödda immunförsvaret med slemhinnor, lågt pH, komplementsystem och fagocyterande celler som av det förvärvade immunförsvarets antikroppar. Inledningsvis och centralt i detta scenario är att på något sätt undgå att förstöras av komplementsystemet och undgå lysis genom MAC (Sviberg & Meri (2004)) Utnyttjade strategier i detta avseende är att variera uttrycket av ytproteiner, OSPs och CRASPs, och också att med hjälp av dessa binda in komplementsystemet faktor H ( bl.a. OSP E) för att på så sätt blockera komplementreaktionen (Sviberg& Meri (2004), Nilsson-Ekdahl et al. (2008), Hellwage et al. (2001)).
Komplementsystemet spelar en stor roll som medaktör till det medfödda immunsystemet. Benämningen ”komplementsystem” har sitt ursprung i experiment utförda av Jules Bordet kort efter upptäckten av antikroppar. Vad Bordet visade var att om färskt serum innehållande antikroppar mot vissa bakterier adderades till dessa bakterier vid fysiologisk temperatur (37oC), så lyseras bakterierna. Om serumet däremot värmeinaktiverats (minst 56oC) före experimentet, fås agglutination men inte lys av bakterierna, detta då antikroppar är värmestabila. Av detta drog Bordet slutsatsen att serum måste få hjälp av, ”kompletteras
med”, någon värmelabil komponent med förmåga att lysera de agglutinerade bakterierna. Denna ”komponent” fick benämningen komplement (Abbas et al. (2000), Kraiczy et al. (2003)). Detta kompletterande system, komplementsystemet, är uppbyggt av serum– och cellyte– proteiner som interagerar dels med varandra dels med andra molekyler i immunsystemet på ett högst reglerat sätt.
Hos vertebrater är komplementsystemet ett av de viktigaste skyddssystemen mot mikroorganismer och andra invaderande agens och omfattar ca 30 olika lösliga proteiner. Dessa plasmaproteiner, som normalt är inaktiva, kan aktiveras av olika processer kopplade till infektion och immunförsvarsinteraktion med invaderande organismer, resulterande i kaskadartad proteolys och produktion av aktiva molekyler med olika effektorfunktioner (Abbas et al. (2000)). Exempel är ämnen som förorsakar lokal kärlvidgning, utövar kemotaktisk attraktion gentemot fagocyterande celler (inflammatorisk reaktion) eller opsonisering och lys av agglutinat (Abbas et al. (2000)).
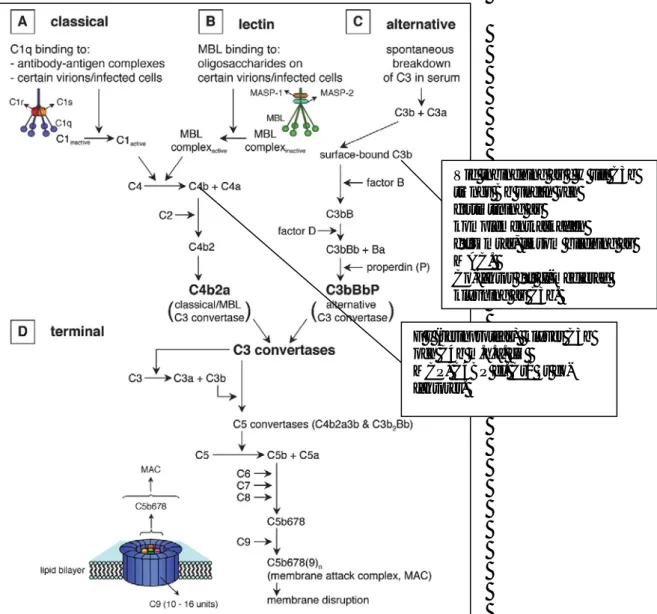
Fig. 2. Översiktsbild över komplementsystemet, dess kaskad av reaktioner och betydelsen av inbindning av ffa faktor H. Även andra regulatoriska proteiner agerar men fH tilldrar sig det största
intresset ((Favoreel et al. (2003))
Vid inbindning av f H till C3b trängs Bb undan och
fortsättning av komplementkaskaden försämras, liksom bildning av MAC. Co-faktor för fI-medierad klyvning av C3b. F I (serinproteas) klyver C3b och C4b m.h.a. fH MCP, C4BP el. Cr1 är co-faktorer.
I komplementsystemet ingående proteiner, glykoproteiner och övriga komponenter syntetiseras till stor del av hepatocyter, monocyter, vävnadsmakrofager och epitelceller i gastrointestinal respektive genourital vävnad (Kuby (1994)). Komplementkomponenterna cirkulerar i blodet i en inaktiv form, flera av dem som proenzymer, vars enzymatiskt aktiva site är dolt. När ett proenzym aktiveras klyvs den maskerande delen bort och det aktiva sitet kommer till uttryck. Aktiveringstegen är sekundsnabba förlopp och varje aktiverad komponent har en kort halveringstid innan den blir inaktiv.
Varje komponent i systemet benämns antingen med en numrerad bokstav (C1 – C9) eller med andra triviala benämningar som exempelvis H, I eller B. Efter aktivering och klyvning namnges peptidfragmenten med små bokstäver, ”a” för det mindre fragmentet och ”b” för det större. b - fragmentet binder in till mikrobers cellytor, till fria antikroppar eller bundna antikroppar samt till olika vävnadsceller. Det mindre a-fragmentet initierar ofta lokal inflammatorisk respons (Abbas et al. (2000)).
Aktivering av komplementsystemet kan ske genom ett antal olika vägar – den klassiska, den alternativa och via lektin. Den klassiska vägen aktiveras genom antikroppar bildade mot den invaderande mikroorganismen, den alternativa genom direktinteraktion med molekyler på mikrobens cellyta medan lektinvägen aktiveras genom inbindning av plasmalektin till mannosgrupper på mikrobytan. Detta innebär att komplementsystemet genom den alternativa vägen kan attackera invaderande mikroorganismer direkt och innan antikroppar hunnit bildas (Abbas et al. (2000)).
En minsta gemensam nämnare i komplementsystemet utgörs av komplementproteinet C3. De olika aktiveringsvägarna skiljer sig i hur C3b bildas i de tidiga stegen medan aktiveringsprocessen i de senare stegen är lika. Oavsett väg fås en aktivering av C3 som klyvs i en större subenhet, C3b och en mindre, C3a varefter C3b binder in till mikrobens membranyta som därigenom opsoniseras. Detta följs upp av en kaskadliknande reaktionssekvens resulterande i bildandet av terminalt komplement komplex (TCC) och membran - attack – proteinkomplex (MAC), som lyserar mikroben, medan C3a förekommer löst i plasman och stimulerar inflammatoriska processer. C3b attraherar dessutom fagocyterande leukocyter (Abbas et al. (2000), Brändén & Andersson (1999)).
Eventuell spontanaktivering av komplementsystemet förhindras av regulatoriska proteiner på cellytan hos normala värdceller.
Komplementsystemets klassiska väg (aktivering genom antikroppsinbindning till mikrobytan) upptäcktes först – därav namnet – medan den alternativa vägen anses vara fylogenetiskt äldre (Abbas et al. (2000)).
Reglering av komplementaktivering
Aktivering av komplementkaskaden och ”stabiliseringen” av dess aktiva produkter regleras strikt i syfte dels att förhindra komplementattack på normala värdceller dels att begränsa varaktigheten av komplementaktivitet riktad mot mikrober (tabell II) (Kuby (1994)).
Komplementsystemets faktor H och dess funktion vid mikrobangrepp
Många arter/ stammar av vilda borreliabakterier har förmåga att binda in faktor H (fH) från värdens blod på sin cellyta genom CRASPs och Osps, syntetiserade under bakteriens vistelse i
tarmen hos fästingar, vilket leder till blockering av komplementkaskaden (Hellwage et al (2001), Kraiczy et al. (2003)). Även odlade stammar av B. burgdorferi s.l. uttrycker ofta CRASPs.
Verifiering med radioisotopmärkta proteiner visade att fH band in starkt till B. burgdorferi med OspE som ligand. Detta resulterade i utebliven aktivering av C3b, komplementaktivering och fagocytos genom att den fH -förmedlade inbindningen av faktor B till C3b förhindras eller skiljs faktor Bb av från aktivt C3-konvertas i den alternativa vägen.
En viktig strategi hos de patogena borreliastammarna är alltså att förvärva ett skydd mot komplementsystemattack från värden. Detta sker genom att, under vistelsen i fästingens tarm, på cellytan uttrycka olika CRASPs och Osps, särskilt. CRASP-1 och OspE, vilket leder till uppbindning av fH och inhibering av C3b från värddjurets blod resulterande i blockering av komplementsystemets alternativa väg (Kraiczy et al. (2003).
Liknande mekanismer återfinns också hos andra, patogena bakteriesläkten som Streptococcus,
Neisseria och Yersinia med syntes av kopplingsmolekyler för inbindning av fH och C3 samt
också den klassiska vägens nyckelprotein C4 till cellytan, ledande till inaktivering av komplementsystemet (Nilsson- Ekdal et al. (2008), Kraiczy et al. (2003), Schneider et al. (2007)).
Tabell II Sammanställning av de viktigaste komplementsystemreglerande faktorerna med substrat och
effekt (MCP = Membrane Cofactor Protein, DAF = Decay Accelerating Factor)förstärkt av inbindning
av fI till membranbundet C3b, vilket leder till en minst 30- faldig ökning i inhiberingen av C3 (Hellwage et al. (2001)).
Figur 3. Komplementsystemets faktor H och dess funktion vid mikrobangrepp. Figuren beskriver hur en borreliainfekterad fästing suger blod och konsekvenserna av detta. Spiroketerna, som nått spottkörtlarna uttrycker OspA och OspC och invaderar däggdjursvärden i samband med bettet. Erps och CRASPs (beroende på art) uttrycks och kan binda in de komplementreglerande proteinerna faktor H och FHL-1 i värddjurets blod varvid C3-komponenterna inaktiveras. Som följd av detta undgår
Protein Interaktion Funktion
C1-inhibitor C1r, C1s serinproteasinhibitor; binder till C1r och C1s och dissocierar dem från C1q
faktor I C4b, C3b serinproteas; klyver C3b och C4b m.h.a. faktor H MCP, C4BP el. CR1 som co-faktorer
Faktor H C3b binder C3b och tränger undan Bb; co-faktor för faktor I- medierad klyvning av C3b
C4BP C4b binder C4b och tränger undan C2; co-faktor för
faktor I medierad klyvning av C4b
MCP, CD46 C3b, C4b co-faktor för fI-medierad klyvning av C3boch C4b DAF C4b2b, spjälkar C4b2b och C3bBb resulterande i förlust av
C3-konvertasaktivitet
CD59 C7, C8 blockerar C9-inbindning och förhindrar bildning av
spiroketerna komplementsystemets bildning av MAC och därmed lys (http://e.wikipedia.org/wiki/Lyme disease (2008)).
Fagocytos
Ett ytterligare försvar mot invaderande borreliabakterier utöver komplementattack utgörs av olika typer av fagocyterande celler som neutrofila granulocyter, monocyter och makrofager. De långa och rörliga borreliaspiroketerna fagocyteras av de neutrofila granulocyterna genom en speciell teknik, s.k. rör - eller tubfagocytos. Detta innebär att den fagocyterande neutrofilen utvecklar ett tunt, långsmalt utskott, som omsluter spiroketen varefter utskottet med innesluten spiroket dras in i cellen (figur 8) (Sviberg & Meri (2004), Suhonen et al. (1998), Rittig et al. (1992)).
Fagocytos genom makrofager underlättas av men kräver inte föregående opsonisering. Viktiga faktorer för opsonisering är komplementprodukterna C3b och iC3b som binder in till bakterieytans C3 – receptorer (CR1 och CR3). Även närvaro av Fc – receptorer leder till snabb fagocytos och avdödning (Montgomery et al. (2002), Rittig et al. (1992)).
Figur 4. Den långa och mycket rörliga borreliabakterien fagocyteras med hjälp av ett rörliknande utskott. Bakterien omsluts av utskottet och innesluts därefter i den fagocyterande cellen samt avdödas genom exponering för cellens lyzosomer. Ibland kan vakuoler innehålla både spiroketer och pseudopodier (Rittig et al. (1992))
SYFTE
Föreliggande arbete syftar till att utveckla metoder för att öka förståelsen för borreliabakteriers egenskaper och krav samt deras strategier för överlevnad genom att undfly värddjurets immunsystem.
Studierna delas upp i följande delmoment:
Optimering av odlingsbetingelser för olika stammar av Borrelia garninii och Borrelia afzelii. Bestämning av resistens mot komplement i NHS för de olika stammarna.
Urval av en komplementresistent och en komplementkänslig stam för fortsatta studier.
Exponering av de utvalda borreliastammarna i olika koncentrationer mot ospätt NHS, INHS och hirudinbehandlat helblod.
Fagocytosförsök med olika koncentrationer av de FITC - inmärkta borreliastammarna i hirudinbehandlat helblod, med och utan tillsats av EDTA.
MATERIAL OCH METODER
In vitro odlingBakterien B. burgdorferi är mikroaerofil med ett komplext näringsbehov, vilket gör den svårodlad. Den kräver ett rikt odlingsmedium som exempelvis Barbour-Stoenner Kelly II (BSK II) (Ruzic-Sabljic (2001)) och den har en lång generationstid (10 - 18 timmar) vilket förstärker problematiken (Murray et al. (1990)). Under utdragen in vitro – odling (flera veckor) kommer bakterierna dessutom att förlora plasmider och därmed ofta sin virulens (Volk et al. (1995)).
Vanlig odlingstemperatur är 35 oC till 37 oC, men för biopsimaterial rekommenderas 33oC (Ruzic-Sabljic (2001), Aguero-Rosenfeld et al. (2005)). Vid en inkuberingstemperatur på 39oC eller högre försämras eller upphör tillväxten (Aguero-Rosenfeld et al. (2005)). Under odlingens gång är det viktigt att följa förändringar i mediet som t.ex. färgomslag och grumlighet. Då bakterietätheten ökar, ökar också halten av slaggprodukter medan tillgången på essentiella näringsämnen och pH sjunker, vilket indikerar att det är dags att subkultivera odlingen. Subkultivering sker genom att en bestämd volym av odlingen pipetteras över i ett nytt rör med fräscht medium. Antalet subkultiveringar bör dock begränsas och om odling skall pågå under en längre tid bör man utgå från nedfrusna stamkulturer.
Bakterierna kan långtidsförvaras vid -80oC under lång tid. För infrysning odlas bakterierna upp till en celltäthet av helst 108 bakterier/ml. Bakteriesuspensionen centrifugeras därefter vid 2500 x g i 12 minuter och bakteriepelleten resuspenderas i infrysningsmedium (odlingsmedium innehållande 10 volym % glycerol) (Barbour (1998), Byram et al. (2004)). Lämpliga infrysningsvolymer är 2,0 ml i kryorör med utanpåliggande kork.
Odlingsmedium och Borreliastammar
Stamkulturer av olika Borrelia - stammar uppslammade i odlingsmedium BSK II erhölls från avdelningen för molekylär biologi, Umeå Universitet.
BSK II bereds enligt:
• Sterilt vatten (super MQ) • BSA, 5 % • Neopepton 0,5 % • Hepes 0,6 % • Citronsyra 0,07 % • Glukos 0,5 % • TC Yestolate 0,2 % • Pyrodruvsyra 0,08 % • N-acetyl-D-glucosamin 0,04 %
• Natriumbikarbonat 0,22 % • CMRL-1066 medium 10 %
Blandningens pH justerades till 7, 6 med 1 M NaOH varefter mediet sterilfiltreras genom 0,22 μm filter. Därefter tillsätts sterilt kaninserum till en slutkoncentration av 6 volyms %. Alla använda kemikalier höll p.a. kvalitet eller motsvarande. I föreliggande arbete bereddes odlingsmediet ej på plats utan tillhandahölls i frusen form från Umeå universitet (-20oC). Följande bakteriestammar har studerats:
• B. garninii Far 03, isolat från fågelblod från Färöarna • B. garninii PBi, humant neuroisolat från Tyskland • B. garninii IP90, fästingisolat från inre Ryssland, • B. garninii Lu59, humant isolat från liquor
• B. afzelii ACA1, humant hudisolat från Sverige • B. afzelii UO1, humant isolat från Sverige • B. afzelii K78, humant isolat
Odling
Borreliabakterierna är utomordentligt känsliga för kontamination och allt praktiskt odlingsarbete genomfördes under iakttagande av strikt sterilteknik och i LAF-bänk.
Inledningsvis odlas de olika bakteriestammarna upp till en celltäthet av ca 108 bakterier per ml i 10 ml BSK II i rör med utanpåliggande skruvlock (Nunc) och med en minimal luftpelare över mediet. Därefter subkultiveras bakterierna genom att pipettera över ca 2 ml odlingssuspension i nya rör varefter fräscht medium till en slutvolym av 10 ml tillsattes. Bakteriernas kondition i odlingarna följdes dels genom visuell makroskopisk bedömning dels genom mikroskopering av våtpreparat i faskontrastmikroskop. Både viabilitet och cellantal bedömdes genom att 10 μl representativt prov ur odlingen placerades på objektglas, täcktes med täckglas och studerades vid 400 ggr förstoring i faskontrastmikroskop. Viabiliteten bestäms genom subjektiv uppskattning medan cellantalet beräknas genom räkning av antal viabla celler i 10 synfält. Beräkning av antal celler/ ml sker sedan med hjälp av formeln (Umeå universitet, personlig kommunikation, opublicerad uppgift (Nilsson (2008))):
Vid höga koncentrationer späddes provet med antingen BSK II eller PBS Ca2+ före kvantifiering.
Vid frysning för långtidsförvaring centrifugerades en bakteriesuspension vid 2500 x g i 20 minuter i en Eppendorff-centrifug med swing – out – rotor, varefter supernatanten sögs bort och bakteriepelleten resuspenderades i infrysningsmedium, BSK II med 10 volym % glycerol, till en koncentration om ca 108 celler/ ml. 1,25 ml av suspensionen fördes sedan över till sterila kryorör (med utanpåliggande skruvkork) och placerades i superfrys (- 80oC).
Vid förvaring vid denna temperatur kunde konstateras att bakterierna behöll sin viabilitet under minst ett år. Vid uppodling överförs ca 108 bakterier (ett kryorör) till ett odlingsrör och
Antal spiroketer/ ml = 165,308 x Σ
volymen justeras till 10 ml med odlingsmedium varefter de inkuberas. Efter ett dygn kontrolleras odlingen med avseende på eventuell kontamination och viabilitet. Vid viabilitet < 50 % och/ eller kontamination kasseras odlingen. Så snart cellerna passerat lagfasen, subkultiveras de i syfte att späda ut glycerolen från infrysningsmediet.
För undvikande av kontamination bör borreliabakterierna helst odlas i egen inkubator. Om detta inte är möjligt är det lämpligt att placera odlingsrören i en separat box i inkubatorn. Odlingstemperaturen vid samtliga försök var 37oC och skedde utan tillsats av CO2.
Bedömning av de olika bakteriestammarnas känslighet respektive resistens mot immunförsvarets komplementsystem
Olika bakteriestammar odlades upp och kvantifierades enligt ovan samt tvättades en gång med sterilfiltrerad (0,22 μm) veronalbuffert (145 mM NaCl, 1,8 mM 5,5- dietylnatriumbarbiturat, 3,1 mM 5,5- dietylbarbitursyra, 0,5 mM Mg2+ och 0,15 mM Ca2+) med centrifugering vid ca 2150 x g. Startkulturer bereddes sedan genom resuspendering i en mindre volym odlingsmedium följt av beräkning av bakterieantal .
Pilotförsök
100 μl startkultur av bakteriestammarna B. garninii Lu59 och B. afzelii ACA1, svarande mot 0,33 x 108 respektive 7,5x108 bakterier, exponerades för 200 μl upptinat normalt humanserum (NHS). NHS bereddes genom steril tappning av venblod i rör utan tillsats, koagulation under 30 minuter i rumstemperatur, centrifugering vid 3 000 x g i 20 minuter följt av dekantering och nedfrysning av supernatanten vid – 80oC inom 4 timmar.
Inkubering skedde vid 37 oC under 1 timme och bedömning gjordes genom studium av 10 μl våtpreparat vid 400x förstoring i faskontrastmikroskop enligt tidigare.
Exponering av startkultur från samtliga borreliastammar mot spädningsserie av NHS/ INHS
Startkulturer (100 μl från samtliga borreliastammar) exponerades i två parallella försök för spädningsserier av NHS respektive värmeinaktiverat NHS (INHS). Spädningsserien var baserad på ”3 – steg”, dvs. rör 1 ospätt humanserum, rör 2 spädning 1:3 med BSK II osv. till spädning 1:729. INHS framställdes genom inkubering av NHS vid 56 oC i 30 minuter.
Vid försöksstart tinades NHS och placerades antingen på is alternativt värmebehandlades för att sedan placeras på is. Spädningsserier upprättades för såväl NHS som INHS och 200 μl av respektive spädning överfördes till sterila mikrorör, varefter 100 μl startkultur (med varierande bakterietäthet för de olika bakteriestammarna) tillsattes (tabell III). Efter spädning och bakterietillsats inkuberades proverna vid 37oC under 1 timma. Inkuberingen avbröts genom att proverna flyttades tillbaka på is och 10 μl brytlösning (0,2 M EDTA, pH 7,4, i spädningsbuffert ( PBS, Tween och 1 % BSA) tillsattes.
Bedömning av överlevnad uttryckt som % sker genom fasmikroskopering av våtpreparat och räkning av viabla/ icke viabla spiroketer.
Resterande suspensioner från spädningsserierna centrifugerades vid 2500 x g i 12 minuter varefter supernatanten aspirerades och filtrerades genom 0,22 μm sterilfilter. Filtratet fördes
över till nytt sterilt rör och 10 μl brytlösning tillsattes medan bakteriepelleten tvättades en gång med PBS Ca2+. Samtliga rör, såväl den sterilfiltrerade supernatanten från första centrifugeringen som pelleten efter den andra, fördes över till – 80oC – frys i avvaktan på analys av fritt C3a och TCC. Samtliga experiment utfördes med dubbelprover. Dessutom gjordes en kontroll med PBS i stället för NHS.
Schema över experimentupplägg framgår av appendix C.
Tabell III Bakterietäthet för de olika startkulturerna i experimentet
På basis av utfallet i dessa försök beslutades att fortsättningsvis arbeta med stammarna Lu59 och K78.
Studium av komplementaktivering som funktion av bakterietätheten
Komplementaktivering som funktion av bakterietätheten studerades genom exponering av B.
garninii Lu59 och B. afzelii K78 med varierande celltäthet för ospätt NHS och INHS.
Efter uppodling centrifugeras respektive bakteriesuspension vid 2500 x g under 15 minuter, varefter supernatanten sugs bort och kastas. Bakteriepelleten resuspenderas i ca 1 ml BSK II (startkultur) och celltätheten bestäms genom faskontrastmikroskopi och beräkning enligt tidigare.
Bakteriesuspension med känd bakterietäthet späddes sedan i 10-steg genom att till det första röret i en försöksserie sätta 100 μl startkultur. Ur detta rör togs sedan 10 μl och sattes till rör 2 innehållande 90 μl BSK II osv.; inalles 7 rör plus ett kontrollrör med 90 μl BSK II men utan bakterier. Samtliga rör med bakteriesuspension centrifugerades därefter vid 2500 x g under 12 minuter, varefter supernatanten sögs bort och kastades. Kvarvarande bakteriepellets luckrades upp med hjälp av lab-mixer varefter 100 μl ospätt NHS/ INHS, tinat på isbad, tillsattes och rören inkuberades vid 37oC under 1 timma.
Efter avslutad inkubering placerades rören åter på is varefter 500 μl brytlösning tillsattes. Rören centrifugerades vid 8oC, 2500 x g, under 12 minuter, varefter supernatanten filtrerades genom 0,22 μm-filter och fördes över till nya sterila rör som placerades i – 80o
C – frys i avvaktan på C3a – och TCC – analys (för schema över experimentupplägg, se appendix D). Experimenten upprepades fem gånger.
Bakteriestam Bakterietäthet; antal celler/ 100 μl
B. afzelii, K78 1,2x108 B. afzelii ACA1 4,6x107 B. afzelii UO1 0,3x108 B. garninii LU 59 6,1x107 B. garninii Pbi 1,4x107 B. garninii Far03 1,3x107 B. garninii IP90 1,0x108
Pilotförsök för C3a/ TCC - analys (spädning 107 => 102)
Försöket utfördes på en startkultur av Lu59 med en celltäthet om 4x107/100 μl som späddes i 5 steg (4x107, 4x106, 4x105, 4x104, 4x103, 4x102 ) samt 0 och utfördes i analogi med försöket ovan, med modifieringen att mängden brytlösning ökades till 500 μl. På basis av utfallet i detta försök modifierades metoden för fortsättningen enligt följande:
• Volymen brytlösning ökades till 950 μl • Antalet spädningssteg minskades till 4 • Volymen NHS/ INHS minskades till 50 μl • Filtrering genom 0,22 μm filter slopades
• Volymen supernatant till infrysning bestämdes till 800 μl Studium av Lu59 och K78 med modifierad metod
Preparation av bakteriekulturer utfördes som tidigare och bakterietätheten för båda stammarna i startkulturen var 8 x 107 och i den högsta spädningen 8 x 105, med utförande som framgår av flödesschema; se appendix E.
För att ytterligare öka bakterietätheten i startkulturerna av Lu59 och K78 modifierades metoden ytterligare:
1. Fyra odlingsrör med tät växt poolades i 50 ml-s Falconrör varefter dessa centrifugerades vid 2150 x g i 15 minuter. Pelletarna resuspenderades i 2 ml BSK II. Bakterietätheten bestämdes till 4x 108/ 100 μl för Lu59 och 6x 108/ 100 μl för K78. Spädning utfördes i tre steg, 108 => 105 .
2. Försöket upprepades ytterligare en gång varvid startkulturer med bakterietäthet 9,5x 108/100 μl för Lu59 och 7,6x 108/100 μl för K78 erhölls. Tre spädningssteg gav 108 => 105.
3. I ytterligare ett försök med Lu59 höjdes bakteriekoncentration ytterligare och uppgick i startkulturen till 1,2x 109/ 100 μl med spädning i tre steg till1,2x 106/ 100 μl.
Studium av Lu59 och K78 med hög celltäthet och exponering för NHS och färskt humant helblod
Humant helblod tappades ca en timme innan försökets start. Som antikoagulationsmedel användes hirudin (50μg/ml). Preparation av starkulturer utfördes på samma sätt som beskrivits ovan med tillägget att bakterietätheterna justerades till 1,2x 109/ 100 μl för båda stammarna. Spädning utfördes i 10 – steg 109 => 105 inför exponering för NHS och 109 => 103 inför exponering för helblod. Experimentet med helblod utfördes i hepariniserade reaktionsrör (Eppendorf) och i övrigt i enlighet med appendix E med undantaget att 400 μl brytlösning användes. Efter centrifugering pipetterades 400 μl supernatant till kryorör och fördes över till – 80oC frys tillsammans med centrifugrör inklusive pellet för senare analys. Experimenten upprepades fem gånger.
Inmärkning med fluorescerande isothiocyanat (FITC) (Pilotstudie)
Inmärkning av borreliabakterier med fluorescerande ämnen kan användas för att identifiera typ av fagocyterande vit(a) blodcell(er) och ett pilotförsök med inmärkning genom ett fluorescinderivat, fluorescin isothiocyanat, FITC, utfördes.
Inför försöket odlades Lu59 och K78 till hög celltäthet, som justerades med BSK II till 2x108/ml för båda stammarna. 1 ml av respektive startkultur fick sedan reagera med 1 ml FITC – lösning (fluorescin isothiocyanat (0,5 mg/ml) i 50 mM Na - karbonat och 100 mM NaCl, pH 7,4). Reaktionsrören inkuberades på vaggbord med låg hastighet vid rumstemperatur i 20 minuter.
Efter avslutad inkubering följde tre tvättsteg med 1 ml PBS Ca2+ och centrifugering vid 2150 x g under 8 minuter. Slutligen resuspenderades respektive pellet i 100 μl BSK II och 10 μl våtpreparat studerades i konfokalmikroskop med fluorescens (Schneider et al. (2007), Weingart et al. (1999)).
Fagocytosförsök med FITC - inmärkta borreliabakterier (Pilotstudie)
Lu59 och K78 odlades upp till hög celltäthet och justerades till 1x1010/ml. Efter FITC - inmärkning enligt ovan späddes bakteriesuspensionerna i BSK II till koncentrationerna 103, 106 och 109/100 μl.
De inmärkta borreliabakterierna fick under 30 resp. 60 minuter reagera dels med helblod dels med helblod med tillsats av EDTA (10 mM slutkoncentration/ ml helblod). Försöket utfördes i mikrorör placerade på flytblock i 37oC vattenbad. Efter uppnådd tid bröts reaktionen genom tillsats av EDTA -lösning till en slutkoncentration av 10 mM i rören med enbart helblod. Till reaktionsrören med EDTA – tillsats gjordes ingen ytterligare tillsats.
Provvolymer om 100 μl fördes över till speciella FACS-rör och 1 ml AKC -lösning (155mM NH4Cl, 120 mM KHCO3 och 0,1 mM EDTA) tillsattes i syfte att lysera erytrocyterna. Efter ca
8 minuter centrifugerades proverna vid 300 x g under 5 minuter och analyserades genom flödescytometri (FACS) under 90 sekunder.
Extracellulär inbindning av FITC quenchades bort genom tillsats av 50 μl av en 0,4 % lösning av trypanblått till vart annat rör. Detta resulterar i att FACS-en ”registrerade” såväl
totalinmärkning som enbart intracellulär inmärkning (totalantal borreliabakterier och fagocyterade dito).
För att åskådliggöra fagocytosen och dess förlopp utfördes en kärninfärgning av representativa prover från försöket ovan. Prov om 10 μl från FACS - rör placerades på objektglas och vätskan fick avdunsta. Cellerna fixerades med 4 % formaldehydlösning under 15 minuter följt av tvätt med PBS inklusive 0,05 % Tween. Propidiumjodidlösning (1:10 000 i PBS) droppades över och fick verka under 10 minuter. Slutligen tvättades med PBS/Tween-lösning som ovan och preparaten monterades med monteringsmedium (Dako).
C3a-analyser med ELISA - teknik (Enzyme Linked Immuno Sorbent Assay)
96-håls ELISA – plattor (Maxisorp, Nunc, Danmark) coatades med monoklonala mus-anti-human-C3a- antikroppar (4SD 17.3). Antikropparna späddes 1:300 i PBS och varje brunn coatades med 150 μl följt av inkubering av plattan vid + 4o
C över natt. Efter tvättning med tvättbuffert (PBS med 0,05 % v/v Tween 20) blockerades med 300 μl spädningsbuffert (tvättbuffert + 1 % BSA + 10 mM EDTA) per brunn. Därefter inkuberades plattorna på skakbord, 30 minuter i rumstemperatur, följt av tre tvättningar med tvättbuffert. Prover, supernatanter från tidigare försöksomgångar, tinades och späddes 104 ggr i spädningsbuffert. Zymosanaktiverat serum med känd koncentration C3a användes som standard och en standardkurva gjordes från 0,054 ng/ ml till 3,49 ng/ml. Som kontroll användes poolat zymosanaktiverat serum från blodgivare.
Vid analys beskickades brunnarna med 100 μl prov, standard eller kontroll följt av inkubering på skakbord, 60 minuter, i rumstemperatur följt av tre tvättsteg med tvättbuffert. Till varje brunn sattes därefter 100 μl biotinylerade polyklonala anti - C3a- antikroppar spädda 1:50 i spädningsbuffert följt av inkubering på skakbord, 60 minuter, vid rumstemperatur. Efter ytterligare tre tvättningar med tvättbuffert tillsattes konjugat, 100 μl streptavidin – HRP (GE Healthcare) spätt 1/500 i spädningsbuffert, till samtliga brunnar, varpå följde inkubering, 15 minuter, vid rumstemperatur, förnyad tvättning om tre steg med tvättbuffert följt av tillsatts av reagens enligt nedan, 100 μl/ brunn. Efter 5 minuter stoppades reaktionen genom tillsats av 100 μl 1M H2SO4 per brunn. Reagenset, 20 ml färgbuffert, bereddes strax före användningen
med koncentrationerna 35 mM citronsyra, 70 mM Na2HPO4 x 2 H2O, pH 5,0, 250 μl
phenyldiaminedihydrochlorid (Sigma Chemicals) och 20 μl H2O2. Absorbansen avlästes
sedan vid 492 nm i en ELISA - spektrofotometer. TCC - analys med ELISA - teknik
Metodiken för denna analys är identisk med den för C3a med skillnaden att de monoklonala antikropparna utgörs av anti-HU-C9 mab aEII 1/2000 i PBS och de polyklonala av anti - human C5 från kanin (Dako A 0055) och konjugatet av anti - kanin - Ig - HRP (Dako PO 217).
RESULTAT OCH DISKUSSION
Samtliga bakteriestammar med undantag av B. afzelii UO1 uppvisade god överlevnad efter uppodling, nedfrysning, upptining, subkultivering och återgång i odling.
Exponering av startkulturer om 7,5 x 108/100 μl respektive 0,33 x 108/100 μl av B. afzelii ACA1 respektive B. garninii Lu59 för 200 μl ospätt NHS resulterade i ca 97 % överlevnad för ACA1 och 0 % för Lu59 efter en timmas inkubering. Ökad spädning av NHS resulterade i successivt ökad överlevnad för Lu59 (figs 5, 6). Exponering för INHS påverkade ej överlevnaden hos någon av stammarna. Mot bakgrund av effekter av komplementet (= känslighet mot NHS) klassas bakteriestammarna som känsliga, intermediära och resistenta.
Borrelia afzelii K78, Borrelia afzelii UO1 och Borrelia afzelii ACA1 uppvisade samtliga god resistens (figs 5, 9, 11). Bland Borrelia garninii - stammarna uppvisade IP 90 viss resistens medan Pbi, Far03 och Lu59 visade sig vara känsliga mot komplement i ospätt serum medan överlevnaden tilltog med fallande serumkoncentration resulterande i en glidande klassning över intermediär till känslig (figs 6, 7, 8, 10). För samtliga försök gäller n = 5.
Figur 5. Överlevnad i % av B. afzelii ACA1 efter exponering för en spädningsserie av NHS/INHS. Kulturen bedöms som resistent (exponering för NHS ljus rastrering, INHS mörk rastrering)
Figur 6. Överlevnad i % av B. garninii Lu59 efter exponering för en spädningsserie av NHS/ INHS. Kulturen bedöms som känslig.
B.garninii LU59 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö ver levn ad B.afzelii ACA 1 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö ver levn ad
Föreliggande resultat stämmer i stort överens med (Sviberg & Meri 2004), där B. afzelii - stammar uppvisade övervägande resistents medan B. garninii – stammar var intermediära eller känsliga.
.
Figur 7. Överlevnad i % av B. garninii Pbi efter exponering för en spädningsserie av NHS/ INHS. Kulturen bedöms som känslig.
Figur 8. Överlevnad i % av B. garninii Far 03 efter exponering för en spädningsserie av NHS/ INHS. Kulturen bedöms som känslig.
Figur 9. Överlevnad i % av B. afzelii K78 efter exponering för en spädningsserie av NHS/ INH S. Kulturen bedöms som resistent.
B.garninii Pbi 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö ver levn ad B.garninii Far 03 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö ver levn ad B.afzelii K78 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö ver levn ad
Figur 10. Överlevnad i % av B. garninii IP 90 efter exponering för en spädningsserie av NHS/ INHS. Kulturen bedöms som resistent/ intermediär.
Figur 11. Överlevnad i % av B. afzelii UO1 efter exponering för en spädningsserie av NHS/ INHS. Kulturen bedöms som resistent.
Tabell IV. Bedömning av känslighet/ resistens för olika borreliastammar mot aktivt serumkomplement
Bakteriestam
%
Överlevnad NHS
%
Överlevnad INHS Bedömning
B.garninii Lu59 0 97 känslig
B.garninii Pbi 0 91 känslig
B.garninii Far 03 0 95 känslig
B.garninii IP90 75 100 resistent/intermediär
B.afzelii ACA1 98 100 resistent
B.afzelii K78 98 100 resistent
B.afzelii UO1 92 100 resistent
B.garninii IP90 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö ver levn ad B.afzelii UO1 0 20 40 60 80 100 1/1 1/3 1/9 1/27 1/81 1/243 1/729 serum spädning % ö v e rl evn ad
Utifrån erhållna resultat med avseende på interaktion med komplementsystemet utvaldes B.
garninii Lu59 (känslig) och B. afzelii K78 (resistent) för fortsatta studier.
Figur 12. Relativ halt fritt C3a efter exponering av högre halter av B. garninii Lu59 (ljus stapel) resp. B. afzelii K78 (mörk stapel) för ospätt NHS; Lu59 utlöser en komplementaktivering först vid en
bakterietäthet av 8x107 medan K78 ej utlöser någon nämnvärd aktivitet.
Exponering av de båda bakteriestammarna för NHS med efterföljande analys av C3a och TCC resulterade i markanta ökningar i båda variablerna för LU59 medan för K78 ingen nämnvärd ökning noterades. Anmärkningsvärt är den höga bakterietäthet (>107) som krävdes för signifikant reaktion (figs 12, 13).
Försök med lägre halter av bakterier (102 – 104) gav generellt ingen aktivering varför dessa resultat ej redovisas i stapeldiagrammen.
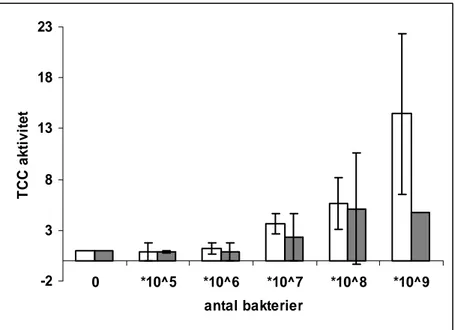
Figur 13. Relativ halt fritt TCC efter exponering av högre halter av B.garninii Lu59 (ljus stapel) resp. B.
afzelii K78 (mörk stapel). Lu59 utlöser en komplementaktivering först vid en bakterietäthet av 8x107
medan K78 resulterar i en betydligt svagare aktivering.
0 1 2 3 4 5 0 *10^5 *10^6 *10^7 *10^8 *10^9 antal bakterier C 3a akt iv it et -2 3 8 13 18 23 0 *10^5 *10^6 *10^7 *10^8 *10^9 antal bakterier T C C ak ti vi te t
De förhållandevis höga halterna av såväl fritt C3a som TCC uppmätt efter exponering av den komplementkänsliga stammen Lu59 för NHS visar att komplementkaskaden har aktiverats. De observerade stora spridningarna (figs 12, 13) kan ha sin orsak dels i små provvolymer med höga koncentrationer av spiroketer dels i att spiroketerna i sig är långa och lätt bildar aggregat, vilket kan resultera i en inhomogen suspension. Av resultaten framgår klart att den känsliga stammen Lu59 aktiverar komplementsystemet medan K78 ej uppvisar motsvarande tydliga effekt.
Figur 14. Relativ halt av fritt C3a efter exponering av B.garninii Lu59 resp. B. afzelii K78 för humant hirudinbehandlat helblod respektive NHS.
Dock är de bakteriehalter (Lu59) som krävs för komplementaktivering mycket höga och på gränsen till biologiskt orealistiska. Ett uppföljande försök med exponering för biologiskt mer relevant hirudinbehandlat helblod, resulterade i såväl kvalitativt som kvantitativt i stort sett likvärdiga resultat jämfört med tidigare (figs 14, 15)
Figur 15. Relativ halt fritt TCC efter exponering av B.garninii Lu59 resp. B. afzelii K78 för humant hirudinbehandlat helblod respektive NHS.
När kroppen angrips av inkräktare t. ex i form av främmande mikroorganismer inleds en strid mellan inkräktaren och kroppen. Inkräktaren försöker vinna mark dels genom snabb replikering dels genom en arsenal av strategier som produktion av toxiner, enzymer, proteiner
0,00 1,00 2,00 3,00 4,00 5,00 0 *10^5 *10^6 *10^7 *10^8 *10^9 antal bakterier C 3a akt iv it et LU59 serum LU59 hir.blod K78 serum K78 hir.blod 0,00 2,00 4,00 6,00 8,00 10,00 12,00 0 *10^5 *10^6 *10^7 *10^8 *10^9 antal bakterier T C C ak ti v it e t LU59 serum Lu59 hir.blod K78 serum K78 hir.blod
m.m. Kroppen möter med hela sitt immunförsvar, både det medfödda och det förvärvade. Som tidigare redovisats har faktor H en nyckelroll i immunförsvarets komplementkaskad. I borreliabakteriens strategi ingår en sofistikerad ändring i uttrycket av ytproteiner, OSPs, Erps och CRASPs, med förmåga att binda upp faktor H till bakteriens yta och på så sätt förhindra aktivering av C3 och fortsatt komplementkaskad (Lyme disease (2008)). Inbindning till sådan uttryckta specifika ytproteiner hos K78 är en trolig förklaring till den i föreliggande arbete observerade höga komplementresistensen hos denna stam medan den komplementkänsliga Lu59 har begränsade möjligheter i detta avseende, en slutsats i överensstämmelse med (Kraiczy et al. (2001), Nilsson-Ekdahl et al. (2008)).
En ytterligare försvarsmöjlighet utgörs av fagocytos av bakterieceller. Denna kan stimuleras genom inbindning av C3b, även detta en spjälkningsprodukt från C3, till mikrobens ytproteiner (opsonisering), men kan även ske utan denna inbindning, om än i mindre omfattning. Detta innebär att en bakteriestam med faktor H – bindande ytproteiner blockerar bildningen även av C3b och på så sätt undviker opsonisering med efterföljande stimulerad fagocytos.
Inför pilotstudien av fagocytos utfördes inmärkning av borreliabakterier med FITC. Resultaten av detta framgår av figs 16, 1 -3. I 16:1 syns hur bakterierna kan bilda aggregat medan morfologin framgår tydligast i 16:3.
Fagocytos studerades som tidigare beskrivits genom exponering av FITC - inmärkta borreliabakterier för hirudinbehandlat helblod och analys genom dels mikroskopering dels FACS (figs 17 A – D, 18 – 22, tab V).
1 2
3
Figur 16:1-3. FITC-inmärkta borreliaspiroketer fotograferade i konfokalmikroskop försett med fluorescens (foto: Ulrika Cristerson). 1 = översiktsbild, 2 = del av översiktsbild och 3 = detaljförstoring.
A B
C D
Figur 17. Konfokalmikroskopisk illustration av fagocytos av borreliabakterie (foto Per Nilsson).
Analys genom mikroskopering exemplifieras i figur 17 där bilderna A, B, C och D visar olika stadier vid degradering av Lu59 i samband med fagocytos. De FITC-inmärkta borreliabakterierna har grön färg medan de med propodiumjodidlösning infärgade leukocytkärnorna är röda. A visar borreliabakterier fria i lösning medan B visar en delvis fagocyterad borreliabakterie. C visar fagocyterade och delvis degraderade borreliabakterier medan D visar fullständigt degraderade borreliabakterier.
Utfallen från fagocytosförsök med humant hirudinbehandlat helblod av FITC-inmärkta borreliabakterier, K78 och Lu59, och flödescytometrisk analys presenteras i tabell V. I tabellen redovisas endast resultaten vid hög bakterietäthet (109) och efter 30 minuters inkubation, då ingen ytterligare effekt kunde påvisas efter 60 minuter
Av erhållna resultat (tab V, Figs 18, 19, 20) tycks framgå att granulocyterna som helhet utövar en mer effektiv fagocytos än monocyterna. Samtidigt är de dock ca 5 gånger så många i det cirkulerande blodet och dessutom ger använd metod inga upplysningar om antal fagocyterade bakterier/ cell.
Tabell V. Utfall efter 30 minuters inkubering med bakterietätheten 109/100 l och 90 sekunders analystid för monocyter respektive granulocyter; * = total fluorescensaktivitet svarande mot totalantal inmärkta bakterier, såväl adhererade som fagocyterade. i = intracellulär fluorescensaktivitet svarande mot fagocyterade bakterier (sammanställning av resultat från figs 18, 19, 20)
Bakteriestam Bakterieantal Behandling av blod Monocyter Granulocyter B.garninii Lu59 109 Hirudin 576,3 * 907,1 * ” ” ” 433,0 i 662,3 i ” ” Hirudin+EDTA 455,3 * 401,0 * ” ” ” 328,7 i 248,5 i ” 0 Hirudin 2,7 4,8 B. afzelii K78 109 Hirudin 215,5 * 929,5 * ” ” ” 367,7 i 824,6 i ” ” Hirudin+EDTA 356,3 * 546,4 * ” ” ” 187,6 i 242,5 i ” 0 Hirudin 2,3 2,6
Sammanfattningsvis har alltså visats att såväl monocyter som granulocyter har förmåga att adherera och fagocytera borreliabakterier men utifrån föreliggande resultat kan inga slutsatser dras avseende vilken celltyp som är mest effektiv (Montgomery et al. (2002), Rittig et al.(1992)).
Figur 18. Medelfluorescensintensitet (MFI) för extra- och intracellulär förekomst av FITC-inmärkta bakterier hos monocyter respektive granulocyter som mått på adherens plus fagocytos.
0 200 400 600 800 1000 mo n o c y te r gr an ul o c y ter mo n o c y te r gr an ul o c y ter LU59 K78 MFI hir.blod EDTA
0 200 400 600 800 1000 mo n o c y te r g ran ul oc y te r mo n o c y te r g ran ul oc y te r LU59 K78 MF I hir.blod EDTA
Figur 19. Medelfluorescensintensitet (MFI) i närvaro av trypanblått. Trypanblått quenchar bort extracellulär FITC – inmärkning varför redovisad MFI representerar intracellulära eller fagocyterade bakterier.
0 200 400 600 800 1000 mo n o c y te r granu lo c y te r mo n o c y te r granu lo c y te r LU59 K78 MFI hir.blod EDTA
Figur 20. Medelfluorescensintensiteten (MFI) för adhererade bakterier (total MFI minus intracellulär MFI).
Vidare tycks K78 fagocyteras i något större omfattning än Lu59 (tab V, fig 19). Detta kan förefalla motsägelsefullt då K78 är betydligt mer resistent mot komplement än Lu59, dvs. K78 binder in faktor H och C3 till cellytan, varvid komplementets alternativa väg försvagas
relaterat till de lägre halterna av uppmätt fritt C3a och TCC för K78 (figs 14, 15) (Lyme disease (2008)). En förklaring kan vara att den känsliga Lu59 inte binder in faktor H i lika stor utsträckning som K78. Detta indikeras av de dubbelt så höga halterna av C3a (fig 14) och TCC (fig 15) vilket pekar på ett aktiverat komplement som genom bildning av MAC resulterat i en stimulerad lys med färre bakterier tillgängliga för fagocytos.
EDTA binder effektivt upp Ca2+ och Mg2+. Resultaten (tab V, figs 18, 19, 20) visar tydligt effekten av blockerat Ca2+ /Mg2+ på komplementsystemet och även på fagocytosen.
Åtminstone vissa B. garninii - stammar anses kunna orsaka neuroborrelios (Kraiczy et al. (2001)) medan de samtidigt är känsliga mot serumkomplement (figs 6, 7, 8, 10, tab IV). Två av de borreliastammar, B garninii Pbi och Lu59, som studerats i föreliggande studie var isolerade från cerebrospinalvätska (CSF). CSF bildas genom filtrering av blod i framförallt choroid plexus och utgörs av en vattenlösning med joner, vissa proteiner, glukos och ett fåtal leukocyter men inget komplementsystem (http://uscneurosurgery.com/glossary/c/cerebro-spinal % 20fluid % 20csf.htm). Dock anses en viss komplementsyntes kunna äga rum genom intrathecal komplementaktivering (Nilsson-Ekdahl et al. (2008)). Uppkomst av neuroborrelios kan förklaras av att det bland de komplementkänsliga borreliabakterierna alltid finns enstaka individer som undkommer kroppens immunförsvar. Detta gäller såväl komplementattack som fagocytos. Dessa resistenta individer kan eventuellt penetrera blod/ hjärnbarriären och infektera celler i hjärnan samt orsaka betydande skador för den drabbade individen (Nilsson-Ekdahl et al. (2008)).
TACK
Ett stort tack till min handledare professor Kristina Nilsson-Ekdahl för förtroendet att tilldela mig den spännande och inspirerande uppgiften och god vägledning under arbetets gång. Tänk att sådana små ”skruvar” kan ställa till med så mycket elände. Det var fascinerande att studera deras förehavanden under kontrollerade former!
Tack, Kerstin Sandholm, du finns alltid med både uppmuntran, råd, stöd och fantastisk hjälp. Även ett stort tack för ditt digra bidrag med utförande av C3a – och TCC – samt FACS – analyser samt sammanställning av resultat och diagram.
Tack, professor Sven Bergström och Ingela Nilsson, avdelningen för Molekylär Biologi, Umeå Universitet, för de olika isolaten av borreliastammar. Och tack Ingela för odlingsråd, recept och beredning av medium, som du har fixat och skickat till mig med kort varsel.
Tack, Georg Gleffe, för lån av faskontrastmikroskop och hjälp när ”fasen skenat”. Tack, Ulrika Cristerson, för god hjälp med konfokalmikroskopet.
Tack, Per Nilsson, för hjälp med kärninfärgningen av de fagocyterande cellerna, visualisering i konfokalmikroskop och för värdefulla synpunkter.
Tack, Anna Engberg, för dina värdefulla synpunkter och suveräna hjälp med uppstart och inställning av FACS - utrustningen.
Så till sist, men inte minst, tack Ulf, min livskamrat, för att du tålmodigt och engagerat lyssnat på mig, diskuterat med mig, hjälpt och lugnat mig när logistiken mellan datorn och mig inte har fungerat.