Power lines – Wasteland or
Biodiversity Hotspots?
Ett examensarbete av: Ahlgren, Christian
Boström, Magnus Norström Paananen, Marcus
Akademin för hållbar samhälls- och teknikutveckling, HST Mälardalens Högskola
Abstract
As a consequence of the intensification of various forms of human resource utilization rural Sweden has changed radically over the past 200 years from offering a varied and diverse landscape to a more monotonous, homogenised type of environment. This has led to fragmentation of habitats for many of the species occurring. Power line corridors might harbour habitats that resemble some of the now lost or fragmented habitats (e.g. grazed forest land and certain types of meadow), and could have important functions as refuge habitats and / or distribution corridors for these species.
In a pitfall trap study in Köping and Strängnäs municipalities in Mälardalen, the occurrence and abundance of ground-living invertebrates were investigated in power line corridors, adjoining forest and pastures. Comparisons were made between these habitat types, and between positions within the power line corridor (central and distal parts) and the nearby forested area. The comparisons included analysis of number of species (or rather the number of taxa) and several biodiversity indexes, as well as analysis of the similarity of the
occurrence of certain species and individual numbers by use of "similarity index". Separate tests were made in different taxonomic groups (e.g. all taxa, only within insects, only within spiders). The number of replicates allowed statistical testing of patterns in the number of taxa and biodiversity index.
No significant differences were documented, neither between the different habitat types, nor between positions in the power line corridors and nearby forest. There was also no consistent (non-significant) pattern indicating that this would be the case. We suggest these results to indicate that power line corridors at least are not (significantly) poorer quality habitats than are forest or pasture land with regard to number of taxa and biodiversity. Number of taxa and biodiversity indices take no account of the species or taxa included in the analysis. Thus the same weight is assigned to an unwanted species (e.g. an invasive pest species or parasite) as to a red-listed, highly valued species. Similarity index takes more heed to the species involved. Although similarity indices do not consider the exact identity of involved species (or their possible value or desirability), a high index value indicates that the same species occur in the compared habitats. In this study, where an index that takes into account the abundance of species was used, a high similarity index value also indicates that the numbers of individuals are similar.
Overall, the results showed high similarity between habitat types. This would suggest that, to a large extent, power lines, forest and pasture land had the same composition of taxa, and that the taxa had similar abundances. Power lines and forest seemed to exhibit particularly high similarities, whereas the similarity between power lines and pasture land was less
pronounced. Thus, this study indicates, in contrast to several previous suggestions, that power line corridors do not seem to be low quality habitats. We also suggest that power line
corridors with well designed management routines could play an important role creating edges and habitats resembling meadow or low intensity grazed pasture land.
Sammanfattning
Det svenska kulturlandskapet har förändrats radikalt under de senaste 200 åren från ett varierat och heterogent landskap till ett mer monotont, homogeniserat landskap som följd av att olika former av mänskligt resursutnyttjande har effektiviserats. Detta har lett till en fragmentering av livsmiljöerna för flera av kulturlandskapets arter. Kraftledningsgator kan tänkas hysa naturtyper som påminner om vissa av de nu försvunna eller fragmenterade livsmiljöerna (t ex betad skogsmark och vissa typer av ängsmarker) och skulle kunna ha en viktig betydelse som reträttplats och/eller spridningskorridor för dessa arter.
I en fallfällsinventering i Köpings och Strängnäs kommun i Mälardalen undersöktes förekomst och abundans av marklevande evertebrater i kraftledningsgator, skog och betesmark. Jämförelser i förekomst och abundans gjordes mellan dessa marktyper (d v s kraftledningsgator, skog och betesmark), samt mellan positioner inom kraftledningsgator (centrala och distala delar) och närliggande skogsmark. Jämförelserna innefattade dels analyser av artantal (eller snarare antal taxa) och flera olika biodiversitetsindex och dels analyser av likhet i artförekomst och individantal med "likhetsindex" (similarity index). Separata analyser gjordes inom olika taxonomiska grupper (t ex alla taxa, endast inom insekter, endast inom spindeldjur). Antalet replikat tillät statistisk testning av eventuella mönster i antal taxa och biodiversitetsindex.
Inga signifikanta skillnader dokumenterades, varken mellan de olika marktyperna eller mellan positioner inom kraftledningsgator och närliggande skog. Vi tolkar dessa resultat som att kraftledningsgator med avseende på antal taxa respektive biodiversitet inte är (signifikant)
sämre än skogs- eller betesmark. Det kan betonas att det inte heller fanns något konsekvent
(icke-signifikant) mönster som pekade på att så skulle vara fallet. Antal taxa och biodiversitetsindex tar ingen hänsyn till vilka arter eller taxa som ingår i analyserna. En naturtyp som hyser en individ- och artrik fauna bestående av oönskade arter (introducerade arter, "skadedjur" etc.) registrerar t ex ett högre biodiversitetsindex än en naturtyp med fåtaligt förekommande rödlistade, skyddsvärda arter. Likhetsindex belyser bättre vilka arter som är inblandade. Visserligen tas inte heller här hänsyn till exakt vilka arter som ingår (eller deras eventuella önskvärdhet eller skyddsvärde), men ett högt index indikerar att samma arter förekommer i de jämförda naturtyperna. I denna studie indikerar ett högt likhetsindex dessutom att antalet individer av de inblandade arterna är likartat, eftersom ett index som tar hänsyn till abundans användes.
Resultaten visade överlag höga likhetsindex, speciellt verkade kraftledningsgator och skogsmark hysa likartad evertebratfauna medan likheten mellan kraftledningsgator och betesmark var mindre uttalad. Sammanfattningsvis indikerar studien att kraftledningsgator inte verkar vara lågvärdiga livsmiljöer för de marklevande evertebrat-taxa som ingått i studien. Vi föreslår att kraftledningsgator med väl avvägda rutiner för röjning och skötsel skulle kunna spela en viktig roll i skapandet av artrika kantzoner eller marker som liknar ängs- eller
Global nivå
De senaste 300 åren har världens befolkning ökat med ungefär 1100 %, ökningen har främst skett under det senaste seklet. Under samma tid har markarealen för födoproduktion ökat med ungefär 550 % (Trewavas 2001). Att arealen inte ökat i samma takt som befolkningen beror bland annat på att odlingsmarken idag utnyttjas effektivare med hjälp av moderna
jordbruksmaskiner, konstgödsel, bekämpningsmedel m.m. jämfört med innan
industrialiseringen och 1900-talets ”gröna revolution” (International Food Policy Research Institute, IFPRI, 2002). Dock har avkastningen från åkermark på global nivå minskat i stor utsträckning sedan 1950-talet. Orsakerna är många men den främsta anledningen är
jorderosion (Pimentel m.fl. 1997).
Idag sker en omfattande omvandling av regnskog till odlingsmark i bl. a. Brasilien (Laurance m.fl. 2007) medan utvecklingen i Europa snarare är den motsatta. Arealen skogsmark i
Västeuropa har ökat med 30 % sedan 1950-talet medan Central- och Sydeuropa sett en ökning på omkring 20 % under samma tid. I norra Europa har ökningen varit mer måttlig på omkring 5 % (Gold m.fl. 2006). Det är främst produktionsskogen som står för ökningen och i Sverige har produktionsskogen under det senaste seklet ersatt en stor del av den s.k. ”naturskogen” som endast utgör omkring 5 % av dagens totala skogsareal (Bohlin 2007).
Storskaligt lantbruk
Innan skiftesreformen i början av 1800-talet var det svenska kulturlandskapet främst ett beteslandskap som var uppdelat i flera olika slags betesmarker och ängar (bland annat hagmarker, hedar, skogsbeten och näringsfattiga ängsmarker där slåtter och lövtäkt hade skapat en rik flora. Detta landskap var öppet eller halvöppet och mosaikartat med rik
förekomst av kantzoner och en heterogen uppsättning av marktyper (Frycklund 2002, Bohlin 2007). I och med skiftesreformen avskaffades bland annat det system inom jordbruket som hade inneburit att åkertegar hade delats vid varje generationsskifte. Istället slogs varje teg en bonde ägde ihop till en sammanhängande åker (bl. a. Åberg 1953, Bohlin 2007). Det
medförde att många kantzoner försvann och att landskapet fick en mer homogen struktur. Under 1800-talet fortsatte förändringen av jordbruket, åkerarealen utökades på bekostnad av slåtterängarna och beteshagarna, betet koncentrerades främst till vall och många slåtterängar omvandlades till hagmarker. Under 1900-talet försvann en stor del av det småskaliga
lantbruket. Brukandet blev mer industrialiserat och avkastningen blev större, inte minst i och med införandet av konstgödsel, herbicider och pesticider (IFPRI 2002). Betesmarkerna ersattes i stor utsträckning med antingen åker- eller skogsbruk, åkerholmarna odlades upp och åkertegarna blev större och mer koncentrerade (Bernes 1994, Bohlin 2007).
Under 1900-talet reducerades ängsmarksarealen (vilken omfattar samtliga ängstyper) till omkring 1 % av den ursprungliga ytan, dock har ängsmarksarealen ökat något under 2000-talet (Anon. 2007). Att ängs- och betesmarkerna minskade i areal och antal innebar också att de betesmarker som ännu fanns kvar riskerade få ett för högt betestryck medan många slåtterängar omvandlades till betesmarker. Sedan tidigare är det känt att svagt betade marker kan uppvisa en artrikare insektsfauna jämfört med hårdhävdade marker (Appelqvist m.fl. 2001, Lennartsson & Hoflin 2003, Lennartsson 2008). Visserligen kan slåtterängar som överförs till betesmark inledningsvis få en ökad artrikedom (Bernes 1994) men eftersom flera
ängslevande växter är både ljuskrävande och känsliga för betestryck kan detta på lång sikt negativt påverka insekter beroende av ängsväxter. Dessutom är många av de insektsarter som är knutna till dessa växter ännu mer känsliga för förändringar än växterna själva (Lennartsson & Hoflin 2003). Ängar gödslades inte tidigare och en stor del av ängsfloran kräver en
näringsfattig mark. I gödslad betesmark blir artrikedomen på sikt mycket lägre som en följd av att marken blir mer näringsrik, vilket leder till att konkurrenskraftiga arter kan dominera och ljuskrävande arter missgynnas. I näringsfattig mark kan ingen art dominera och fler arter samexistera (Dänhardt 2003). Som en följd av dessa förändringar har flera ängslevande och hävdgynnade arter, såväl växter som djur, blivit starkt hotade. Eftersom många insektsarter under sitt levnadslopp dessutom är i behov av flera olika biotoper (Appelqvist m.fl. 2001) blir bristen på marker i olika successioner också en missgynnande faktor.
Runt Mälaren är antalet hårdvallsängar, det vill säga ängar på torr mark, mycket få. I Köpings kommun har det bedömts att några sådana ängar inte finns kvar eller att före detta ängsmarker inte bedöms restaurerbara (Anon. 2006a). Mellan 1990 och 2004 försvann dessutom ungefär 100 hektar av den befintliga naturbetesmarken i Köpings kommun, vilket motsvarar ca 20 % av den totala naturbetesmarksarealen i kommunen och är en av de största nedgångarna i länet (Anon. 2006a).
Landskapstruktur
Mälardalens mosaiklandskap
Det traditionella jordbruket gav ett mosaikartat landskap med många s.k. småbiotoper. Småbiotoper i det traditionella odlingslandskapet utgjordes av bland annat diken, stenmurar, odlingsrösen, åkerholmar och skogsbryn. Det traditionella jordbruket förändrade landskapet kontinuerligt eftersom foder- (ängar och betesmark) och åkermarker ständigt befann sig i olika successioner i och med trädessystemet (Bernes 1994, Dahlström 2006). För Mälardalen gällde detta i hög grad där det småbrutna landskapet, klimatet och jorden gav möjlighet till ett intensivt odlande (Anon. 2004, figur 1). Artdiversiteten i ett område ökar med variationen på habitat och hur olika de är och detta är vad Wagner m.fl. (2000) kallade ”mosaikkonceptet”. I ett landskap med homogen struktur kan ett ekologiskt jordbruk, som bl.a. innebär att kantzoner tillskapas, gynna den biologiska mångfalden i odlingslandskap som tidigare varit homogena och artfattiga. Däremot kan det ekologiska jordbruket ha en mindre effekt på artrikedomen i ett landskap som redan har en mosaikartad struktur (Bengtsson & Ahnström 2007). Detta skulle kunna förklara varför ekologiskt jordbruk ger en mindre effekt på artrikedomen i Mälardalens redan tidigare tämligen mosaikartade landskap.
Figur 1. Illustration över ett typiskt mosaikartat landskap i Mälardalen (från Beckman-Thoor 2003, beskuren).
I Köpings kommun finns de mest intressanta natur- och kulturvärdena i den östra delen av kommunen med bl. a. en rik torrbacksflora (Anon. 2006a) men endast 30 % av den totala betesmarksarealen i kommunen bedöms vara av tillräckligt bra hävd. Området kring Stora Sundby, Läggesta, består av ett omväxlande landskap med åkrar, hagmarker och
lövskogsbestånd. Betes- och hagmarkerna består av en lätt kuperad miljö, bevuxna med sporadiskt busk- och trädskikt. Äldre ekar förekommer frekvent, även inplanterad bok finns. Delar av området används än idag för djurbete (Anon. 1991).
Kantzoner och deras funktion
Kantzonseffekter är de olika konsekvenser på vegetation och djur som är ett resultat av att en typ av vegetation gränsar till en annan. Dessa kantzoner kan vara naturliga såsom skog som gränsar till bränd/obränd mark eller konstgjorda, t.ex. skog som gränsar till kalhygge eller skogsvägar (Rowley m.fl. 1999).
Kantzonseffekter är viktiga drivkrafter för förändringar i många fragmenterade landskap, men är ofta föränderliga (Laurance m.fl. 2007). I kantzoner klarar sig i regel generalister bättre än mer specialiserade arter (Didham m.fl. 1996, Laurance m.fl. 2007).
β-diversiteten inom samma landskap tenderar att vara lika medan γ-diversiteten skiljer sig mellan fragmenten i olika landskap (Townsend 2003). Detta kan vara viktigt i förståelsen av dynamiken hos fragmenterade ekosystem (Laurance m.fl. 2007).
Typiska faktorer som kan påverka förhållandena inom kantzoner är exempelvis: Mikroklimatförändringar
Ökad abundans och diversitet av rovdjur och arter som människan anser vara skadedjur
Effekter från intilliggande markanvändning
Ändrad artsammansättning, förekomst av specialiserade kantzonsarter Ogrässpridning
Kantzonseffekter tros mest påverka angränsande stråk och små habitatytor (Matlack 1992, Rowley m.fl. 1999, Ries m.fl. 2004) och kantzonens påverkan på angränsande habitat blir större ju mindre ytan är på dessa habitat (Ewers m.fl. 2007)
Vid förlust av habitat och fragmentering av landskap är det oftast de arter som uppvisar lägst abundans som försvinner först (Andrén 1996). Få studier har dock gjorts på hur kantzoner och fragmentering av habitat påverkar olika insektsgrupper och resultaten är inte entydiga
(Didham m.fl. 1996, Ries m.fl. 2004). Resultaten kan påverkas av storleken på undersökta fragmenterade habitat och i vissa fall kan artrikedomen gå ner men inte den totala abundansen (Didham m.fl. 1996). I kantzoner kan dock artrikedomen av t ex. skalbaggar och spindlar vara högre än i omgivande habitat (Magura 2002, Öberg 2007). Vilka insektsarter som egentligen lever i kantzonen och vilka som tillfälligt vistas där kan vara svårt att avgöra, men det är känt att själva fragmenteringen och ökade avstånd och minskad konnektivitet mellan födoplatser har en negativ effekt på t ex. pollinatörer (Didham m.fl. 1996).
Det traditionella skogsbruket innan skiftesreformerna bestod framför allt av skogsbete och ett uttagssätt av timmer som liknar dimensionshuggning, det vill säga, man tog ut äldre träd i beståndet istället för att avverka ett helt bestånd samtidigt (Ekelund & Hamilton 2001). Skogsbetet fungerade mer eller mindre som gallring, vilket medförde att skogen var relativt öppen, ljus och hade en lång kontinuitet med gammal skog (Bohlin 2007). Detta gynnade en speciell skogsflora där bland annat skogsklocka (Campanula cervicaria) och linnéa (Linnaea
borealis) ingick. Hur stor skillnaden i flora och fauna mellan betad och obetad skog är har
först på senare tid uppmärksammats (Nilsson & Schönfeldt 1999), men skillnaderna har inte kunnat klargöras ännu. Arealen skog var relativt låg redan innan 1800-talet då skogen fick ett ekonomiskt värde och timmeravverkning i större skala påbörjades. Redan under 1500-talet försvann en stor del av naturskogarna i Örebro län, både löv- och barrskogar, på grund av behovet av timmer och odlingsmark (Emanuelsson 1994). I Mälardalen var skogen hårt undanträngd av odlingslandskapet samtidigt som skogen avverkades runt bruken i regionen (Bernes 1994). I mitten av 1800-talet rådde skogsbrist i stora delar av södra Sverige
(Dahlström 2006, Bohlin 2007) och samtidigt inleddes en intensiv avverkning i norra Sverige där skogen tidigare stått tämligen orörd (Bohlin 2007).
Detta medförde att skogsbetet kom i konflikt med virkesbehovet och den ljusa, mer öppna skogen ersattes med en tät och sluten skog. Även åldersstrukturen förändrades radikalt då främst gamla och grövre träd togs ut. Omvandlingen till ett industriellt utnyttjande av skogen och införandet av kalhyggesavverkningen under 1900-talet har påverkat den biologiska mångfalden radikalt. Volymen död ved och förekomsten av grövre träd blev obefintlig eller mycket liten i stora delar av Sverige (Bernes 1994). Det industriella skogsbruket innebar också att störningsprocesser som tidigare varit vanliga försvann i stor utsträckning, i synnerhet gällde detta skogsbränderna.
Denna omvandling till en mer homogen och sällan eller aldrig störningsutsatt skog innebar att den hävdgynnade skogsfloran och insekter försvann från stora delar av sina tidigare
utbredningsområden. För många insektsarter är idag skogsbryn och igenväxande marker (Lennartsson & Hoflin 2003) de habitat som mest liknar deras ursprungliga habitat. Flera insektsarter som idag lever i skogsbryn eller kantzonsliknande habitat har tidigare varit uteslutande skogslevande arter när skogsbetet höll skogen öppen (Lennartsson 2006). Kraftledningsgatans funktion i landskapet
Det har ofta diskuterats huruvida kraftledningsgators funktion i landskapet bidrar till fragmenteringen av landskapet eller ej (Clarke m.fl. 2006), men på senare tid har också kraftledningsgatans eventuella positiva funktion lyfts fram.
Som struktur i landskapet kan kraftledningsgator fylla en roll för ängslevande arter, både som habitat men också som spridningskorridor mellan habitat (Frycklund 2002).
Kraftledningsgatan kan alltså underlätta utbyte av individer mellan populationer, och mellan metapopulationer som annars drabbats av fragmentering i landskapet (Didham m.fl. 1996, Frycklund 2002). En anledning till att kraftledningsgatan kan uppehålla populationer av arter som är eller har varit ängslevande beror på hur den sköts med avseende på grad och
periodicitet av röjning (Windell 2001, Grusell 2007). En väl avvägd röjning kan skapa speciellt områden som liknar svagt hävdade ängs- och hagmarker och kan därför gynna arter som är beroende av dessa förutsättningar. Tidigare har man funnit att flera rödlistade
fjärilsarter förekommer i kraftledningsgator. Dessa arter lever annars i typisk ängsmark och för dessa arter kan kraftledningsgatan fungera som en reträttplats (Frycklund 2002). Av Sveriges kraftledningsgator bedöms 2-5 % vara artrika. Artrikedomen påverkas bland annat av markanvändningshistorik, geologi och jordmånens gynnsamhet (Grusell 2007). Många marklevande insekterna behöver flera olika biotoper för att fullfölja sin livscykel (Appelqvist m.fl. 2001) och missgynnas många gånger av en allt för stark hävd. I för hårt betade marker skapas en monoton livsmiljö som för många marklevande insekter försvårar både fullföljande av livscykeln men också födobehovet (Jonsell & Linkowski, MS.).
Kantzoner i allmänhet anses leda till en högre artrikedom i skogsmiljön och ge utrymme för flera arter att etablera sig (Temple & Flaspohler 1998, Clarke m.fl. 2006, Wermelinger m.fl. 2007). I vår studie ville vi jämföra evertebratfaunans biodiversitet i kraftledningsgator i Köpings och Strängnäs kommuner i Mälardalen (1) mot den i skogsmark, (2) mot den i betesmark, samt (3) hur faunan är fördelad inom kraftledningsgatan med hjälp av en
fallfällsinventering. Studien analyserade dels alla evertebrattaxa tillsammans, och i separata analyser klassen spindeldjur, klassen insekter som helhet och olika taxonomiska indelningar inom klassen insekter. Målet var att beskriva kraftledningsgatornas biodiversitet och
eventuella värde i landskapsbilden. Metoder
Studien utfördes mellan 26 maj och 15 juni 2008 i Strängnäs och Köpings kommun.
Fallfällor beståendes av plastburkar med en volym på 100 ml. placerades ut i 4 olika biotoper. De 4 biotoperna var mitt i kraftledningsgata (kraftledning central), i kanten av
kraftledningsgata (kraftledning distal), skog och betesmark. Tolv lokaler användes per biotop, vilket innebar totalt 48 lokaler i undersökningen (se tab. 1) och i varje lokal placerades tre fallfällor.
Tabell 1. Lokaler som ingick i studien, deras benämningar och positioner.
Lokal Benämning Position
Skog 1 och Kraftledning 1 Norrslyta, Köping 59º 35' 41.19" N, 15º 57' 28.57" E
Skog 2 och Kraftledning 2 Gränby, Köping 59º 31' 20.44" N, 16º 7' 22.06" E
Skog 3 och Kraftledning 3 Lindbacken, Köping 59º 30' 27.72" N, 16º 3' 49.03" E
Skog 4 och Kraftledning 4 Skogshäll, Köping 59º 29' 51.34" N, 16º 2' 31.14" E
Skog 5 och Kraftledning 5 Husta, Köping 59º 29' 35.91" N, 15º 58' 6.42" E
Skog 6 och Kraftledning 6 Husta, Köping 59º 29' 41.05" N, 15º 58' 43.31" E
Skog 7 och Kraftledning 7 Sticklinge, Köping 59º 29' 13.02" N, 15º 51' 56.41" E
Skog 8 och Kraftledning 8 Sticklinge, Köping 59º 29' 14.95" N, 15º 52' 3.68" E
Skog 9 och Kraftledning 9 Ulva, Strängnäs 59º 13' 46.23" N, 17º 6' 35.46" E
Skog 10 och Kraftledning 10 Ulva, Strängnäs 59º 13' 41.61" N, 17º 6' 27.21" E
Skog 11 och Kraftledning 11 Bredsjönäs, Strängnäs 59º 12' 42.20" N, 17º 5' 1.80" E
Skog 12 och Kraftledning 12 Bredsjönäs, Strängnäs 59º 12' 38.86" N, 17º 4' 56.46" E
Betesmark 1 Lia, Köping 59º 31' 36.77" N, 16º 9' 34.05" E
Betesmark 2 Östhamra, Köping 59º 31' 28.93" N, 16º 13' 14.37" E
Betesmark 4 Erikslund, Köping 59º 29' 49.54" N, 16º 11' 52.60" E
Betesmark 5 Ekebytorp, Köping 59º 29' 55.45" N, 16º 11' 16.45" E
Betesmark 6 Ytterskälby, Köping 59º 29' 49.57" N, 16º 7' 19.83" E
Betesmark 7 Nalbesta, Köping 59º 30' 19.62" N, 16º 7' 4.61" E
Betesmark 8 Norsa, Köping 59º 29' 43.62" N, 16º 3' 28.40" E
Betesmark 9 Reutersberg, Köping 59º 31' 39.75" N, 15º 54' 33.92" E
Betesmark 10 Väg, Köping 59º 29' 41.87" N, 15º 51' 44.51" E
Betesmark 11 Stora Sundby, Strängnäs 59º 14' 44.11" N, 17º 9' 14.43" E
Betesmark 12 Stora Sundby, Strängnäs 59º 14' 36.20" N, 17º 9' 31.34" E
I ”kraftledning, central” placerades fällorna mitt i kraftledningsgatan med ca 5 meters
mellanrum i en linje i rät vinkel tvärs gatans riktning. I ”kraftledning, distal” placerades fällor i anslutning till de centrala, men i kraftledningens kant med cirka 5 meters mellanrum.
Fällorna i skog placerades i anslutning till de i kraftledningsgatan men vid sidan av själva gatan. Två fällor på ena sidan och en på den andra sidan slumpvis. Avståndet till tydlig övergång till kraftledningsgata var cirka 20 meter. I betesmark placerades fällorna slumpvis men med hänsyn tagen så att kantzoner och betesdjurens stigar undveks vid fällplaceringen. Fällorna fylldes med en blandning av vatten och oparfymerat diskmedel. Diskmedlet användes för att minska ytspänningen så att fångade djur snabbt skulle drunkna och ha små möjligheter att ta sig ur fällan och en oparfymerad typ användes för att djur, i möjligaste mån, inte aktivt skulle lockas till fällan.
Över varje markfälla placerades ett plastlock några centimeter ovan marknivån med hjälp av intilliggande naturmaterial. Locken användes för att undvika att eventuellt regn föll i och översvämmade fällorna. Dessutom reducerades avdunstningen i de mest solexponerade
fällorna. Locken preparerades med teknisk rödsprit (C2H5OH) för att undvika skadegörelse på
fällorna av betesdjur. Fällfångsterna förvarades i denaturerad alkohol (Etanollösning 95,5%
med 20 gram/liter metyletylketon (CH3COCH2CH3) för taxonomisk bestämning vid en senare
tidpunkt. Fällorna var utplacerade i 21 dagar och vittjades var tredje dag.
Marklevande insekter blir aktivare under senvåren när ljusintensiteten blir högre och marktemperaturen stiger (Chinery 1988). En pilotstudie utfördes innan ordinarie insamling påbörjades för att se när mängden infångat material blev konstant. Provstudien utfördes i de 4 olika biotoper som senare skulle ingå i huvudstudien. Att markfällorna placerades ut 26 maj var för att insektslivet då kommit igång i alla naturtyper, och att vi därvid undvek att ett för litet material fångades eller att det fanns en snedfördelning av data mellan naturtyperna. Alla fångade djur bestämdes med hjälp av lupp, stereolupp och mikroskop samt
bestämningslitteratur (Reitter 1908, Chinery 1988, Sandhall 1992, Roberts 2001, Anon. 2008, Lissner 2008, Wahlén 2008). Då vi saknar taxonomiska specialkunskaper gjordes
bestämningarna till en ”rimlig” nivå med avseende på arbets- och tidsmässig insats. I några fall kunde objekt bestämmas till artnivå, i andra fall till släkte, familj eller högre taxonomiska nivåer. I Appendix 1 presenteras vilka olika taxa som urskildes, var de påträffades och med vilken abundans (se Appendix 1).
Olika diversitetsmått kalkylerades; antal taxa (S), Shannon-Wiener index (H), Jämnhet (J) och Simpsons index (D). Ett webbaserat kalkyleringsprogram utformat av Chang Bioscience (2004) användes för att beräkna Shannon-Wiener och Simpsons index och även Jämnhet.
Shannon-Wiener index (Krebs 1978) är ett index som kombinerar artrikedom och individantal enligt en formel, och ger ett högt värde till biotoper med många arter och där skillnaderna i abundans mellan arterna är små (Bernes 1994). Ett lågt värde kan innebära att en eller få arter dominerar i abundans (Sandsten 2005). Simpsons index (Krebs 1978) är till skillnad från Shannon-Wiener index mindre känsligt för stora skillnader i abundans mellan arter men istället känsligt för stora olikheter hos dominerande arter. Värdet på Simpsons index blir högre ju större skillnader det är i abundans men tar liten hänsyn till arter med få individer (Kull 2007).
Jämnhetsindex (evenness, J), är ett diversitetsmått för att beskriva jämnheten i individantal hos ingående arter. Ju högre värde, det vill säga nära 1, desto jämnare är abundansen av arterna i systemet. Är jämnhetsindex lågt indikerar detta att en eller få arter kraftigt dominerar (Krebs 1978). Det kan betonas att varken jämnhet, Simpsons eller Shannon-Wiener index kan användas för att få en kvalitetsvärdering (Bernes 1994) av arterna som påträffats, det vill säga en bedömning av vilka arter det rör sig om. Dessa index används oftast för jämförelse
genom ”ögonmått”, ofta finns bara en observation per naturtyp som jämförs. Vi hade däremot tillgång till tillräckligt många replikat (n=12) och kunde därför testa skillnader i index
statistiskt. Alla data testades med avseende på normalfördelning. Parametriska tester gjordes på normalfördelat data och icke-parametriska tester på ej normalfördelat data.
Vi analyserade skillnader mellan (a) kraftledning (medelvärdet av kraftledning central och kraftledning distal), skog och betesmark samt (b) inom kraftledning, d v s kraftledning central, kraftledning distal och skog. Testerna utfördes i Statistica 7.06 (StatSoft, Inc. 2008).
Dessutom testades likheten mellan de olika naturtyperna i parvisa jämförelser med Horns ”likhetsindex”. Till skillnad från det index som ursprungligen utformades av Horn (1966), som endast använder binära data på artförekomst (ja/nej) registreras, använde vi en variant som använder abundansdata (Boyce 2008) enligt;
Horns likhetsindex=
Där står S för det totala antalet taxa, j och k för de två platser som jämförs, xij för antalet
individer av taxon i på plats j och xik för antalet individer av taxon i på plats k, Nj för det totala
antalet individer (av alla taxa) på plats j och Nk för totala antalet individer (av alla taxa) på
plats k.
Horns likhetsindex tar således hänsyn både till artsammansättning och individantal inom varje art. Enligt Boyce (2008) skall proceduren fungera väl inom vida intervall av variation i
individ- och artantal (Boyce 2008). Horns likhetsindex beräknades i SAS 8.02 (SAS Institute Inc. 2000). Värdet på Horns likhetsindex kan variera mellan 0 och 1. Värdet 0 indikerar en total avsaknad av likhet i fördelning av arter och individantal mellan två undersöka platser, medan värdet 1 indikerar en identisk fördelning av arter och individantal.
Horns likhetsindex är, liksom andra likhetsindex, inte ett statistiskt test utan endast ett index. Det finns inga tydliga riktlinjer för var gränserna går mellan en hög respektive låg likhet, utan detta måste bedömas för varje enskild undersökning (R. L. Boyce pers. komm.). Att ett
likhetsindex på 0,97 är högt råder det ingen tvekan om, medan ett likhetsindex på 0,48 kan vara högt eller lågt beroende på omständigheterna (R.L. Boyce pers. komm.).
För att försöka utröna huruvida ett index var högt eller lågt specifikt för denna undersökning, det vill säga om våra lokaler eller positioner var lika eller ej, gjordes ett randomiseringstest med hjälp av ett speciellt konstruerat program i QuickBasic. Programmet gjorde parvisa jämförelser mellan två områden (biotoper respektive positioner, se ovan). Inom varje taxon kalkylerades det totala antalet individer genom att addera de verkligt funna individantalen i de två områdena. Därefter slumpades ett värde mellan (och inklusive) noll och det totala antalet individer. Det slumpade värdet blev det ena områdets "individantal" och resterande del av totalantalet blev det andra områdets "individantal". När alla aktuella taxon behandlats kalkylerades Horn likhetsindex på den nya, slumpade fördelningen. Programmet upprepade denna procedur 1000 gånger och jämförde varje gång om det "slumpade" Horn index var högre eller lika högt som det verkligt funna.
Proceduren innebar i princip en statistisk test av det verkligt funna Horn index, t.ex. om 49 av 1000 slumpningar gav ett lika högt eller högre Horn index var P=0.049 och det verkligt funna värdet var "signifikant". Vi är dock inte helt säkra på att vår procedur, som alltså skulle påvisa om område 1 och område 2 är ”signifikant lika", är oantastlig och försöker tolka dessa P-värden återhållsamt.
Resultat
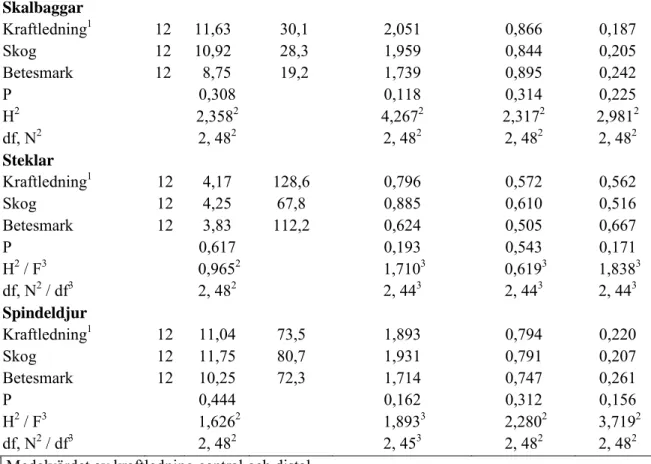
Vi fann inga statistiskt signifikanta skillnader i antal taxa eller biodivseritetsindex mellan kraftledning (medelvärdet av kraftledning central och distal), skog och betesmark (se tabell 2). Möjligen kan noteras att skillnaden i Shannon-Wiener index i fyra fall och Simpson index i två fall ”närmade sig” signifikans (p<0,20, se tabell 2).
Tabell 2. Medelvärden för antal taxa, antal individer, diversitet och taxas "jämnhet" i numerär i kraftledning (medelvärdet av kraftledning central och distal), skog och betesmark.
Taxonomisk enhet/ biotop n Taxa (S) Individer Shannon-Wiener index (H) Jämnhet (J) Simpson index (D) Alla taxa Kraftledning1 12 34,17 248,2 2,446 0,697 0,186 Skog 12 33,17 189,3 2,663 0,763 0,125 Betesmark 12 31,00 227,3 2,384 0,710 0,187 P 0,377 0,186 0,252 0,223 H2 1,9572 3,3702 2,7592 3,0002 df, N2 2, 482 2, 482 2, 482 2, 482 Insekter Kraftledning1 12 21,00 167,8 1,781 0,593 0,319 Skog 12 19,75 105,8 2,012 0,682 0,251 Betesmark 12 19,50 152,8 1,851 0,640 0,322 P 0,763 0,478 0,292 0,472 F3 0,2723 0,7513 1,2643 0,7653 df3 2, 453 2, 453 2, 453 2, 453
Skalbaggar Kraftledning1 12 11,63 30,1 2,051 0,866 0,187 Skog 12 10,92 28,3 1,959 0,844 0,205 Betesmark 12 8,75 19,2 1,739 0,895 0,242 P 0,308 0,118 0,314 0,225 H2 2,3582 4,2672 2,3172 2,9812 df, N2 2, 482 2, 482 2, 482 2, 482 Steklar Kraftledning1 12 4,17 128,6 0,796 0,572 0,562 Skog 12 4,25 67,8 0,885 0,610 0,516 Betesmark 12 3,83 112,2 0,624 0,505 0,667 P 0,617 0,193 0,543 0,171 H2 / F3 0,9652 1,7103 0,6193 1,8383 df, N2 / df3 2, 482 2, 443 2, 443 2, 443 Spindeldjur Kraftledning1 12 11,04 73,5 1,893 0,794 0,220 Skog 12 11,75 80,7 1,931 0,791 0,207 Betesmark 12 10,25 72,3 1,714 0,747 0,261 P 0,444 0,162 0,312 0,156 H2 / F3 1,6262 1,8933 2,2802 3,7192 df, N2 / df3 2, 482 2, 453 2, 482 2, 482
1 Medelvärdet av kraftledning central och distal. 2 Kruskall-Wallis test. 3 ANOVA.
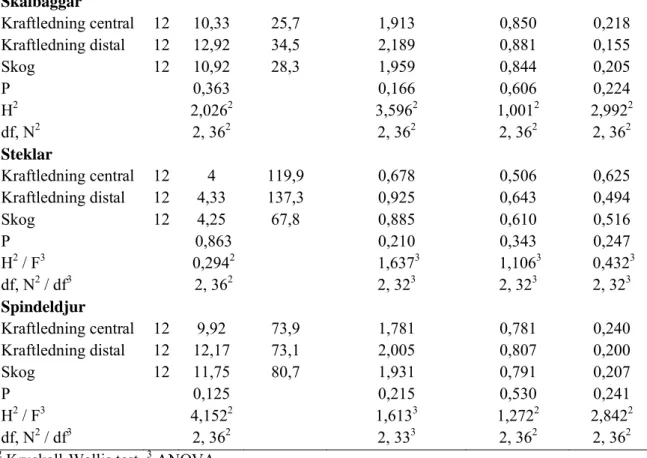
Inte heller vid jämförelse inom kraftledning och intilliggande skog påvisades signifikanta skillnader (se tabell 3). Återigen kan möjligen noteras att skillnader närmade sig ”signifikans” (p<0,20) för antal taxa, Shannon-Wiener och Simpson index i ett fall vardera (se tabell 3). Tabell 3. Medelvärden för antal taxa, antal individer, diversitet och taxoners "jämnhet" i numerär i tre positioner i transekter tvärs kraftledningsgator.
Taxonomisk enhet/ position n Taxa (S) Individer Shannon-Wiener index (H) Jämnhet (J) Simpson index (D) Alla taxa Kraftledning central 12 31,75 239,3 2,336 0,680 0,213 Kraftledning distal 12 36,58 257,1 2,556 0,715 0,159 Skog 12 33,17 189,3 2,663 0,763 0,125 P 0,209 0,216 0,279 0,195 H2 3,1362 3,0652 2,5542 3,2752 df, N2 2, 362 2, 362 2, 362 2, 362 Insekter Kraftledning central 12 19,83 156,3 1,702 0,577 0,356 Kraftledning distal 12 22,17 179,3 1,861 0,610 0,282 Skog 12 19,75 105,8 2,012 0,682 0,251 P 0,436 0,248 0,217 0,219 F3 0,8513 1,4573 1,6013 1,5903 Df3 2, 333 2, 333 2, 333 2, 333
Skalbaggar Kraftledning central 12 10,33 25,7 1,913 0,850 0,218 Kraftledning distal 12 12,92 34,5 2,189 0,881 0,155 Skog 12 10,92 28,3 1,959 0,844 0,205 P 0,363 0,166 0,606 0,224 H2 2,0262 3,5962 1,0012 2,9922 df, N2 2, 362 2, 362 2, 362 2, 362 Steklar Kraftledning central 12 4 119,9 0,678 0,506 0,625 Kraftledning distal 12 4,33 137,3 0,925 0,643 0,494 Skog 12 4,25 67,8 0,885 0,610 0,516 P 0,863 0,210 0,343 0,247 H2 / F3 0,2942 1,6373 1,1063 0,4323 df, N2 / df3 2, 362 2, 323 2, 323 2, 323 Spindeldjur Kraftledning central 12 9,92 73,9 1,781 0,781 0,240 Kraftledning distal 12 12,17 73,1 2,005 0,807 0,200 Skog 12 11,75 80,7 1,931 0,791 0,207 P 0,125 0,215 0,530 0,241 H2 / F3 4,1522 1,6133 1,2722 2,8422 df, N2 / df3 2, 362 2, 333 2, 362 2, 362
2 Kruskall-Wallis test. 3 ANOVA.
Horns likhetsindex var överlag höga i alla parvisa jämförelser av kraftledning, skog och betesmark (se tabell 4). Vår randomiseringstest visade dessutom att likheten var signifikant i fyra fall: alla taxa i jämförelse mellan kraftledning och betesmark, insekter, steklar och spindeldjur i jämförelse mellan kraftledning och skog (se tabell 4).
Tabell 4. Horn index för fördelning av taxa och individantal i parvisa jämförelser av kraftledning (medelvärdet av kraftledning central och distal), skog och betesmark. P-värden refererar till utfört randomiseringstest i QuickBasic (se metoder).
Biotoper Alla taxa Insekter Skalbaggar Steklar Spindeldjur
Kraftledning1 och betesmark 0,862 P=0,004 0,688 P=0,705 0,606 P=0,833 0,732 P=0,746 0,768 P=0,319 Kraftledning1 och skog 0,712 P=0,587 0,873 P=0,036 0,737 P=0,110 0,973 P=0,021 0,881 P=0,015
Skog och betesmark 0,653
P=0,790 0,577 P=0,876 0,463 P=0,999 0,642 P=0,849 0,795 P=0,223
1Medelvärdet av kraftledning central och distal.
Även vid parvisa jämförelser inom kraftledning (kraftledning central och kraftledning distal) och skog var Horns likhetsindex överlag höga. Vår randomiseringstest visade dessutom att likheten var signifikant i fem fall: alla taxa i jämförelse mellan kraftledning central och distal, insekter, steklar och spindeldjur i jämförelse mellan kraftledning distal och skog, alla taxa i jämförelse mellan kraftledning distal och betesmark (se tabell 5).
Tabell 5. Horn index för fördelning av taxa och individantal i parvisa jämförelser av kraftledning central, kraftledning distal, skog och betesmark. P-värden refererar till utfört randomiseringstest i QuickBasic (se metoder).
Positioner Alla taxa Insekter Skalbaggar Steklar Spindeldjur
Kraftledning central och kraftledning distal
0,847 P=0,032 0,852 P=0,182 0,671 P=0,556 0,926 P=0,181 0,847 P=0,077 Kraftledning central och skog 0,696 P=0,669 0,7912 P=0,401 0,592 P=0,936 0,921 P=0,294 0,819 P=0,183 Kraftledning central och betesmark 0,792 P=0,223 0,675 P=0,758 0,568 P=0,958 0,700 P=0,793 0,747 P=0,442 Kraftledning distal och skog 0,688 P=0,682 0,888 P=0,011 0,764 P=0,069 0,973 P=0,019 0,899 P=0,008 Kraftledning distal och betesmark 0,874 P<0,001 0,662 P=0,757 0,575 P=0,939 0,737 P=0,681 0,751 P=0,407 Testerna av Horns index ger en märklig signal vad gäller jämförelsen av kraftledning och skog och kraftledning distal och skog där alla taxa är icke signifikant medan däremot flera av de enskilda taxonomiska grupperna är signifikanta, samtidigt är det tvärtom i jämförelsen av kraftledning och betesmark och kraftledning distal och betesmark där alla taxa är signifikanta medan ingen av de enskilda taxonomiska grupperna är signifikanta (se tabell 4 & 5).
Diskussion
Vår studie antydde att det inte fanns några skillnader mellan kraftledning, skog och betesmark eller mellan positionerna tvärs kraftledningarna (kraftledning central, distal och skog) i
artantal (i vårt fall antal taxa) eller biodiversitet (Shannon-Wiener index, Jämnhet och Simpsons index). Detta gällde inom alla de testade taxonomiska grupperna (d v s alla taxa, endast insekter, endast skalbaggar, endast steklar och endast spindeldjur). Vi är fullt medvetna om att avsaknaden av signifikant skillnad mellan områdena inte innebär att de därmed är lika, men vi kan ändå dra slutsatsen att kraftledningsgatorna med avseende på biodiversitet och artantal i varje fall inte var statistiskt signifikant sämre än skog eller betesmark. Det kan vara värt att betona att ingenting tydde på att så skulle vara fallet. De fall där de statistiska testerna "närmade sig signifikans" (p<0.20, se Resultat) indikerade inte något konsekvent mönster sådant att kraftledningsgator skulle vara sämre (eller bättre) än skog och betesmark. Vi är också medvetna om att mått på artantal och biodiversitetsindex har begränsat värde. Dessa mått värderar inte vilka arter eller taxa som är inblandade, eller tar hänsyn till hur skyddsvärda de är. Som redan nämnts kommer ett område med en individ- och artrik fauna bestående av oönskade invasionsarter och "skadedjur" att registreras för högre värden på artantal och biodiversitet än ett område med fattig och fåtalig fauna bestående av rödlistade, skyddsvärda arter.
Horns likhetsindex (Boyce 2008) minskar problemet med ”anonyma” taxa. Inte genom att ta hänsyn till exakt vilka arter som ingår eller värdering av arterna, men ett högt index indikerar att samma arter förekommer i de jämförda områdena. Ett högt index indikerar dessutom att individantalet är likartat hos de arter som ingick i jämförelsen, eftersom den version av Horns index som vi använde tog hänsyn till abundans hos de ingående arterna.
Horns likhetsindex var överlag högt vid jämförelser mellan de olika marktyperna. Det kan betonas att Horns index i sig inte är ett statistiskt test, utan bara en indexering. Med hjälp av vårt egenhändigt skapade randomiseringsprogram (se Metoder) kunde vi dock avgöra om våra funna Horn index var högre än förväntat.
Stor likhet i artsammansättning och individantal, d v s signifikant höga Horn index, indikerades i flera fall. Så var fallet för gruppen alla taxa i jämförelser mellan kraftledning (medelvärdet av kraftledning central och kraftledning distal) och betesmark, och för
grupperna insekter, steklar och spindeldjur i jämförelser mellan kraftledning (medelvärdet av kraftledning central och kraftledning distal) och skog (se Tabell 4). Signifikant höga Horn index fanns också för gruppen alla taxa i jämförelser mellan kraftledning central och kraftledning distal och i jämförelser mellan kraftledning distal och betesmark, samt för grupperna insekter, steklar och spindeldjur i jämförelser mellan kraftledning distal och skog (se Tabell 5).
Vi tolkar sammanfattningsvis detta som att kraftledningsgatornas marklevande
evertebratfauna var lik den som fanns i skog och betesmark. Speciellt hög verkade likheten vara mellan kraftledningsgatornas distala delar och de övriga marktyperna.
En tänkbar förklaring skulle kunna vara att avståndet mellan betesmarker och
kraftledningsgatorna gör det svårare för hävdgynnade marklevande arter att förflytta sig från betesmarker till kraftledningsgator. Därför kan kraftledningsgator som liknar betesmarker sakna likheter i artsammansättning trots att förutsättningarna finns.
Det fanns dock en konstig oregelbundenhet eller brist på överensstämmelse i resultaten. I flera fall var resultatet av analysen av gruppen alla taxa motsatt de i de andra grupperna (detta trots att "de andra grupperna" ju ingår i gruppen "alla taxa"). Detta var t ex fallet i jämförelser mellan kraftledning (medelvärdet av kraftledning central och distal) och betesmark där Horns index för alla taxa var signifikant medan det var långt ifrån signifikans för grupperna insekter, skalbaggar, steklar och spindeldjur (se Tabell 4). Samma mönster fanns även i jämförelser mellan kraftledning central och kraftledning distal, samt i jämförelser mellan kraftledning distal och betesmark (Tabell 5). En lika stor brist på överensstämmelse, fast "tvärtom", fanns i jämförelser mellan kraftledning (medelvärdet av kraftledning central och distal) och skog där Horns index för alla taxa inte var signifikant medan det var signifikant för grupperna insekter, steklar och spindeldjur och nära signifikans för gruppen skalbaggar (se Tabell 4). Samma mönster fanns i jämförelser mellan kraftledning distal och skog (Tabell 5).
Det är svårt att förklara vad som kan ligga bakom dessa mönster. Det skall dock noteras att i gruppen "alla taxa" ingick förutom de andra, i analyserna ingående, grupperna (d v s insekter, steklar, skalbaggar och spindeldjur) även snäckor, fåborstmaskar och tusenfotingar. Antalet fångade individer inom dessa grupper var mycket litet. Detta medför att förhållandevis många nollvärden på förekomst (abundans) introduceras i analyser där dessa grupper ingår. Detta kan vara en möjlig förklaring till bristen på överensstämmelse i resultaten. Vid testkörningar där Horns index beräknades på simulerade dataset fick vi ett bestämt intryck att Horns index är känsligt för nollvärden. Även randomiseringsprogrammet som testade värdena på Horns index borde vara känsligt för nollor och låga värden på det totala antalet individer i taxa. Med lågt totalantal individer torde nollvärden genereras tämligen frekvent, samt torde nollvärden vid slumpningarna omfördelas i hög utsträckning.
Därför tolkar vi de erhållna indexen för gruppen alla taxa med återhållsamhet och väljer att lägga större vikt på resultaten för grupperna insekter, steklar och spindeldjur.
Artsammansättningen och individantalet hos grupperna insekter, steklar och spindeldjur var signifikant lika i jämförelserna mellan kraftledning och skog samt kraftledning distal och skog medan skalbaggar inte var signifikant lika i någon jämförelse. För spindlar är det sedan
tidigare känt att dessa påverkas positivt av skog i sin omgivning och att flera arter gynnas av fältkanter (Öberg 2007). Detta gäller för arter typiska för odlingslandskapet, men det kan mycket väl vara så att arter som lever i skogsmark också utnyttjar kantzoner i hög grad, vilket våra resultat indikerar. Att det finns mindre likhet mellan kraftledningen och betesmark för spindlar kan bero på att olika spindelfamiljer använder olika spridningssätt (Öberg 2007). Eftersom vi har använt markfällor kan detta ha medfört att fler spindelarter som sprider sig via marken infångades jämfört med spindlar som sprider sig via luften.
För steklar fick vi överlag mycket höga likhetsindex och det var precis som i fallet spindeldjur signifikant vid jämförelse mellan kraftledning och skog samt kraftledning distal och skog. Några få taxa, främst inom släktena Formica, Lasius och Myrmica var väldigt rikt
förekommande i våra fallfällor, medan det stora flertalet stekeltaxa var fåtaliga och där de flesta påträffades i mindre utsträckning på betesmark. Även de individrika grupperna förekom generellt i mindre utsträckning på betesmark. Mark med kortvuxen vegetation påverkar individantalet hos myror negativt (Steiner m. fl. 2005) och detta skulle kunna ske på välhävdade betesmarker. Flertalet av våra betesmarker var klassade som välhävdade i den senaste inventeringen som genomfördes av kommunen.
För skalbaggar påträffades däremot inga signifikanta likheter i någon jämförelse. Dock var kraftledning distal och skog nära signifikans (p=0,069, se tabell 5). Anledning till detta kan vara att flera skalbaggsarter, främst vivlar, är växtätare som angriper specifikt en eller få växtarter (Lindroth 1993). Detta kan medföra att stora skillnader påträffas i artuppsättning beroende på vilka växter som förekommer där inventeringen genomförs. Dessutom är kraftledningens vedstruktur olik skogsmarken med mycket högre förekomst av klenved och andra trädslag, medan den distala kraftledningen kan ha mer grövre dödved och i högre utsträckning likna skogen sett till trädslag och struktur.
Att betesmarkerna inte hade en signifikant högre artrikedom än kraftledningarna, utan snarare en något, om än inte statistiskt signifikant, lägre artrikedom, kan bero på att betestrycket har historiskt sett varit högt och missgynnat ljuskänslig flora eller att floran redan från början varit likartad mellan dem. Om de undersökta betesmarkerna hade haft ett lägre eller mer varierat betestryck över säsongen tidigare år skulle den biologiska mångfalden ha kunnat gynnas i högre grad (Dahlström 2006). Det är sedan tidigare känt att insekter knutna till kärlväxter är minst lika eller mer känsliga för högt betestryck än kärlväxterna själva
(Lennartsson & Hoflin 2003), vilken kan ha varit en bidragande orsak till att betesmarkerna inte hade en högre artrikedom än kraftledningsgatorna. Precis som fallet är med ekologiskt jordbruk i ett mosaikartat landskap (Bengtsson & Ahnström 2007), kan kraftledningsgatorna i vår studie ha en liten effekt på den biologiska mångfalden eftersom de finns i ett redan
tämligen mosaikartat landskap. En tydligare effekt av deras bidragande roll till ett mer mosaikartat landskap skulle istället kunna ses i ett mer homogent landskap.
Kraftledningsgator i anslutning till tidigare ängs- och betesmark kan fungera som reträttplatser (Frycklund 2002) och skulle även kunna fungera som spridningskorridorer
mellan metapopulationer och lämpliga habitat. Det relativa värdet av detta för en given art kan bero på vilken spridningsförmåga den har.
Sammanfattningsvis kan man se att den marklevande evertebratfaunan i kraftledningarna sett till artrikedom och de jämförda diversitetsmåtten inte skiljer sig mellan kraftledning, skog eller betesmark, medan i jämförelserna med Horns likhetsindex gav en generellt högre likhet mellan kraftledning (medelvärdet av kraftledning central och distal), kraftledning central, kraftledning distal och skog än med betesmark.
På sikt kan kraftledningsgatorna bli föremål för kvävegödsling i försök att minska betesskador av vilt på nyplanterad produktionsskog intill kraftledningar (Mikaelsson 2006). Vidare är det föreslaget att kraftledningsgator skall toppröjas och foderväxter sparas vid röjning av gatorna (Mikaelsson 2006). Prioritering av foderväxter kan inom ramen av biotopvård gynna
insektslivet i kraftledningsgatorna, men om gödsling inkluderas i skötseln innebär det en kraftig tillväxt av markvegetationen. Detta skulle kunna missgynna den flora och fauna i kraftledningsgator som liknar ängs- eller betesmarker med svag till måttlig hävd. Om toppröjning vore möjlig, skulle detta kunna vara ett sätt att skapa förekomst av grövre ved i kraftledningsgatans centrala och distala delar och på så vis kunna skapa livskraftiga miljöer för vedlevande insekter.
Flera insektsarter använder sig av flera olika biotoper och olika element i dessa under sitt levnadslopp (Appelqvist m.fl. 2001) och i kraftledningsgatorna finns i många fall gott om olika element så som död klenved och variationer i markvegetation. I och med den
kontinuerligt återkommande röjningen skapas ansenliga mängder död klenved (≤10 cm i diameter) i och intill kraftledningsgatan. Sedan tidigare är det känt att flera insektsarter är direkt beroende av tillgången på grövre död ved, men även död solexponerad klenved har betydelse för många insektsarter (De Jong m.fl. 2004, Niklasson & Nilsson 2005). Dessutom finns närheten till kantzon och skogsmark, vilket kan ge goda förutsättningar för många insektsarter som är i behov av olika biotoper att fullfölja sin livscykel. Själva
kraftledningsgatan skulle också kunna fylla funktionen som ekotonmiljö, vilket innebär att den är en miljö mellan två olika biotoper (t.ex. mellan skog och ängs- eller betesmark). Ekotonmiljöer uppvisar en unik artsammansättning och miljö (Appelqvist m.fl. 2001) och om kraftledningsgator liknar denna beskrivning, skulle kraftledningsgatans naturvärde kunna höjas eller bibehållas med hjälp av skötsel som är utformad för de förutsättningar som finns i den specifika ekotonmiljön. Det kan innebära till exempel att behålla eller öka inslaget av busk- och högörtsvegetation och skapa större variation i trädens åldersstruktur. Denna skötsel skapar förutsättningar för ett rikt insektsliv och för att bibehålla eller förhöja befintliga naturvärden.
Kraftledningsgator skulle också kunna ingå i vård av mosaiklandskap i de fall de höjer värdet på landskapsstrukturen. Detta gäller speciellt i de fall där kraftledningsgatan är i direkt anslutning till värdefull skog och/eller ängs- och betesmark.
I framtiden är det sannolikt att många kraftledningar som ingår i regionnätet kommer att grävas ned i marken (Bengtsson m.fl. 2006) vilket kan hota arter som finns i
kraftledningsgatan (Svensson 1997) och även förändra markens struktur (Länsstyrelsen Södermanland 2006). Därför är det viktigt att bedöma vilka kraftledningsgator som kan ingå i landskapsplanering och skapande av större sammanhängande mosaikstrukturer, och på så vis skapa bättre förutsättningar för bl.a. insektslivet i odlingslandskapet.
Tack till
Mats Lindén & Anders Telenius, Mälardalens Högskola, för handledning och granskning. Lars Lindström & Kjell Waltersson, Mälardalens Högskola & Daniel Larsson, Kungliga Tekniska Högskolan, för matematisk handledning. Ulla Hillerdal, Mälardalens Högskola, för litteratur. R. L. Boyce, Northern Kentucky University, för handledning och instruktioner. Sandra Öberg, SLU, för hjälp med artbestämning. Lars Bohlin & Ola Lindholm, Köpings kommun, för kartor, inventeringslitteratur & markägaruppgifter. Alla markägare som låtit oss göra inventeringen på deras ägor. Alla andra som på ett eller annat sätt bidragit till att detta arbete blev fullbordat.
Referenser
Andrén, H. 1996. Population responses to habitat fragmentation: statistical power and the random sample hypothesis. Oikos 76, 235-242.
Anonym. 1991. Sörmlands natur, Naturvårdsprogram. Österbergs tryckeri, Nyköping. Anonym. 2004. Mälarens stränder i Sörmlands län, Fördjupad landskapsanalys. Länsstyrelsens rapportserie 2004:1.
Anonym. 2006a. Ängar och betesmarker i Västmanlands län – Inventering 2002-2004. Länsstyrelsens rapportserie 2006:21.
Anonym. 2006b. Bevarandeplan för Natura 2000-område Torsmossen (SE0220330) Vingåkers kommun, Södermanlands län. Diarienummer: 511-11432 -2004, Länsstyrelsen Södermanland.
Anonym. 2007. Ett rikt odlingslandskap – underlag för fördjupad utvärdering 2008. Jordbruksverket, rapport 2007: 15.
Anonym. 2008. Zoological Institute RAS, St. Petersburg, Russia
(http://www.zin.ru/Animalia/Coleoptera/eng/ - senast använd 15 oktober 2008). Appelqvist, T., Gimdal, R. & Bengtson, O. 2001. Insekter och mosaiklandskap. Entomologisk tidskrift 122, 81-97.
Beckman-Thoor, K. 2003. Kulturhistoriskt planeringsunderlag för Ostlänken, exempel från Södermanland. Riksantikvarieämbetet och Länsstyrelsen
Södermanlands län.
Bengtsson, J. & Ahnström, J. 2007. Eko-odling positivt för biologisk mångfald och ekosystemtjänster. Forskningsnytt 2, 5-9.
Bengtsson, J., Ivansson, P. & Werner, C. 2006. Kraftkabelförläggning i mark – en studie av produktionsmetoder. Examensarbete nr: TD 058/2006, Växjö Universitet.
Bernes, C. 1994. Biologisk månfald I Sverige: en landstudie. Statens naturvårdsverk, Solna. Bohlin, A. 2007. Vegetations- och floraförändringar under 1900-talet. Svensk botanisk tidskrift 101 65-80.
Boyce, R. L. 2008. Choosing the Best Similarity Index when Performing Fuzzy Set Ordination on Abundance Data. Department of Biological Sciences, Northern Kentucky University, Highland Heights, KY 41099.
Chang Bioscience. 2004. Shannon-Wiener diversity index: Shannon
entropy calculator (http://www.changbioscience.com/genetics/shannon.html - senast använd 15 oktober 2008). Chang Bioscience, Castro Valley, CA.
Chinery, M. 1988. Insekter i Europa. 4:e upplagan: Bonniers, Stockholm.
Dahlström, A. 2006. Betesmarker, djurantal och betestryck 1620-1850 – Naturvårdsaspekter på historisk beteshävd i Syd- och Mellansverige. Doctoral Thesis, Swedish University of Agricultural Sciences.
De Jong, J., Dahlberg, A. & Stokland, J. N. 2004. Död ved i skogen. Hur mycket behövs för att bevara den biologiska mångfalden? Svensk Botanisk Tidskrift 98, 278-297.
Didham, R., Ghazoul, J., Stork, N. E. & Davis, A. J. 1996. Insects in fragmented forests: a functional approach. Trends in Ecology and Evolution 11, 255-260.
Dänhardt, J. 2003. Hävdgynnade växter i Dalarna – exempel på vanliga arter i slåtter- och betesmarker. Länsstyrelsen Dalarnas län.
Emanuelsson, U. 1994. Markanvändningen i ett historiskt perspektiv. Från: Markanvändningen och miljön, sid 19-35. Naturvårdsverket Rapport 4137.
Ewers, R. M., Thorpe, S. & Didham, R. K. 2007. Synergistic interactions between edge and area effects in a heavily fragmented landscape. Ecology 88, 96-107.
Frycklund, I. 2002. Rödlistade fjärilar i kraftledningsgator samt ärenprisnätfjärilens
Euphydras aurinia status i Uppsala län sommaren 2001. Upplandsstiftelsen, Uppsala.
Gold, S., Korotkov, A. V. & Sasse, V. 2006. The development of European forest resources, 1950 to 2000. Forest Policy and Economics 8, 183-192.
Grusell, E. 2007. Biologisk mångfald i Svenska Kraftnäts ledningsgator. Stockholm: Svenska Kraftnät.
International Food Policy Research Institute, IFPRI. 2002. Green Revolution – Curse or Blessing? Washington.
Krebs, C. J. 1978. Ecology - the experimental analysis of distribution and abundance. 2:a upplagan. New York: Harper and Row, Publishers.
Kull, T. 2007. The biodiversity at the ecosystem and community level, measurement of Biodiversity. Institute of Zoology and Botany, Estonian Agricultural University.
Laurance, W. F., Nascimento, H. E. M., Laurance, S. G., Andrade, A., Ewers, R. M., Harms, K. E., Luizão, R. C. C. & Ribeiro, J. E. 2007. Habitat Fragmentation, Variable Edge Effects, and the Landscape-Divergence Hypothesis. PLoS ONE 2, 1-8.
Lennartsson, T. & Hoflin, M. 2003. Miljöersättningsrelaterade ersättningsproblem i naturbetesmarker. Centrum för Biologisk Mångfald, Sveriges Lantbruksuniversitet och Upplandsstiftelsen.
Lennartsson, T. 2006. Biologisk mångfald i utmarksbeten. Från seminariet ”Utmarksbete, traditionell kunskap och biologisk mångfald i skogsbygd” anordnat av NAPTEK (Nationella programmet för traditionell och lokal kunskap relaterad till bevarandet och det hållbara nyttjandet av biologisk mångfald). Centrum för biologisk mångfald, Uppsala.
Lennartsson, T. 2008. Biologisk mångfald och traditionell markanvändning - Att läsa och förstå odlingslandskap i Sverige och Rumänien. Centrum för biologisk mångfald, Sveriges Lantbruksuniversitet.
Lindroth, C. H. 1993. Våra skalbaggar och hur man känner igen dem. 5:e upplagan. Stockholm: Fältbiologerna förlag.
Lissner, J. 2008. Spiders of Europe. (http://www.jorgenlissner.dk/ senast använd 15 oktober 2008)
Magura, T. 2002. Carabids and forest edge: spatial pattern and edge effect. Forest Ecology and Management 157, 23-37.
Matlack, G. R. 1992. Microenvironment variation within and among forest edge sites in the eastern United States. Biological Conservation 66, 185-194.
Mikaelsson, M. 2006. Mervärdesskog – Slutbetänkande av Skogsutredningen 2004. Statens Offentliga Utredningar. Rapportserie 2006:81.
Niklasson, M. & Nilsson, S. G. 2005. Skogsdynamik och arters bevarande. Lund: Författarna och Studentlitteratur 2005.
Nilsson, T. & Schönfeldt, I. 1999. Kor på skogen – En jämförande studie mellan betad och obetad skog. Länsstyrelsen Norrbotten.
Pimentel, D., Huang, X., Cordova, A. & Pimentel, M. 1997. Impact of Population Growth on Food Supplies and Environment. Population and Environment: A journal of
Interdisciplinary Studies 19, 9-14.
Reitter, E. 1908. Die Käfer des Deutschen Reiches. 1: a upplagan. Stuttgart: K. G. Lutz Verlag.
Ries, L. & Fagan, W. F. 2004. Habitat edges as a potential ecological trap for an insect predator. Ecological Entomology 28, 567-572.
Roberts, M. J. 2001. Spiders of Britain and Northern Europe, 1: a upplagan. New York: HarperCollins Publishers.
Rowley, L., Edwards, R. & Kelly, P. 1999. Edges – Their effect on vegetation and wildlife. Land for wildlife 4, 1-2.
Sandhall, Å. 1992. Småkryp: Bestämningsbok för 445 arter. 1: a upplagan. Bonniers, Stockholm.
Sandsten, H. 2005. Undervattensväxter i Ivösjön och Levrasjön: Fälttest av metoder för basinventering och uppföljning av makrofyter i två Natura 2000-områden. Länsstyrelsen Skåne Län.
SAS Institute Inc. 2000. SAS User’s Guide. V8. Cary (NC).
Steiner, F. M., Schlick-Steiner, B. C., Moder, K., Bruckner, A. & Christian, E. 2005. Congruence of Data from Different Trapping Periods of Ant Pitfall Catches (Hymenoptera: Formicidae). Sociobiology 46, 105-116.
Svensson, I. 1997. Faktablad: Nemophora cupriacella – ängsväddantennmal. ArtDatabanken, Sveriges Lantbruksuniversitet.
Temple, S. A. & Flashpohler, D. J. 1998. The edge of the cut – implications for wildlife populations. Journal of Forestry 96, 22-26.
Townsend, C. R., Begon, M. & Harper, J. L. 2003. Essentials of Ecology. 2nd edition.
Blackwell, Oxford.
Trewavas, A. J. 2001. The Population/Biodiversity Paradox. Agricultural Efficiency to Save Wilderness. Plant Physiology 125, 174-179.
Wagner, H. H., Wildi, O. & Ewald, K. C. 2000. Additive partitioning of plant species diversity in an agricultural mosaic landscape. Landscape Ecology 15, 219-227.
Wahlén, P. 2008. Halländska skalbaggar
(http://www.wahlens.se/levande_Halland/insekter/coleoptera.htm senast använd 15 oktober 2008).
Wermelinger, B., Flückiger, P. F., Obrist, M. K. & Duelli, P. 2007. Horizontal and vertical distribution of saproxylic beetles (Col., Buprestidae, Cerambycidae, Scolytinae) across
sections of forest edges. Journal of Applied Entomology 131, 104-114.
Windell, M. 2001. Livsmiljö i kraftledningsgatan. Stockholm: Vattenfall AB Elnät Sverige. Åberg, A. 1953. När byarna sprängdes. Stockholm: LT:s förlag.
Öberg, S. 2007. Spiders in the Agricultural Landscape – Diversity, Recolonisation and Body Condition. Doctoral Thesis, Swedish University in Agricultural Science.
Appendix
Klass Ordning Familj Släkte Artnamn Kraftledning central Kraftledning distal Betesmark Skog
Oligochaeta Haplotaxida Lumbricidae Dendrobaena Dendrobaena sp. 0 0 0 1
Oligochaeta Haplotaxida Lumbricidae Flera obestämda arter 2 0 1 2
Gastropoda Pulmonata Obestämd art 1 0 0 0 1
Gastropoda Pulmonata Obestämd art 2 4 1 10 0
Chilopoda Lithobiomorpha Lithobiidae Lithobius Lithobius sp. 1 3 1 0
Diplopoda Julida Blaniulidae Blaniulus Blaniulus spp. 1 5 0 0
Diplopoda Julida Blaniulidae Polymicrodon Polymicrodon spp. 35 14 11 7
Diplopoda Julida Blaniulidae Schizophyllum Schizophyllum spp. 0 0 2 1
Diplopoda Julida Blaniulidae Tachypodoiulus Tachypodoiulus spp. 47 16 4 9
Diplopoda Julida Blaniulidae Obestämd art 0 0 0 1
Arachnida Actinedida Trombidiidae Trombidium Trombidium sp. 1 247 236 185 98
Arachnida Actinedida Trombidiidae Trombidium Trombidium sp. 2 15 6 0 4
Arachnida Araneae Araneidae Araneus Araneus diadematus 0 0 0 1
Arachnida Araneae Clubioninae Obestämd art 0 1 0 0
Arachnida Araneae Gnaphosidae Aphantaulax Aphantaulax sp. 1 0 0 0
Arachnida Araneae Gnaphosidae Callilepis Callilepis nocturna 20 5 0 0
Arachnida Araneae Gnaphosidae Drassodes Drassodes spp. 5 0 0 0
Arachnida Araneae Gnaphosidae Drassyllus Drassyllus sp. 1 1 0 0 0
Arachnida Araneae Gnaphosidae Drassyllus Drassyllus sp. 2 0 1 0 0
Arachnida Araneae Gnaphosidae Drassyllus Drassyllus sp. 3 0 2 0 0
Arachnida Araneae Gnaphosidae Haplodrassus Haplodrassus spp. 0 0 0 5
Arachnida Araneae Gnaphosidae Phaeocedus Phaeocedus spp. 0 1 1 0
Arachnida Araneae Gnaphosidae Scotophaeus Scotophaeus sp. 0 0 0 1
Arachnida Araneae Gnaphosidae Zelotes Zelotes sp. 1 51 46 26 32
Arachnida Araneae Gnaphosidae Zelotes Zelotes sp. 2 16 2 2 27
Arachnida Araneae Gnaphosidae Obestämd art 1 3 8 4 2
Arachnida Araneae Gnaphosidae Obestämd art 2 0 2 0 0
Arachnida Araneae Gnaphosidae Obestämd art 3 0 0 1 0
Arachnida Araneae Gnaphosidae Obestämd art 4 0 0 0 2
Arachnida Araneae Gnaphosidae Obestämd art 5 0 1 0 0
Arachnida Araneae Gnaphosidae Obestämd art 6 44 22 37 30
Arachnida Araneae Gnaphosidae Obestämd art 7 0 0 0 19
Arachnida Araneae Gnaphosidae Obestämd art 8 0 0 1 1
Arachnida Araneae Gnaphosidae Obestämd art 9 0 0 1 0
Arachnida Araneae Gnaphosidae Obestämd art 10 0 1 2 2
Arachnida Araneae Gnaphosidae Obestämd art 11 0 0 0 1
Arachnida Araneae Gnaphosidae Obestämd art 12 0 0 1 0
Arachnida Araneae Gnaphosidae Obestämd art 13 0 0 0 9
Arachnida Araneae Gnaphosidae Obestämd art 15 48 56 93 19
Arachnida Araneae Gnaphosidae Obestämd art 16 33 4 5 8
Arachnida Araneae Gnaphosidae Obestämd art 17 34 17 19 60
Arachnida Araneae Gnaphosidae Obestämd art 18 0 0 3 3
Arachnida Araneae Gnaphosidae Obestämd art 19 0 8 0 0
Arachnida Araneae Gnaphosidae Obestämd art 20 0 0 2 0
Arachnida Araneae Labidognatha Obestämd art 2 0 0 0
Arachnida Araneae Linyphiidae Ceratinella Ceratinella sp. 0 0 0 1
Arachnida Araneae Linyphiidae Linyphia Linyphia spp. 35 46 52 144
Arachnida Araneae Linyphiidae Obestämd art 1 0 0 1 0
Arachnida Araneae Linyphiidae Obestämd art 2 6 13 54 128
Arachnida Araneae Linyphiidae Obestämd art 3 0 0 0 21
Arachnida Araneae Linyphiidae Obestämd art 4 0 1 0 0
Arachnida Araneae Liocranidae Scotina Scotina spp. 0 3 0 0
Arachnida Araneae Lycosidae Alopecosa Alopecosa cuneata 176 119 246 145
Arachnida Araneae Lycosidae Alopecosa Alopecosa sp. 1 0 1 0 0
Arachnida Araneae Lycosidae Alopecosa Alopecosa sp. 2 44 66 26 25
Arachnida Araneae Lycosidae Alopecosa Alopecosa sp. 3 0 5 1 1
Arachnida Araneae Lycosidae Alopecosa Alopecosa sp. 4 0 0 4 0
Arachnida Araneae Lycosidae Pardosa Pardosa sp. 1 7 0 0 0
Arachnida Araneae Lycosidae Pardosa Pardosa sp. 2 45 0 0 0
Arachnida Araneae Lycosidae Obestämd art 1 4 0 0 0
Arachnida Araneae Lycosidae Obestämd art 2 0 4 0 0
Arachnida Araneae Lycosidae Obestämd art 3 0 1 0 0
Arachnida Araneae Lycosidae Obestämd art 4 0 0 0 3
Arachnida Araneae Oxyopidae Obestämd art 0 0 1 0
Arachnida Araneae Pisauridae Dolomedes Dolomedes fimbriatus 0 1 0 0
Arachnida Araneae Salticidae Aelurillus Aelurillus spp. 0 0 0 2
Arachnida Araneae Salticidae Euophrys Euophrys sp. 0 1 0 0
Arachnida Araneae Salticidae Evarcha Evarcha spp. 0 0 1 1
Arachnida Araneae Salticidae Icius Icius spp. 0 3 3 0
Arachnida Araneae Salticidae Pellenes Pellenes sp. 0 0 1 0
Arachnida Araneae Salticidae Salticus Salticus scenicus 0 1 0 0
Arachnida Araneae Salticidae Obestämd art 1 0 0 1 0
Arachnida Araneae Salticidae Obestämd art 2 0 1 0 0
Arachnida Araneae Salticidae Obestämd art 3 0 0 1 0
Arachnida Araneae Theridiidae Theridiidae sp. 1 0 5 0 0
Arachnida Araneae Theridiidae Theridiidae sp. 2 0 1 0 0
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 1 0 0 1 0
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 2 3 3 6 1
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 3 0 0 1 0
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 4 1 0 2 0
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 5 8 72 78 31
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 6 1 1 0 1
Arachnida Araneae Thomisidae Ozyptila Ozyptila sp. 7 2 0 0 2
Arachnida Araneae Thomisidae Xysticus Xysticus erraticus 3 0 0 2
Arachnida Araneae Thomisidae Xysticus Xysticus sp. 1 0 0 1 0
Arachnida Araneae Thomisidae Xysticus Xysticus sp. 2 2 27 43 0
Arachnida Araneae Thomisidae Xysticus Xysticus sp. 3 0 0 0 2
Arachnida Araneae Thomisidae Xysticus Xysticus sp. 4 0 0 0 4
Arachnida Araneae Thomisidae Xysticus Xysticus sp. 5 2 18 0 12
Arachnida Araneae Thomisidae Xysticus Xysticus sp. 6 1 0 0 0
Arachnida Araneae Thomisidae Xysticus Xysticus ulmi 0 1 1 0
Arachnida Araneae Thomisidae Obestämd art 1 0 1 0 0
Arachnida Araneae Thomisidae Obestämd art 2 0 0 0 2
Arachnida Araneae Titanoecidae Titanoeca Titanoeca sp. 2 0 0 0
Arachnida Araneae Zoridae Zora Zora spp. 22 54 53 10
Arachnida Araneae Aranea sp. 0 0 0 1
Arachnida Opiliones Nemastomatidae Nemastoma Nemastoma sp. 1 3 5 1 0
Arachnida Opiliones Nemastomatidae Nemastoma Nemastoma sp. 2 0 1 0 0
Arachnida Opiliones Sclerosomatidae Leiobunum Leiobunum spp. 0 3 1 4
Insecta Apoidea Andrenidae Obestämd art 0 0 0 3
Insecta Blattodea Ectobiidae Ectobius Ectobius lapponicus 9 29 29 12
Insecta Coleoptera Anobiidae Obestämd art 1 1 3 0 0
Insecta Coleoptera Anobiidae Obestämd art 2 0 1 0 0
Insecta Coleoptera Anthicidae Anthicus Anthicus sp. 0 1 0 0
Insecta Coleoptera Anthicidae Obestämd art 1 1 0 0 0
Insecta Coleoptera Anthribidae Obestämd art 2 0 0 0 1
Insecta Coleoptera Apionidae Apion Apion spp. 1 4 2 13
Insecta Coleoptera Apionidae Obestämd art 1 8 2 2 8
Insecta Coleoptera Apionidae Obestämd art 2 0 0 1 0
Insecta Coleoptera Apionidae Obestämd art 3 4 6 1 0
Insecta Coleoptera Byrrhidae Byrrhus Byrrhus fasciatus 0 1 0 0
Insecta Coleoptera Byrrhidae Byrrhus Byrrhus pilula 0 1 0 0
Insecta Coleoptera Byrrhidae Obestämd art 1 1 0 0 2
Insecta Coleoptera Byrrhidae Obestämd art 2 0 0 0 3
Insecta Coleoptera Cantharidae Podabrus Podabrus spp. 2 5 2 4
Insecta Coleoptera Carabidae Calathus Calathus sp. 0 0 0 1
Insecta Coleoptera Carabidae Carabus Carabus cancellatus 0 2 1 0
Insecta Coleoptera Carabidae Carabus Carabus glabratus 0 0 1 0
Insecta Coleoptera Carabidae Carabus Carabus hortensis 0 0 4 0
Insecta Coleoptera Carabidae Carabus Carabus nemoralis 2 4 1 0
Insecta Coleoptera Carabidae Carabus Carabus sp. 1 0 1 0 0
Insecta Coleoptera Carabidae Carabus Carabus sp. 2 1 0 0 0
Insecta Coleoptera Carabidae Carabus Carabus violaceus 0 1 0 0
Insecta Coleoptera Carabidae Cicindela Cicindela campestris 0 1 0 0
Insecta Coleoptera Carabidae Dromius Dromius sp. 1 0 0 0
Insecta Coleoptera Carabidae Harpalus Harpalus sp. 4 0 0 0
Insecta Coleoptera Carabidae Leistus Leistus sp. 1 2 2 2 1
Insecta Coleoptera Carabidae Leistus Leistus sp. 2 0 0 1 0