Examensarbete 15 hp Malmö universitet
METODOPTIMERING FÖR
HJÄRTAMYLOIDOS
METODOPTIMERING FÖR
HJÄRTAMYLOIDOS
ANNIKA CHAN
Chan, A. Metodoptimering för hjärtamyloidos. Examensarbete i biomedicinsk
laboratorievetenskap, 15 högskolepoäng. Malmö universitet: Fakulteten för hälsa
och samhälle, institutionen för Biomedicinsk vetenskap, 2020.
Amyloidos uppstår när amyloid, felveckade proteiner, ackumuleras extracellulärt i vävnaden. Det finns två typer av amyloid som ger upphov till hjärtamyloidos: lätt immunoglobulinkedja amyloidos (AL-amyloidos) och transtyretinamyloidos (TTR-amyloidos). TTR-amyloidos delas in i hereditär transtyretinamyloidos (hATTR) och wild-type transtyretinamyloidos (wtATTR). Beroende på vilken typ av amyloidos ges olika behandlingar. Idag används alltmer en icke-invasiv
nuklearmedicinsk undersökning, för diagnostik och differentiering vid hjärtamyloidos. Bedömningen är visuell och utgår från ett utarbetat
graderingssystem av Perugini. Vid klinisk fysiologi och nuklearmedicin på Skånes universitetssjukhus har efterfrågan av den nuklearmedicinska undersökningen för hjärtamyloidos ökat. Syftet med denna studie är att optimera hjärtscintigrafi amyloidos med 99mTc-DPD genom beräkning av antalet counts i SPECT/CT och i
planara bilder, och därefter beräkna aktiviteten per kilogram kroppsvikt för att undersöka om stråldosen till patienten kan minskas. Dessutom kommer en jämförelse mellan manuella och cirkulära ROI att utföras för att undersöka om någon skillnad föreligger. Denna retrospektiva studie omfattade tidigare genomförda undersökningar och hitintills har 17 patienter genomgått
hjärtamyloidos scintigrafi med 99mTc-DPD. Resultaten av studien visade ingen signifikant skillnad mellan cirkulära och manuella ROI (p = 0,504), vilket talade för en god överensstämmelse. För att reducera stråldosen till patienten kan viktbaserad dosmängd vara ett alternativ i framtiden.
Nyckelord: hjärtamyloidos, hjärtscintigrafi, region of interest, transtyretin,
AN OPTIMIZED METHOD FOR
CARDIAC AMYLOIDOSIS
ANNIKA CHAN
Chan, A. An optimized method for cardiac amyloidosis. Degree project in
Biomedical Science 15, Credit Points. Malmö University: Faculty of Health and
Society, Department of Biomedical Science, 2020.
Amyloidosis occurs when amyloid, misfolded proteins, accumulate extracellularly in the tissue. There are two types of amyloid that cause cardiac amyloidosis: immunoglobulin light chain amyloidosis (AL amyloidosis) and transthyretin amyloidosis (TTR amyloidosis). TTR amyloidosis is divided into hereditary transthyretin amyloidosis (hATTR) and wild-type transthyretin amyloidosis (wtATTR). Different treatments are available depending on what type of
amyloidosis. Today, a non-invasive nuclear medicine examination is increasingly being used for the diagnosis and differentiation of cardiac amyloidosis. The assessment of cardiac amyloidosis involves a visual assessment based on the Perugini grading system. In the Clinical Physiology and Nuclear medicine Department at Skåne University Hospital, there is an increasing demand for cardiac amyloidosis scintigraphy with 99mTc-DPD. The aim of this study is to optimize 99mTc-DPD scintigraphy for cardiac amyloidosis by identifying the number of counts in planar and in SPECT/CT images. The patient’s body weight will also be studied to determine if the patient’s radiation dose can be reduced. In addition, a comparison between manual and circular region of interest (ROI) will be performed to examine whether a difference exists. The study involved a retrospective analysis of 17 patients that have undergone cardiac amyloidosis scintigraphy with 99mTc-DPD. The results showed no significant difference between circular and manual ROI (p = 0.504), which indicated good agreement. Weight-based radiation dose may be an alternative in the future, in order to reduce the radiation dose to the patient.
Keywords: Cardiac amyloidosis, cardiac scintigraphy, radiation dose, region of
FÖRORD
Jag skulle vilja rikta ett stort tack till mina handledare Susanne Olsson och Jessica Hagerman samt läkaren Ragna Fridriksdottir för deras hjälp, stöd och vägledning under arbetets gång. Dessutom vill jag tacka enhetschefen på Klinisk fysiologi och nuklearmedicin på Skånes Universitetssjukhuset i Lund, Bodil E Andersson, för möjligheten att utföra examensarbetet i hennes verksamhet.
INNEHÅLLSFÖRTECKNING
BAKGRUND 6
Syfte 8
MATERIAL OCH METOD 8
Urval 9 Metod 9 Planara bilder 9 SPECT/CT bilder 10 Databehandling 10 Statistik 10 Etisk bedömning 11 RESULTAT 11 DISKUSSION 14 Urvalsdiskussion 14 Statistikdiskussion 15 Metoddiskussion 15 Resultatdiskussion 16 Begränsningar 18 KONKLUSION 18 REFERENSER 19 BILAGA 1 22
BAKGRUND
Amyloidos är en sällsynt sjukdom som uppstår när amyloid (svårlösliga fibriller) deponeras i flera organ eller vävnader. Det finns olika typer av amyloid, därmed olika sjukdomar av amyloidos [1-4]. Amyloid är abnormala proteiner som orsakats av felveckning av proteiner till följd av felaktig aminosyrasekvens. De felveckade proteinerna ackumuleras tillsammans i så kallade fibriller, i en lång kedja [3-7]. Vanligtvis bryts felveckade proteiner ned av proteas, men för amyloidfibrillerna gäller inte detta eftersom de ackumuleras extracellulärt i vävnaden, där de succesivt börjar orsaka skador [1,3,5-6,8].
Inlagring av amyloid i hjärtvävnaden kan störa hjärtfunktionen såsom störningar i hjärtats förmak, kammare eller klaffar. Hjärtsvikt är det dominerande symptomet för hjärtamyloidos [4,6-7,9-10]. Andra fynd är restriktiv kardiomyopati med en försämrad elasticitet i hjärtmuskulaturen, samt rubbning av hjärtats
retledningssystem, med symptom som arytmier och hjärtblock [2,5,11–12]. Det finns två typer av amyloid som påverkar hjärtat: lätt immunoglobulinkedja amyloidos (AL-amyloidos) och transtyretinamyloidos (TTR-amyloidos) [2-3,5-6,8]. Vid AL-amyloidos är det en störning av klonala plasmaceller som
produceras i benmärgen, vilket resulterar till felveckning av de lätta
immunoglobulinkedjorna [2-3,5-6,13]. De deponeras som amyloidfibriller i flera organ, vanligtvis i njurar, levern, mjuka vävnader, perifera och autonoma
nervsystemen [1–2,11,13].
Transtyretin (TTR) är ett protein som produceras i levern och dess uppgift är att transportera tyroxin och retinol (vitamin A) [3,5,7,10]. TTR-amyloidos delas in i hereditär transtyretinamyloidos (hATTR) och wild-type transtyretinamyloidos (wtATTR) [1,5,8,11-12]. hATTR amyloidos är en ärftlig sjukdom som
härstammar från DNA mutation och är mer benägen till felaktig proteinveckning [5-6,10-11]. Det resulterar i att TTR:s proteinstruktur avviker från det normala och blir ostabilt, vilket tenderar till lagring av amyloidfibriller i hjärtat och nerver som kan orsaka kardiomyopati och polyneuropati [2,7,12,14]. Uppkomsten av wtATTR amyloidos är okänd och har ingen bakomliggande genetisk defekt eftersom proteinstrukturen i TTR är normal [2,5,7]. Det som kan orsaka uppkomsten av wtATTR amyloidos är bland annat åldrandet eller felaktig proteinveckning som leder till ostabilt protein [2,3,5-7]. Sjukdomen kan orsaka karpal tunnelsyndrom, spinal stenos och hjärtsvikt [4-5,7]. Det är främst män över 60 år som drabbas av wtATTR amyloidos [5,9-11].
Beroende på vilken typ av amyloidos patienten drabbas av ges olika behandlingar. AL-amyloidos patienter behandlas med kemoterapi [2,4,6-7,11]. Exempelvis på kemoterapi är kombinationer av melphalan, dexamethasone, cyclophosphamide eller bortezomib [1,3,5]. Patienter med TTR-amyloidos behandlas med läkemedel som antingen bryter ned amyloidfibriller, stabiliserar eller reducerar syntesen av TTR [3-5,7]. Tafamidis är ett läkemedel som används för behandling av TTR-amyloidos. Det stabiliserar TTR och fördröjer perifer neurologisk försämring [2,5,7,15-16]. Läkemedlet Inotersen inhiberar produktionen av TTR i levern, vilket minskar amyloidfibrernas deponering i kroppens organ och därmed även symptomen [5,7,10,17].
Ekokardiografi (EKO), elektrokardiografi (EKG), kardiovaskulär magnetresonans (CMR) och nuklearmedicinska undersökningar har länge använts för evaluering av hjärtamyloidos [3-4,6-7,18]. Vid frågeställningen hjärtsvikt är EKO ett värdefullt verktyg, men sensitiviteten och specificiteten är låg för hjärtamyloidos [1,11]. Typiska fynd som talar för hjärtamyloidos vid EKO är exempelvis
förtjockning av kamrarnas väggar och förmaksseptum [11]. CMR fungerar som ett komplement till EKO. CMR har mycket större diagnostiskt värde vid
hjärtamyloidos eftersom undersökningen ger information om både strukturen och funktionen [2,6,11]. Däremot är undersökningen kostsam [11]. Dock kan inte EKO och CMR skilja mellan olika typer av hjärtamyloidos [3]. Tidigare krävdes en endomyokardiell biopsi (EMB) för diagnostik och differentiering mellan AL-amyloidos och ATTR-AL-amyloidos [7-8,10-11]. EMB har alltid varit golden standard eftersom metoden har hög sensitivitet men nackdelen är att den är invasiv och inte är komplikationsfri, vilket kan vara fatalt [3-4,6,8,11].
Nuförtiden används alltmer en icke-invasiv nuklearmedicinsk undersökning, för diagnostik och differentiering vid hjärtamyloidos [2-6]. Radioaktiva spårämnen som används är Teknetium (99mTc) märkt bisfosfonat, exempelvis 99mTc-3,3-difosfono-1,2-propandikarboxyl syra (99mTc-DPD), 99mTc-hydroxdifosfonat (99mTc-HDP), 99mTc-pyrofosfat (99mTc-PYP) [3-5,8]. Flera studier har visat att Tc-märkt bisfosfonat har en hög sensitivitet och specificitet för diagnostik av ATTR-amyloidos [4,8,11,18-19]. Upptaget av radiofarmakat i hjärtat i relation till upptaget i skelettet bestämmer graden av hjärtamyloidos. Det finns ett utarbetat graderingssystem av Perugini [4,6,8,11]. Inget upptag av radiofarmakat i hjärtat och normalt upptag i skelettet graderas som 0, se figur 1. Patienter som bedöms med grad 1 har vanligtvis ett mindre upptag i hjärtat jämfört med revbenen. Detta kan ses hos patienter med AL-amyloidos. Vid grad 2 är upptaget av radiofarmakat i hjärtat ungefär lika mycket som upptaget i revbenen. Patienter med större upptag i hjärtat jämfört med revbenen bedöms som grad 3. Grad 2 och 3 tyder på ATTR-amyloidos [4,6-8]. Bedömning av radiofarmakats upptag i hjärtat är framförallt visuell, men kan kompletteras med beräkning av kvoten mellan upptag i hjärtat (H) och dess kontralaterala bild (CL) [6,8,18,20]. H/CL<1,5 tyder på AL-amyloidos (alternativt grad 0) medan H/CL>1,5 bedöms som ATTR-AL-amyloidos [6,20].
Tidigare studier har visat det finns en skillnad vid användning av de olika radiofarmaka. 99mTc-DPD och 99mTc-HDP har en högre sensitivitet och specificitet vid påvisning och differentiering av hjärtamyloidos jämfört med
99mTc-PYP [14,18,20]. 99mTc-DPD och 99mTc-HDP används mestadels i Europa
eftersom de inte är godkända i USA, där 99mTc-PYP används istället [6,14,19]. Nackdelar vid användning av 99mTc-PYP är att det ger falskt positivt och negativt resultat hos patienter med tidigt diagnostiserad ATTR-amyloidos [19-20]. Vid Bild och funktion, Klinisk fysiologi och nuklearmedicin på Skånes universitetssjukhus (SUS) har efterfrågan av den nuklearmedicinska
undersökningen för hjärtamyloidos ökat. 570 MBq av det radioaktiva spårämnet
99mTc-DPD injiceras intravenöst. Aktivitetsfördelningen är optimal ungefär tre
timmar efter injektionen och därmed kan bildtagningen påbörjas [8]. Bildinsamlingen sker med hjälp av gammakamera och en högupplösande
kollimator (Low Energy High Resolution, LEHR) används. En planar bild (hjärtat anteriort och posteriort) tas och undersökningen kompletteras med en SPECT/CT (Single photon emission computed tomography/computed tomography) bild. CT-undersökningen är en röntgenundersökning med låg stråldos (lågdos-CT) och utförs för att få en bättre anatomisk lokalisation av det radioaktiva spårämnet, samt för att kunna attenueringskorrigera SPECT-undersökningen [21].
Bildtagningen sker med två detektorer och tar ungefär 25-30 minuter beroende på vilken modell av gammakamera som används. Utvärdering och beräkning utförs på utvärderingsprogrammet Hermes Hybrid Viewer (version 3.0.2).
All radioaktivitet innehåller instabila atomkärnor som spontat sönderfaller samtidigt som joniserande strålning avges. 99mTc emitterar gammastrålning och mäts med hjälp av detektorer i enheten counts per second [21].
Strålsäkerhetsmyndigheten arbetar ständigt med att minska strålningen till människan och miljön. Vid användning av strålning inom vården ska
undersökningarna vara berättigade och optimerade. Myndigheten har publicerat diagnostiska referensnivåer (DRN) som bidrar till optimering av stråldosen [22]. Den nuklearmedicinska undersökningen vid hjärtamyloidos medför stråldos till patienten och det är därför viktigt att optimera metoden [3-5].
Syfte
Syftet med studien är att optimera hjärtscintigrafi amyloidos med 99mTc-DPD genom beräkning av antalet counts i SPECT/CT och i planara bilder. Därefter beräkna aktiviteten per kilogram kroppsvikt för att undersöka om stråldosen till patienten kan reduceras. Dessutom kommer en jämförelse mellan manuella och cirkulära ROI att utföras.
MATERIAL OCH METOD
För bestämning om antalet counts i hjärtscintigrafi amyloidos med 99mTc-DPD är optimal och om stråldosen till patienten kan minskas gjordes mätningar på redan utförda undersökningar i Hermes Hybrid Viewer (version 3.0.2). Planara
Urval
Denna studie var en retrospektiv studie som omfattade tidigare genomförda undersökningar. Hitintills har 17 patienter, varav 12 män och 5 kvinnor, med varierande ålder, genomgått hjärtscintigrafi amyloidos med 99mTc-DPD på Klinisk fysiologi och nuklearmedicin på SUS under 2019. 7 blev diagnostiserade med upptag grad 3 medan 10 patienter med upptag grad 0. Samtliga patienter inkluderades i denna nio veckors studie.
Metod
För att svara på studiens syfte samlades patientdata in från journal- och bildhanteringssystem Sectra IDS 7 (version 21.1.5.2096) för information om frågeställning och svar av undersökningen.
Planara bilder
För beräkning av antalet counts (N) i den planara bilden justerades gråskalan för visualisering av hjärtat för varje patient. Därefter ritades ett område (region of interest, ROI) manuellt runt hjärtat i den anteriora bilden och ROI:et kopierades över spegelvänt (kontralateralt). Sedan kopierades samma område till den posteriora bilden, både över hjärtat och kontralateralt. Vid ritning av ROI runt hjärtat på patienter med upptag grad 0, togs det hänsyn till patientens vikt och ROI:ets area från patienter med upptag. Hos tyngre patienter ritades större ROI medan hos patienter som vägde mindre ritades mindre ROI runt hjärtat. Utifrån de ritade ROI:en erhölls arean, antalet counts och medelvärdet av antalet counts. Med hjälp av antal counts från ROI:en beräknades H/CL mellan hjärtat och dess kontralaterala område för varje patient, både i den anteriora och den posteriora bilden. Ett geometriskt medelvärde (x) beräknades på de manuella ROI:en för samtliga patienter enligt följande formel [23]:
𝑥 = √𝑁𝑎𝑛𝑡𝑒𝑟𝑖𝑜𝑟 ∗ 𝑁𝑝𝑜𝑠𝑡𝑒𝑟𝑖𝑜𝑟
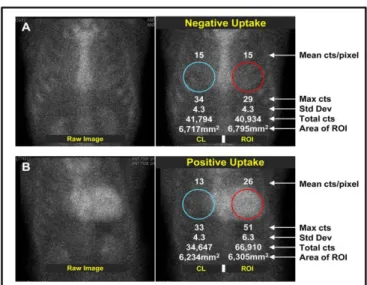
Vid beräkning av den injicerade aktiviteten av 99mTc-DPD per kilogram samt BMI, togs det hänsyn till patientens längd och vikt. För att studera eventuellt skillnad mellan manuella respektive cirkulära ROI, placerades cirkulära ROI över hjärtat anteriort hos patienter med upptag grad 3. De cirkulära ROI:en kopierades över kontralateralt, se figur 2 [6–8,20]. Efteråt erhölls medelvärdet av antalet counts som användes för beräkning av H/CL [20]. I de planara bilderna placerades även rektangulära ROI i bröstbenet hos patienter med upptag grad 3 och
medelvärdet av antalet counts erhölls. Därefter beräknades en kvot mellan hjärtat och bröstbenet för patienter med upptag grad 3.
Figur 2. Negativt upptag (A) och positivt upptag (B) av radiofarmaka i hjärtat vid en
hjärtscintigrafi amyloidos. De röda cirkulära ROI:en representerar upptag i hjärtat medan de blåa ROI:en är kontralaterala till de röda ROI:en [20].
SPECT/CT bilder
Utifrån SPECT/CT erhålls tre olika projektioner, vilka är transversal-, sagittal-, och coronalaplan. En fusionerad bild av transversalplan och lågdos CT användes för ritning av ROI och därefter för beräkning av antalet counts. ROI ritades manuellt runt hjärtat i de snitt hjärtat var synligt för patienter med upptag grad 3. Från dessa ROI i transversalplan summerades en så kallad volume of interest (VOI) och antal counts i hjärtat erhölls. I programmet HERMES finns det en funktion VOI där programmet själv skapar ett ROI kring aktivitetsupptaget i hjärtat, vilket baseras på ett självinställt tröskelvärde. Det automatiska ROI:et användes hos patienter med upptag grad 3. Tröskelvärdet används för att
subtrahera bort all bakgrundsaktivitet i det markerade ROI:et och ett tröskelvärde på 30% användes. Det gjordes en jämförelse om arean av VOI och antalet counts skiljdes åt vid användning av det automatiska ROI och manuellt ritade ROI planart.
Databehandling
Bearbetning av all rådata och mätningar från de planara respektive SPECT/CT bilderna utfördes i Excel (Version 2019, Microsoft). Beräkning av H/CL, BMI, aktivitet/kg och aktivitet/BMI utfördes också i Excel.
Statistik
Två olika statistiska analyser användes för sammanställning av mätningarna, vilka är spridningsdiagram och Bland-Altmananalys. Samtliga analyser utfördes med
IBM SPSS Statistics (Version 26.0).
Spridningsdiagram användes för att analysera förhållandet mellan två variabler, huruvida någon korrelation förelåg mellan den förklarande variabeln, x-axeln, och responsvariabeln, y-axeln [24]. Sambandet mellan aktivitet per kilogram
kroppsvikt samt aktivitet per BMI studerades.
T-test är en statistik analysmodell som används för att bestämma om det finns någon signifikant skillnad mellan två medelvärden. Ett konfidensintervall på 95 procent valdes till testet, vilket innebär att signifikansnivån är 0,05 och utifrån t-testet erhölls ett p-värde. Om p-värdet är mindre än signifikansnivån, det vill säga <0,05, då talade det före en statistik skillnad mellan mätmetoderna [24-25].
Bland-Altmananalysen utfördes för bestämning av överensstämmelse mellan två olika metoder. För att kunna jämföra mätsystemen beräknades differensen på y-axeln och medelvärdet på x-y-axeln mellan de två individuella mätningarna. De erhållna värdena presenterades i ett Bland-Altmandiagram [24-25]. Ett konfidensintervall på 95 procent valdes för analyserna. Om det fanns en god överensstämmelse mellan mätsystemen förväntades mätningarna vara
normalfördelade, det vill säga 95 procent av värdena skall befinna sig inom limits of agreement. Limits of agreement består av tre referenslinjer, som beräknades genom medelskillnaden ± 1,96SD (standardavvikelse). Utifrån dessa beräkningar erhölls medelskillnadslinjen, övre respektive undre gränsen. Medelskillnadslinjen utgör medelvärdet av alla skillnader mellan mätningarna. Ett p-värde från
ovanstående beräkningar erhölls. Om p-värde > 0,05 tyder det på att ingen statistiskt signifikant skillnad förelåg mellan mätmetoderna. Det vill säga en god överensstämmelse mellan mätningarna erhölls [25].
Etisk bedömning
Denna studie var en retrospektiv studie och material som användes var från redan genomförda hjärtscintigrafi amyloidos undersökningar. En begäran om etisk prövning lämnades in till det etiska rådet vid Malmö universitet för fakulteten Hälsa och samhälle innan projektet påbörjades eftersom studien berörde patienters persondata. Ett utlåtande från etikrådet erhölls 2020-02-07 (HS2020 löp nr. 8). Inga risker förelåg för patienterna eftersom undersökningarna redan är utförda. Deltagarnas patientdata avidentifierades genom ersättning med löpnummer och kommer inte att offentliggöras vid presentation av resultat.
RESULTAT
Studien inkluderade 17 patienter, varav 7 patienter med upptag grad 3 och 10 patienter med upptag grad 0. Resultaten från samtliga mätvärden redovisas i form av diagram (figur 3-6) och tabell (tabell 1). SPECT/CT utfördes inte vid ett utav fallen, därav uteslöts patienten från jämförelsen mellan det geometriska
medelvärdet och VOI.
Av 17 patienter erhöll 6 patienter H/CL (anteriort) >1,5, varav samtliga
undersökningssvar anger hög sannolikhet för ATTR-amyloidos (upptag grad 3) (bilaga 1). En av patienterna med upptag grad 3 erhöll H/CL (anteriort) = 1,4. För samtliga patienter med upptag grad 0 (friska) är H/CL ≤1,0. Medelvärdet för H/CL anteriort beräknades till 1,7 medan motsvarande värde för H/CL posteriort är 1,3. För patienter med upptag grad 3 är medelvärdet för H/CL manuella 2,9, medan motsvarade värde för H/CL cirkulära är 2,9 (bilaga 1).
I figur 3 illustreras ett spridningsdiagram där patienter med upptag grad 3 har högre upptag i hjärtat jämfört med i bröstbenet.
Figur 3. Spridningsdiagram för kvoten mellan upptaget av radiofarmaka i hjärtat (H) och dess
kontralaterala område (CL) samt kvoten mellan hjärtat och bröstbenet för patienter med upptag grad 3.
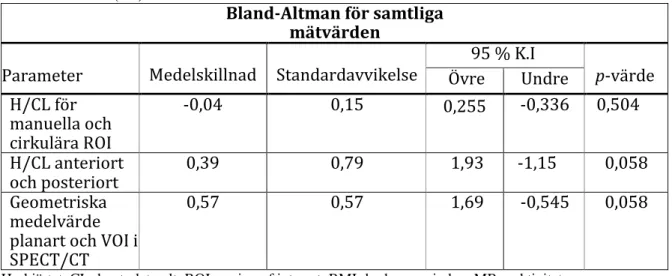
De beräknade värdena, övre- och undregräns, för Bland-Altmananalys redovisas nedan i tabell 1. P-värdet som erhölls från samtliga parametrar är större än 0,05 och tyder på att ingen signifikant skillnad föreligger mellan mätningarna. Det talar alltså för en god överensstämmelse för samtliga mätningar.
Tabell 1. Värdena för Bland-Altmandiagrammen (figur 4-5). För limits of agreement valdes ett
konfidensintervall (K.I) till 95%.
Bland-Altman för samtliga mätvärden
Parameter Medelskillnad Standardavvikelse
95 % K.I p-värde Övre Undre H/CL för manuella och cirkulära ROI -0,04 0,15 0,255 -0,336 0,504 H/CL anteriort och posteriort 0,39 0,79 1,93 -1,15 0,058 Geometriska medelvärde planart och VOI i SPECT/CT
0,57 0,57 1,69 -0,545 0,058
H= hjärtat, CL=kontralateralt, ROI=region of interest, BMI=body mass index, MBq=aktivitet, VOI= volume of interest, SPECT/CT = single proton emission computed tomography/computed tomography.
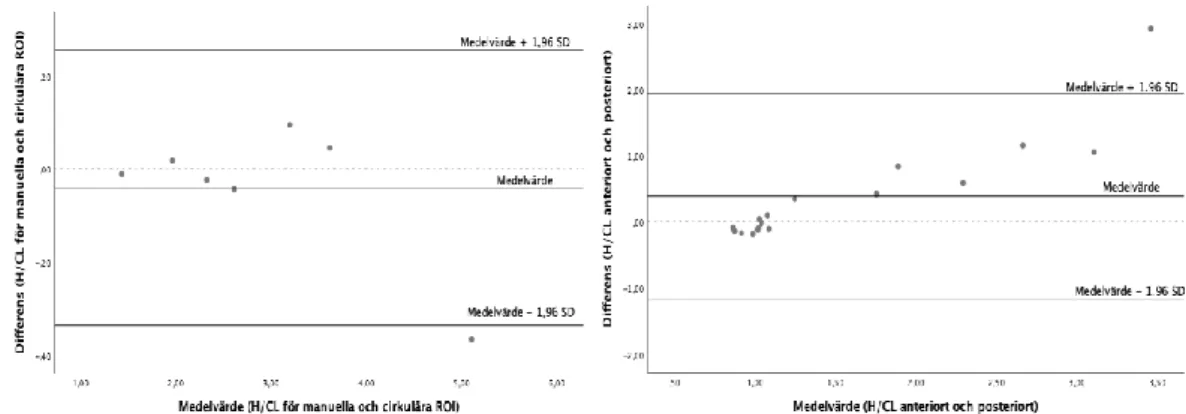
Nedan illustreras Bland-Altmandiagrammen för samtliga mätningar (figur 4-5). I diagrammen ligger de flesta punkterna inom konfidensintervallet, dock
förekommer enstaka icke-signifikanta punkter utanför konfidensintervallet,
Figur 4. Bland-Altmandiagram för kvoten mellan upptaget av radiofarmaka i hjärtat (H) och dess
kontralaterala område (CL). Till vänster: manuella och cirkulära regions-of-interest (ROI) för patienter med upptag grad 3. Till höger: anteriora och posteriora ROI för samtliga patienter.
Figur 5. Bland-Altmandiagram för geometriska medelvärden planart och volume of interest (VOI)
i SPECT/CT bilder för patienter med upptag grad 3.
Vid uträkning av aktivitet per kilogram kroppsvikt exkluderades 3 patienter, eftersom information om deras längd och vikt saknades. Aktivitet per kilogram kroppsvikt uträknades i genomsnitt till 7,5 MBq/kg, som minst 5,4 MBq/kg och som mest 11,4 MBq/kg (bilaga 1).
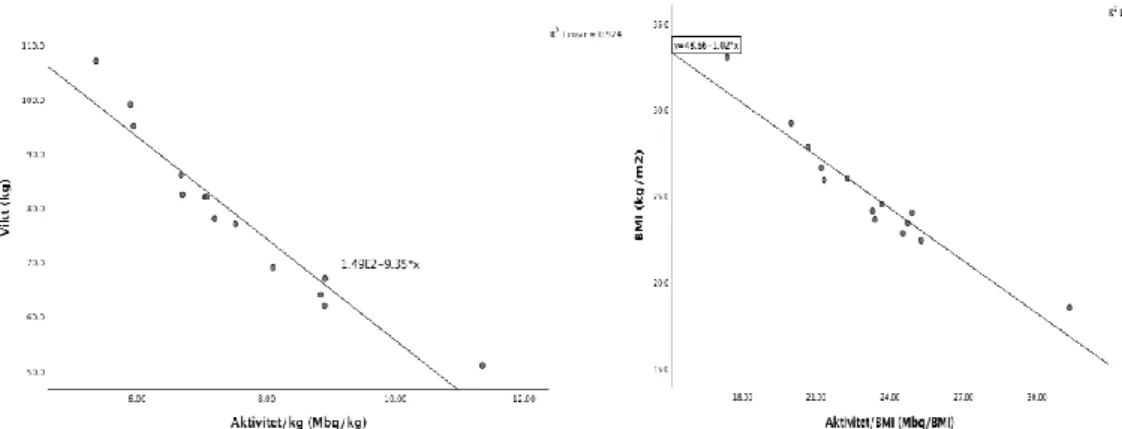
Nedan presenteras korrelationerna för samtliga patienter mellan aktivitet per kilogram med patientens vikt och aktivitet per BMI med patientens BMI i form av spridningsdiagram. I figur 6 bilden till vänster ses en negativ korrelation, vilket innebär att det föreligger ett negativt samband mellan aktivitet per kilogram och patientens vikt. Om vikten minskas ökar aktiviteten per kilogram och vice versa. En negativ korrelation visas i figur 6 bilden till höger som tyder på att ett negativt samband föreligger mellan aktivitet per BMI och patientens BMI. För varje ökning i aktivitet per BMI leder det till en minskning av kroppsmasseindex på 1.02 kg/m2. Ju högre BMI värde patienten har, desto mindre aktivitet fördelas hos
Figur 6. Spridningsdiagram över sambandet mellan aktivitet (MBq) per kilogram kroppsvikt (till
vänster) samt sambandet mellan aktivitet per body mass index (BMI) och patientens BMI (till höger).
DISKUSSION
För diagnostisering och differentiering av hjärtamyloidos är hjärtscintigrafi amyloidos för närvarande den mest använda icke-invasiva metoden [2-6].
Metoden har en hög sensitivitet och specificitet för sjukdomen [4,8,11,18-19], och har nyligen börjat tillämpas på SUS. Det finns olika radiofarmaka att tillgå och tidigare studier har visat att skillnader finns beroende på vilken radiofarmaka som används [3-5,8]. I nuläget utförs bedömningen visuellt på verksamheten, som baseras på graderingssystemet Perugini [4,6,8,11]. Bokhari m.fl. [20] använder sig av en ytterligare metod för bedömning av hjärtamyloidos, vilket är beräkning av H/CL. I denna studie studerades därför det genom att H/CL beräknades från manuella respektive cirkulära ROI. Undersökningen medför stråldos till patienten, för att undvika onödig stråldos analyserades den injicerade aktiviteten. Det
gjordes genom beräkning av den injicerade aktiviteten per kilogram kroppsvikt och BMI.
Urvalsdiskussion
I samband med att hjärtscintigrafi amyloidos nyligen börjat användas vid Klinisk fysiologi och nuklearmedicin på SUS har endast ett fåtal undersökningar utförts. Hitintills har 17 patienter, varav 12 män och 5 kvinnor, med varierande ålder genomgått undersökningen. Samtliga patienter inkluderades i denna studie. En av patienterna med upptag grad 0 hade skelettmetastas kring revbenen vid hjärtat. Vid beräkning av antalet counts runt hjärtat kan ett högre värde ha erhållits på grund av skelettmetastasen, därför borde patienten exkluderats från studien. Ett för högt värde av antalet counts, leder till falskt för högt H/CL. 99mTc-DPD används som ett alternativ till 99mTc-HDP eller 99mTc-MDP vid skelettscintigrafi, därför visades skelettmetastasen [4,11]. Vid uträkning av aktivitet per kilogram kroppsvikt exkluderades 3 patienter, eftersom information om deras längd och vikt saknades. Det kan ha påverkat det genomsnittliga värdet vid beräkning av aktivitet per kilogram samt BMI. Vanligtvis sker en planar och en SPECT/CT bildtagning, men eftersom undersökningen är ny på verksamheten utfördes ingen planar eller SPECT/CT bild på den första patienten, utan en helkroppsbild. Därför uteslöts patienten från jämförelsen mellan det geometriska medelvärdet (planara bilder) och VOI (SPECT/CT). Denna patient borde ha exkluderats helt från studien eftersom i de flesta beräkningarna avviker värdena från patienten, se figur
Statistikdiskussion
För bestämning av förhållandet mellan två variabler är spridningsdiagram
användbart. Korrelationen tar inte hänsyn till avvikande observationer, vilket kan vara missvisande. Dessutom är korrelationsmåttet beroende på spridningen, det vill säga ju större spridning, desto högre blir korrelationen. Det resulterar i en otillförlitlig korrelationsanalys. Korrelationmåttet mäter graden av det linjära sambandet mellan två mätningar och inte hur bra överensstämmelsen är [24]. Därför kompletterades Bland-Altmananalys till denna studie, en analys som undersöker hur väl två mätningar stämmer överens med varandra. Denna analys visar även hur mycket och vilken mätning det är som avviker. Om
överrensstämmelsen är god mellan mätningarna, betyder det att inga signifikanta avvikelser förekommer och tillförlitligheten är god [24-25].
Metoddiskussion
Allt material som användes bestod av tidigare insamlade undersökningar. Det insamlade materialet innehöll planara och SPECT/CT- bilder som användes för ritning av ROI runt hjärtat. Syftet med undersökningen var bland annat att optimera hjärtscintigrafi amyloidos med 99mTc-DPD för både i planara- och i SPECT/CT bilderna. I de planara bilderna ritades ROI på samtliga patienter, patienter med och utan upptag av radiofarmaka. Det försvårade studien eftersom hos patienter med inget upptag var hjärtat inte synligt. För att på ett ungefär kunna bestämma hjärtats position och storlek hos patienter med inget upptag, togs det hänsyn till patientens vikt och ROI:ets area från patienter med upptag.
I tidigare studier har antingen planara- eller både planara- och SPECT/CT bilder använts vid bedömning av hjärtamyloidos. För visuell tolkning är planara bilder användbart, speciellt hos patienter med upptag grad 0 eller 3. I och med att bedömningen görs genom en visuell jämförelse mellan upptag i hjärtat och i revbenen [4,6,8]. Däremot kan det vara svårare att bedöma patienter med upptag grad 1 och 2 med hjälp av de planara bilderna. Då är SPECT/CT bilderna till fördel eftersom en 360 graders rotation av hjärtat erhålls, och en överlappning av benupptaget undviks [8,11,14]. Peruginis graderingssystem har använts för bedömning av hjärtamyloidos och beräkning av H/CL [4,6,8,11,18]. På SUS är bedömningen visuell och baseras på Peruginis graderingssystem. I denna studie har därför en H/CL beräknats för samtliga patienter, framförallt för att undersöka om den kan användas som en komplettering vid bedömningen. Bhambhvani m.fl. [19] har beräknat H/CL genom att placera cirkulära ROI över hjärtat anteriort och sedan kopierat över det kontralateralt. Av den anledningen gjordes detsamma i denna studie. Dessutom undersöktes det om någon skillnad förelåg mellan
cirkulära respektive manuella ROI vid beräkning av H/CL, eftersom hjärtat inte är cirkulärformad. Analysen utfördes endast hos patienter med upptag på grund av tidsbegränsningar i denna studie. Egentligen borde cirkulära ROI ha placerats på alla patienter för att en fullständig jämförelse mellan manuella respektive
cirkulära ROI ska fås.
Insamlingen sker med två detektorer och risken för över- eller underskattning av upptag i hjärtat finns, därför beräknades ett geometriskt medelvärde i de planara bilderna för alla patienter [26]. Det geometriska medelvärdet tar hänsyn till att hjärtat inte befinner sig i en projektion utan är sfärisk. Från de planara bilderna observeras hjärtat endast från två vinklar, vilket kan ha påverkat beräkningen av det geometriska medelvärdet. Därför blir det mer exakt att utgå från SPECT/CT,
eftersom alla projektioner av hjärtat registreras [21]. För varje snitt hjärtat var synligt ritades manuella ROI runt hjärtat, vilket var besvärligt och tidskrävande. Av den anledningen gjordes en jämförelse mellan det geometriska medelvärdet från de planara bilderna och VOI från SPECT/CT bilderna på patienter med hjärtamyloidos.
På utvärderingsprogrammet HERMES kan programmet själv skapa automatiska ROI kring aktivitetsupptaget genom självinställt tröskelvärde. För att undvika över- och underskattning av hjärtupptaget måste ett optimalt tröskelvärde användas [21]. Det eftersom om upptaget är högre någon annanstans än hjärtat, kommer inget automatisk ROI att ritas runt hjärtat. För att hitta det optimala tröskelvärdet för patienterna, testades olika tröskelvärden från 60% till 30%. Ett tröskelvärde på 30% valdes för samtliga patienter med hjärtupptag, eftersom det gav minst avvikelse vid uppskattning av hjärtupptaget. Ju högre tröskelvärde, desto mer undervärderades upptaget av radiofarmaka i hjärtat. Det automatiska ROI:et placerades inte över hjärtat på en av patienter utan i skelettet, på grund av för högt skelettupptag. Fördelningen av radiofarmakat studerades hos patienter med hjärtamyloidos, genom att rektangulära ROI ritades i bröstbenet planart. En jämförelse mellan upptag i hjärtat och bröstbenet genomfördes. Under arbetets gång upptäcktes det att det är lättare att rita ROI i bröstbenet planart jämfört med SPECT/CT. Därför ritades inga ROI i bröstbenet i SPECT/CT.
Resultatdiskussion
Frågeställningen för samtliga patienter gällde graden av upptag, tecken på hjärtamyloidos och misstanke om ATTR-amyloidos. Graden av hjärtamyloidos beror på upptaget av radiofarmaka i hjärtat. Patienter som bedömdes med upptag grad 3 har en hög sannolikhetsgrad för ATTR-amyloidos [4,6,8,11]. Vid
beräkning av H/CL för patienter med upptag grad 3, blev kvoten >1,4, medan H/CL för patienter med inget upptag blev ≤1. H/CL<1,5 tyder på AL-amyloidos medan H/CL>1,5 bedöms som ATTR-amyloidos [6,20]. Vidare studier kring H/CL krävs i framtiden, för att det ska kunna användas som en ytterligare metod för bedömning på verksamheten. Dessutom omfattade studien endast 17 patienter, där 7 av dem hade upptag grad 3. Ytterligare studier kring var gränsen för AL-amyloidos går behöver utvärderas. I och med att patienter med inget upptag hade en H/CL på ≤1, och H/CL<1,5 tyder på AL-amyloidos samt grad 0 [6,20]. Dorbala m.fl. [6] skriver i sin rapport att inget upptag av radiofarmaka tyder på ingen hjärtamyloidos. Egentligen behövdes inga H/CL beräknas för patienter med upptag grad 0, eftersom det graderades som negativt upptag. För patienter med upptag grad 1 kan H/CL vara till hjälp, eftersom de vanligtvis har ett minskat upptag i hjärtat jämfört med revbenen. H/CL avviker för en patient som blivit diagnostiserad med upptag grad 3 eftersom kvoten blev 1,4 och utifrån
referensvärdena hade patienten blivit bedömd som AL-amyloidos. Det kan bero på att en oerfaren student har ritat ROI:en runt hjärtat och förmodligen
underskattat hjärtupptaget. Beräkning av H/CL är endast som referens vid bedömning av hjärtamyloidos.
I diskussion med en av läkarna på kliniken angående en patient med H/CL på 1,4 (bilaga 1), hade läkaren idag utifrån bilderna bedömt patienten som upptag grad 2. Det eftersom upptaget av radiofarmakat i hjärtat var ungefär lika mycket som upptaget i revbenen. På grund av att undersökningen är ny på SUS har läkarna olika erfarenhet vid bedömning av hjärtamyloidos. Därför kan H/CL vara till hjälp vid bedömningen. Donnelly m.fl. [7] har beräknat H/CL utifrån cirkulära ROI,
men i denna studie beräknades H/CL både i manuella och cirkulära ROI. Det förelåg en god överensstämmelse mellan mätningarna (p=0,504) [24-25]. Därför kan cirkulära ROI användas istället för manuella ROI, för besparing av tid. I figur 4 till vänster ligger en punkt under den undre gränsen. En förklaring till det kan vara för att bilden var tagen som en helkroppsbild och inte planart, över
bröstkorgen, vilket resterande av bilderna var. Vid ritning av ROI runt hjärtat i helkroppsbilden kan det antingen leda till en under- eller överskattning av upptaget.
På SUS injiceras 570 MBq 99mTc-DPD till patienter som genomför hjärtscintigrafi amyloidos 1. I tidigare studier har en bestämd dosmängd från 700 till 800 MBq injicerat till patienterna [4,11,15]. På bild- och funktionsmedicin i Västerbotten är aktiviteten som injiceras viktbaserat, 8,5 MBq/kg 99mTc-DPD 2. Utförandet för
hjärtscinitgrafi amyloidos är liknande på SUS och i Västerbotten. Planar- och SPECT/CT samt scanning anteriort och posteriort genomförs. Tiden för bildtagning är densamma på SUS och i Västerbotten, bildtagningen sker tre timmar efter injektion. Det som skiljer metoderna åt är mängden aktivitet som injiceras. Verksamheter med joniserande strålning eftersträvar ständigt att reducera stråldosen för både personal och patienterna [27]. Gimelli m.fl. [28] förmedlar att om en vikt- eller BMI baserad dosmängd används kan stråldosen reduceras med 58% jämfört med bestämd dosmängd, samtidigt som bildkvalitén bibehålls.
I denna studie undersöktes det därför huruvida stråldosen till patienten kunde minskas, genom beräkning av aktivitet per kilogram kroppsvikt och aktivitet per BMI. Dessutom utfördes en korrelationsanalys och en negativ korrelation förelåg. Fördelningen av radiofarmakat i kroppen studerades hos patienter med upptag och som förväntat var upptaget högre i hjärtat jämfört med bröstbenet. Strauss m.fl. [29] skriver i sin rapport att en ökad aktivitet av radiofarmaka krävs för tyngre patienter. Ju tyngre patienten är, desto mindre aktivitet per kilogram fördelas i kroppen. Patienter som väger mindre får betydligt mer stråldos [28]. Fördelningen av radiofarmakat beror alltså på patientens längd och vikt [28-29]. För överviktiga patienter bör därför en bestämd dosmängd användas istället för en viktbaserad dosmängd [28]. Det genomsnittliga värdet för aktivitet per kilogram kroppsvikt beräknades till 7,5 MBq/kg. För att undvika onödig stråldos till patienten men samtidigt bibehålla bildkvalitén kan en viktbaserad dosmängd vara till användning i framtiden.
En jämförelse mellan anteriora och posteriora ROI genomfördes, utifrån det erhållna p-värdet, 0,058, förelåg ingen signifikant skillnad. Däremot är p-värdet ganska nära 0,05 och i Bland-Altman diagrammet visas en tydligt ökande trend. En misstanke om systematisk skillnad kan förekomma, vilket kan bero på
mätningsfel [24]. En av felkällorna kan vara för att en oerfaren student genomfört studien och underskattat hjärtats storlek vid ritning av ROI. Det var betydligt lättare att rita ROI runt hjärtat anteriort jämfört med posteriort, eftersom hos patienter med hjärtamyloidos var upptaget tydligare anteriort.
Utöver det gjordes en jämförelse mellan det geometriska medelvärdet från de planara bilderna och VOI från SPECT/CT bilderna på patienter med
1 Skånes universitetssjukhus, (2019) Hjärtscintigrafi-amyloidosis: kompendium. Lund
hjärtamyloidos. Ett p-värde på 0,058 erhölls, vilket är relativt nära 0,05. Fastän det talar för en god överensstämmelse mellan mätningarna, är denna typ av jämförelse inte tillförlitlig. Det beror främst på att något systematiskt fel föreligger, eftersom värdena av differensen ligger över noll [25]. Därutöver inkluderades endast 6 patienter i den undersökningen och inga tidigare studier gällande det har genomförts. Från de planara bilderna registreras hjärtat från två vinklar, därför är SPECT/CT bilderna ett mer korrekt sätt att beräkna arean av upptaget i hjärtat eftersom bildtagningen sker i olika projektioner.
Begränsningar
Då studien är ny på SUS och omfattade endast 17 patienter, varav 7 med upptag och 10 med inget upptag, kan ingen generaliserad slutsats för samtliga
genomförda mätningar dras. Dessutom exkluderades enstaka patienter från en del mätningar, på grund av att material saknades. Gillmore m.fl. [11] har i sin studie påvisat att Tc-märkt bisfosfonat har en hög sensitivitet samt specificitet för diagnostik och differentiering av hjärtamyloidos. I studien kunde detta inte konstateras, eftersom studien omfattade ett begränsat antal patienter och var tidsbegränsad. Förutom det hade patienterna antingen upptag grad 0 eller 3. Som tidigare nämnt har metoden bevisat att upptag av grad 2 och 3 har en hög
sannolikhet för ATTR amyloidos. Men för att fastställa det krävs ytterligare information om patienten, exempelvis serum- och urinprover [1,11-12]. Dessutom bidrar symptom som karpal tunnelsyndrom, spinal stenos och hjärtsvikt till att hjärtamyloidos misstänks [2-5,7]. Men eftersom information saknades kunde inte denna analys utföras. För en ökad tillförlitlighet av mätmetoderna krävs ett större antal deltagare med varierande sjukdomstillstånd i framtida studier.
KONKLUSION
Den här studien har visat att det är betydligt lättare att rita ROI runt hjärtat planart jämfört med SPECT/CT bilder. Ingen skillnad föreligger om manuella eller cirkulära ROI hade tillämpats. Troligtvis kan H/CL användas som ett komplement för framtida bedömningar av hjärtamyloidos på verksamheten. För att undvika onödig stråldos till patienten kan en viktbaserad dosmängd vara till användning i framtiden. Det var ett begränsat antal patienter att tillgå till under studien, därför krävs ytterligare studier innan säkra slutsatser kan fastställas.
REFERENSER
1. Baker KR, Rice L, (2012). The Amyloidoses: Clinical Features, Diagnosis And Treatment. Methodist DeBakey Cardiovascular Journal, 8(3), 3–7. 2. Martinez-Naharro A, Hawkins PN, Fontana M, (2018). Cardiac
amyloidosis. Clinical medicine (London), 18(2), 30-35. 3. Chacko L, Martone R, Cappelli F, Fontana M, (2019). Cardiac
Amyloidosis: Updates in Imaging. Curr Cardiol Rep, 21(9), 108. 4. Costache II, Buburuz AM, Crisu D, Statescu AM, Ungureanu C,
Aursulesei V, (2019). The role of echocardiography and 99mTc-HDP scintigraphy in non-invasive diagnosis of cardiac amyloidosis: A case series and literature review. Medicine (Baltimore), 98(38), e17256. 5. Manolis AS, Manolis AA, Manolis TA, Melita H, (2019). Cardiac
amyloidosis: An underdiagnosed/underappreciated disease. European
Journal of Internal Medicine, 67, 1–13.
6. Dorbala S, Ando Y, Bokhari S, Dispenzieri A, Falk RH, Ferrari VA, Fontana M, Gheysens O, Gillmore JD, Glaudermans AWJM, Hanna MA, Hazenber BPC, Kristen AV, Kwong RY, Maurer MS, Merlini G, Miller EJ, Moon JC, Murthy VL, Quarta CC, Rapezzi C, Ruberg FL, Shah SJ, Slart RHJA, Verberne HJ, Bourque JM, (2019).
ASNC/AHA/ASE/EANM/HFSA/ISA/SCMR/SNMMI expert consensus recommendations for multimodality imaging in cardiac amyloidosis: Part 1 of 2—evidence base and standardized methods of imaging. J Nucl
Cardiol, 26(6), 2065–123.
7. Donnelly JP, Hanna M, 2017). Cardiac amyloidosis: An update on diagnosis and treatment. Cleve Clin J Med, 12 (3), 12–26.
8. Cappelli F, Gallini C, Di Mario C, Costanzo EN, Vaggelli L, Tutino F, Ciaccio A, Bartolini S, Angelotti P, Frusconi S, Farsetti S, Vergaro G, Giogetti A, Marzullo P, Genovoesi D, Emdin M, Perfetto F, (2019). Accuracy of 99mTc-Hydroxymethylene diphosphonate scintigraphy for diagnosis of transthyretin cardiac amyloidosis. J Nucl Cardiol, 26(2), 497– 504.
9. Perfetto F, Cappelli F, Bergesio F, Ciuti G, Porciani MC, Padeletti L, Moggi Pignone A, (2013). Cardiac amyloidosis: the heart of the matter.
Intern Emerg Med, 8(3), 191–203.
10. Yamamoto H, Yokochi T, (2019). Transthyretin cardiac amyloidosis: an update on diagnosis and treatment. ESC Heart Failure, 6(6), 1128–39. 11. Gillmore JD, Maurer MS, Falk RH, Merlini G, Damy T, Dispenzieri A,
Wechalekar AD, Berk JL, Quarta CC, Grogan M, Lachmann HJ, Bokhari S, Castano A, Dorbala S, Hohnson GB, Glaudemans AW, Rezk T, Fontana M, Palladini G, Milani P, Guidalotti PL, Flatman K, Lane T, Vonberg FW, Whelan CJ, Moon JC, Ruberg FL, Miller EJ, Hutt DF,
Hazenberg BP, Rapezzi C, Hawkins PN, (2016). Nonbiopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation, 133(24), 2404–12. 12. Dorbala S, Ando Y, Bokhari S, Dispenzieri A, Falk RH, Ferrari VA,
Fontana M, Gheysens O, Gillmore JD, Flaudermans AWJM, Hanna MA, Hazenber BPC, Kristen AV, Kwong RY, Maurer MS, Merlini G, Miller EJ, Moon JC, Murthy VL, Quarta CC, Rapezzi C, Ruberg FL, Shah SJ, Slart RHJA, Verberne HJ, Bourque JM, (2019).
ASNC/AHA/ASE/EANM/HFSA/ISA/SCMR/SNMMI expert consensus recommendations for multimodality imaging in cardiac amyloidosis: Part 2 of 2—Diagnostic criteria and appropriate utilization. J Nucl Cardiol, 25(11), 854-865.
13. Desport E, Bridoux F, Sirac C, Delbes S, Bender S, Fernandez B, Quellard N, Lacombe C, Goujon JM, Lavergne D, Abraham J, Touchard G,
Fermand JP, Jaccard (2012). Al amyloidosis. Orphanet J Rare Dis, 7 (54). 14. Bokhari S, Shahzad R, Castano A, Maurer MS, (2014). Nuclear imaging
modalities for cardiac amyloidosis. J Nucl Cardiol, 21(1), 175-184. 15. Maurer MS, Schwartz JH, Gundapaneni B, Elliott PM, Merlini G,
Waddington-Cruz M, Kristen AV, Grogan M, Witteles R, Damy T, Drachman BM, Shah SJ, Hanna M, Judge DP, Barsdorf AI, Huber P, Patterson TA, Riley S, Schumacher J, Stewart M, Sultan MB, Rapezzi C, (2018). Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med, 379(11), 1007-1016.
16. FASS, (2019) Vyndaqel. >http://www.fass.se<HTML (2020-02-01) 17. FASS, (2019) Tegsedi. >http://www.fass.se<HTML (2020-02-01) 18. Moral F, Sanchez-Lajusticia A, Gomez-Bueno M, Garcia-Pavia P,
Salas-Anton C, Segovia-Cubero J, (2012). Role of Cardiac Scintigraphy with
99mTc-DPD in the differentiation of Cardiac Amyloidosis Subtype. Rev
Esp Cardiol, 65(5), 440-446.
19. Bhambhvani P, Hage FG, (2018). Nuclear imaging of cardiac amyloidosis, 'We've only just begun'. J Nucl Cardiol, 25(1), 191-194.
20. Bokhari S, Castano A, Pozniakoff T, Deslisle S, Latif F, Maurer MS, (2013). 99mTc-pyrophosphate scintigraphy for differentiating light-chain cardiac amyloidosis from the transthyretin-related familial and senile cardiac amyloidoses. Circulation, Cardiovasc Imaging, 6(2), 195-201. 21. Berglund E, Jönsson BA, (2007) Medicinsk fysik. Lund, Studentlitteratur. 22. Strålsäkerhetsmyndigheten, (2018) SSMF 2018:5
Strålsäkerhetsmyndighetens föreskrifter och allmänna råd om medicinska exponeringar. >http://www.stralsakerhetsmyndigheten <HTML
(2020-02-22)
imputation on interferences about population means when data are missing in biomedical research due to detection limits. Shanghai Arch Psychiatry, 27(5), 319-325.
24. Bring J, Taube A, Wikman P, (2015) Introduktion till medicinsk statistik. Studentlitteratur AB.
25. Bland J M, Altman D G, (1999). Measuring agreement in method
comparison studies. Statistical methods in medical research, 8(2), 135-60. 26. Pereira JM, Stabin MG, Lima FR, Guimaraes MI, Forrester JW, (2010).
Image quantification for radiation dose calculations-limitations and uncertainties. Health Physics, 99(5), 688-701.
27. Strålsäkerhetsmyndigheten, (2018) Vägledning med bakgrund och motiv
till Strålsäkerhetsmyndighetens föreskrifter (SSMFS 2018:5) och allmänna råd om medicinska exponeringar. >http://www.stralsakerhetsmyndigheten
<HTML (2020-03-15)
28. Gimelli A, Achenbach S, Buechel RR, Edvardsen T, Francone M, Gaemperli O, Hacker M, Hyafil F, Kaufmann PA, Lancellotti P, Nieman K, Pontone G, Pugliese F, Verberne HJ, Gutberlet M, Bax JJ, Neglia D, (2018). Strategies for radiation dose reduction in nuclear cardiology and cardiac computed tomography imaging: a report from the European Association of Cardiovascular Imaging (EACVI), the Cardiovascular Committee of European Association of Nuclear Medicine (EANM), and the European Society of Cardiovascular Radiology (ESCR). European
Heart Journal, 39(2), 286-296.
29. Strauss HW, Miller DD, Wittry MD, Cerqueira MD, Carcia EV,
Iskandrian AS, Schelbert HR, Wackers FJ, Balon HR, Land O, Machac J, (2008). Procedure guideline for myocardial perfusion imaging 3.3. J Nucl
BILAGA 1
Resultat från gradering av hjärtamyloidos, visuell bedömning samt kvoten mellan upptag av radiofarmaka i hjärtat (H) och dess kontralaterala område (CL) för anteriort, posteriort. Resultat från manuella respektive cirkulära ROI (region-of-interest) hos patienter med upptag grad 3. Geometriskt medelvärde, volym of interest (VOI) och aktivitet per kilogram.
Grad av hjärtamyloidos Svar från visuell bedömning H/CL anteriort H/CL posteriort H/CL för manuella ROI H/CL för cirkulära ROI Geometriskt medelvärde planart (counts) VOI i SPECT/CT (counts) Aktivitet/kilogram 0 Frisk 0,8 1,0 - - 22 694 - 5,9 0 Frisk 1,0 1,0 - - 35 863 - 5,4 0 Frisk 0,8 0,9 - - 23 807 - 6,7 0 Frisk 1,0 1,0 - - 23 303 - 7,5 0 Frisk 0,8 0,9 - - 45 554 - 8,8 3 Hög sannolikhet för ATTR-amyloidos 3,6 2,6 3,6 3,6 229 112 509 7,2 3 Hög sannolikhet för ATTR-amyloidos 2,6 2,0 2,6 2,6 250 094 545 - 0 Frisk 1,0 1,0 - - 34 916 - 11,4 0 Frisk 0,9 1,1 - - 52 846 - 7,1 0 Frisk 1,0 1,1 - - 26 479 - 7,1 3 Hög sannolikhet för ATTR-amyloidos 4,9 2,0 4,9 5,3 220 963 472 - 0 Frisk 1,0 1,1 - - 41 339 - 8,9 3 Hög sannolikhet för ATTR-amyloidos 3,2 2,1 3,2 3,2 132 908 408 8,1 0 Frisk 1,0 1,0 - - 25 551 - 5,9 3 Hög sannolikhet för ATTR-amyloidos 2,0 1,5 2,0 2,0 72 584 423 - 3 Hög sannolikhet för ATTR-amyloidos 1,4 1,1 1,4 1,4 56 792 258 8,9
3 Hög sannolikhet för ATTR-amyloidos 2,3 1,5 2,3 2,3 41 948 Ingen SPECT/CT tagen 6,7
![Figur 1. Hjärtamyloidos scintigrafi vid gradering 0 till 3 [6].](https://thumb-eu.123doks.com/thumbv2/5dokorg/3973711.78009/7.892.155.569.816.1152/figur-hjärtamyloidos-scintigrafi-gradering.webp)