Går det att hitta ett
provtagningsmaterial för att
påvisa dysbiosis i den
subgingivala biofilmen?
- In vitro och in vivo
Tina Honnér
Hannah Ingman
Handledare:
Gunnel Svensäter
Bertil Kinnby
Examensarbete 30 hp
Malmö universitet
Tandläkarprogrammet
Odontologiska fakulteten
Sammanfattning
Bakgrund/syfte: I Sverige drabbas cirka 7-10 % av befolkningen av allvarlig parodontit med
risk att förlora sina tänder. Den riskbedömning som används idag leder till att många individer överbehandlas, medan andra inte får den behandling som krävs. Tandvården behöver därför nya effektiva verktyg för att identifiera patienter med ökad risk för allvarlig parodontal sjukdom. Syftet med studien var att hitta en provtagningsteknik som kan användas för att undersöka samband mellan proteiner och bakterier i den subgingivala biofilmen.
Metod: För att hitta lämplig provtagningsteknik undersöktes tre olika membran,
polyvinylidenfluoridmembran (PVDF), polytetrafluoretenmembran (PTFE) och skydds-pappret som fanns mellan polyvinylidenfluoridmembranen i förpackningen. Studien undersökte membranens förmåga att adsorbera bakterier, absorbera proteiner och möjligheten att eluera ut proteiner för analys. Undersökningen skedde in vitro och konfirmerades sedan in
vivo.
Resultat: Samtliga membran kunde adsorbera bakterier och absorbera proteiner in vitro. Det
var möjligt att eluera ut proteiner för analys. Kliniskt var PTFE mer lätthanterligt då det var mer stabilt. De patologiska proverna visade stark proteolytisk aktivitet och stor bakterie-mängd.
Slutsats: Studien visade att PTFE kan användas kliniskt för att påvisa parodontitassocierade
bakterier, cellbundna proteaser och analysera proteinsammansättning från den subgingivala biofilmen. Ytterligare studier krävs där patienter följs under en längre tid. Kan biomarkörer påvisas för sjukdomsutveckling kan detta bidra till utveckling av att nya diagnostiska metoder och riskmarkörer. På så sätt kan vården fokusera på rätt individer, vilket ger en etisk och ekonomisk fördel ur både ett samhällsperspektiv, och på individnivå.
Abstract
Background/aims: In Sweden, about 7-10 % of people suffers from severe periodontitis with
the risk of losing their teeth. With the risk assessment tools available today, many individuals are over-treated while others do not receive the right treatment. Oral healthcare is therefore in need of tools to identify patients with increased risk of severe periodontal diseases. The aim of this study was to find a sampling technique to investigate the relationship between proteins and bacteria in subgingival biofilms.
Method: Three membranes were examined, polyvinylidene fluoride membrane (PVDF),
polytetrafluoroethylene membrane (PTFE) and the protective membrane between the polyvinylidene fluoride membranes in the package. The study investigated their ability to adsorb bacteria, absorb proteins and the possibility to elute proteins for analysis. The study was conducted in vitro and confirmed in vivo.
Results: All membranes could adsorb bacteria and absorb proteins in vitro, and it was
possible to elute proteins. Clinically, the PTFE was more manageable, as it was more stable. The pathological samples showed strong proteolytic activity and a great amount of bacteria.
Conclusion: The study showed that PTFE could be used clinically to detect periodontal
associated bacteria, cell-bound proteases, and analyse protein composition from the subgingival biofilm. Further studies are required. If biomarkers can be detected for disease, this may contribute to the development of new diagnostic methods and risk markers. In this way, resources can be focused on those most in need, which gives an ethical and economic benefit from both a social perspective, and at the individual level.
Innehållsförteckning
Inledning ... 5 Förekomst av parodontala sjukdomar ... 5 Gingivit och parodontit ... 5 Mukosit och peri-implantit ... 5 Vävnader kring tänder och tandimplantat ... 6 Kolonisering av bakterier runt tänder och tandimplantat ... 6 Det inflammatoriska svaret runt tänder och tandimplantat ... 7 Sjukdomarnas etiologi ... 9 Dysbiosis i den orala miljön ... 9 Virulens ... 10 Ökad risk för parodontal sjukdom ... 11 Syfte ... 11 Frågeställningar ... 12 Hypotes ... 12 Studiedesign ... 12Material och metod ... 13
Bakteriestammar ... 13 Multibakteriellt konsortium ... 13 Visualisering av bakterier ... 14 Live/Dead® BacLight™ Bacterial Viability Kit ... 14 Fluorescense In Situ Hybridisation ... 14 Bestämning av proteolytisk aktivitet ... 14 Två-dimensionell gelelektrofores ... 15 Klinisk provtagning och mikrobiologisk analys ... 15 Resultat ... 17 Multibakteriellt konsortium in vitro ... 17 Visualisering av bakterier ... 17 Analys av proteasaktivitet ... 18 Analys av proteinsammansättning ... 19 Multibakteriellt konsortium in vivo ... 19 Provtagning ... 19 Visualisering av bakterier ... 20 Analys av proteasaktivitet ... 20 Diskussion ... 22 Studiedesign ... 22 Dysbiosis vid parodontal sjukdom ... 22 Potentiella biomarkörer för parodontal sjukdom ... 23 Provtagningsmetoder för dysbiosis vid parodontal sjukdom ... 23 Analysmetoder för dysbiosis vid parodontal sjukdom ... 24 Fluorescense In Situ Hybridisering ... 24 FITC-casein ... 24 Analys av extracellulära proteiner med två-dimensionell gelelektrofores ... 25 Felkällor och resultatens tillförlitlighet ... 25 Slutsats ... 26 Tack till ... 26 Referenser ... 27
Inledning
Förekomst av parodontala sjukdomar
Gingivit och parodontit
Gingivit (tandköttsinflammation) och parodontit (tandlossning) är de vanligaste parodontala sjukdomarna. Gingivit är en reversibel, mildare inflammation som förekommer hos 90 % av Sveriges befolkning. Vid parodontit är en stor del av mjukvävnaden inflammerad och benvävnaden bryts ner som en del av inflammationsprocessen(1). Det uppskattas att över 500 miljoner av världens befolkning har allvarlig parodontit, vilket motsvarar cirka 7,4 %.(2) Detta överensstämmer med prevalensen för Sveriges befolkning, där 7-10 % drabbas av allvarlig parodontit. Allvarlig parodontit innebär förlust av benvävnad som är större än 2/3 av tandrotens längd. Parodontit föregås alltid av gingivit, men gingivit ger inte alltid upphov till parodontit. Som kan utläsas i figur 1, drabbas en stor del av befolkningen av gingivit och även av en mindre benvävnadsförlust. Betydligt färre individer utvecklar ett allvarligare tillstånd. Inflammationen vid de båda tillstånden initieras och underhålls av en polymikrobiell biofilm som koloniserar tand och tandköttsficka(1).
Mukosit och peri-implantit
Ersättning av förlorade tänder med tandimplantat blir en allt vanligare behandling. Studier visar en hög lyckandefrekvens som utvärderats efter 10 år. Detta bidrar till att många anser behandlingen som ett bra alternativ. Trots den höga lyckandefrekvensen förekommer peri-implantära sjukdomar hos ett stort antal individer(3). Peri-peri-implantära förändringar kan delas in i mukosit och peri-implantit. Mukosit är en reversibel inflammation i mjukvävnaden kring ett tandimplantat utan någon involvering av benvävnaden, medan peri-implantit inkluderar en förlust av tandimplantatets stödjande benvävnad. Idag råder det ingen konsensus angående definitionen för peri-implantit och dess diagnostik. Detta medför att prevalensen för tillståndet har stor spridning i olika studier, från 6,5 % till 36,6 % av inopererade tandimplantat(4).
Dental biofilm
Blödning vid sondering vid fler än 12 tandytor Benvävnadsförlust vid någon tandyta
Benvävnadsförlust
omfattande mer än 2/3 av rot-längden vid flertalet tänder Enstaka tandförluster
Tandlöshet
Figur 1. Förekomst av parodontala tillstånd för individer i 50-års ålder,
baserade på studier med regionalt urval i Sverige(1). Illustrationen är modifierad efter figur 1.2 i SBU:s rapport ”Kronisk parodontit – prevention, diagnostik och behandling”.
Vävnader kring tänder och tandimplantat
Det finns både likheter och skillnader mellan mjukvävnadsuppbyggnaden kring tandimplantat och tänder, se figur 2. Ytan täcks i båda fallen av ett keratiniserat epitel. Tandköttsfickan omges av ett kontaktepitel under fickepitelet. Kontaktepitelets mest apikala del är i kontakt med tandens rotyta och avgränsar därigenom den bakteriella biofilmens möjlighet till utbredning. Kring implantatet finns istället ett tunt barriärepitel under fickepitelet. Barriär-epitelet liknar tandens kontaktepitel och sträcker sig, liksom kontaktBarriär-epitelet, cirka 2 mm apikalt från mjukvävnadsgränsen. Mellan epitelet och benet finns en bindvävszon på 1-1,5 mm som har direkt kontakt med tandimplantatet respektive tanden. Kollagenfibrerna runt tandimplantatet går från periostet parallellt med implantatet, till skillnad från runt en tand där de går ut från tanden. Trots skillnaderna är mjukvävnaden runt implantat fenotypiskt oskiljbar från den runt tanden och därmed funktionellt anpassad för att fungera som en god barriär(5,6).
Kolonisering av bakterier runt tänder och tandimplantat
Den orala miljön innefattar en av de mest komplexa mikrobiella sammansättningarna i kroppen, där det sker en kolonisering av över 700 bakteriearter. Biofilmen utgör en heterogen mikrobiell miljö, som är stabil vid hälsa. Balansen i biofilmen upprätthålls av värdens försvar och normalfloran. Mikroberna i normalfloran utgör en viktig del för god oral hälsa, bland annat genom att fungera som ett motstånd mot kolonisering av patogener. Balansen mellan de koloniserande bakterierna bidrar till att upprätthålla ett friskt tillstånd i symbios. Denna balans kan rubbas genom olika biologiska förändringar och ett tillstånd associerat med sjukdom kan utvecklas(7).
I sjukdomsförloppet är interaktionen mellan olika bakterier väsentligare än en specifik patogen(8). I den polymikrobiella biofilmen förekommer synergistiska interaktioner mellan bakterier, såsom molekylär signalering, metaboliskt utbyte och cell-till-cell-kontakt. Detta kan ge bakterierna en ökad virulens och en ökad tolerans mot försvaret(9).
Som ett första stadium i biofilmsbildningen skapas en pellikel på tandens yta från komponent-er i saliven (exempelvis proteinkomponent-er, lipidkomponent-er och glykoproteinkomponent-er). På liknande sätt skapas en pellikel på titanytan på tandimplantat(10). Denna skiljer sig från pellikeln som skapas kring tanden, men studier har visat att detta inte påverkar biofilmens bildning och samman-sättning(6). Tidiga bakteriekolonisatörer adhererar till ytan genom interaktioner med saliv-proteiner i pellikeln. De tidiga kolonisatörerna är framför allt fakultativt anaeroba, gram-positiva bakterier, exempelvis Actinomyces naeslundii, Streptococcus gordonii och
Strepto-Figur 2. Modifierad illustration som visar likheter och skillnader mellan
mjukvävnads-uppbyggnaden kring tänder och tandimplantat (6,44).
Sulcusepitel Barriärepitel ca 2 mm Bindvävnadsfastsättning ca 1-1,5 mm Alveolarben Sulcusepitel Kontaktepitel ca 2 mm Bindvävnadsfastsättning ca 1-1,5 mm Alveolarben TAND TANDIMPLANTAT
coccus oralis. Dessa tidiga kolonisatörer förändrar miljön och möjliggör även vidare
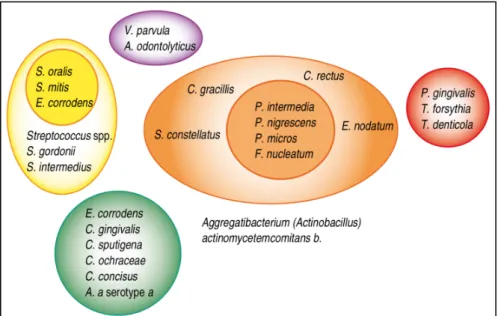
kolonisering genom ko-aggregation till senare kolonisatörer(10). En supragingival biofilm har etablerats. Den supragingivala biofilmssammansättningen skiljer sig inte nämnvärt mellan tänder och tandimplantat vid friska tillstånd. Sammansättningen vid mukosit är i stora drag samma som vid gingivit och likaså värdens försvar mot bakteriernas angrepp(5,10,11). Båda tillstånden representeras av ett vävnadssvar mot en bakteriell belastning. När sjukdomen fort-skrider utvecklas en subgingival biofilm. Biofilmssammansättningen vid peri-implantit och parodontit är liknande och innehåller vanligen en stor mängd anaeroba gramnegativa bakterier från det så kallade röda komplexet, se figur 3, exempelvis Treponema denticola,
Porphyro-monas gingivalis och Tannerella forsythia. Dessa bakterier föregås ofta av bakterier från det
orange komplexet, som ofta även ses vid både parodontit och peri-implantit. Exempel på dessa bakterier är Prevotella intermedia och Fusobacterium nucleatum(10,11).
Det inflammatoriska svaret runt tänder och tandimplantat
Det inflammatoriska svaret runt tänder och tandimplantat fungerar likartat. I båda fallen sker tidigt ett uttryck av inflammationsmediatorer. Signalering för rekrytering av leukocyter följer samma mönster vid båda tillstånden genom att olika vaskulära celladhesionsmolekyler i gingivans och mukosans kapillärer uttrycks för transmigration från kärlen(5).
Det finns likheter mellan parodontit och peri-implantit, som biofilmssammansättning och det tidiga inflammationssvaret. Det finns dock skillnader mellan de båda tillstånden, framför allt i tillståndens utbrott och progression. Dessa skillnader kan förklaras med histologiska olikheter(12). Djurstudier har visat att inflammationen vid peri-implantit vanligen är mer omfattande än vid parodontit, innehåller större mängd osteoklaster och breder ut sig närmre alveolarbenet. Histologiska snitt från patienter med kliniskt dokumenterad peri-implantit respektive parodontit visade att inflammationen vid peri-implantit var dubbelt så omfattande som vid parodontit. De histologiska snitten visade även att mängden plasmaceller, makrofager och polymorfkärniga celler (PMN-celler) var signifikant högre. Inflammationsmediatorer,
Figur 3. Indelning av orala bakterier i komplex utifrån dess förhållande till
värden vid oral hälsa och sjukdom. Bakterier i det gula, lila och gröna komplexet associeras med friska tillstånd. Det röda komplexet innefattar bakterier som framförallt ses i djupa parodontala tandköttsfickor, dessa föregås vanligen av bakterier i det orange komplexet (45).
såsom interleukin 6 (IL-6), IL-8 och tumörnekrosfaktor-alfa (TNF-α), förekommer i större mängd vid peri-implantit än vid parodontit. Dessa sammanlagda skillnader tyder på att inflammationssvaret är kraftigare vid peri-implantit än vid parodontit, både med hänsyn till det specifika och ospecifika immunförsvaret(12).
Vid parodontit finns, till skillnad från vid peri-implantit, en opåverkad bindvävnadszon mellan inflammationen och den alveolära benvävnaden. Vid parodontit finns även ett fickepitel som separerar bindväven från biofilmen i tandköttsfickan(13). Vid peri-implantit saknar den apikala tredjedelen av fickan epiteltäckning, vilket resulterar i en öppen såryta mellan biofilmen och inflammationen i bindvävnad(6). Dessa skillnader kan bidra till de histologiska skillnader som konstaterats och förklara de högre mängderna av PMN-celler och plasmaceller vid peri-implantit(13).
När bakterier och deras produkter påverkar vävnaden svarar kroppen med ett initialt, ospecifikt, immunsvar. Ökad permeabilitet av kärlen och kärltillväxt tillåter komponenter från kroppens immunsystem att nå platsen. Målet med kroppens initiala immunsvar är att bekämpa och eliminera mikroberna genom att uppreglera försvaret. Detta sker genom att aktivera komplementsystemet, attrahera neutrofiler och utsöndra proinflammatoriska cytokiner som IL-1, IL-6, IL-8 och TNF. PMN-cellerna ingår i det initiala immunsvaret och är tidigt på plats vid det infekterade området(8). Vid parodontit sker en ökad PMN-cellsaktivering. En hyper-aktivering av PMN-cellerna leder till ökad utsöndring av fria syreradikaler och proteolytiska enzymer vilket bidrar till vävnadsnedbrytning. Aktiverade PMN-celler utsöndrar proteaser som till exempel elastas. Vid peri-implantit ses en högre elastase- och laktoferrinaktivitet jämfört med vid friska tillstånd. Dessa proteaser är exempel på biomarkörer för inflammation. Proteaser som myeloperoxidas och β-glucuronidas har även identifieras i vävnader vid peri-implantit(14).
Den initiala reaktionen stimulerar ett specifikt immunsvar där B-celler, T-celler och anti-kroppar aktiveras(8). Det specifika immunförsvaret aktiveras genom att antigener från biofilmen penetrerar kontaktepitelet till bindväven. I bindväven finns antigenpresenterande celler, exempelvis Langerhansceller och makrofager, som transporterar antigenerna vidare till lymfan. och B-celler aktiveras av antigenet genom samspelande reaktioner. Cytotoxiska T-celler tar sig ut i vävnaden. B-T-celler aktiveras till antikroppsproducerande plasmaT-celler (15). När inflammationen fortgår påverkas även benvävnadscellerna till en obalans vilket leder till benvävnadsnedbrytning. T-celler utsöndrar cytokiner, som t.ex. IL-1 och TNF-α. När inflammationen närmar sig benet signalerar dessa cytokiner till osteoblaster att bryta ned osteoiden och uttrycka RANKL (ligand) på sin yta. RANKL binder till receptorn RANK på pre-osteoklaster som aktiveras till osteoklaster. Osteoklasten fäster på det mineraliserade benet och skapar ett slutet rum där de utsöndrar bland annat enzymer som leder till ned-brytning av benet (16). Koncentrationerna av RANKL och RANK är högre vid peri-implantit och parodontit. RANK är signifikant associerad till peri-implantit, i jämförelse med parodontit, vilket kan visa på en skillnad i patogenesen av bennedbrytningen vid de olika tillstånden (17).
Idag saknas evidens om det är ett fåtal biomarkörer som är avgörande och som kan peka ut sjukdomarna peri-implantit och parodontit. Men som nämnts ovan, har det identifierats ett antal som associeras med peri-implantit och parodontit.
Sjukdomarnas etiologi
En plackansamling längs tanden initierar en inflammationsreaktion i gingivan. Detta leder till en ökad mängd proteinrik plackvätska i tandköttsfickan. Proteolytiska bakterier främjas av den förändrade miljön vilket ger upphov till en nedbrytande inflammationsprocess med benvävnadsförlust. Detta kan i allvarliga fall leda till förlust av tänder och tandimplantat(8). Mikrober som ses vid parodontal sjukdom kan även förekomma vid friska tillstånd. Detta visar på att sjukdomens etiologi även beror på andra mekanismer, såsom värdens inflammationssvar i form av inflammationsmediatorer(10). Relationen mellan bakterier och värden är dynamisk och påverkas av olika faktorer, såsom kost, hormoner, tobak och stress. Faktorerna bidrar till att biofilmen och dess egenskaper kan förändras(7).
Idag råder en viss oenighet kring etiologin bakom peri-implantära sjukdomar. Det har ifrågasatts huruvida peri-implantit är en bakteriellt inducerad sjukdom eller om förlust av benvävnad runt implantatet är ett resultat från en främmandekroppsreaktion (18). En främmandekroppsreaktion kan uppkomma då material kommer i kontakt med levande vävnad, vilket kan utlösa ett immunsvar (19). Efter att implantatet har installerats uppstår en inflammationsprocess, som kan bero på en främmandekroppsreaktion enligt vissa teorier (20). Studier har visat att metallpartiklar och metalljoner kan inducera ett immunsvar (18). Detta leder till att implantatet antingen osseointegrerar eller inkapslas i bindväv, vilket leder till att implantatinstallationen misslyckas (20).
Dysbiosis i den orala miljön
Den orala miljön utgörs av en varierande polymikrobiell flora vars sammansättning är beroende av lokala faktorer (21). Vissa parodontit-associerade bakterier som finns närvarande vid parodontit/peri-implantit kan även ses vid friska ytor, men i lågt antal. Får biofilmen växa orört kan en obalans skapas där värden svarar med en inflammation. Detta gör att mängden gingivalexudat ökar och därmed tillgången av proteiner och glykoproteiner vilket resulterar i en proteinrik miljö (22). Den bakteriella tillväxten främjas av den ökade näringstillgången från gingivalvätskan, där olika bakteriearter gynnas beroende på var i tandköttsfickan de förekommer (21). I djupare tandköttsfickor gynnas tillväxt av proteolytiska, anaeroba gramnegativa bakterier eftersom de vanligen använder proteiner som näringskälla och trivs i en syrefattig miljö(10). Detta främjar tillväxt av bakterier som ofta associeras till det röda komplexet (23). Skiftet i miljön leder till en obalans i biofilmen, vilket kallas dysbiosis(10). Vid parodontit råder en dysbiosis med en ökad mångfald i den subgingivala biofilmen (24). Anledningen kan vara en immundysfunktion där proliferation av bakteriearter som normalt kontrolleras av värdens försvar tillåts. Även bakterierna i sig kan påverka immunförsvaret, exempelvis kan P. gingivalis inhibera IL-8 och på så sätt minska effektiviteten av immun-svaret (21). Vid en ökad tillgång av hemin från gingivalexudatet blir P. gingivalis mer proteolytisk, och ökar bland annat produktionen av gingipainer. Detta gör att P. gingivalis blir mer konkurrenskraftig (23).
Vid dysbiosis kan bakterier som främjar hälsa minska och patologiska bakterier öka. Den orala miljön och synergin till andra bakterier kan avgöra om bakterier associeras med friska eller sjuka tillstånd. Biofilmen bör ses i sin helhet för att avgöra om dysbiosis råder. Specifika bakterier kan dock spela roll och påverka miljön, där till exempel anrikning av P. gingivalis kan göra att en biofilm uppnår dysbiosis (21).
F. nucleatum är viktig för biofilmens etiologi och sammansättning vid parodontal sjukdom.
Vid dysbiosis ökar den i antal och kan bidra till ett ökat inflammationssvar genom uppreglering av proinflammatoriska cytokiner. F. nucleatum bidrar även till gynnsamma förhållanden för anaeroba bakterier som P. gingivalis och P. intermedia genom att till exempel utsöndra serinproteaser. Dessa proteaser bidrar till ökad näringstillgång och ökad patogenicitet hos anaeroba bakterier. F. nucleatum aktiverar epitelceller till att utsöndra metallomatrixproteaser (MMP) som bidrar till nedbrytning av vävnaden (25).
Virulens
Virulensfaktorer främjar sjukdomsprocessen genom att öka bakteriernas motståndskraft mot kroppens försvar. Bakterierna får då en dominerande roll i biofilmen. Bakteriernas virulensfaktorer bidrar även till kolonisering och adhesion till orala ytor samt ökat näringsintag och vävnadsdestruktion (26). Bakterierna uttrycker virulensfaktorer för att skapa en gynnsam miljö. Uttrycket är beroende av omgivningen, där bland annat pH-värde och näringstillgång är viktigt för bakteriernas tillväxt. Bakterier kan ha olika virulensfaktorer som gör att de kan invadera kroppens vävnader. Vissa bakterier kan skada epitelceller, medan andra kan utsöndra toxiner som diffunderar genom epitel till bindväv och orsaka skada på underliggande vävnad(8).
Man har i studier sett att receptorerna toll like receptor 2 (TLR 2) och protease-activated receptor 1 (PAR 1) på fibroblaster kan känna igen och svara på P. gingivalis genom att frisätta CXCL8 och IL-6. Fibroblasterna är en av mest förekommande celltyperna i tandköttet. CXCL8 och IL-6 bidrar till en nedbrytning av tandens stödjevävnad och därför en viktig faktor i utveckling av parodontit (27).
Proteasaktivitet hos bakterier är en viktig virulensfaktor. En hög proteasaktivitet i tandköttsfickan avspeglar ett skifte av både biofilmens genotyp och fenotyp. Aktiviteten möjliggör ökad näring till bakterier genom att bryta ner vävnad och förse bakterier med peptider, aminosyror och hemin(28). I biofilmer vid peri-implantit finns en högre proteas-aktivitet jämfört med biofilmer vid friska ytor. Proteasproteas-aktiviteten behöver inte relateras till en specifik bakterie utan snarare associeras med en förändrad sammansättning av biofilmen. Proteasaktiviteten kan vara en prediktor för framtida progression av sjukdom(10). Både proteaser från kroppsegna celler (till exempel kollagenaser, MMPs, hyaluronidase) och olika enzymer från bakterier (till exempel trypsinlika proteaser som gingipains R och G) kan bryta ner kollagen och andra vävnadsproteiner och kan därmed bidra till sjukdomsprogressionen (29). Trypsinlika proteaser frisätts av parodontala patogener som P. gingivalis och Treponema
denticola(28). De mest studerade är gingipains som utsöndras av P. gingivalis. Gingipains
orsakar en nedbrytning av extracellulära vävnadskomponenter, aktiverar värdens MMPs och inhiberar komplementfaktorer(10). Gingipainerna kan även aktivera koagulationskaskaden och kallikrein/kinin-systemet, vilket leder till en ökad inflammation och ökad näringstillgång för bakterierna(30).
Flertalet av de gramnegativa bakterierna har lipopolysackarider (LPS) i cellmembranen, exempelvis P. gingivalis, F. nucleatum och A. actinomycetemcomitans(31-33). LPS är en beståndsdel i det yttre membranet på gramnegativa bakterier och ses som ett endotoxin. LPS främjar utsöndringen av proinflammatoriska mediatorer som relateras till parodontal sjuk-dom(33). När bakterier dör frisätts LPS, men bakterier kan även frisätta LPS under tillväxten. LPS kan ge upphov till många patologiska tillstånd hos värden där närvaron ger högre uttryck av proinflammatoriska mediatorer såsom PGE2, TNF- α och IL-1β(34). LPS påverkar även
bennedbrytning genom att hämma osteoblasternas differentiering(33). Bakterier och fritt LPS kan nå cirkulationen genom bakteriemi och inducera ökat inflammationssvar i kärlväggar(34).
Ökad risk för parodontal sjukdom
För att identifiera individer med ökad risk för parodontit och peri-implantit används vid den kliniska riskbedömningen en rad riskfaktorer som till exempel, rökning, diabetes och blödning vid sondering av tandköttsfickor. En patient som tidigare drabbats av parodontit anses ha en förhöjd risk att utveckla peri-implantit(11).
En bakteriell biofilm är nödvändig för att en parodontal sjukdom ska utvecklas. Men endast biofilmen i sig är sällan tillräcklig för att sjukdom ska uppstå. Riskfaktorer kan förändra individens mottaglighet och försvar mot sjukdom. Riskfaktorer för parodontal sjukdom kan vara lokala eller systemiska. Systemiska faktorer kan till exempel vara rökning, dåligt kontrollerad diabetes mellitus och livsstil. Dessa faktorer kan individen själv påverka. Andra faktorer, så som genetik och etnicitet, är däremot icke-påverkbara(35). Det finns ett stort antal riskfaktorer för parodontal sjukdom. Ingen av faktorerna som kan prediktera framtida risk är i dagsläget värderad och utvärderad prospektivt under tillräckligt lång tid för att kunna få helt tillförlitliga resultat(36).
För att uppskatta den individuella risken för utveckling och progression av parodontal sjukdom kan man utgå från en riskbedömning. Riskbedömningen utgörs av fler faktorer, så som blödning vid sondering, graden av fästeförlust i förhållande till patientens ålder, tand-förlust, förekomst av kvarstående parodontala tandköttsfickor, patientens allmänhälsa, samt miljö och livsstilsfaktorer. Alla dessa faktorer bör tas i beaktning och sammanvägas i risk-bedömningen(37).
Utöver riskfaktorerna nämnda ovan finns ytterligare specifika faktorer som kan bidra till och förvärra den marginala benvävnadsnedbrytningen kring implantat. Dessa är relaterade till implantatets egenskaper, protetiska konstruktionen och det kliniska handhavandet under behandlingen (18).
Syfte
Idag saknar tandvården tydliga kliniska verktyg för att prediktera parodontit och peri-implantit och identifiera patienter med ökad risk för sjukdomarna. Kan riskpatienter identifieras skulle behandlingen kunna individanpassas för att förhindra sjukdomsutveckling, vilket gör vården kostnadseffektiv för samhället.
Det finns idag provtagningsmetoder för att enskilt undersöka proteinsammansättning respektive bakteriell förekomst i tandköttsfickor kring tänder och tandimplantat. Dock finns det ingen metod där båda delarna kan analyseras med samma provtagning. Därför är det av intresse att utprova en teknik som kan analysera bakterier, proteinmönster och proteasaktivitet från en och samma tandköttsficka med en och samma provtagningsmetod. Detta för att kunna identifiera riskmarkörer för parodontal sjukdom och hitta ett samband som i längden kan bidra till att hitta nya kliniska verktyg så patienterna identifieras i ett tidigt stadie.
Syftet med studien är att hitta en provtagningsteknik som kan användas för att undersöka samband mellan proteiner/bakterier i den subgingivala biofilmen.
Frågeställningar
- Är det möjligt att utveckla en provtagningsmetod som kan påvisa parodontitassocierade bakterier in vitro och in vivo? Kan samma teknik användas för att analysera cellbundna bakteriella proteaser och specifika proteinmönster från biofilmen?
- Kan den utprovade provtagningsmetoden påvisa möjliga biomarkörer för identifiering av allvarlig parodontal sjukdom?
Hypotes
Vi antar att det är möjligt att undersöka både bakterier, proteasuttryck och proteinsamman-sättning med hjälp av samma provtagningsmaterial och teknik. Detta antagande grundas på preliminära resultat och litteraturstudier. Svårigheten förmodas istället vara det kliniska hand-havandet vid provtagningstekniken i fickor kring tänder och tandimplantat.
Vi antar att den utprovade provtagningsmetoden kan påvisa möjliga biomarkörer för allvarlig parodontal sjukdom. Provtagningsmetoden antas kunna visa på en större mängd och variation av proteaser i de patologiska proverna jämfört med de friska. Detta antagande grundas på att dessa proteolytiska enzymer är drivande för benvävnadsdestruktion vid allvarlig parodontit. Dessa proteaser kan då utgöra möjliga biomarkörer.
Studiedesign
Projektet bestod av en experimentell del och en klinisk del. Den experimentella delen var en laboratoriestudie vars resultat konfirmeras med hjälp av den kliniska studien på patienter. Målet med den experimentella delen är att hitta ett provtagningsmaterial och en teknik för att kunna undersöka protein- och bakteriesammansättningen i fickor kring tänder och implantat som var friska respektive patologiska.
I den kliniska delen användes den utprovade metoden för provtagning i tandköttsfickor på patienter med dokumenterad peri-implantit och/ eller parodontit, för att undersöka om metoden kunde appliceras kliniskt. Denna del av projektet godkändes av den lokala etik-prövningskommittén på Odontologiska fakulteten, Malmö högskola.
Material och metod
Bakteriestammar
Till studien användes fyra olika bakteriearter. Typstam: Streptococcus constellatus NCTC 10714. Kliniska isolat av P. micra, P. gingivalis och F. nucleatum. Dessa bakterier valdes för att få med en så bred bild som möjligt med olika sjukdomsstadier. S. constellatus associeras med den friska orala floran. F. nucleatum är vanligt förekommande vid gingivit. P. gingivalis och P. micra associeras med kronisk parodontit.
Från en djup tandköttsficka togs bakterieprov med papperspoint som överfördes till reducerat transportmedium (RTF) för transport till laboratoriet för oral biologi, Odontologiska fakulteten, Malmö universitet. På laboratoriet överfördes papperspoint till saltlösning (dilution blank) och skakades på en Vortexmixer för att eluera bakterierna. Bakterie-suspensionen späddes 102, 103, 104 gånger i PBS (10 mM kaliumfosfatbuffert pH 7,2 + 0,07 M NaCl [NaCl 70 mM, K2HPO4 7,0 mM, KH2PO4 2,4 mM]) och 50µl från varje spädning
överfördes till Brucella- och blodagar. Med hjälp av sterila glaskulor fördelades bakterie-suspensionen över agarn som sedan inkuberades i anaerob miljö (5 % CO2 i N2 och 10 % H2)
i 37 °C för tillväxt. Efter 7 dagar analyserades bakterietillväxten i stereomikroskop och agar med 30-300 kolonibildande enheter (CFU) valdes för isolering av Parvimonas micra,
Porphyromonas gingivalis och Fusobacterium nucleatum. F. nucleatum identifierades med
hjälp av följande kriterier: kolonier med diameter på 5-7 mm, oregelbundna, platta och skimrande från gul till blå/lila. Gramfärgning visade smala gramnegativa stavar med spetsiga ändar. P. gingivalis: Svartpigmenterade kolonier med metallisk glans på Brucella, indol-positiv, trypsinpositiv och negativ för fluorescens i enzymtester och P. micra: vita kolonier med diameter 3-5 mm, toppiga och med jämn kant. Gramfärgning visade grampositiva små kocker. För renodling och anrikning av dessa bakterier togs enskilda CFU med platinös och ströks ut på nya agarplattor. Isolat från de enskilda bakterierna fördes över med hjälp av platinöser till rör med 10 % skummjölkslösning och förvarades i -80 °C. Bakteriestammarna fick följande namn: Porphyromonas gingivalis SUB1, Fusobacterium nucleatum BK:0,
Parvimonas micra JN.
Multibakteriellt konsortium
Inför försök med multibakteriella konsortier tinades bakterieisolaten och odlades ut på reducerad Brucella-agar respektive prereducerad blodagar. Samtliga plattor inkuberades anaerobt i 37 °C och placerades i plastpåsar för att förhindra uttorkning. Dessa inkuberades tills en bra tillväxt uppnåtts. Efter inkubering analyserades plattorna i mikroskop för att säker-ställa att de inte kontaminerats. Bakteriekolonier av P. micra, P. gingivalis, S. constellatus och F. nucleatum ingick i konsortiet. 10 x 1µl bakteriekolonier togs upp med platinös och överfördes till 1ml sterilt prereducerat serum (10 %) i H2O. Bakterielösningen
resuspenderades kraftigt med en pipett flera gånger. Lösningen överfördes sedan med pipett till Eppendorfrör. Tre olika typer av membran användes för provtagning av multibakteriell bakteriekultur: polyvinylidenfluoridmembran (PVDF [Millipore Durapore® Membrane Filters, pore size 0,22 µm]), skyddspapper som fanns mellan PVDF i förpackningen och polytetrafluoretenmembran (PTFE [Cytoplast TXT-200 Non-Resorbable PTFE Barrier Membranes]). Membranen applicerades i sin helhet i bakteriekonsortium under 15, 20 respektive 25 sekunder. Membran med prov taget från multibakteriellt konsortium placerades i ibidi cells (ibidi cells in focus, 1µ-Slide 8 Well ibiTreat) för analys av bakterier och för proteolytisk aktivitet samt i Eppendorfrör för proteinanalys.
Visualisering av bakterier
Live/Dead® BacLight™ Bacterial Viability Kit
Live/Dead® BacLight™ Bacterial Viability Kit användes för infärgning av bakterier. Infärgningen avgörs av bakteriens membran, där celler med intakt membran färgas gröna medan döda eller döende bakterier färgas röda.
Infärgningen skedde sedan genom att 1 ml 0,9 % NaCl och 1,5 µl av vardera Live/Dead® BacLight™ överfördes till Eppendorfrör och skakades på vortexmixer. BacLight-lösningen pipetterades sedan över membranet. Ibidi cellerna placerades i mörker under 15 minuter. Bakterieförekomsten noterades sedan med hjälp av konfokalmikroskopi med excitation- och emissionsvåglängder på 488 respektive 565 nm. Samtliga tre membran färgades in med Live/Dead BacLight™ vid fem tillfällen vardera för att öka tillförlitligheten av resultaten.
Fluorescense In Situ Hybridisation
FISH (Fluorescense In Situ Hybridisation) är en teknik där olika fluorescerande DNA-prober binder in till bakteriens ribosomala RNA, som är specifikt för varje bakterieart. Detta gör att specifika bakterier kan identifieras genom att de får olika färg. Vid försöken in vitro användes prober som gav bakterierna följande färger: P. micra: blå, P. gingivalis: röd, S. constellatus: gul och F. nucleatum: grön.
Samtliga tre membran färgades med FISH för att analysera om samtliga fyra bakteriearter från bakteriekonsortiet adsorberats till respektive membran. Infärgningen skedde genom att respektive membran placerades i ibidi cells efter att ha doppats i bakteriesuspension. Membranen fixerades med 200 µl 4 % formaldehyd under 30 minuter i rumstemperatur och tvättades därefter med 200 µl PBS. Bakterierna inkuberades med en lysozymlösning (2mg i 200 µl 1M Tris buffert pH 7,5 med 50 mM EDTA) i 37 °C under 9 minuter för att öka permeabiliteten. Membranen tvättades igen med 200 µl rumstempererat UHQ H2O.
Membranen dehydrerades därefter i olika steg med etanol 50 %, 80 % respektive 99 % under 3 minuter vardera. Avslutningsvis lufttorkades membranen i 10 minuter. Därefter utfördes hybridiseringen, 200 µl probe-lösning (20 µl per probe löst i 520 µl hybridiseringsbuffert) tillsattes och inkuberades i 48 °C under 90 minuter. Därefter avlägsnades obundna prober genom inkubering i tvättbuffert under 15 minuter i 48 °C. Därefter tvättades membranen med 200 µl rumstempererat UHQ H2O. Specifika bakterier kunde därefter identifieras i ett
konfokalmikroskop genom dess fluorescens. Försöken utfördes vid tre tillfällen vardera för samtliga membran.
Bestämning av proteolytisk aktivitet
Bredspektrumproteassubstratet FITC-casein (QuantiCleave Fluorescent Protease Assay kit, Pierce, Rockford, IL, USA), som enligt tillverkaren klyvs av serin-, cystein- och metallo-proteaser, användes för att mäta den kvantitativa proteasaktiviteten som uttryckts från bakterierna i provet.
Samtliga tre membran behandlades med FITC-casein, dels ensamt och dels med efterföljande infärgning av FISH. Försöken utfördes ensamt med FITC-casein vid två tillfällen vardera och två gånger med efterföljande infärgning av FISH för samtliga membran. 200 µl PBS blandades med 20 µl FITC-casein och pipetterades över valt membran som doppats i bakterie-konsortium. Membranen placerades i ibidi cells och inkuberades i 5 % CO2 i 37 °C under 60
Två-dimensionell gelelektrofores
Från samtliga tre membran eluerades proteiner för analys av proteinsammansättning med hjälp av två-dimensionell gelelektrofores (2-DE).
Vardera membran preparerades med bakteriekonsortium och placerades i sterila eppendorfrör och 150 µl rehydreringsbuffert (för 1 ml totalt: 0,48 g 8 M urea, 0,02 g 2 % chaps, 1,6 mg 10mM DTT, 20 µl 2 % IPG, 20 µl [av 0,5 %] 0,01 % BFB. Förvarat i -20 °C) pipetterades över. Rören skakades på vortexplatta 2 x 15 sekunder. Membranen avlägsnades och vätskan centrifugerades med 3000 varv/ minut under 5 minuter i kylrum. De resulterande supernatanterna, cirka 130 µl, sögs upp med pipett och överfördes till nya eppendorfrör. 125 µl av respektive supernatant överfördes med pipett till kanalerna i rehydreringstråget och Immobiline DryStrip gel (pH 4-7, 7 cm; GE Healthcare Bio-Sciences AB) placerades över. Dessa täcktes med silikonolja för att undvika att proteinerna oxiderade eller torkade ut. Detta rehydrerades under 24 timmar i rumstemperatur. Isoelektrisk fokusering utfördes med användning av Multiphor II (GE Healthcare Bio-Sciences AB) med kylning av 15 °C vatten. Isoelektrisk fokusering initierades vid 150 V under 60 minuter, spänningen höjdes sedan till 300 V under 60 minuter, vidare till 600 V under 60 minuter och vidhölls därefter vid 3500 V under 13 timmar. Efter fokusering placerades stripsen i – 80 °C. Stripsen placerades sedan i en ekvilibreringslösning under skak, först i 50 mM (pH 6.8), 26 % glycerol, 2 % SDS och 16 mM ditiotreitol i destillerat H2O under 15 minuter och sedan ytterligare 15 minuter i samma
buffert men innehållande 250 mM iodoacetamide (GE Healthcare Bio-Sciences AB) och 0,005 % bromfenolblått istället för ditiotreitol. Gelerna sköljdes sedan med UHQ-vatten. För att separera proteinerna tvådimensionellt placerades stripsen på 10 % respektive 12 % polyakrylamidgeler. Gelerna bäddades sedan in med smält agarose (0,5 %) och stelnade under 5-10 minuter. SDS-polyakrylamidelektroforesen kördes sedan i PROTEAN II xi Cell (Bio-Rad Laboratories) under en konstant spänning på 100 V under cirka 2 timmar med running buffer innehållande 50 mM Tris (pH 8.3), 0.1% SDS and 0,384 M glycine i destillerat H2O.
För färgning fixerades gelerna i 40 % etanol och 5 % ättiksyra under 30 minuter med långsamt skak. Gelerna färgades sedan med silver enligt protokollet av tillverkaren (GE Healthcare Bio-Sciences AB). Amersham High-Range Rainbow Molecular Weight Markers (GE Healthcare Bio-Sciences AB) användes som standard. Geler kördes vid ett tillfälle med 10 % polyakrylamidgeler och vid ett tillfälle med 12 % polyakrylamidgeler för vardera membran.
Klinisk provtagning och mikrobiologisk analys
Provtagning utfördes på fyra försökspersoner med dokumenterad peri-implantit och/ eller parodontit, som var patienter hos professor Andreas Stavropoulos på lärarkliniken vid avdelningen för parodontologi under hösten 2016 och våren 2017. I kontrollsyfte utfördes provtagning även på en parodontalt frisk försöksperson. Membranen kvarhölls under 60 sekunder i tandköttsfickan respektive i fickan kring implantat. Membranen placerades efter provtagning i ibidi cells som direkt transporterades till oral biologi för analysering.
Totalt sju membranprover från tre olika försökspersoner färgades in med Live/Dead BacLight™. Provernas bakterieförekomst undersöktes genom analys av fluorescensen i ett konfokalmikroskop. Se tabell I.
Tabell I. Bakterieinfärgning med Live/Dead BacLight™
Membrantyp Försöksperson Provtagningssite Fickdjup (mm)
PVDF 1 Peri-implantit 6
PVDF 1 Mukosit 5
PVDF 5 Frisk tandköttsficka 3
Skyddspapper 2 Parodontit 6
Skyddspapper 5 Frisk tandköttsficka 3
PTFE 2 Parodontit 6
PTFE 5 Frisk tandköttsficka 3
Totalt fyra membranprover från tre olika försökspersoner färgades in med FISH, där probe eub 338 användes som färgade in samtliga bakterier i rött.Provernas bakteriesammansättning analyserades enligt beskrivning ovan. Se tabell II.
Totalt sex membranprover från fem olika försökspersoner behandlades med FITC-casein. Provernas proteasaktivitet analyserades enligt beskrivning ovan. Se tabell III.
Totalt fyra membranprover från tre olika försökspersoner behandlades med FITC-casein och färgades in med FISH. Provernas proteasaktivitet, bakteriesammansättning och proteas-aktivitet bundna till bakterier analyserades enligt beskrivning ovan. Se tabell IV.
Tabell IV. Behandling med FITC-casein och infärgning med FISH
Membran Försöksperson Provtagningssite Fickdjup (mm)
Skyddspapper 2 Peri-implantit 6
PTFE 2 Peri-implantit 6
PTFE 3 Parodontit 7
PTFE 4 Utläkt tandköttsficka 4
Tabell II. Bakterieinfärgning med FISH
Membran Försöksperson Provtagningssite Fickdjup (mm)
Skyddspapper 2 Peri-implantit 6
PTFE 2 Parodontit 6
PTFE 3 Parodontit 7
PTFE 5 Frisk tandköttsficka 3
Tabell III. Behandling med FITC-casein för analys av proteasaktivitet
Membran Försöksperson Provtagningssite Fickdjup (mm)
PVDF 1 Peri-implantit 6
Skyddspapper 2 Peri-implantit 6
PTFE 2 Peri-implantit 6
PTFE 3 Parodontit 7
PTFE 4 Utläkt tandköttsficka 4
Resultat
Multibakteriellt konsortium in vitro
Visualisering av bakterier
För att undersöka den totala bakteriemängden som adsorberats till membranproverna användes infärgning med Live/Dead® BacLight™ Viability Kit. Resultaten visade ingen större skillnad mellan olika appliceringstider. Efter att membranen doppats i bakterie-konsortiet identifierades en riklig bakteriemängd med urskiljbara kolonier. Samtliga tre membran adsorberade riklig bakteriemängd efter applicering i bakteriekonsortium (figur 4). Vid närmare analys förefaller alla fyra bakterietyper finnas på samtliga membran baserat på cellmorfologi och cirka 90 % av bakterierna var viabla.
För att säkerställa att samtliga fyra bakteriearter, P. micra, P. gingivalis, F. nucleatum och S.
constellatus, adsorberats till samtliga membran, och på så sätt bedöma om olika arter kunde
adsorbera till materialen, användes infärgning med FISH. Prober som användes gav följande färger: P. micra: blå, P. gingivalis: röd, S. constellatus: gul och F. nucleatum: grön. Analys i ett konfokalmikroskop visade att samtliga membran som doppats i bakteriekonsortium adsorberade samtliga fyra bakteriearter (figur 5).
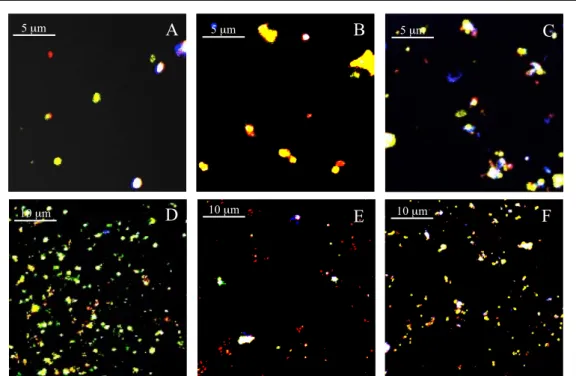
Figur 4. Bilder tagna i ett konfokalmikroskop. Membran doppade i bakteriekonsortium
och infärgade med Live/Dead BacLight™. Viabla bakterier färgades grönt, icke-viabla färgades rött. PVDF (A), skyddspapper (B) och PTFE (C) användes i försöket. Samtliga fyra bakteriearter, F. nucleatum (pil 1), P. micra (pil 2), P. gingivalis (pil 3) och S.
constellatus (pil 4) kunde identifieras baserat på cellmorfologi.
A B C 3→ 2→ 1→ 4→ 5 µm 5 µm 2,5 µm
Analys av proteasaktivitet
För att bedöma hur väl respektive membran absorberade proteaser, analyserades den proteolytiska aktiviteten med bredspektrumproteassubstratet FITC-casein. Samtliga tre membran som doppats i bakteriekonsortium och som behandlats med FITC-casein, visade proteasaktivitet vid analys av fluorescens i ett konfokalmikroskop (figur 6).
Membran som doppats i bakteriekonsortium och behandlats med FITC-casein samt färgats in med FISH visade rikligt med bakterier och bakteriebunden proteasaktivitet vid analys i konfokalmikroskop. Vid närmare analys förefaller alla fyra bakterietyper proteolytiskt aktiva baserat på cellmorfologi.
Figur 5. Bilder tagna i ett konfokalmikroskop. Membran doppade i bakterie-konsortium
och infärgade med FISH för att undersöka om samtliga bakteriearter adsorberade på respektive membran, PVDF (A, D), skyddspapper (B, E) och cytoplastmembran (C, F). Prober färgade P. micra blå, P. gingivalis röd, S. constellatus gul och F. nucleatum grön. Samtliga färger kunde ses på samtliga membrantyper.
A B C D E F F C 5 µm 5 µm 5 µm 10 µm 10 µm 10 µm
Figur 6. Bilder tagna i konfokalmikroskop. Membran doppade i bakterie-konsortium och
behandlade med FITC-casein för att analysera den proteolytiska aktiviteten. Samtliga membran, PVDF (A), skydds-papper (B) och PTFE (C), visade proteolytisk aktivitet.
A B C
Analys av proteinsammansättning
För att undersöka om det var möjligt att eluera ut proteiner från de olika materialen och analysera sammansättningen av extracellulära proteiner från P. micra, P. gingivalis, F.
nucleatum och S. constellatus användes en tvådimensionell gelelektrofores. Supernatanterna
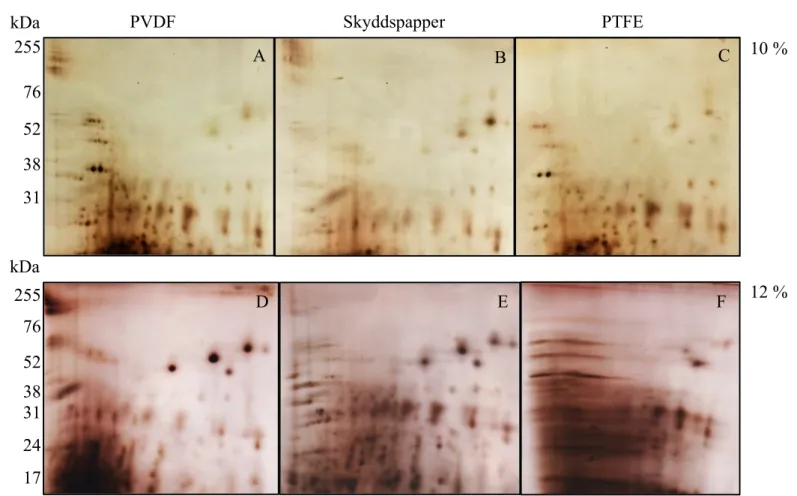
från de tre membranen kördes med 10 % och 12 % geler (se figur 7).
Analys visade relativt likt mönster mellan de olika membranen. PVDF och PTFE visar något fler proteiner än skyddspappret. Proteiner med molekylvikterna 60 kDa, 55 kDa, 50 kDa, 38 kDa, 36 kDa, 31 kDa, 24 kDa respektive 17 kDa kunde detekteras i gelerna (se figur 7).
Multibakteriellt konsortium in vivo
Provtagning
Provtagning på försökspersoner utfördes dels som en del i materialutprovning för att undersöka om det var kliniskt möjligt att använda membranen, och dels för att analysera bakterieförekomst och proteasaktivitet. Kliniskt visade det sig att det fanns svårigheter att använda PVDF då de snabbt absorberade vätska och vek sig, vilket medförde svårigheter i provtagningen. Skyddspapper och PTFE gick båda att hantera kliniskt, men mest lätthanterligt var PTFE. 255 76 52 38 31 kDa A B C 255 76 52 38 31 24 17 kDa D E F
Figur 7. Två-dimensionell gel-elektrofores av extracellulära proteiner från P. micra, P. gingivalis, F. nucleatum
och S. constellatus. Fig A-C visar 10 % polyakrylamidgeler från prover med PVDF (A), skyddspapper (B) och PTFE (C). Fig. D-F visar 12 % polyakrylamidgeler från prover med PVDF (D), skyddspapper (E) och PTFE (F).
10 %
12 % PVDF Skyddspapper PTFE
Visualisering av bakterier
Vid infärgning med Live/Dead BacLight™ visade patogena prover från peri-implantära siter riklig bakterie-mängd vid analys i ett konfokalmikro-skop (figur 8). Vid analys av kontroll-prov från parodontalt friska sites sågs ett mindre antal bakterier på samtliga membran (figur 9). Utifrån bakteriernas cellmorfologi bedöms att det finns många stavar i olika storlek och en del streptokocker.
Infärgning med FISH visade en stor bakteriemängd på patologiska prover (figur 10). Utifrån bakteriernas cellmorfologi bedömdes att det fanns en stor mängd stavar i de patologiska proverna.
Analys av proteasaktivitet
För att analysera den totala proteolytiska aktiviteten behandlades proven med FITC-casein. Analys i ett konfokalmikroskop från subgingivala patologiska tandköttsfickor/ fickor kring implantat visade en stor proteolytisk aktivitet. Vid analys av kontrollprov från en parodontalt frisk försöksperson sågs en låg proteolytisk aktivitet på samtliga membran.
Figur 10. Bild tagen i ett
konfokalmikroskop. Prov med PTFE från en subgingival pato-logisk ficka, där provet färgats in genom FISH med en generell probe som färgar samtliga bakterier röda. En stor mängd stavar kan identifieras genom bakteriernas cellmorf-ologi.
5 µm
Figur 8. Bild tagen i ett
konfokalmikroskop. Prov med PVDF på subgingival patologisk ficka vid implantat. Prov infärgat med Live/Dead BacLight™.
7 µm
Figur 9. Bilder tagna i ett konfokalmikroskop. Prover tagna från tandköttsficka hos en
parodontalt frisk försöksperson och infärgade med Live/Dead BacLight™. Bild 1: PVDF. Bild 2: skyddspapper. Bild 3: PTFE. I bild 1 kan, förutom bakteirer, även epitelceller ses.
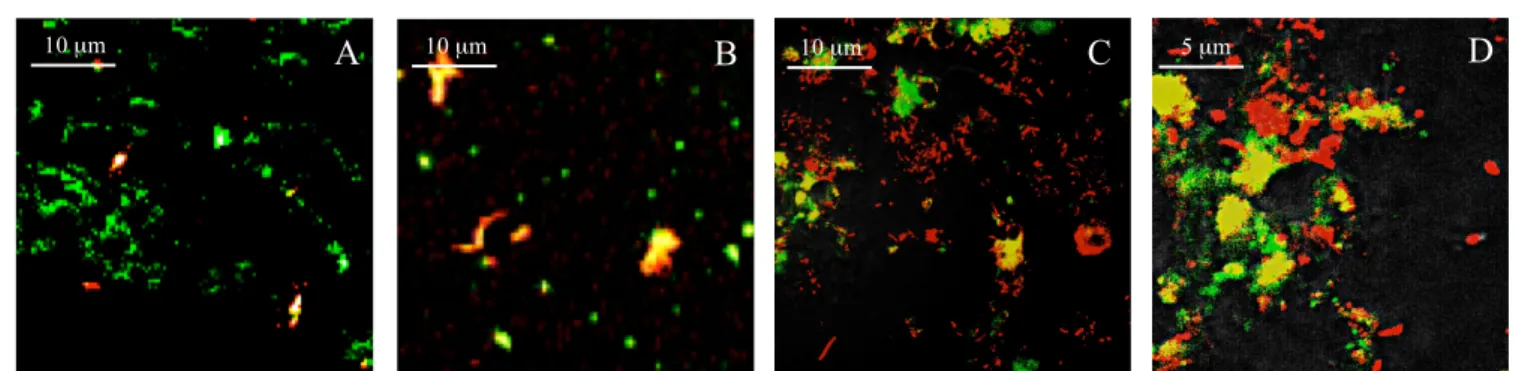
För att kunna analysera bakteriebundna proteaser färgades prover in med FISH och behandlades med FITC-casein. Analys i ett konfokalmikroskop visade en stor proteolytisk bakteriebunden aktivitet hos de patologiska proven. Se figur 11 för aktivitet från subgingivala patologiska fickor kring implantat.
Figur 11. Bilder tagna i ett konfokalmikroskop. Prover från subgingivala patologiska fickor kring implantat (A och B)
som behandlats med FITC-casein och färgats in med FISH. I just denna bild ses skyddspapper (A) PTFE (B). Prover (C, D) från patologiska tandköttsfickor färgade med Live/Dead BacLight™.
A 10 µm B 10 µm C 5 µm D
Diskussion
Studiedesign
Studien undersökte om det var möjligt att påvisa bakterieförekomst, proteasuttryck och proteinförekomst i en tandköttsficka med ett och samma prov. För att detta ska vara möjligt krävs ett material som både kan adsorbera bakterier, absorbera proteiner och där det är möjligt att eluera ut proteiner. Följande tre membran undersöktes: PVDF (polyvinyliden-fluoridmembran, Millipore Durapore® Membrane Filters, pore size 0,22 µm), skyddspapper till PVDF, och PTFE (polytetrafluoretenmembran, Cytoplast TXT-200 Non-Resorbable PTFE Barrier Membranes).
Metoden utprovades med samtliga tre membran in vitro med hjälp av multibakteriella konsortier som bestod av P. micra, P. gingivalis, F. nucleatum och S. constellatus i prereducerat 10 % serum. Sedan följde en klinisk del där den utprovade metoden användes in
vivo för provtagning i tandköttsfickor på patienter med dokumenterad peri-implantit och/ eller
parodontit, för att undersöka om metoden kan appliceras kliniskt.
I studien utfördes experiment i både in vitro och in vivo. Denna studiedesign är en styrka som ger resultaten en högre klinisk relevans. Att enbart utföra en laborationsstudie in vitro motsvarar inte verkligheten, eftersom den verkliga biofilmen är komplex och inte kan återspeglas identiskt in vitro. Kliniskt kan den komplexa sammansättningen i biofilmen hypotetiskt ha en annorlunda påverkan på provtagningsmaterialen än det multibakteriella konsortiet in vitro. Med bakgrund mot detta är det viktigt att undersöka om provtagningsmaterialet går att applicera kliniskt och därefter analyseras laborativt.
Dysbiosis vid parodontal sjukdom
Vid parodontit sker en förändring i den subgingivala biofilmens sammansättning och mångfald. Den orala biofilmens mångfald ökar vid parodontit (21,38). Förändringar i biofilmen kan leda till dysbiosis. Vid dysbiosis sker ett skifte i synergin av den poly-mikrobiella biofilmen från en ekologiskt balanserad biofilm till en obalans. Studier har tidigare visat att det snarare sker en förändring i bakteriernas uttryck eller fenotyp än att förändringen skulle finnas i mutation av bakteriernas genotyp vid parodontit. Förändringen i fenotypen kan förklara länken mellan biofilmens dysbiosis och parodontit, men det behöver inte nödvändigtvis vara orsaken(39). Det betyder att parodontit inte utvecklas bara för att vissa bakterier finns närvarande, så som P. gingivalis, utan att bakterien måste ha den fenotyp som associeras med sjukdomen. Vilken fenotyp detta skulle vara är ännu okänt, och fler studier behövs, men mycket talar för att det är proteasuttrycket som är avgörande. I denna studie stämmer resultaten mot litteraturen, där en ökad bakteriemängd kunde ses vid analys av sjuka sites, jämfört med friska. Bakterieprov från sites med parodontit och peri-implantit visade på en riklig bakteriemängd, medan bakterieprov från parodontalt friska sites visade en betydligt längre bakteriemängd på samtliga membran. På samma sätt visade analys från sites med parodontit och peri-implantit stark proteolytisk aktivitet vid visuell bedömning, medan analys av parodontalt friska sites visade en mindre proteolytisk aktivitet på samtliga membran. Minst 10 fält bedömdes som visade likartade resultat. Dessa fynd indikerar ytterligare på att det vid dysbiosis råder ökad mångfald och bakteriemängd i biofilmen. Resultaten från studien stämmer mot den litteratur som finns idag, både angående den ökade bakteriemångfalden och den starka proteolytiska aktiviteten. Dessa fynd visar på att provtagningsmetoden fungerar. Resultaten i studien måste dock verifieras med en större,
longitudinell studie. För verifiering av resultat skulle till exempel en grupp patienter med låg risk för allvarlig parodontal sjukdom och en grupp patienter med dokumenterad parodontal sjukdom jämföras.
Potentiella biomarkörer för parodontal sjukdom
Det är svårt att prediktera vilka patienter som kommer att utveckla allvarlig parodontit utifrån de riskfaktorer som idag är identifierade. Inte heller utifrån kliniska parametrar så som plack, gingivit och mindre benvävnadsförlust kan man med säkerhet bedöma vilka som kommer att utveckla allvarlig parodontal sjukdom. Det skulle kunna vara möjligt att identifiera biomarkörer i den subgingivala biofilmen långt innan benvävnadsförlust sker. För detta krävs nya kliniska undersökningsmetoder.
En stor mängd biomarkörer och enzymer kan relateras till peri-implantit och parodontit. Bland annat ses förhöjda nivåer av olika cytokiner (IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, IL-17, IFN-γ, PGE-2 och TNF-α) och förhöjda nivåer av olika MMP (MMP-1, MMP-3, MMP-8 och MMP-13) i biofilmer vid peri-implantit. MMPs kan orsaka nedbrytning av extracellulära matrixproteiner och påverkar cellers proliferation, differentiering, migration och apoptos. MMP främjar vävnadsnedbrytning (40). IL-1β är en av de vanligaste inflammatoriska cytokinerna vid parodontit och peri-implantit där dess koncentration är korrelerad till graden av sjukdom(14). Dessa cytokiner kan utgöra biomarkörer för peri-implantit och parodontit.
För att säkerställa om de cytokiner som är funna i subgingivala biofilmer har påverkan på fortsatt sjukdomsutveckling, och kan utgöra biomarkörer för parodontal sjukdom, krävs prospektiva longitudinella studier där man följer patienterna. Genom dessa studier skulle man kunna kartlägga vad det finns ett samband mellan biomarkörer i biofilmen och utveckling av allvarlig parodontit. Det är osannolikt att det finns en specifik biomarkör som orsakar sjukdom. Det är snarare en kombination av biomarkörer som är orsaksfaktorn till dysbiosis.
Provtagningsmetoder för dysbiosis vid parodontal sjukdom
Traditionellt sker provtagning av bakterier i tandköttsfickor med hjälp av papperspoints i cellulosa. En nackdel med papperspoints är att man inte kan analysera dessa i konfokal-mikroskop. Detta eftersom en för stor mängd sugs in i materialet och att papperspoints har en form som inte möjliggör analysering i konfokalmikroskopet. En ytterligare nackdel med materialet är att man endast kan få ut ett medelvärde av innehållet, men inte kan titta på enskilda bakteriers aktivitet.
För undersökning av värdproteiner har det i kliniska studier använts cellulosamembran, till exempel PVDF, som applicerats ytligt i tandköttsfickor. Ytterligare en provtagningsmetod för bakterier och värdproteiner är med hjälp av glaskapillärrör, detta är inte en optimal provtagningsmetod då tandköttsfickan lätt sårgörs.
I denna studie användes PVDF, skyddspapper och PTFE för provtagning i subgingivala tandköttsfickor och fickor kring implantat. Som nämnt har PVDF använts i tidigare studier för att absorbera proteiner, men dess förmåga att adsorbera bakterier har inte, vad författarna vet, undersökts tidigare. Skyddspapper till PVDF och PTFE har inte tidigare undersökts i detta sammanhang.
De experimentella försöken med multibakteriellt konsortier i denna studie visade att samtliga material kunde adsorbera bakterier och absorbera proteiner. Testerna visade även att olika bakteriearter kunde adsorberas. Det var även möjligt att eluera ut extracellulära proteiner från samtliga membran. Dock gav skyddspappret ett något svagare resultat vid eluering av bakterier för analys av proteinsammansättning. En fördel med samtliga membran, till skillnad från tidigare provtagningsmetoder, är alltså att flera parametrar kan undersökas med samma metod. Detta gör att bakterier, proteinsammansättning och proteasuttryck kan undersökas i samma tandköttsficka istället för att ta flera prover. Om flera prover tas på samma site kan sammansättningen i tandköttsfickan förändras och därför inte ge ett sanningsenligt resultat vid analys.
För att kunna analysera fluorescensen i konfokalmikroskop krävs ett material som i sig inte fluorescerar. Samtliga membran var icke-fluorescerande och platta och därför möjliga att använda vid analys i konfokalmikroskop. Detta är en stor fördel mot tidigare provtagnings-material som inte kunnat analyseras i mikroskopet. Genom detta kan man kvalitativt undersöka bakteriens aktivitet och egenskaper. Analysering kan visa vilka bakteriearter som är proteolytiskt aktiva. Metoden kan även visa hur stark den proteolytiska aktiviteten är för just den bakteriearten. På så sätt kan man undersöka om den totala proteolytiska aktiviteten utgörs av enstaka bakterier med stark aktivitet eller av en större mängd låggradigt aktiva bakteriearter.
De stora skillnaderna mellan de tre membran uppkom i de kliniska försöken där appliceringen i tandköttsfickor eller kring implantat var väsentligt svårare med skyddspapper och PVDF än PTFE. PTFE var något styvare än de andra två membranen, vilket gjorde att det inte krökte sig vid applicering och därför var det möjligt att nå djupet av tandköttsfickan. Med bakgrund mot detta kom denna studie fram till att PTFE var det bästa provtagningsmaterialet för analys av bakteriekomposition, proteinsammansättning och proteolytisk aktivitet i tandköttsfickor på patienter med dokumenterad peri-implantit och/ eller parodontit.
Analysmetoder för dysbiosis vid parodontal sjukdom
Fluorescense In Situ Hybridisering
För att bekräfta att samtliga bakteriearter adsorberades till membranen i den experimentella delen färgades proverna in med FISH. Proverna var behandlade med konsortiet som innehöll bakterier från olika nivåer av hälsa och sjukdom. S. constellatus associeras med den friska orala floran. F. nucleatum är vanligt förekommande vid gingivit. P. gingivalis och P. micra associeras med kronisk parodontit. Dessa bakterier valdes för att undersöka om bakterier från olika sjukdomsstadier adsorberades till membranet. En fördel med FISH är att det finns specifika prober för olika bakterier. Analyseringen av färgerna kunde då visa att samtliga bakteriearter adsorberats till samtliga membran.
I kliniska tester är det inte möjligt att veta exakt vilka bakterier som är närvarande. Därför är det svårt avgöra vilka specifika prober som ska användas vid FISH-infärgning. I den kliniska delen användes därför en generell bakterieinfärgning för att inte missa bakteriearter. Från den generella infärgningen kunde den kvantitativa bakteriemängden analyseras och bakteriearter kunde identifieras genom cellmorfologi.
FITC-casein
av serin-, cystein- och metalloproteaser. Med hjälp av FITC-casein kunde därför den kvantitativa proteasaktiviteten analyseras.
Fördelen med FITC-casein är att tre stora grupper av proteaser kan undersökas. Proteaser från dessa grupper uttrycks vanligen av parodontala bakterier och är vanligt förekommande vid parodontal sjukdom. Att dessa tre grupper undersöks i ett test möjliggör att många olika proteaser kan undersökas samtidigt. Metoden är lätthanterligt och tidsåtgången kort, vilket gör att resultat snabbt fås fram. FITC-casein går även att kombinera med FISH för att kunna undersöka den bakteriebundna proteasaktiviteten. Detta möjliggör att mer information kan utvinnas samtidigt.
Nackdelen med FITC-casein är att modifieringar kan krävas för att kunna detektera specifika proteaser. Metoden är även ljuskänslig, där exponering för ljus kan äventyra resultatet.
Analys av extracellulära proteiner med två-dimensionell gelelektrofores
För att undersöka om proteiner kunde elueras ut från de olika membranen användes en två-dimensionell gelelektrofores. Detta för att sedan kunna analysera sammansättningen av proteiner. Det multibakteriella konsortiet innehöll P. micra, P. gingivalis, F. nucleatum och S.
constellatus, vars proteiner kunde detekteras i gelerna. Proteiner med molekylvikterna 60
kDa, 55 kDa, 50 kDa, 38 kDa, 36 kDa, 31 kDa, 24 kDa respektive 17 kDa kunde detekteras i gelerna. Flera av dessa, 38-60 kDa, ligger i ett molekylviktsområde som skulle kunna vara proteaser.
Proteasuttryck hos F. nucleatum analyserades i en studie där proteolytisk aktivitet identifierades i form av serinproteaser mellan 55-62 kDa (41). Dessa molekylvikter kan överensstämma med molekylvikt 55 kDa och 60 kDa som visades på gelerna i denna studie. Proteaser uttryckta från P. gingivalis har undersökts i flera studier. Gingipainer har tidigare identifierats med molekylvikt 50 kDa och 60 kDa (42,43) Båda dessa molekylviktsområden identifierades i denna studie. Trypsinlika proteaser uttryckta från P. gingivalis har identifierats med molekylvikt 53 kDa (43). Dessa kan motsvara molekylviktsområden från denna studie på 50 kDa respektive 55 kDa.
I denna studie visades att proteiner med olika molekylvikter kunde absorberas till de olika membranen och även elueras ut från materialen. Detta visar att membranen kan användas i syfte att identifiera proteinsammansättningen i patologiska fickor kring tänder och tandimplantat.
Felkällor och resultatens tillförlitlighet
Den biologiska variationen kan skifta vid olika provtagningstillfällen, även inom samma bakteriestam. Denna variation utgör en större riskfaktor för felkällor i studien än den tekniska variationen. Försöken utfördes vid upprepade tillfällen för att öka reproducerbarheten och minska risken för felkällor.
För öka tillförlitligheten vid den kliniska provtagningen utfördes samtliga provtagningar av en och samma operatör, vilket minskar risken för interobservatörsvariationer.
Slutsats
Studien undersökte tre membran, PVDF, skyddspapper till PVDF och PTFE. De två senare har aldrig undersökts i liknande sammanhang tidigare. Membranen undersöktes i syfte att finna en teknik som i framtiden kan användas för att undersöka samband mellan proteiner och bakterier vid peri-implantit/ parodontit. I studien kunde samtliga membran adsorbera bakterier och absorbera proteiner in vitro. Det var även möjligt att eluera ut extracellulära proteiner för analys av proteinsammansättning.
Kliniskt var PTFE bättre än de andra membranen eftersom de var mer lätthanterliga. Denna provtagningsmetod bedöms därför kunna användas för att kliniskt påvisa parodontit-associerade bakterier. Med denna metod kan även den kliniska sammansättningen av cellbundna bakteriella proteaser och specifika proteinmönster från biofilmen analyseras. Provtagningsmetoden kan påvisa en stor mängd proteaser och proteinuttryck. Dessa kan vara möjliga biomarkörer för allvarlig parodontal sjukdom. Dock krävs prospektiva longitudinella studier där man följer patienterna. Detta för att se vilken påverkan de biomarkörer som idag är identifierade faktiskt har på utveckling av allvarlig parodontal sjukdom. I längden skulle detta kunna leda till att markörer för sjukdomsutveckling identifieras och att nya diagnostiska metoder och riskmarkörer etableras i framtiden.
I världen finns idag 500 miljoner individer med allvarlig parodontit. Procentuellt är det ungefär samma mängd i Sverige, där 7-10 % drabbas av allvarlig parodontit. Detta ger stora samhällskostnader, cirka 10 miljarder kronor årligen i Sverige. Kan patienter med ökad risk för allvarlig parodontal sjukdom hittas redan i ett tidigt stadie kan vården fokuseras på dessa patienter. I dagsläget behandlas alla patienter med lätt parodontal sjukdom på samma sätt. Trots att endast en liten del av dessa patienter kommer utveckla allvarlig parodontal sjukdom. I dagsläget är det inte möjligt att identifiera riskpatienterna och därför sker det en stor överbehandling. Kan man istället fokusera vården på de 7-10 % som drabbas av allvarlig parodontal sjukdom redan innan den utvecklas ger det både en etisk och ekonomisk fördel ur ett samhällsperspektiv. Kan man hitta biomarkörer för att identifiera patienter med ökad risk kan man ge dessa den vård de behöver. Detta ger i längden en minskad tandvårdskostnad både för samhället och patient.
Det räcker dock inte att man hittar specifika markörer för sjukdom, man måste även hitta ett effektivt sätt att behandla dessa. Idag går majoriteten av de med allvarlig parodontit hos specialisttandvården för behandling. Men trots detta är det sällan som dessa patienter blir helt friska i sin parodontala sjukdom. Kanske kommer man i framtiden hitta nya behandlings-metoder som baseras på specifika biomarkörer.
Tack till
Vi vill tacka biomedicinsk analytiker Agnethe Henriksson för all hjälp med våra experimentella försök och professor Andreas Stavropoulos för hjälp vid klinisk provtagning.
Referenser
(1) SBU- Statens beredning för medicinsk och social utvärdering. Kronisk parodontit- prevention, diagnostik och behandling. ; 2004. s. 25-27.
(2) GBD 2015 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 315 diseases and injuries and healthy life expectancy (HALE), 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet 2016 Oct 8;388(10053):1603-1658.
(3) Ramanauskaite A., Juodzbalys G. Diagnostic Principles of Peri-Implantitis: a Systematic Review and Guidelines for Peri-Implantitis Diagnosis Proposal. J.Oral Maxillofac.Res. 2016 Sep 9;7(3):e8-Sep.
(4) Froum S. J., Rosen P. S. A proposed classification for peri-implantitis. Int.J.Periodontics Restorative Dent. 2012 Oct;32(5):533-540.
(5) Lang N. P., Bosshardt D. D., Lulic M. Do mucositis lesions around implants differ from gingivitis lesions around teeth? J.Clin.Periodontol. 2011 Mar;38 Suppl 11:182-187.
(6) Lindhe J., Lang NP. Clinical Periodontology and Implant Dentistry. 6 red. Oxford: Wiley-Blackwell; 2015. s. 85-91.
(7) Kilian M., Chapple I. L., Hannig M., Marsh P. D., Meuric V., Pedersen A. M., et al. The oral microbiome - an update for oral healthcare professionals. Br.Dent.J. 2016 Nov
18;221(10):657-666.
(8) Dahlén G., Fiehn N-E, Olsen I., Dahlgren U. Oral microbiology and immunology: The Scandinavian approach.Kobenhavn: Munksgaard; 2012. s. 201-203.
(9) Short F. L., Murdoch S. L., Ryan R. P. Polybacterial human disease: the ills of social networking. Trends Microbiol. 2014 Sep;22(9):508-516.
(10) Neilands J., Wickstrom C., Kinnby B., Davies J. R., Hall J., Friberg B., et al. Bacterial profiles and proteolytic activity in peri-implantitis versus healthy sites. Anaerobe 2015 Oct;35(Pt A):28-34.
(11) Becker S. T., Beck-Broichsitter B. E., Graetz C., Dorfer C. E., Wiltfang J., Hasler R. Peri-implantitis versus periodontitis: functional differences indicated by transcriptome profiling. Clin.Implant Dent.Relat.Res. 2014 Jun;16(3):401-411.
(12) Carcuac O., Berglundh T. Composition of human peri-implantitis and periodontitis lesions. J.Dent.Res. 2014 Nov;93(11):1083-1088.
(13) Carcuac O., Abrahamsson I., Albouy J. P., Linder E., Larsson L., Berglundh T. Experimental periodontitis and peri-implantitis in dogs. Clin.Oral Implants Res. 2013 Apr;24(4):363-371.